一种双特异性肽聚合物及其制备方法和应用
本发明涉及医药,具体涉及一种双特异性肽聚合物及其制备方法和应用。
背景技术:
1、双特异性抗体(bispecific antibody,bsab),指能同时特异性靶向两个抗原或一个抗原的两个表位。1960年,nisonoff及其合作者首次提出双特异性抗体概念,因独特的构造设计,引起广泛关注。20世纪80年代中期,一种典型的双特异性抗体设计--双特异性的cd3接合器(bispecific cd3engagers,bce)提出,通过同时靶向t细胞受体cd3亚基(促使t细胞活化)和仅限于癌细胞的表面抗原,其可特异性桥接t细胞和肿瘤细胞,进而使活化的t细胞杀伤肿瘤细胞。bce是双特异性抗体领域最成功,应用最成熟的一种,如第一例被批准的bce药物catumaxomab,靶向一种常见的肿瘤标志物抗原epcam。
2、目前已有119种处于临床阶段和176种处于临床前的双抗项目,其中99种临床和153种临床前项目针对肿瘤领域。除cd3和肿瘤抗原靶点外,还发展了针对免疫检查点(pd-1/pd-l1,ctla-4等),血管生成通路(vegf、vegfr2、dll4及angpt2)和调节肿瘤微环境(如tgfβ、cd73)的双特异性抗体。全球已有三款获批上市的双抗,2009年推出的双抗药物catumaxomab,用于治疗恶性腹水;2014年靶向cd19和cd3的双抗blinatumomab,治疗复发或难治性b细胞急性淋巴细胞白血病;2017年,靶向激活因子fix和fx的emicizumab,用于治疗血友病。国内目前已有多个双抗品种进入临床试验。
3、尽管如此,双特异性抗体存在着一些挑战,影响了其开发和临床转化的进程。首先,双特异性抗体的制备中存在链关联问题。双特异性抗体的合成,即通过两个不同的重(h)链和轻(l)链的共表达,需要从十种可能的h2l2重组的混合物中获得功能性bsab,给下游纯化造成困难。虽然目前已开发了一些方法来减轻这个问题,如只保留抗原结合位点的结构域亚基而省去fc段或将fc段替换成固定结构的多肽链,但这些方法的生产过程繁琐,且由于更改了抗体本身架构,可能会出现例如体内循环时间短,抗原结合位点改变导致两个目标的结合错位,从而降低功能效价。此外,双特异性抗体尤其bce存在一些安全性问题,由于cd3分布在所有谱系的t细胞中,特异性靶向cd3的双抗会引起正常器官如肝脏中t细胞的异常活化。例如前述双抗药物catumaxomab,静脉注射不可行,并且在低剂量下会引起致命毒性。
4、与治疗性抗体相比,合成肽具有作为候选药物的多种优势,包括更低的制造成本,更高的稳定性,降低的免疫原性以及更好的器官或肿瘤渗透性。但多肽分子量小,体内循环时间短,相较于抗体的亲和力弱。将多肽修饰在聚合物上,可增加多肽数量提高对靶点亲和力并借助聚合物延长体内循环时间。如一种连接pdl1多肽的聚合物可通过多价效应交联肿瘤细胞表面pdl1(lian li,et al.inhibition of immunosuppressive tumors bypolymer-assisted inductions of immunogenic cell death and multivalent pd-l1crosslinking.[j].adv.funct.mater.2020,1908961)。一种融合表达pdl1多肽的铁蛋白材料,被证明能阻断pd1与pdl1相互作用,起到pdl1单抗的作用(in seon jeon,etal.anticancer nanocage platforms for combined immunotherapy designed toharness immune checkpoints and deliver anticancer drugs.[j].biomaterials.270,2021,120685)。
5、目前,未见将两个及以上靶向肽修饰到聚合物上用于特异性靶向两种细胞的报道,利用聚合物和多肽分子合成双特异性肽聚合物,可有效规避双抗制备复杂且纯化困难的问题。通过构建一系列聚合物平台,“即插即用”不同靶点的多肽分子组合,可构建一系列具有不同靶点的双特异性肽聚合物,为其走向临床转化增加可行性。
技术实现思路
1、本发明的目的是提供一种高效且通用的双特异性肽聚合物平台,通过简便高效的化学反应连接两种具有一定数目和比例的多肽链,通过展示多肽链模拟两种单克隆抗体,起到双特异性抗体的目的效用,从而增强肿瘤的免疫治疗效果。
2、为实现上述目的,本发明采用如下技术方案:
3、本发明提供了一种双特异性肽聚合物,所述双特异性肽聚合物包含聚合物载体以及靶向肿瘤细胞的多肽链和靶向t淋巴细胞的多肽链,所述靶向肿瘤细胞的多肽链和靶向t淋巴细胞的多肽链分别修饰在聚合物载体上。
4、所述聚合物载体具有若干重复的分支结构,聚合物载体上重复的分支结构可用于修饰接连上多个靶向肿瘤细胞的多肽链和靶向t淋巴细胞的多肽链,多价效应可以增强聚合物和细胞的相互作用,从而增强肿瘤细胞和靶向t淋巴细胞的连接。因此,本发明构建了一种可简便高效合成的双特异性肽聚合物平台,连接肽段模拟抗体的fab段,可以模拟双特异性抗体,实现多价性和双特异性。
5、优选的,所述聚合物载体为八臂聚乙二醇(8arm-peg)或聚酰胺-胺树枝状大分子(pamam)。八臂聚乙二醇和pamam具有清晰可控的分子结构,利用化学反应对分子结构进行功能性修饰,可以作为多肽展示平台和骨架。
6、优选的,所述八臂聚乙二醇的分子量为4000-40000,利用该分子量范围内八臂聚乙二醇形成的肽聚合物可以达到较优的体内循环时间。大分子量的聚乙二醇保证了较长的体内循环时间,避免肾脏的快速清除。
7、优选的,所述pamam的分子量为4000-40000,在该分子量范围下可修饰多个靶向细胞的多肽链,其他臂可修饰peg分子,避免空间位阻干扰多肽发挥作用。
8、靶向肿瘤细胞的多肽链可特异性跟肿瘤细胞结合,靶向t淋巴细胞的多肽链可特异性跟t淋巴细胞结合。优选的,所述双特异性肽聚合物中靶向肿瘤细胞的多肽链与靶向t淋巴细胞的多肽链的摩尔比为1:0.125-8。
9、更为优选,肽聚合物中靶向肿瘤细胞的多肽链与靶向t淋巴细胞的多肽链的摩尔比为1:1或3:5。
10、具体的,本发明提供了一种针对pd-l1/pd-1途径的双特异性肽聚合物,所述双特异性肽聚合物中靶向肿瘤细胞的多肽链为靶向pd-l1的多肽链,靶向t淋巴细胞的多肽链为靶向pd1的多肽链。
11、所述靶向pd-l1的多肽链可特异性结合pd-l1过表达的肿瘤细胞,优选的,所述靶向pd-l1的多肽链的氨基酸序列为cnyskptdrqyhf(seq id no.1所示)或nyskptdrqyhfc(seq idno.2所示)。
12、所述靶向pd1的多肽链可特异性结合t淋巴细胞,优选的,所述靶向pd1的多肽链的氨基酸序列为cfsestns(seq id no.3所示)或fsestnsc(seq id no.4所示)。
13、本发明还提供了一种制备所述双特异性肽聚合物的方法,所述方法包括:首先对聚合物载体的分支末端进行化学修饰,再利用化学反应将靶向肿瘤细胞的多肽分子和靶向t淋巴细胞的多肽分子修饰连接到聚合物载体的分支末端上。
14、优选的,在有机碱催化条件下,聚合物载体与靶向肿瘤细胞的多肽分子和靶向t淋巴细胞的多肽分子反应生成所述双特异性肽聚合物,其中聚合物载体的分支末端上修饰有马来酰亚胺,所述多肽分子的末端具有巯基基团。即在有机碱催化条件下,多肽分子的巯基基团与聚合物载体的分支末端马来酰亚胺反应,实现两者结合。
15、优选的,所述有机碱可以为但不限于三乙胺、4-二甲氨基吡啶(dmap)、n,n-二异丙基乙胺(dipea)。
16、优选的,所述多肽分子的末端为半胱氨酸(cys)。
17、优选的,反应介质为二甲基亚砜(dmso)。
18、优选的,反应体系中,聚合物载体的浓度以修饰的马来酰亚胺计为0.4-40mmol/l,其与多肽分子的摩尔比为1:1;多肽分子中靶向肿瘤细胞的多肽分子和靶向t淋巴细胞的多肽分子的摩尔比为1:1。
19、优选的,所述反应为在氮气氛围中常温反应24-48h。
20、优选的,所述制备方法为分别将马来酰亚胺修饰的聚合物载体和多肽分子溶解在除水dmso中,在氮气氛围中将多肽溶液加入到聚合物载体溶液中,随后加入三乙胺,在氮气氛围中,常温反应24h。
21、所述方法还包括:利用透析截留肽聚合物,并透析置换介质dmso为水,利用冷冻干燥得到相应产物。
22、本发明还提供了所述的双特异性肽聚合物用于制备肿瘤免疫治疗药物的用途。
23、当肽聚合物中连接的肽段针对pd-l1/pd-1途径,所述肿瘤为pd-l1过表达的肿瘤。具体的,所述肿瘤为黑色素瘤或结直肠瘤。
24、本发明具备的有益效果:
25、(1)本发明构建得到的双特异性肽聚合物平台可以方便高效地通过一到两步反应得到,结构清晰,表征明确。肽链可通过固相合成规模化标准化制备得到。通过使用树状大分子展示肽段,该肽聚合物平台可模拟抗体fab段,起到双特异性效用,创造性地合成了一种人工双特异性抗体。
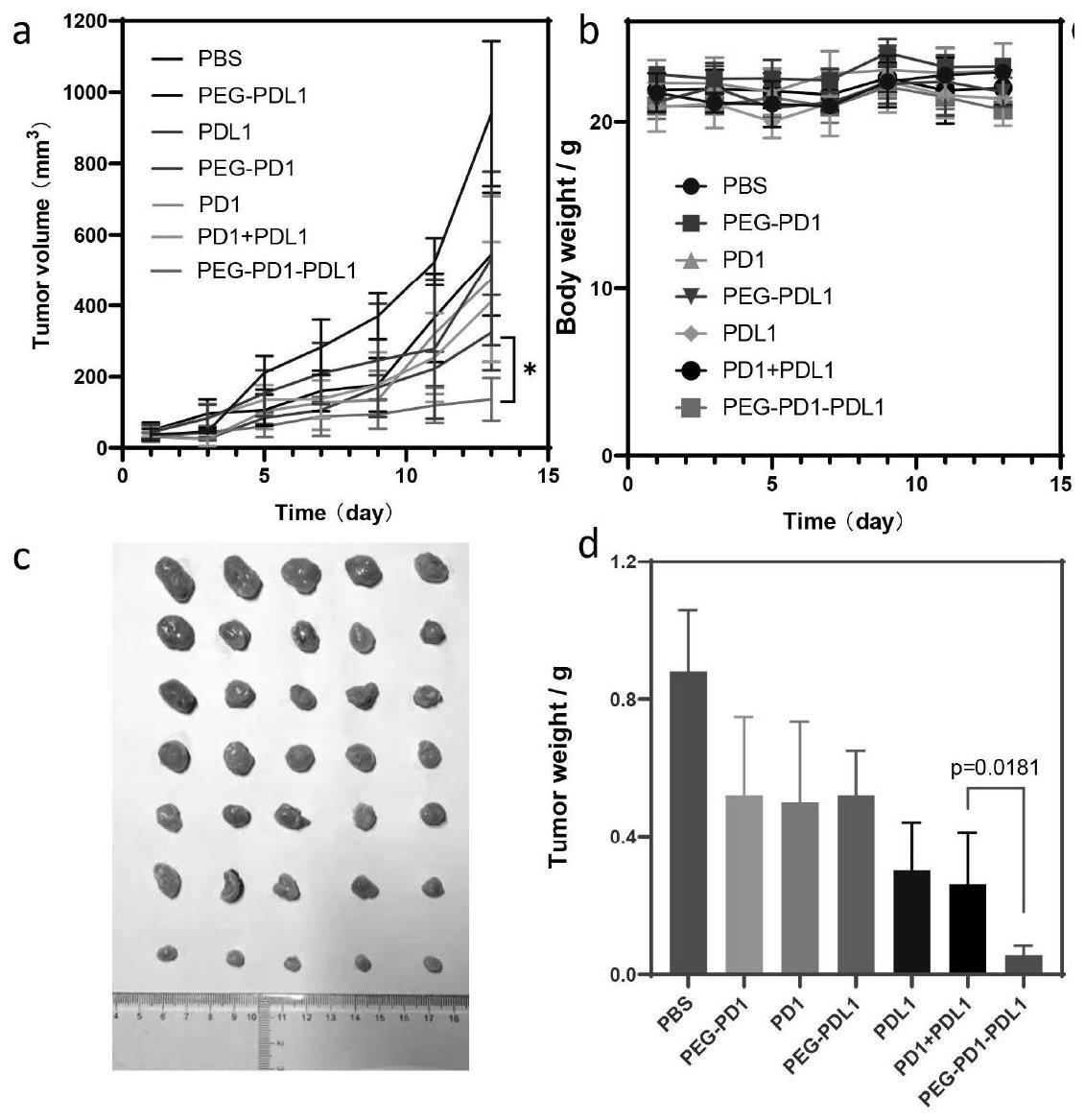
26、(2)经体内外实验证明,本发明提供的双特异性肽聚合物可桥接靶-效应细胞(肿瘤细胞与脾细胞),并增强效应细胞的细胞杀伤作用。在体内实验中,相比于游离多肽的联合治疗,本发明提供的双特异性肽聚合物peg-pd1-pdl1具有更显著的优越性,且无明显毒副作用,具有良好的临床转化前景。
- 还没有人留言评论。精彩留言会获得点赞!