用于肺癌早诊及预后评价的检测试剂和试剂盒
1.本发明属于生物医学技术领域,具体涉及一种用于肺癌早诊及预后评价的检测试剂和试剂盒。
背景技术:
2.目前,肺癌早诊手段包括影像学检查,肺癌细胞学或组织学、痰液细胞学和血清学肿瘤标志物等,但都对预测敏感性及特异性欠佳,不能在多种标本中应用。即使是近年新兴的液体活检技术,就现阶段而言缺乏标准化的检测方法、成本高昂以及临界水平的不确定性等问题,限制了其在常规临床实践中的广泛使用。dna甲基化是最重要的表观遗传修饰方式,贯穿于肿瘤发生发展的全过程。检测基因在癌症中的甲基化水平,在肺癌的研究中取得较大进展。但目前应用于临床检测的甲基化标志物试剂盒在肺癌中(如septin 9甲基化检测试剂盒)的敏感性和特异性并不理想。
3.cldn11为cldn家族非经典类型的成员之一,该家族成员包含至少27个跨膜蛋白,是细胞紧密连接和细胞屏障的主要成分。目前cldn11已被证实在各种实体瘤中被下调,从而减少细胞-细胞粘附导致癌症的转移和进展。也有报道指出在多种癌症中cldn11启动子区域甲基化可以作为早期诊断的潜在有用生物标志物,如黑色素瘤、膀胱癌、胃癌、结直肠癌和鼻咽癌。但在肺癌中却未见其与甲基化的相关报道。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种用于肺癌早诊及预后评价的检测试剂和试剂盒,所述检测试剂和试剂盒中包括特异性检测cldn11基因启动子区域甲基化的试剂,可以在肺癌的一种或多种不同类型样本中检测cldn11基因启动子区域的甲基化状态,为肺癌的诊断、风险预测、预后判断提供依据,具有灵敏、快速、准确、效率高、成本低等优点。
5.本技术发明人利用tcga在线数据库和实验室收集的配对肺癌和癌旁样本检测结果,进行了cldn11在肺癌中的表达情况分析,结果表明,cldn11在肺癌中的表达低于癌旁组织;进一步地,本技术发明人对cldn11表达与甲基化的相关性进行了分析,结果表明,cldn11在肺癌中的表达水平与甲基化水平呈负相关;进一步地,本技术发明人对cldn11在肺癌中的生存曲线进行了分析,结果表明,cldn11的低表达与肺腺癌患者的不良预后相关。基于此,本技术发明人确定cldn11可以作为肺癌的生物标志物,用于肺癌的早诊和预后评价。进一步地,本技术发明人分析了cldn11启动子区域cpg岛,确定了cldn11高频甲基化区域,高频甲基化启动子区域的转录起始位点为tss:+1021~+1132。进一步地,本技术发明人针对cldn11高频启动子甲基化区域设计了特异性引物,并进行了验证,结果表明,特异性引物可以与cldn11基因dna甲基化位点序列特异性结合,灵敏、快速、准确地检测cldn11的甲基化水平。进一步地,本技术发明人还比较了cldn11与已应用于临床的甲基化标志物septin9对于癌和非癌的区分能力,结果提示cldn11的甲基化水平的检测可以更准确和灵敏的区分肿瘤和非肿瘤,有助于肺癌临床诊断。
6.基于此,本发明公开了如下技术方案:
7.本发明公开了一种用于肺癌早诊及预后评价的检测试剂,所述检测试剂包括特异性检测cldn11基因启动子区域甲基化的试剂。
8.优选的,所述cldn11基因启动子区域的转录起始位点为tss:+1021~+1132。
9.优选的,所述特异性检测cldn11基因启动子区域甲基化的试剂中包括cldn11基因启动子区域甲基化的特异性扩增引物,所述引物为:
10.cldn11m1:aaatgttacgttgattttcgtac,
11.cldn11m2:aacccaacgacgcgaaacg,
12.cldn11u1:gaaatgttatgttgatttttgtat,
13.cldn11u2:ggaacccaacaacacaaaaca。
14.本发明还公开了上述用于肺癌早诊及预后评价的检测试剂在制备肺癌早诊及预后评价检测试剂盒中的应用。
15.本发明还公开了一种用于肺癌早诊及预后评价的检测试剂盒,所述检测试剂盒中包括上述用于肺癌早诊及预后评价的检测试剂。
16.本发明的有益效果在于:(1)本发明公开的肺癌早诊及预后评价的检测试剂和试剂盒,通过特异性检测cldn11基因启动子区域甲基化状态,为肺癌的诊断、风险预测、预后判断提供依据,效率高、成本低。(2)本发明公开的肺癌早诊及预后评价的检测试剂和检测试剂盒,通过特异性引物对与cldn11基因甲基化位点序列特异性结合,可灵敏、快速、准确地检测cldn11的甲基化水平。(3)本技术公开的肺癌早诊及预后评价的检测试剂和试剂盒相对于已应用于临床的甲基化标志物试剂盒septin9甲基化检测试剂盒而言,可以更准确和灵敏的区分肿瘤和非肿瘤,有助于肺癌临床诊断。
附图说明
17.图1为cldn11在肺癌中的表达情况,luad为肺腺癌,lusc为肺鳞,a为tcga中cldna11在肺癌中的表达,b为cldn11在配对癌和癌旁组织中的表达,c为cldn11在不同分期或分型中的表达情况,d为cldn11在肺癌中的曲线下面积;
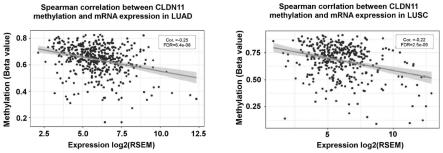
18.图2为cldn11表达与甲基化的相关性分析;
19.图3为cldn11在肺癌中的生存曲线图;
20.图4为methytarget检测cldn11和septin 9在肺癌及癌旁组织中的甲基化状态结果,a为cldn11在30对配对肺癌和癌旁组织中的甲基化水平,b为cldn11在非配对肺癌及癌旁组织中的甲基化水平,c为septin9在肺癌、癌旁组织中的甲基化水平;
21.图5为利用msp检测cldn11和septin9在肺癌组织中的甲基化状态结果,a为cldn11在肺癌中的甲基化状态,b为septin9在肺癌中的甲基化状态;
22.图6为methyltarget检测肺癌患者和健康患者血清中基因的甲基化情况结果,a为cldn11在血清样本中的甲基化状态,b为septin9在血清样本中的甲基化状态。
具体实施方式
23.下面将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。
凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
24.本技术发明人利用tcga在线数据库和实验室收集的配对肺癌和癌旁样本检测结果,进行了cldn11在肺癌中的表达情况分析,结果表明,cldn11在肺癌中的表达低于癌旁组织;进一步地,本技术发明人对cldn11表达与甲基化的相关性进行了分析,结果表明,cldn11在肺癌中的表达水平与甲基化水平呈负相关;进一步地,本技术发明人对cldn11在肺癌中的生存曲线进行了分析,结果表明,cldn11的低表达与肺腺癌患者的不良预后相关。基于此,本技术发明人确定cldn11可以作为肺癌的生物标志物,用于肺癌的早诊和预后评价。进一步地,本技术发明人分析了cldn11启动子区域cpg岛,确定了cldn11启动子甲基化区域,启动子区域的转录起始位点为tss:+1021~+1132。进一步地,本技术发明人针对cldn11启动子甲基化区域设计了特异性引物,并进行了验证,结果表明,特异性引物可以与cldn11基因dna甲基化位点序列特异性结合,灵敏、快速、准确地检测cldn11的甲基化水平。进一步地,本技术发明人还比较了cldn11与已应用于临床的甲基化标志物septin9对于癌和非癌的区分能力,结果提示cldn11的甲基化水平的检测可以更准确和灵敏的区分肿瘤和非肿瘤,有助于肺癌临床诊断。
25.实施例1cldn11在肺癌中的表达情况分析
26.利用tcga在线数据库和实验室收集的配对肺癌和癌旁样本检测结果,分别分析cldn11在肺腺癌(luad)和肺鳞癌(lusc)中的表达情况,结果如图1a-d所示;结果显示cldn11在癌组织中的表达水平明显低于癌旁组织(图1a,1b)。在肺腺癌中,其分期越晚cldn11的表达越低,在肺鳞癌中,cldn11在中央型肺癌中的表达更低(图1c)。曲线下面积的结果提示cldn11具有较好的特异性和敏感度,其中肺腺癌auc:0.895,ci:0.864-0.925,肺鳞癌auc:0.837,ci:0.802-0.871(图1d)。
27.进一步对cldn11表达与甲基化的相关性进行皮尔森相关性分析,结果如图2所示,结果提示cldn11的表达与甲基化水平负相关,其中肺腺癌的相关系数为-0.25,fdr=6.4e-08,肺鳞癌的相关系数为-0.22,fdr=2.5e-05(图2)。
28.进一步对cldn11在肺癌中的生存曲线进行分析,结果如图3所示,结果提示,在肺腺癌中cldn11的表达水平越高,患者的生存时间越久,反之则生存时间短,hr:0.6(0.47-0.77)p=3.8e-05;但是在肺鳞癌中,并没有发现cldn11的表达水平与鳞癌患者的预后有统计学相关性,hr=0.88(0.65-1.2),p=0.42(图3)。
29.其中,cldn11在肺癌中的表达检测方法如下:
30.(1)组织rna提取:取肺癌及其配对癌旁组织适量,用组织匀浆器进行研磨,加入1ml trizol,于摇床上5min,收集瓶中细胞及裂解液于干净的ep管中。加入200ul氯仿,剧烈震荡15s,充分混匀并室温静置3min后于4℃离心机离心(12000rpm/min
×
15min)。吸取上清于新的ep管中,加入0.5ml异丙醇,上下颠倒混匀后放置10min,4℃离心机离心(12000rpm/min
×
15min),可见管底有白色沉淀。弃上清液,加入75%乙醇1ml洗涤沉淀2次,4℃离心(7500rpm/min
×
5min)。弃上清液,冰上干燥5min,加入20ul depc水溶解沉淀,酶标仪测定rna浓度。
31.(2)逆转录在体积为0.2ml ep管中加入rna 1μg,oligo 1μl,补充适量depc水使总体积达5μl。离心混匀后,置于70℃加热5min,冰上3min。然后加入下列试剂的混合物:
[0032][0033]
混匀,离心,上机:40℃1h;70℃15min;4℃10min。
[0034]
(3)pcr扩增:pcr反应体系配制(10μl)
[0035][0036][0037]
pcr反应条件:95℃2min;95℃30s,55℃30s,72℃30s,目的基因组重复以上过程32个循环,内参组重复以上过程23个循环;72℃3min。以β-actin基因为内参照。反应结束后用2%琼脂糖凝胶电泳(120v,25min)77。
[0038]
1)稀释cdna:用depc水按9:1稀释cdna
[0039]
2)避光配制pcr反应混合液(10μl):
[0040][0041]
3)混合离心后上机:50℃2min;95℃10min;95℃15s,60℃1min,重复40次;95℃15s;60℃1min;95℃15s。
[0042]
4)根据2-δδct公式处理分析数据。
[0043]
实施例2确定cldn11启动子区域甲基化的启动子区域
[0044]
利用methytarget技术,检测肺癌、癌旁样本中cldn11启动子区域(转录起始位点tss:+1021~+1233)甲基化状态,共计61例肺癌组织,47例癌旁组织,其中30例样本为配对样本。结果如图4a、4b所示,结果显示,cldn11在转录起始位置tss:+1021~+1132这个区域内肺癌的甲基化频率更高,且癌旁的甲基化频率更低。
[0045]
利用methytarget技术,检测肺癌、癌旁样本中septin9(转录起始位点tss:+771~
+952)甲基化状态,共计10例肺癌组织,9例癌旁组织。结果如图4c所示,结果显示,与已有甲基化标志物septin9结果相似。
[0046]
其中,检测方法如下:
[0047]
(1)组织dna提取及纯化
[0048]
按照qiaamp dna mini kit(qiagen,usa)试剂盒操作说明书对肺癌及癌旁组织提取dna并进行纯化。
[0049]
(2)特异性甲基化引物设计
[0050][0051]
(3)methyltarget进行多重目的区域甲基化富集测序
[0052]
使用亚硫酸盐将dna进行修饰后,结合目的区域富集和二代测序技术,对cldn11m目的区域甲基化水平检测。methyltarget方法基于二代测序,可以获得目标区域内所有c的甲基化数据;-500
×
的测序深度;精确计算每个位点c的甲基化程度;通量高,可同时对成百上千个区域进行甲基化程度分析;适用于大样本多区域的dna甲基化水平检测。
[0053]
methyltarget引物序列如下:
[0054][0055]
(4)甲基化特异性pcr方法
[0056]
1)dna重亚硫酸盐修饰
[0057]
配制ct conversion reagent混合液:m-dilution buffer 300μl,m-dissolving buffer 50μl,depc h2o 900μl。在m-wash buffer中加入100%乙醇24ml备用。
[0058]
在130ul ct conversion reagent中加入20uldna,混匀后孵育。反应条件:98℃10mins,64℃2.5h,4℃20h。随后转移液体至离心柱,加入600ul m-binding buffer,混匀后离心(12000rpm/30s),弃上清。加入200ul m-wash buffer,离心(12000rpm/30s),弃上清。加入m-desulphonation buffer,室温静置20mins,离心(12000rpm/30s),弃上清。加入200ul m-wash buffer,离心(12000rpm/30s),弃上清。将离心柱套入新的无酶ep管中,加入10μl m-elution buffer,离心(12000rpm/30s),收集滤液,-20℃保存。
[0059]
2)0.5ul经重亚硫酸盐修饰的dna加入下列试剂混合物:
[0060][0061]
混匀后瞬离,上机40个循环。反应条件:95℃10mins,95℃30s,(58℃/u;60℃/m)30s,72℃30s,72℃10mins。反应结束后用琼脂糖凝胶电泳。
[0062]
实施例3cldn11甲基化在肺癌中的检测灵敏度验证
[0063]
取20例肺癌样本,用msp方法分别对cldn11甲基化在肺癌中的检测灵敏度和septin9甲基化在肺癌中的检测灵敏度进行验证,结果如图5所示,结果表明,cldn11甲基化在肺癌中的检测灵敏度为95%(19/20)(图5a),而septin9甲基化的检测灵敏度仅55%(11/20)(图5b)。
[0064]
实施例4cldn11甲基化的状态可以有效区分血清中癌和非癌
[0065]
取20例肺癌患者血清和20例健康患者血清样本,利用biscap液相技术检测血清中全基因组dna的cldn11甲基化(转录起始位点tss:+1021~+1132)状态和septin9甲基化(转录起始位点tss:+771~+952)状态。结果如图6所示,结果表明,通过检测血清中cldn11高甲基化启动子区域(转录起始位点tss:+1021~+1132)甲基化水平可以有效的区分血清样本的来源于肺癌患者还是正常人群(图6a)。然而septin9在血清中的甲基化状态并不能对血清样本的来源进行有效的判断(图6b)。结果提示,在肺癌的早诊早筛中,特别是在易于获得的血清样本,将cldn11作为甲基化标志物研制的试剂盒比现有甲基化试剂盒更具有潜在的应用价值。
[0066]
其中,检测方法如下:
[0067]
(1)血清中基因组dna提取
[0068]
收集20例肺癌患者血清和20例健康患者血清,使用qiaamp dna blood mini kit(qiagen,usa),按照试剂盒说明书提取血清中的全基因组dna。
[0069]
(2)利用biscap液相技术检测对特定区域进行甲基化检测
[0070]
取2ug血清基因组dna进行重亚硫酸盐修饰,采用biscap dna甲基化液相捕获技术,对bisulfite dna进行目标区域的高效、特异富集,在hiseqx10或novaseq平台上进行高通量、高深度测序,采用bsmap自带脚本methratio进行甲基化位点检测。
[0071]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所有的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1