吉西他滨前药及其医药用途
本发明属于生物医药领域,具体涉及一类吉西他滨前药,本发明还涉及该类化合物作为抗肿瘤药物的医药用途。
背景技术:
1、癌症将成为21世纪死亡的首要原因,并且将是世界各国提高预期寿命的最重要障碍。临床上虽然有多种抗肿瘤药物可供使用,但是由于肿瘤病因的复杂性、肿瘤的耐药性以及抗肿瘤药物的毒副作用等因素,现有的药物仍然不能满足临床治疗的需要。因此,寻找药效强、靶向性强、毒副作用小的新型抗肿瘤药物具有重要意义。核苷衍生物是一种广泛用于癌症治疗的化疗药物,而吉西他滨(gemcitabine)是一种胞嘧啶核苷衍生物,1996年被美国fda批准上市,临床上主要用于乳腺癌、膀胱癌、胰腺癌、卵巢癌以及其他各种实体瘤的治疗。在临床使用中,00吉西他滨极易被肝脏和血液中大量存在的胞苷脱氨酶(cda)代谢失活,导致其在体内的半衰期较短(30~90min),又因其具有较强的亲水性,难以扩散入胞,导致其生物利用度较低。2009年,礼来公司用丙戊酸修饰吉西他滨的氨基,得到前药ly2334737。该化合物表现出优良的化学稳定性和酶稳定性;而活性研究表明,口服ly2334737的抗肿瘤活性优于吉西他滨。2014年,mcguigan团队将protide前药策略应用于吉西他滨,并筛选出最理想的前药nuc-1031。nuc-1031的代谢活化并不依赖脱氧胞苷激酶,而吸收入胞不依赖核苷转运体,此外还可抵抗cda的降解失活,目前该药正在开展临床iii期试验。
2、nqo1(依赖还原型辅酶i/ii醌氧化还原酶1,nad(p)h:quinone oxidoreductase1)是一种黄素蛋白酶,以nadh或nadph为辅因子,催化醌类及其衍生物失去两个电子,发生还原反应。nqo1在诸多实体瘤(如乳腺癌、肺癌、前列腺癌、胃癌、结肠癌、胰腺癌等)中高表达,约为正常组织的5-200倍。本发明在吉西他滨上引入nqo1响应的醌丙酸或同时引入protide策略,期望能获得抗肿瘤活性理想的化合物。
技术实现思路
1、针对现有技术存在的问题,本发明的第一个目的是提供一种新型吉西他滨前药,该类前药能够被肿瘤组织及肿瘤微环境内高表达的nqo1酶激活,释放出活性代谢物,进而产生良好的抗肿瘤作用,且有较高的肿瘤特异性,安全性理想。
2、本发明的第二个目的是提供前述吉西他滨前药的制备方法。
3、本发明的第三个目的是提供前述吉西他滨前药的医药用途。
4、为了实现上述目的,本发明解决其技术问题采用的技术方案是:
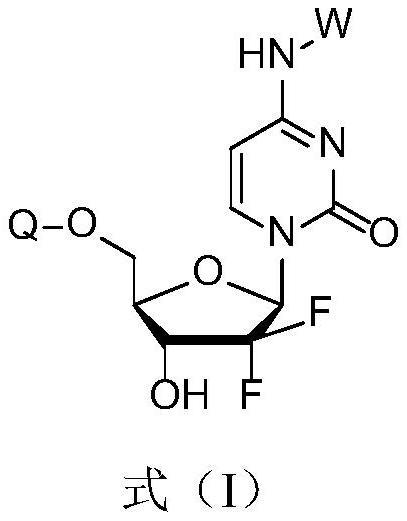
5、第一方面,本发明保护一种吉西他滨前药,所述吉西他滨前药为结构式如式(i)的化合物或其药学上可接受的盐、互变异构体、内消旋体、外消旋体、立体异构体或溶剂化物:
6、
7、其中,w选自:
8、x选自:h、卤素原子、c1-3烷基、c1-3烷氧基、氰基、硝基或羧基;x可以是任意位置的单取代或多取代;
9、y选自:o、s、nh或nch3;
10、q选自:h或
11、r1或r2各自独立的选自:氢、1-6个碳的直链或支链烷基、苄基或苯环含取代基的苄基;
12、r3选自:1-6个碳的直链或支链烷基、苄基或苯环含取代基的苄基;
13、ar选自:苯基、含取代基的苯基、1-萘基或2-萘基。
14、进一步的,
15、其中,w选自:
16、x选自:h、f、cl、br、i、ch3、ch3o、cn、no2或cooh;x可以是任意位置的单取代或多取代。
17、更进一步的,w选自:
18、y选自:o、s、nh或nch3。
19、进一步的,q选自:h或r1或r2各自独立的选自:氢、甲基、乙基、异丙基或苄基。
20、更进一步的,所述r1或r2为氢。
21、进一步的,r3选自:甲基、乙基、异丙基、环己基或苄基。
22、更进一步的,r3选自:异丙基或苄基。
23、进一步的,ar选自:苯基或1-萘基。
24、更进一步的,ar选自:苯基。
25、第二方面,本发明还提供以下化合物:
26、
27、及其药学上可接受的盐、互变异构体、内消旋体、外消旋体、立体异构体或溶剂化物。
28、第三方面,本发明提供一种前述化合物的制备方法,其合成路线如图7所示,其中,g1或g2各自独立的选自:氢或羟基保护基;所述羟基保护基可以是:叔丁氧羰基(boc)、苄氧羰基(cbz)、芴甲氧羰基(fmoc)、苄基(bn)、乙酰基(ac)、三甲基硅基(tms)、二叔丁基甲基硅基(tbs)、三异丙基硅基(tis)或三苯基硅基;
29、w-z1结构式如下所示:
30、
31、其中,w选自:
32、x选自:h、f、cl、br、i、ch3、ch3o、cn、no2或cooh;x可以是任意位置的单取代或多取代;
33、y选自:o、s、nh或nch3;
34、z1或z2各自独立的选自:氢或离去基团;所述离去基团可以是:cl、br、苯氧基、4-硝基苯氧基或五氟苯氧基;
35、q选自:h或
36、r1或r2各自独立的选自:氢、1-6个碳的直链或支链烷基、苄基或苯环含取代基的苄基;
37、r3选自:1-6个碳的直链或支链烷基、苄基或苯环含取代基的苄基;
38、ar选自:苯基、含取代基的苯基、1-萘基或2-萘基。
39、本发明提供前述化合物的制备方法,其选自如下(a1)-(a4)中的任一种:
40、(a1):对吉西他滨的羟基进行保护,合成化合物ii;化合物ii在缩合剂和碱的作用下酰化合成化合物iii;移除化合物iii的保护基,得到目标化合物ia;
41、(a2):对吉西他滨的羟基进行保护,合成化合物ii;化合物ii经磷酰化得到化合物iv;化合物iv在缩合剂和碱的作用下酰化合成化合物v;移除化合物v的保护基,得到目标化合物ib;
42、(a3):化合物ia经磷酰化得到化合物ib;
43、(a4):吉西他滨可直接选择性酰化,得到目标化合物ic。
44、在一些具体的实施方案中,引入羟基保护基的方法是本领域技术人员众所周知的;其实例可参见peter g.m.wuts,greene's protective groups in organic synthesis(第5版),johnwiley&sons,ny(2015),在此将其全部引入作为参考。
45、在一些具体的实施方案中,酰化反应所用碱为三乙胺、二异丙基乙基胺、n-甲基吗啉、dmap或dbu;优选为三乙胺;所用溶剂包括但不限于:二氯甲烷、四氢呋喃、乙腈、n,n-二甲基甲酰胺、二甲基亚砜或者用这些溶剂任选组成的混合溶剂;反应温度为-50℃至100℃,优选的,所述反应温度为-10℃至70℃;更具体的,酰化反应中所用缩合剂为新戊酰氯、氯甲酸异丁酯、dcc或edci;所用添加剂为hobt或氯化锂。
46、在一些具体的实施方案中,移除羟基保护基的方法是本领域技术人员众所周知的;其实例可参见peter g.m.wuts,greene's protective groups in organic synthesis(第5版),johnwiley&sons,ny(2015),在此将其全部引入作为参考。
47、在一些具体的实施方案中,磷酰化所采用的溶剂包括但不限于:甲苯、四氢呋喃、乙腈、n,n-二甲基甲酰胺、二甲基亚砜、n-甲基吡咯烷酮、吡啶或者用这些溶剂任选组成的混合溶剂;所采用的碱为钠氢、叔丁醇钾、叔丁醇钠、叔丁基氯化镁、甲基氯化镁、苯基氯化镁、二甲基氯化铝、dmap或dbu;反应温度为-50℃至80℃,优选的,所述反应温度为-10℃至30℃。
48、第四方面,本发明还保护一种药物组合物,包含前文所述的化合物或其药学上可接受的盐、互变异构体、内消旋体、外消旋体、立体异构体或溶剂化物,以及药学上可接受的载体。
49、本发明的药物可以是前文所述的化合物本身与药学上可接受的稀释剂、辅助剂和/或载体等混合的药物,也可以是以本发明的化合物或其药学上可接受的盐、互变异构体、内消旋体、外消旋体、立体异构体或溶剂化物作为活性成分之一的组合物与药学上可接受的稀释剂、辅助剂和/或载体等混合的药物。
50、第五方面,本发明还保护前文所述的化合物或其药学上可接受的盐、互变异构体、内消旋体、外消旋体、立体异构体或溶剂化物作为有效成分,在制备抗肿瘤药物中的应用。
51、本发明中,所述:
52、dbu是指:1,8-二氮杂双环[5.4.0]十一碳-7-烯(cas:6674-22-2)
53、dcc是指:二环己基碳二亚胺(cas:538-75-0)
54、dmap是指:4-二甲氨基吡啶(cas:1122-58-3)
55、edci是指:1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(cas:25952-53-8)
56、hatu是指:2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(cas:148893-10-1)
57、hbtu是指:o-苯并三氮唑-四甲基脲六氟磷酸盐(cas:94790-37-1)
58、hobt是指:1-羟基苯并三唑(cas:2592-95-2)
59、nbs是指:n-溴代琥珀酰亚胺(cas:128-08-5)
60、nmm是指:n-甲基吗啉(cas:109-02-4)
61、定义
62、除非另有说明,本技术中所用的下列术语具有下列含义。一个特定的术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照本领域普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
63、本文中的c1-3,是该部分具有给定范围中的1-3个碳原子。具体是指该基团可具有1个碳原子、2个碳原子或3个碳原子。
64、术语“烷基”是指通式为cnh 2n+1的烃基。该烷基可以是直链或支链的。例如,术语“c1-3烷基”指含有1至3个碳原子的烷基(例如甲基、乙基、正丙基、异丙基)。
65、术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
66、作为药学上可接受的盐,例如,可以提及金属盐、铵盐、与有机碱形成的盐、与无机酸形成的盐、与有机酸形成的盐、与碱性或者酸性氨基酸形成的盐等。
67、术语“药物组合物”是指一种或多种本技术的化合物或其盐与药学上可接受的辅料组成的混合物。药物组合物的目的是有利于对有机体给予本技术的化合物。
68、本技术还包括与本文中记载的那些相同的,但一个或多个原子被原子量或质量数不同于自然中通常发现的原子量或质量数的原子置换的同位素标记的本技术化合物。可结合到本技术化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,诸如分别为2h、3h、11c、13c、14c、13n、15n、15o、17o、18o、31p、32p、35s、18f、123i、125i和36cl等。
69、本技术的药物组合物可通过将本技术的化合物与适宜的药学上可接受的辅料组合而制备,例如可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等。
70、给予本技术化合物或其药学上可接受的盐或其药物组合物的典型途径包括但不限于口服、直肠、局部、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。
71、本技术的药物组合物可以采用本领域众所周知的方法制造,如常规的混合法、溶解法、制粒法、制糖衣药丸法、磨细法、乳化法、冷冻干燥法等。
72、在一些实施方案中,药物组合物是口服形式。对于口服给药,可以通过将活性化合物与本领域熟知的药学上可接受的辅料混合,来配制该药物组合物。这些辅料能使本技术的化合物被配制成片剂、丸剂、锭剂、糖衣剂、胶囊剂、液体、凝胶剂、浆剂、悬浮剂等,用于对患者的口服给药。
73、可以通过常规的混合、填充或压片方法来制备固体口服组合物。例如,可通过下述方法获得:将所述的活性化合物与固体辅料混合,任选地碾磨所得的混合物,如果需要则加入其它合适的辅料,然后将该混合物加工成颗粒,得到了片剂或糖衣剂的核心。适合的辅料包括但不限于:粘合剂、稀释剂、崩解剂、润滑剂、助流剂、甜味剂或矫味剂等。
74、药物组合物还可适用于肠胃外给药,如合适的单位剂型的无菌溶液剂、混悬剂或冻干产品。
75、本技术的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本技术的实施例。
76、本技术具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本技术的化学变化及其所需的试剂和物料。为了获得本技术的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
77、有益效果
78、与现有技术相比,本发明提供的吉西他滨前药具有理想的抗肿瘤活性;前药能够被nqo1酶代谢,肿瘤靶向性更强;前药受胞苷脱氨酶及核苷转运体影响更小。
- 还没有人留言评论。精彩留言会获得点赞!