一种脂肪干细胞制备方法与流程
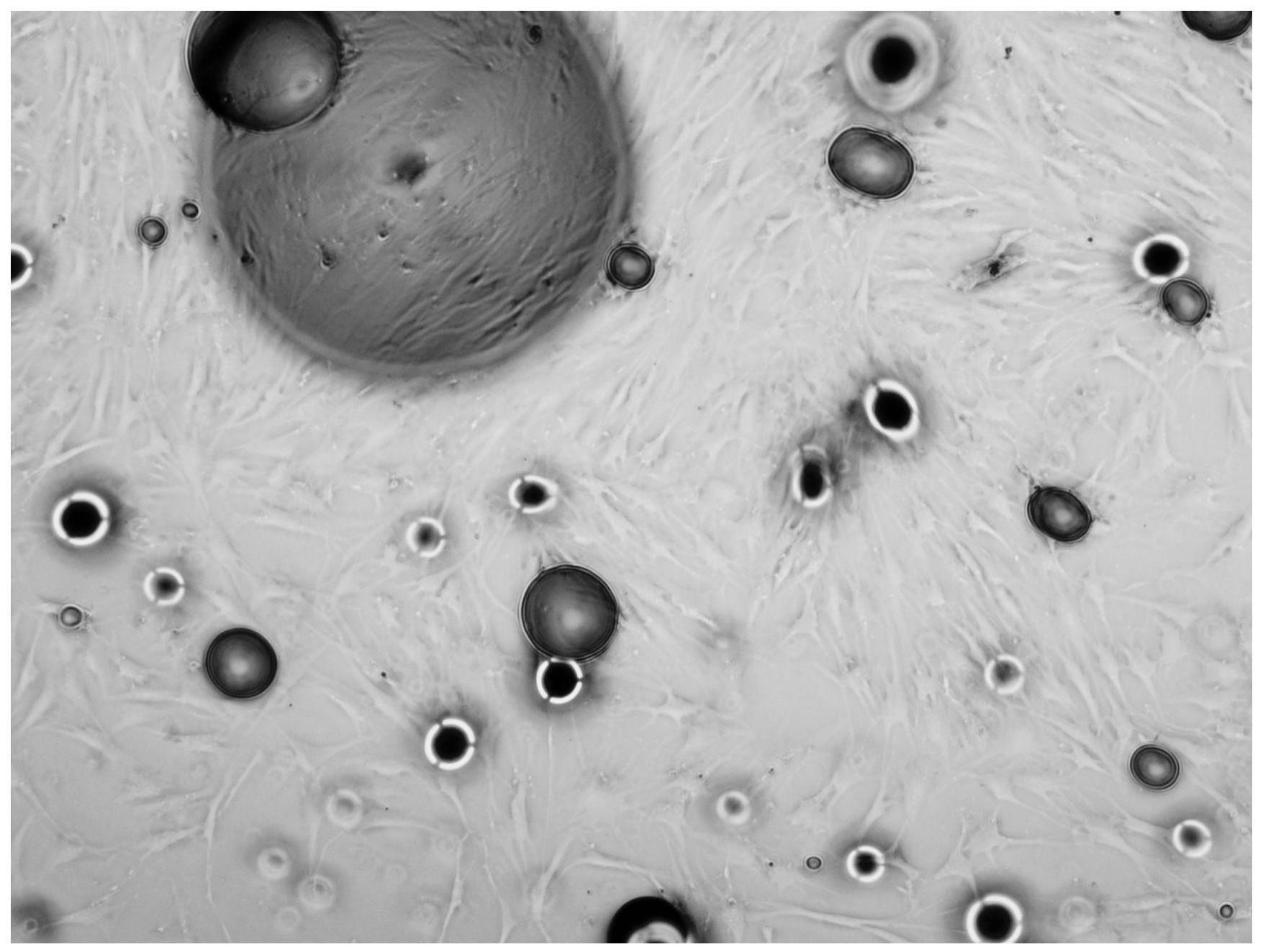
本发明涉及一种干细胞制备方法,特别是涉及一种脂肪干细胞制备方法,属于干细胞制备方法。
背景技术:
1、在再生医学中,成体干细胞是基于细胞疗法的最有希望的细胞类型,作为多能干细胞的新来源,人类脂肪组织已被引入,这些所谓的脂肪干细胞(adsc)被认为是再生疗法应用的理想选择,与源自其他来源(例如骨髓)的间充质干细胞相比,它们的主要优势在于它们可以使用微创技术轻松且可重复地获取,并且发病率低。
2、adsc是多能的并且可以分化成三胚系的各种细胞类型,包括例如骨细胞、脂肪细胞、神经细胞、血管内皮细胞、心肌细胞、胰腺β细胞和肝细胞,adscs的特点是免疫抑制特性和低免疫原性。它们分泌的营养因子在广泛的应用中加强了治疗和再生的结果。因此,adscs的治疗潜力是巨大的。
3、骨髓来源的msc不适合临床使用,为了在21世纪初寻找替代干细胞来源,zuk等人,介绍了一种多能、未分化、自我更新的祖细胞群,该祖细胞群从脂肪组织中分离出来,在形态和表型上与msc相似,这些所谓脂肪组织衍生干细胞(adscs)显示出类似于mscs的分化能力,并显示出体内特定干细胞标志物的表达,重要的是,通过微创方法易于重复获取皮下脂肪组织、简单的分离程序以及不随患者年龄而下降的干细胞质量和增殖能力概述了adsc作为替代临床细胞来源的优势并提供优于骨髓来源的msc的明显优势。
4、干细胞,包括adsc,由于它们能够分化成各种不同的细胞谱系,已成为再生医学疗法的关键要素。
5、在现有技术中进行对脂肪干细胞的制备的过程中其存在提取比较复杂提取纯度不够高的问题。
6、为此设计一种脂肪干细胞制备方法来解决上述问题。
技术实现思路
1、本发明的主要目的是为了提供一种脂肪干细胞制备方法,将50ml脂肪组织样本采集至采集瓶内,并喷洒酒精放入生物安全柜静置5min以上,准备相应的离心管若干5-10个,每个离心管中加入生理盐水20ml,备用,用25ml移液管吸取静置后分层的采集瓶中的脂肪样本中下层液体弃掉,再用25ml移液管吸取脂肪组织,每个离心管中加入等体积的脂肪组织每管加20-25ml,盖好盖子,上下颠倒几次,摇匀,其中上层是油脂层,中层是脂肪组织层,下层是肿胀液层,将上述处理分离完成的脂肪组织配平离心,其中配平采用电子天平配平,且离心旋转为1500rpm,离心5min,将步骤三中的脂肪组织进行离心处理,离心后分上中下三层,上层的油脂和下层的清洗液吸出弃掉,再用25ml移液管吸取脂肪组织至干净的离心管中,每管加入等量脂肪组织,避开白色筋膜组织,将加有脂肪组织的离心管里加入等体积的生理盐水总量不超过45ml,盖好盖子,上下颠倒几次摇匀,同上述操作进行第二次离心,离心完后,同样是吸出脂肪油脂和下层清洗液,避开白色筋膜组织将脂肪组织用25ml移液管吸出到干净的离心管中,将清洗的脂肪组织放入50ml离心管中,用弯尖头精细剪剪碎组织,约剪300次,,剪碎后组织1ml重0.8g,脂肪组织量为15-25ml,加入生理盐水至总体积为40ml,混匀,30mg胶原酶i溶解于10mlpbs溶液,0.22um过滤除菌后2倍稀释,获得浓度为1mg/ml的胶原酶i,将洗涤后的脂肪加入1mg/ml的胶原酶i比例为1:1,置于恒温振荡培养床内,37℃,130rpm条件下消化40分钟,消化完成后1300rpm离心10分钟,去上清,底部沉淀为脂肪干细胞,pbs重悬洗涤离心2次,重复上述步骤十操作,离心后将下清液转移至50ml离心管,并取1.5~2.0ml加入冻存管用于留样。
2、本发明的目的可以通过采用如下技术方案达到:
3、一种脂肪干细胞制备方法,包括如下步骤:
4、步骤一:将50ml脂肪组织样本采集至采集瓶内,并喷洒酒精放入生物安全柜静置5min以上;
5、准备相应的离心管若干5-10个,每个离心管中加入生理盐水20ml,备用;
6、步骤二:用25ml移液管吸取静置后分层的采集瓶中的脂肪样本中下层液体弃掉,再用25ml移液管吸取脂肪组织,每个离心管中加入等体积的脂肪组织每管加20-25ml,盖好盖子,上下颠倒几次,摇匀;
7、其中上层是油脂层,中层是脂肪组织层,下层是肿胀液层;
8、步骤三:将上述处理分离完成的脂肪组织配平离心;
9、其中配平采用电子天平配平,且离心旋转为1500rpm,离心5min;
10、步骤四:将步骤三中的脂肪组织进行离心处理,离心后分上中下三层,上层的油脂和下层的清洗液吸出弃掉,再用25ml移液管吸取脂肪组织至干净的离心管中,每管加入等量脂肪组织,避开白色筋膜组织;
11、步骤五:将加有脂肪组织的离心管里加入等体积的生理盐水总量不超过45ml,盖好盖子,上下颠倒几次摇匀,同上述操作进行第二次离心;
12、步骤六:离心完后,同样是吸出脂肪油脂和下层清洗液,避开白色筋膜组织将脂肪组织用25ml移液管吸出到干净的离心管中;
13、步骤七:将清洗的脂肪组织放入50ml离心管中,用弯尖头精细剪剪碎组织,约剪300次,,剪碎后组织1ml重0.8g,脂肪组织量为15-25ml,加入生理盐水至总体积为40ml,混匀;
14、步骤八:30mg胶原酶i溶解于10mlpbs溶液,0.22um过滤除菌后2倍稀释,获得浓度为1mg/ml的胶原酶i;
15、步骤九:将洗涤后的脂肪加入1mg/ml的胶原酶i比例为1:1,置于恒温振荡培养床内,37℃,130rpm条件下消化40分钟;
16、步骤十:消化完成后1300rpm离心10分钟,去上清,底部沉淀为脂肪干细胞,pbs重悬洗涤离心2次;
17、重复上述步骤十操作,离心后将下清液转移至50ml离心管,并取1.5~2.0ml加入冻存管用于留样。
18、优选的,在步骤七中剪碎后组织1ml重0.8g。
19、优选的,在步骤九后消化完后1300rpm离心10分钟,去上清,底部沉淀为脂肪干细胞,pbs重悬洗涤离心2次,根据洗涤后获的脂肪组织,1ml脂肪组织接种一个t175细胞培养瓶进行接种培养,且每t175培养瓶加入22ml培养基,标记好培养标签,摇匀,放入37℃,5%co2恒温培养箱静置培养。
20、优选的,还包括对细胞进行换液,倾斜瓶口将旧液体倒入50ml离心管内;
21、加入新f-m-n培养基t175培养瓶加入22ml,t75培养瓶加入12ml,t25培养瓶加入5ml,拧紧瓶盖,使培养基平铺于培养面,放入5%co2,37℃培养箱中培养;
22、换液周期根据细胞状况不同有所调整。
23、优选的,换液时在无菌操作情况下并防止细胞间的交叉污染,每次只操作同一供者细胞的操作,移液管只用于对同一种液体的吸取;
24、换液周期根据细胞状况不同有所调整;
25、每天观察细胞形态,掌握好细胞是否健康的标准:健康细胞的形态饱满,折光性好,生长致密时即可传代。
26、优选的,在细胞换液后还包括胰蛋白酶消化如下步骤:
27、步骤一:吸出旧培养液于50ml离心管,用10ml0.9%氯化钠注射液清洗培养瓶并吸出0.9%氯化钠注射液,加入2.5ml重组胰酶溶液;
28、其中f-m-n培养基,在培养过程中之前接种加入的培养基则为旧培养基即培养原液;
29、步骤二:倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不在连接成片;
30、步骤三:加入5ml旧培养液终止消化,吹打分散细胞,用移液管将已经消化细胞反复吹打,使其脱壁并分散;
31、步骤四:将细胞悬液吸入50ml离心管中,加入0.9%氯化钠注射液至40ml;
32、步骤五:将离心管上下颠倒混匀,放入离心机,配平,2000转/分钟离心3分钟,弃上清液,轻拨离心管底部打散细胞,加入适量新鲜培养基制成细胞悬液。
33、优选的,在细胞换液后还包括细胞传代,具体步骤如下:
34、步骤一:取混匀后0.2ml细胞悬液于0.6mlep管中,于计数仪计数;
35、步骤二:根据计数结果确定传代量,取相应量培养瓶,做好标记;
36、步骤三:加入22mlf-m-n培养基;
37、步骤四:根据细胞悬液体积将细胞悬液吸出分装至培养瓶中,拧紧瓶盖,使细胞悬液平铺培养面,于桌面上以画∞形式,混匀细胞悬液;
38、步骤五:将培养瓶放入co2培养箱中培养。
39、本发明的有益技术效果:
40、本发明提供的一种脂肪干细胞制备方法,将50ml脂肪组织样本采集至采集瓶内,并喷洒酒精放入生物安全柜静置5min以上,准备相应的离心管若干5-10个,每个离心管中加入生理盐水20ml,备用,用25ml移液管吸取静置后分层的采集瓶中的脂肪样本中下层液体弃掉,再用25ml移液管吸取脂肪组织,每个离心管中加入等体积的脂肪组织每管加20-25ml,盖好盖子,上下颠倒几次,摇匀,其中上层是油脂层,中层是脂肪组织层,下层是肿胀液层,将上述处理分离完成的脂肪组织配平离心,其中配平采用电子天平配平,且离心旋转为1500rpm,离心5min,将步骤三中的脂肪组织进行离心处理,离心后分上中下三层,上层的油脂和下层的清洗液吸出弃掉,再用25ml移液管吸取脂肪组织至干净的离心管中,每管加入等量脂肪组织,避开白色筋膜组织,将加有脂肪组织的离心管里加入等体积的生理盐水总量不超过45ml,盖好盖子,上下颠倒几次摇匀,同上述操作进行第二次离心,离心完后,同样是吸出脂肪油脂和下层清洗液,避开白色筋膜组织将脂肪组织用25ml移液管吸出到干净的离心管中,将清洗的脂肪组织放入50ml离心管中,用弯尖头精细剪剪碎组织,约剪300次,,剪碎后组织1ml重0.8g,脂肪组织量为15-25ml,加入生理盐水至总体积为40ml,混匀,30mg胶原酶i溶解于10mlpbs溶液,0.22um过滤除菌后2倍稀释,获得浓度为1mg/ml的胶原酶i,将洗涤后的脂肪加入1mg/ml的胶原酶i比例为1:1,置于恒温振荡培养床内,37℃,130rpm条件下消化40分钟,消化完成后1300rpm离心10分钟,去上清,底部沉淀为脂肪干细胞,pbs重悬洗涤离心2次,重复上述步骤十操作,离心后将下清液转移至50ml离心管,并取1.5~2.0ml加入冻存管用于留样。
- 还没有人留言评论。精彩留言会获得点赞!