一种自噬靶向纳米抗体的嵌合体及其应用
本发明属于靶向蛋白降解,具体涉及一种自噬靶向纳米抗体嵌合体及其应用。
背景技术:
1、靶向蛋白降解技术(targeted-protein degradation,tpd)包括基于蛋白酶体和溶酶体的降解技术正在快速成为药物开发的新手段。基于蛋白酶体降解的技术以靶向蛋白酶体嵌合体(proteolysis-targeting chimera,protac)技术为代表,使用双功能的小分子将靶蛋白招募到e3泛素连接酶上,使待降解的靶蛋白被泛素化,泛素化后的靶标蛋白进而被蛋白酶体降解。在另一方面,基于溶酶体的降解手段拥有自己的特色和技术优势,包括可以降解除了可溶的蛋白之外的蛋白酶体难以降解的靶标蛋白,包括细胞器等等。
2、在这个方面,基于巨自噬(macroautophagy,后续均简称为自噬)的降解方法在近几年来被开发出来,基于自噬途径实现除了可溶蛋白之外的细胞膜外蛋白,蛋白聚集体,细胞器,非蛋白质(如脂滴)在内的诸多靶标的降解。从机理上讲,自噬依赖于所形成的自噬体(autophagosome)以包裹待降解的胞内靶标,之后与溶酶体融合之后形成自噬溶酶体(auotolysosome)进而实现对这些靶标蛋白的降解。最近几年发展起来的基于自噬的降解技术相关的代表性工作包括autac,autotac和attec,他们均用双功能的化学小分子,其中一个小分子靶头靶向自噬过程,另一个小分子靶头结合靶标蛋白,从而这些小分子可以将一个靶标蛋白靶向自噬过程。其中autac利用cgmp(半胱氨酸-s-鸟嘌呤)小分子靶头来靶向自噬过程,autotac靶向自噬受体p62蛋白,attec靶向细胞自噬标志物lc3蛋白。以上的这些基于细胞自噬的新一代降解技术均利用化学小分子而实现,这些小分子的化学结构较为复杂,合成和制备都比较有难度,提高了靶向自噬的难度。另外,化学小分子配体在结合能力和特异性方面一般都难以比拟,会存在脱靶效应等问题。这些化学小分子由于含有双靶头,分子量大,不一定能很好地穿透进细胞,很难进入细胞内,实现胞内的自噬效果,同时也往往不大符合经典的成药特征,因为经典的药物分子分子量一般适中(500da前后),穿膜性能良好才能满足成药的特征。
技术实现思路
1、本发明的目的是为了实现细胞内的目标细胞蛋白或细胞器的靶向降解,同时也具有降解膜蛋白和分泌蛋白的潜力。
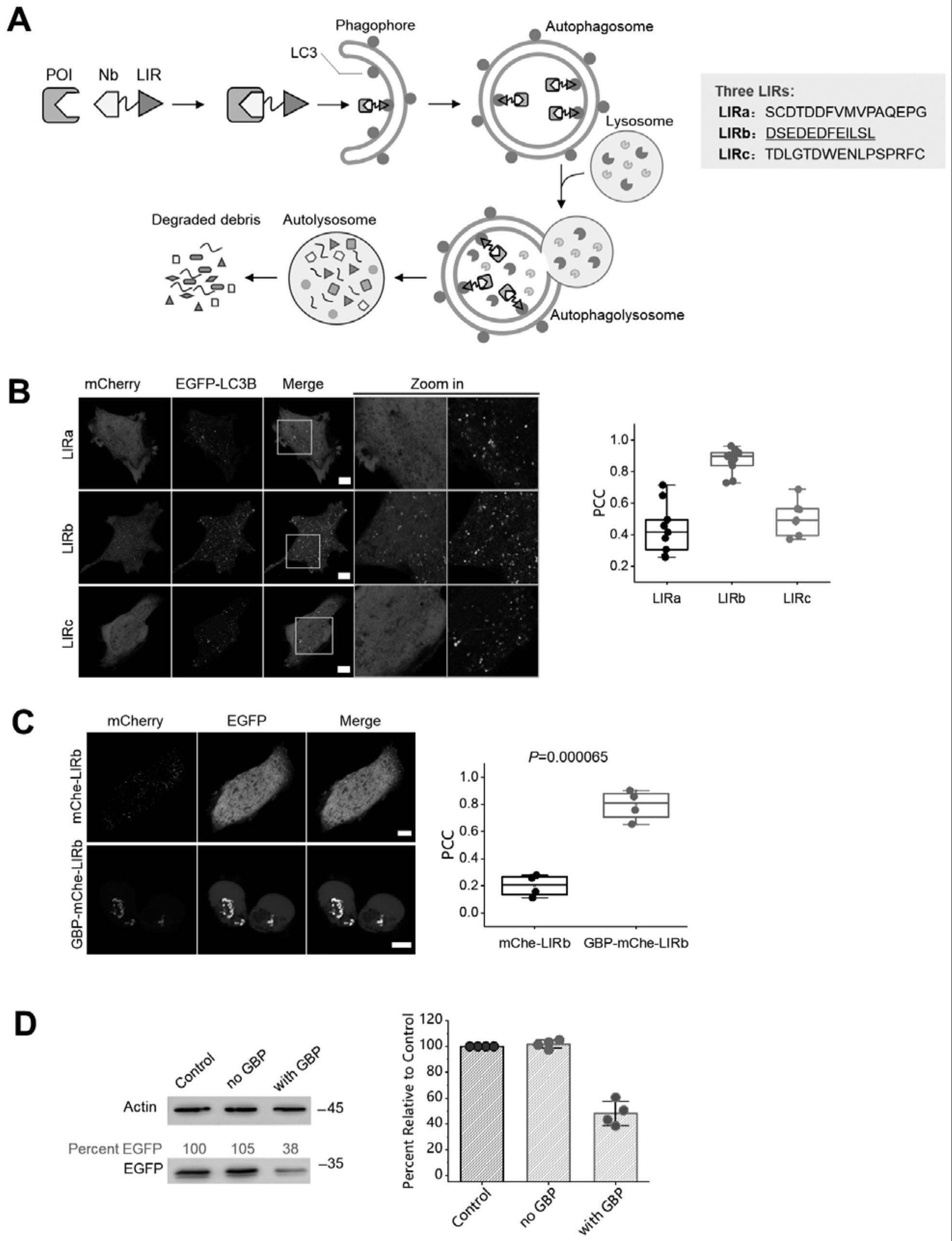
2、本发明提供一种自噬靶向纳米抗体的嵌合体,简称atnc,也就叫做自噬抗体(phagobody)所述嵌合体是由纳米抗体与自噬标记物连接组成的。
3、进一步地限定,所述纳米抗体可以实现靶向识别细胞内的靶标的作用;所述自噬标记物可以实现对靶标的自噬降解作用;所述连接方式是通过基因相连接后表达成自噬靶向纳米抗体的嵌合体、或者蛋白质连接,或者通过二聚化连接。
4、进一步地限定,自噬标记物是lc3互作基序或lc3自噬标记物;所述纳米抗体是识别eg5蛋白、rac1蛋白、tiam1蛋白、rhoa蛋白、荧光蛋白或he4蛋白。
5、进一步地限定,自噬标记是lirb基序或lc3b自噬标记物,连接方式是基因连接或者蛋白连接。
6、进一步地限定,自噬标记是lirb基序或lc3b自噬标记,所述连接方式是利用abics修饰的纳米抗体,pylcs修饰自噬标记,在aba诱导下实现二聚化连接;所述abics的氨基酸序列如seq id no.16所示;所述pylcs的氨基酸序列如seq id no.17所示。
7、进一步地限定,所述lirb基序的氨基酸序列如seq id no.6所示;所述lc3b基序的氨基酸序列如seq id no.8所示。
8、本发明提供上述的嵌合体的制备方法,所述制备方法的具体步骤如下:
9、步骤1:编码纳米抗体的基因与编码自噬标记物的基因连接获得重组的基因序列;
10、步骤2:将步骤1中重组的基因序列连接蛋白表达载体,经过转染到细胞中获得表达的自噬靶向纳米抗体的嵌合体。
11、或者
12、将纳米抗体与lirb自噬标记或lc3b自噬标记连接后,通过二硫键与跨膜肽连接获得自噬靶向纳米抗体的嵌合体。
13、本发明提供上述的嵌合体的制备方法,所述制备方法的具体步骤如下:
14、步骤(1):编码纳米抗体的基因与编码abics基因连接获得重组基因序列1,编码pylcs基因与自噬标记物的编码基因连接获得重组基因序列2;
15、步骤(2):将重组基因序列1和重组基因序列2分别与蛋白表达载体连接获得两个重组表达载体,将上述两个重组表达载体共转染到细胞中,经过aba诱导发生二聚化反应获得表达的自噬靶向纳米抗体的嵌合体。
16、本发明提供一种降解细胞内物质的方法,利用上述的嵌合体,识别纳米抗体特异性结合的物质或与特异性结合的物质连接的其他成分,引发自噬反应降解胞内特异性结合的物质或特异性结合的物质连接的其他成分。
17、进一步地限定,胞内物质是蛋白、基因或者细胞器;所述其他成分是蛋白、基因或者细胞器。
18、本发明提供一种以非治疗目的降解胞内癌症相关蛋白的方法,其特征在于,具体步骤如下:
19、(1)编码荧光蛋白的基因与胞内编码癌症相关蛋白的基因序列连接而得到重组基因并插入到蛋白表达载体中;
20、(2)编码荧光纳米抗体的基因与编码lirb自噬标记或lc3b自噬标记的基因序列连接后获得重组基因并连接到蛋白表达载体中;
21、(3)将上述两个质粒共转染到细胞中,而实现对过表达的靶标蛋白的降解。
22、进一步地限定,所述胞内相关蛋白质为eg5蛋白、rac1蛋白、tiam1蛋白、rhoa蛋白;荧光纳米抗体为纳米抗体rbp时对应的荧光标签是mcherry标签;荧光纳米抗体为纳米抗体gfp时对应的荧光标签是egfp标签。
23、本发明提供一种降解胞内细胞器的方法,其特征在于,具体步骤如下:
24、(1)在胞内的细胞器膜的表面表达荧光标签获得重组细胞;
25、(2)构建嵌合体:编码荧光纳米抗体的基因与编码lirb自噬标记或lc3b自噬标记的基因序列连接后获得重组基因,将重组基因序列连接到蛋白表达载体中,转染到步骤(1)中的重组细胞中。
26、进一步地限定,所述细胞器为线粒体;荧光纳米抗体为纳米抗体rbp时对应的荧光标签是mcherry标签;荧光纳米抗体为纳米抗体gfp时对应的荧光标签是egfp标签。
27、本发明提供一种非治疗目的降解胞内肿瘤标志物的方法,其特征在于,具体步骤如下:
28、(1)构建嵌合体:纳米抗体与lirb自噬标记或lc3b自噬标记连接后,通过二硫键与跨膜肽连接获得嵌合体;
29、(2)将步骤(1)获得的嵌合体加入到细胞培养液中。
30、进一步地限定,所述胞内肿瘤标志物是he4蛋白,纳米抗体是he4纳米抗体(he4nb);进一步地限定,构建步骤(1)的方法是表达含有一个游离半胱氨酸,一个纳米抗体和lirb或者lc3b自噬标记物的嵌合体,基于这个游离半胱氨酸通过二硫键与跨膜肽连接获得嵌合体;
31、进一步地限定,c-端的游离半胱氨酸可以通过表达蛋白连接的反应用半胱氨酸将c-端的intein内肽标签切除而得到;跨膜肽是cys-(gly)n-cyclic(krrrrrrrrrre)-nh2,其中n为零或自然数,r:d-arg,r:l-arg,其结构所述he4蛋白的氨基酸序列如seq id no.15所示;he4nb的氨基酸序列如seq id no.4所示。
32、本发明提供上述的嵌合体在制备降解胞内肿瘤标志的药物或试剂中的应用。
33、有益效果:在本发明中引入了一种强大的模组化的自噬靶向纳抗嵌合体(autophagy-targeting nanobody chimera,atnc)技术,用于实现对胞内靶标的选择性降解,相应的这种模组化的嵌合体也可简称为自噬抗体(phagobody)。与近年来提出的基于小分子的自噬靶向降解技术相比,以及经典的基于蛋白酶体的降解技术相比,atnc技术具有如下有益效果:(1)可以规避化学小分子结构较为复杂,比较难以合成的困难,自噬抗体可以容易地通过构建质粒直接转染通过胞内表达而实现降解靶标蛋白;(2)atnc具有强大的模组化特征,只需要跟换纳米抗体靶头,就可以轻松实现降解不同的靶标蛋白;(3)纳米抗体相比于化学小分子,对靶标蛋白的亲和力强,且具有高特异性,因而脱靶效应小;(4)相比于基于蛋白酶体的降解技术,降解的底物范围很广,除了可溶性蛋白之外,还可以降解聚集蛋白、细胞器等等;(5)atnc技术可以跟化学诱导的临近cip技术相结合,拓展出cip小分子调控的降解手段;(6)可以设计和制备出可穿膜的自噬抗体药物,通过加药的手段降解靶标蛋白或者致病蛋白,具有开发成新一代药物的潜力;(7)具有降解膜蛋白以及胞浆中分泌蛋白的潜力。
- 还没有人留言评论。精彩留言会获得点赞!