一种山羊无浆体分离和鉴定方法
本技术涉及病原体分析,具体而言,涉及一种山羊无浆体分离和鉴定方法。
背景技术:
1、无浆体分类隶属于立克次体目,无浆体科,包括6个种和1个暂定种,分别是嗜吞噬细胞无浆体(a.phagocytophilum)、牛无浆体(a.bovis)、绵羊无浆体(a.ovis)、边缘无浆体(a.marginale)、中央无浆体(a.centrale)和扁平无浆体(a.platys),山羊无浆体(a.capra)为暂定种。2001年,学者基于16srrna和groel基因的种系分育分析对立克次体目进行重新划分,更新了无浆体科的埃立克体属和仅包括边缘无浆体和中央无浆体的无浆体属,当时牛无浆体被归入埃立克体属,牛埃立克体和扁平埃立克体被重新分类为牛无浆体和扁平无浆体,嗜吞噬细胞埃立克体、马埃立克体和人类粒细胞埃立克体由于遗传基因的相似性被统一为嗜吞噬细胞无浆体。山羊无浆体是近年来新发现的一个无浆体种,我国首次报道是在一例无症状山羊体内被检测到,后来li等(2015)在我国黑龙江省牡丹江森林中心医院的有硬蜱叮咬史的病人体内检测到,通过基于无浆体的16s rrna、msp4、glta和groel基因序列分析,认为这是一个无浆体新种,并暂命名为“山羊无浆体”,后来有研究者确定它是一种可经硬蜱传播的人兽共患病原体。
2、无浆体的传播媒介具有多样性,主要包括3种方式:经节肢动物传播、经卵或胎盘传播和经输血或血液污染物传播。在体外培养时,山羊无浆体在体外可成功感染人源hl–60细胞和thp–1细胞系,表明其对人类细胞具有感染能力。无浆体的致病性与受感染细胞的百分比与病原的生长阶段、宿主的易感性和菌株的侵袭力有关。受感染的宿主会产生血小板减少症,中性粒细胞减少症和中性粒细胞功能下降等,从而导致免疫抑制状态,进而促进机会性感染的发生。感染山羊无浆体出现的非特异性症状,包括:发热、头痛、全身乏力、皮疹和寒战等。鉴于山羊无浆体被认为是一种人兽共患病原体,其致病性对人们对待此病原态度至关重要,因此,关于该病原致病性的研究大家应该更加关注,但是现有技术中缺乏对山羊无浆体的有效分离鉴定方法。
技术实现思路
1、本技术的目的在于提供一种山羊无浆体分离和鉴定方法,此山羊无浆体分离和鉴定方法具有对山羊无浆体的有效分离鉴定的优点。
2、本技术解决其技术问题是采用以下技术方案来实现的。
3、本技术实施例提供一种山羊无浆体分离和鉴定方法,包括如下步骤:
4、a1、样品处理:采集山羊无浆体阳性山羊颈部静脉血液样品,抗凝处理后置于4℃下低温保存,作为样品;
5、a2、红细胞分离:将红细胞裂解液加入样品,轻轻吹打混匀,在10min后在2000g离心力条件下离心处理10min,去除沉淀,再在2000g离心力条件下离心处理30min,收集沉淀,得到红细胞悬液;
6、a3、红细胞裂解:向红细胞悬液中补入3体积倍的红细胞裂解液,在4℃下放置3-8min,得到病原悬液;
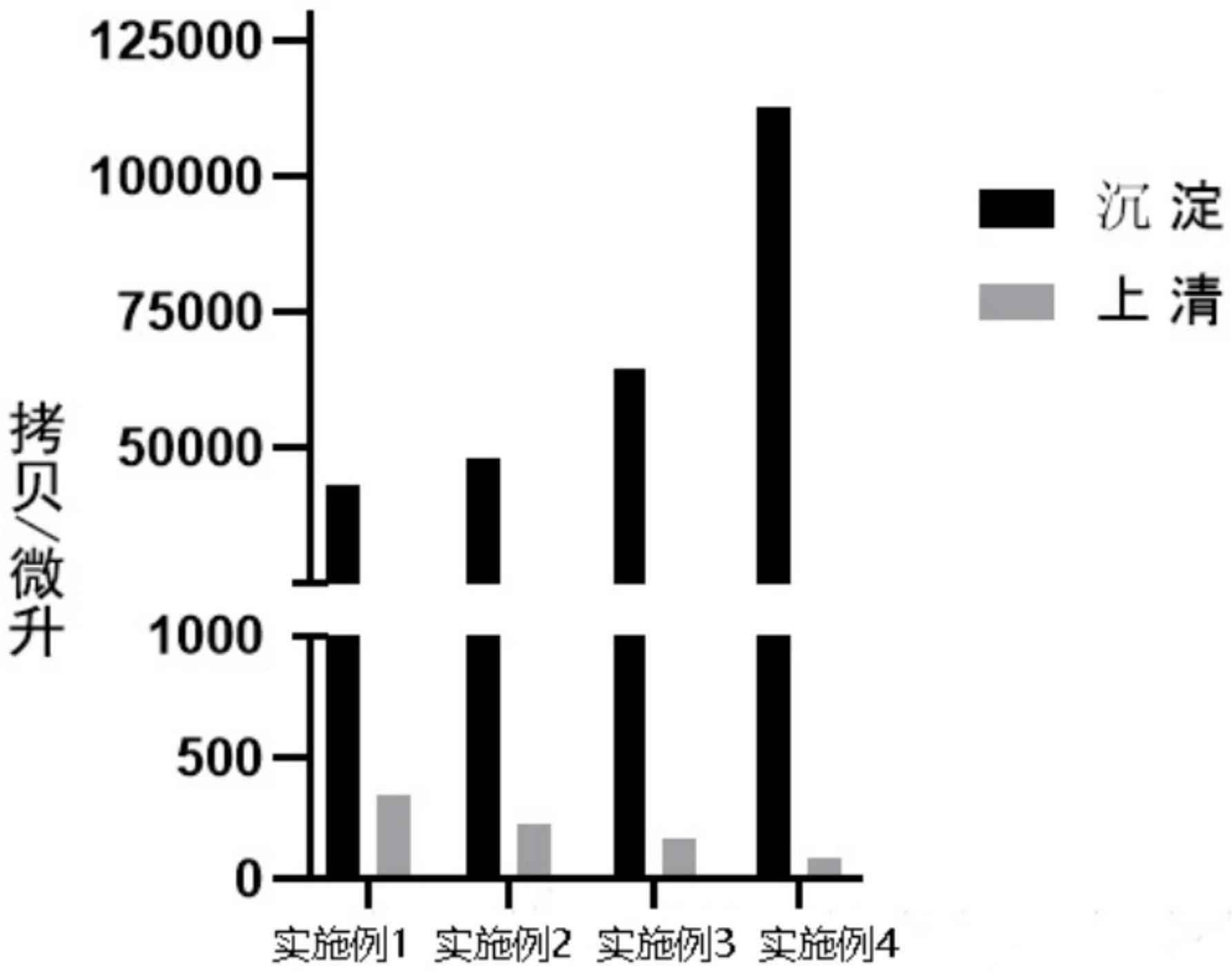
7、a4、病原分离纯化:将病原悬液中装入磁微粒在4℃温度、7000-10000g离心力下进行离心处理20-50min,分离上清液,再在上清液中装入磁微粒在30000g离心力下离心处理60-90min,分离沉淀;将沉淀用1×pbs磷酸盐缓冲溶液重悬后装入磁微粒在30000g离心力下离心处理60-90min,重复洗涤3次,得到最终沉淀;
8、a5、病原dna提取:取最终沉淀用血液dna提取试剂盒提取病原dna,最后用洗脱液洗脱出dna,得到dna样品;
9、病原鉴定:
10、1)质粒及标准曲线的构建:将山羊无浆体groel基因引物的扩增产物克隆至pmd–18t载体,在大肠杆菌dh5α感受态细胞中扩增,构建含山羊无浆体groel基因的质粒,将转化后的细胞用sanprep柱质粒mini–prep kit纯化质粒dna,利用超微量分光光度计进行定量,并根据公式:将单位换算成copies/μl;
11、2)病原鉴定及定量检测:使用荧光定量pcr仪对dna样品进行dna定量检测;
12、a6、病原冷冻和复苏:将分离得到的dna样品用含10%胎牛血清培养基重悬,并加入10%二甲基亚砜作为保护剂,依次置于4℃处理30min,–20℃处理30min,-80℃处理12h后转至液氮中长期保存,前述不同冻存温度下各保存1份用来进行病原形态检测;病原复苏时,将冻存管从液氮罐中取出,放入37℃水浴锅中快速解冻,期间多次晃动冻存管,使解冻在1-2min内完成;
13、a7、病原检测:
14、1)病原形态检测:分别取4℃、-20℃、-80℃和液氮冻存的冻存管内的病原悬液,在10000g离心力下离心30min后用戊二醛电镜固定液固定2h,在4℃12h,固定后离心收集细胞,用1×pbs磷酸盐缓冲溶液洗涤3次,每次10min,2%的oso4后固定,水洗后,用浓度为30%、50%、70%、80%、90%、100%和100%的乙醇系列脱水,用丙酮脱水15min,用1:1的丙酮和812环氧树脂包埋剂混合后处理2h,再用1:2的丙酮和812包埋剂混合后渗透12h,再用纯812包埋剂处理5-8h,将纯812包埋剂倒入包埋板,将样品插入包埋板后在37℃下12h,再在60℃下聚合处理48h,得到固化后的树脂块,将固化后的树脂块修整、切片,收集在规格为200的网格上,然后用2%的醋酸铀酰水和柠檬酸铅进行染色,最后在透射电子显微镜下观察并拍照;
15、2)病原活力检测:取复苏的病原体接种至含10%胎牛血清的培养基中,平均分配在24孔板中进行体外纯培养,分别在培养后0d、1d、2d、3d、4d和5d后收样,每个时间点取3个重复孔,将收取的样品用血液dna提取试剂盒提取dna,使用荧光定量pcr仪对病原体进行dna定量检测;
16、取1份山羊无浆体dna样品平均分成7份,其中1份作为起始浓度对照,另外6份加入与病原培养等量的培养基在24孔板中培养并随着病原收样时间点收取,7份dna样品按照病原dna提取方法提取dna,该dna样品用作dna降解速度的对照组;
17、3)病原感染力检测:取复苏的病原体人工接种至体外培养的山羊红细胞,试验中设置3次重复接种,用未接种的山羊红细胞作为阴性对照,正常培养3d后取样检查病原感染情况,取样后用1×pbs磷酸盐缓冲溶液洗涤3次,为了防止样品接种进去病原体的影响,洗涤时离心条件控制在500g离心力下处理5min;将洗涤后的细胞样品制作细胞涂片,同时提取样品dna,分别进行姬姆萨染色观察和pcr检测。
18、在本技术的一些实施例中,上述抗凝处理具体用肝素锂进行处理。
19、在本技术的一些实施例中,上述红细胞裂解液与样品的质量比为1:8。
20、在本技术的一些实施例中,上述病原鉴定步骤2)病原鉴定及定量检测的荧光定量pcr仪对dna样品进行dna定量检测具体是在20μl体系中进行,包含12.5μl tbgreentmpremix ex taq,上游和下游引物各0.5μl,2.5μl灭菌去离子h2o,样品dna 4μl;pcr反应条件为95℃、30s预变性,95℃、5s变性,55℃退火和延伸30s,35个循环。
21、在本技术的一些实施例中,上述a7步骤2)病原活力检测的荧光定量pcr仪的pcr反应在20μl体系中进行,包含12.5μl tb greentmpremix ex taq,上游和下游引物各0.5μl,2.5μl灭菌去离子h2o,样品dna 4μl;pcr反应条件为95℃、30s预变性,95℃、5s变性,55℃退火和延伸30s,35个循环。
22、在本技术的一些实施例中,上述姬姆萨染色方法具体如下:分别制作山羊无浆体阴性和阳性红细胞涂片用甲醇固定10min,干燥后用姬姆萨染色液染色10min,光学显微镜下观察细胞内的病原包涵体。
23、在本技术的一些实施例中,上述pcr检测方法具体如下:四重pcr体系包含:10×labuffer2.5μl、dntps(2.5mm)4μl、la taq dna聚合酶0.25μl、每个引物(20μmol/l)均0.5μl和2μl dna模板,灭菌纯水补足至25μl;基于不同基因位点的pcr反应体均在25μl反应体系内进行,包含:10×la buffer 2.5μl,dntps 4μl,上、下游引物(20μmol/l)各0.5μl,la taq酶0.25μl,2μl dna模板,灭菌纯水补足至25μl;pcr反应均在pcr扩增仪中进行,反应条件为:94℃预变性5min,94℃变性30s,退火30s,72℃延伸1min,72℃再延伸10min,共40个循环。
24、相对于现有技术,本技术的实施例至少具有如下优点或有益效果:
25、本技术通过将从山羊体内的山羊无浆体进行外培养,再结合多种检测方法对外培养的山羊无浆体进行检测,检测速度快、灵敏性好、重复性好且可靠性高。
- 还没有人留言评论。精彩留言会获得点赞!