同时检测n种目标基因的荧光实时检测系统、方法、多重引物、试剂盒与流程
本发明涉及分子生物学,特别涉及同时检测n种目标基因的荧光实时检测系统、方法、多重引物、试剂盒。
背景技术:
1、多重pcr(聚合酶链式反应),是指在同一pcr反应体系里加上二对以上引物,同时扩增出多个种类核酸片段的pcr反应。在实时pcr方法中,可通过使用荧光标记的寡核苷酸探针来对靶核酸序列进行检测。
2、对于多重实时荧光pcr反应中,可使用不同的荧光基团标记每一条探针;从而根据每条探针携带的独特荧光信号,可以检测每个探针所特异性识别的靶核酸序列。但是由于仪器的限制,单论检测中能检测的最大荧光检测通道的数目不超过6个数目;而在扩增后的熔解曲线分析这一检测模式中,需要在pcr扩增后新增一个分析熔点的步骤,但是其也对于荧光通道数目的要求也便有所减少。
3、wadles等人(biotechniques 2016 ,61(3):123-8)研究了一种五重pcr系统,该系统共使用了5条媒介子探针和5条荧光探针。相比之下,传统的五重实时pcr法仅需要使用5条荧光探针。对于现有设备的条件下,条件复杂且成本高昂。
4、us2015/0072887a1公开了一种可用于熔解曲线分析的实时pcr测定,通过3条探针来实现对靶核酸序列的检测。采用该专利公开的方法用进行多重实时pcr时,需要对每一个靶核酸序列分别设计多条探针,这会导致反应体系的复杂与结果的不稳定性。
5、cn109837333a公开了一种同时检测多种目标基因的荧光实时检测试剂及方法,通过对目标基因进行分组来实现对靶核酸序列的检测。采用该专利公开的方法进行多重实时pcr时,需要对控制pcr扩增产物的tm值,使得同组、标记相同荧光标记的pcr扩增产物tm值之间的差别大于1℃,这对实际操作过程的控制要求很高,同样的针对不同待检测目标需要仔细分析寡核苷酸序列进行引物的设计和分组,这对待检测目标基因的有筛选要求,不具有普及性。
6、同样的,在进行实时荧光检测时需要多孔和多个位点的要求,这对于同时检测的数量和引物的要求都比较苛刻。
7、针对上述情况,需要开发一种新的实时pcr检测方法,可以在可控的荧光通道和位点条件下,方便快捷的检测更多的目标基因,同时具备广谱性,能够实现大范围的使用。
技术实现思路
1、在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的核酸化学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
2、如本技术中,术语“目标基因”、“靶核酸”是指待检测的目标核酸序列,且上述术语可互换使用。
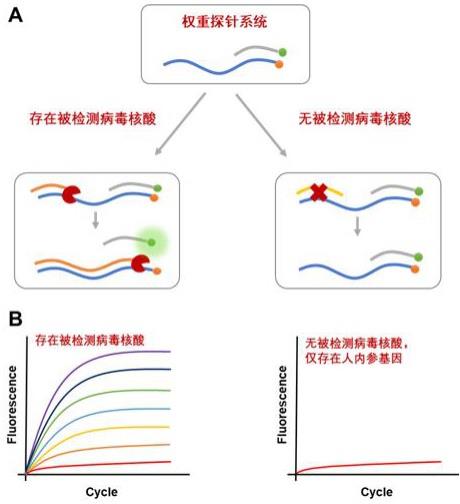
3、如本文中所使用的,术语“权重探针”是指,从5'至3'方向含有寡核苷酸序列(也称媒介子序列)和特异性序列(targetingsequence;即,靶核酸序列)的单链核酸分子。在本技术中寡核苷酸序列不含与靶核酸序列互补的序列,特异性序列包含与靶核酸序列互补的序列。因此,在允许核酸杂交、退火或扩增的条件下,寡核苷酸序列通过特异性序列与待检测的目标基因杂交或退火;而寡核苷酸序列在相同条件下不与所述靶核酸序列杂交。
4、术语“特异性序列”是指,在允许核酸杂交、退火或扩增的条件下,所述序列由于其包含与待检测序列互补的序列,从而能够与待检测核酸序列特异性杂交或退火的序列。同样的,在允许核酸杂交、退火或扩增的条件下,特异性序列或特异性序列仅与特定的互补的靶核酸序列杂交或退火,而不与其他的核酸序列杂交或退火。
5、本技术中,术语“寡核苷酸序列”是指权重探针中不与靶核酸序列互补的序列,其位于权重探针的5'端。
6、在本技术中,针对每一种待检测的目标基因,设计一条权重探针,所述权重探针根据互补的靶核酸序列设计有独特的特异性序列和寡核苷酸序列;且与权重探针匹配的还有荧光探针。
7、本技术中,通过在权重探针上设计多重重复的寡核苷酸序列,荧光探针上实际多重重复的序列(与权重探针互补),从而在检测荧光强度时,根据重复数量的序列组合进行分析,从而分析出相应权重探针互补的靶核酸序列情况。
8、本技术中,术语“互补”是指,两条核酸序列能够根据碱基配对原则形成氢键并形成双链体。即在允许核酸杂交、退火或扩增的条件下,“互补”的两条核酸序列将特异性地发生杂交或退火,并形成双链体。
9、本技术中,术语“荧光探针”是指标记荧光基团、且释放后能够产生荧光信号的一段寡核苷酸序列。
10、检测系统
11、本发明提供一种同时检测n种目标基因的荧光实时检测系统,所述检测系统设计权重探针用于与待检测样品的目标基因互补并释放报告基因;通过检测并分析报告基因发出的荧光强度和权重数以确定所述n种目标基因是否存在于所述待检测样品中;其中,所述权重探针上标记有x种淬灭基团和y个数淬灭基因;且n/3≤x<n≤y。
12、同样的,为检测荧光信号,所述系统还包括荧光探针,其上标记有报告基因,且所述荧光探针上包含有与所述寡核苷酸互补的序列。
13、所述权重探针标记有淬灭基团,所述荧光探针上标记有报告基团,且所述报告基团能够发出信号,并且,所述淬灭基团能够吸收或淬灭所述报告基团发出的信号。
14、常规多重荧光实时检测方法中,采用的是针对每一种目标基因各设计一种荧光探针,且每种荧光探针发射出的荧光颜色均不相同。检测最后发射出的荧光颜色,从而判断样品中是否存在相对应的目标基因。
15、本技术提供的权重探针设计成含有特异性序列和寡核苷酸序列,所述特异性序列与目标基因相互补,所述寡核苷酸序列包含多组短寡核苷酸序列,且每组短寡核苷酸序列上均标记有淬灭基团;且各组短寡核苷酸序列之间可为相同序列或不同序列。
16、本技术中术语“短寡核苷酸序列”是指长度比寡核苷酸序列短,且寡核苷酸序列主要由短寡核苷酸序列组成。本技术中,一段短寡核苷酸序列称为一组短寡核苷酸序列。本技术中根据实际检测需要可以设计多组短寡核苷酸序列,且每条寡核苷酸序列可以包括多组短寡核苷酸序列,且同一条寡核苷酸序列中的每组短寡核苷酸序列可以是相同序列也可以是不同序列。
17、本技术中,每条寡核苷酸序列包含n组短寡核苷酸序列,n为≥1的整数,例如1,2,3,4,5,6,7,8或更大的整数。
18、本技术中,所述权重探针上寡核苷酸序列标记有淬灭基团,优选的所述淬灭基团标记在短寡核苷酸序列上。
19、本技术中,所述短寡核苷酸序列可以是任何长度,例如,每组短寡核苷酸序列可以为10-20nt,例如10-15nt,15-20nt,13-18nt。
20、为提高特异性,本技术中,所述权重探针3'端还设置有尾巴序列,所述尾巴序列在任何条件下不与靶核酸序列发生杂交,且所述尾巴序列可以是任何长度,例如,所述尾巴序列可以为8-15nt,例如8nt,9nt,10nt,11nt,12nt,13nt,14nt,15nt,最佳为10nt。
21、本技术中,所述荧光探针是指标记荧光基团、且释放后能够产生荧光信号的一段寡核苷酸序列;且在允许核酸杂交、退火或扩增的条件下,所述荧光探针上寡核苷酸序列可与权重探针上的短寡核苷酸序列发生杂交或退火。
22、所述荧光探针的3'端同样设置有尾巴序列,所述荧光探针3'端的尾巴序列在任何条件下不与权重探针上的寡核苷酸序列发生杂交,且所述荧光探针3'端的尾巴序列可以是任何长度,例如,所述荧光探针3'端的尾巴序列可以为10-20nt,例如10-15nt,15-20nt,13-18nt,8-15nt。
23、本技术中,所述荧光探针3'端的尾巴序列和权重探针3'端的尾巴序列可以为相同序列,也可以是不同序列。
24、本技术中,所述检测系统根据目标基因设计权重探针和荧光探针,随后在允许核酸杂交、退火或扩增的条件下,待检测样品中目标基因和权重探针上的特异性序列互补;荧光探针和权重探针上的寡核苷酸序列互补。随后在延伸条件下发生延伸,荧光探针上的荧光基团释放出来,并发出荧光信号。统计荧光信号强度,并分析数据,根据不同靶核酸序列互补的权重探针上杂交的荧光探针上的荧光基团数量,进行权重分析,从而判断出样品中存在的目标基因情况。
25、本技术中,所述荧光探针与权重探针上寡核苷酸序列互补,因此荧光探针上荧光基因和权重探针上标记的淬灭基团数量相同,类型互为荧光-淬灭类型;即所述报告基团能够发出信号,并且,互补的荧光探针上的所述淬灭基团能够吸收或淬灭所述报告基团发出的信号。
26、本技术提供的荧光探针为一段寡核苷酸序列,且所述一段寡核苷酸序列标记有荧光基团。相应的,在允许核酸杂交、退火或扩增的条件下,本发明中所述荧光探针的寡核苷酸序列和权重探针上的短寡核苷酸序列互补。
27、本技术中,待检测的样品可获自任何来源,包括但不限于原核生物,真核生物或病毒或类病毒。待检测的样品还可以是任何形式的核酸序列,例如基因组序列,人工分离或片段化的序列,合成的序列等。
28、检测方法
29、本技术提供一种单管检测n种目标基因的非诊断的方法,采用了上述检测系统原理,具体方法步骤如下:
30、步骤1:提供等数量级的n种待检测目标基因;
31、步骤2:针对待检测的每种目标基因,提供一种权重探针和荧光探针,并将权重探针和荧光探针进行退火;
32、所述权重探针上标记有淬灭基因,所述荧光探针上标记有报告基因;
33、步骤3:将待检测目标基因、权重探针和荧光探针进行扩增;从而有荧光基团分离并释放荧光信号,检测荧光信号并进行权重分析,从而检测出目标基因情况。
34、其中,步骤1中等数量级的n种待检测目标基因为采用不对称pcr的方法对n种待检测目标基因进行扩增,扩增至目标基因为等数量级下再进行后续反应。
35、步骤1中不对称pcr的引物设计可以根据目标基因具体情况进行设计,本技术中不做具体限定,只需实现最终n种待检测目标基因为等数量级。
36、本发明检测方法和检测系统中,可以先将权重探针和荧光探针进行退火,再与目标基因进行等温扩增。本发明中,所述等温扩增是采用等温扩增酶,在常温下进行扩增。
37、本发明中,所述等温扩增酶为bst polymerase。
38、每条所述权重探针包含特异性序列和寡核苷酸序列;所述特异性序列与待检测样品的目标基因互补;且所述寡核苷酸上标记有淬灭基因;所述荧光探针上标记有报告基因,且所述荧光探针上包含有与所述寡核苷酸互补的序列。
39、所述权重探针上标记有x种淬灭基团和y个数淬灭基团;所述荧光探针上标记有x种报告基团和y个数报告基团;且n/3≤x<n≤y。
40、多重检测
41、本技术提供一种快速检测甲型流感、乙型流感和新型冠状病毒的非诊断的方法,其使用所述荧光实时检测系统。
42、所述快速检测甲型流感、乙型流感和新型冠状病毒的非诊断的方法,具体方法步骤如下:
43、步骤1:提供等数量级的目标基因:甲型流感病毒m基因、乙型流感病毒ha基因、新型冠状病毒orflab基因、新型冠状病毒n基因以及人源性内参基因经过不对称pcr进行扩增至等数量级;
44、步骤2:针对待检测的每种目标基因,提供一种权重探针和荧光探针,并将权重探针和荧光探针进行退火;
45、所述权重探针上标记有淬灭基因,所述荧光探针上标记有报告基因;
46、步骤3:将待检测目标基因、权重探针和荧光探针进行等温扩增;从而有荧光基团分离并释放荧光信号,检测荧光信号并进行权重分析,从而检测出目标基因情况。
47、其中,上述方法使用的多重引物包括:
48、所述甲型流感病毒m基因特异性引物对为:
49、正向引物:5'-cttctaaccgaggtcgaaacgta-3'
50、反向引物:5'-ggtgacaggattggtcttgtcttta-3'
51、所述甲型流感病毒m基因荧光权重探针为:
52、5'-aactggtccttcgtcgcactcgccctggtgacaggattggtcttgtctttatccactttttttttt-3'
53、所述乙型流感病毒ha基因特异性引物对为:
54、正向引物:5'-aaatacggtggattaaacaaaagcaa-3'
55、反向引物:5'-ccagcaatagctccgaagaaa-3'
56、所述乙型流感病毒ha基因荧光权重探针为:
57、5'-tacatctgcgtctagcaactggtccttcgtcgaacatacctaccagcaatagctccgaagaaacccctttcctttttttttt-3'
58、所述新型冠状病毒orflab基因特异性引物对为:
59、正向引物:5'-ccctgtgggttttacacttaa-3'
60、反向引物:5'-acgattgtgcatcagctga-3'
61、所述新型冠状病毒orflab基因荧光权重探针为:
62、5'-tacatctgcgtctagcaactggtccttcgtcgtacatctgcgtctagcaactggtccttcgtcgaactgtactgacgattgtgcatcagctgactgaagcatggtttttttttt-3'
63、所述新型冠状病毒n基因特异性引物对为:
64、正向引物:5'-ggggaacttctcctgctagaat-3'
65、反向引物:5'-cagacattttgctctcaagctg-3'
66、所述新型冠状病毒n基因荧光权重探针为:
67、5'-tacatctgcgtctagcaactggtccttcgtcggacatcgatacagacattttgctctcaagctggttcaatctttttttttt-3'
68、所述人源性内参基因特异性引物对为:
69、正向引物:5'-tcaagaaggtggtgaagcagg-3'
70、反向引物:5'-cagcgtcaaaggtggaggagt-3'
71、所述人源性内参基因荧光权重探针为:
72、5'-aactggtccttcgtcgattgttaggtcagcgtcaaaggtggaggagtgggtgtcgctttttttttt-3'
73、荧光探针1:5'-cgacgaaggaccagttttttttttt-3'
74、荧光探针2:5'-gctagacgcagatgtattttttttt-3'
75、荧光探针3:5'-cgacgaaggaccagttttttttttt-3'
76、荧光探针4:5'-gctagacgcagatgtattttttttt-3'。
77、其中,上述引物中序列3'的“·····tttttt”为所述尾巴序列,“·····”是指“t”的数量不做限定。
78、其中,所述甲型流感病毒m基因荧光权重探针在5'端标记bhq1淬灭基团;
79、所述乙型流感病毒ha基因荧光权重探针在5'端起第20个碱基(t)标标记bhq1淬灭基团;
80、所述新型冠状病毒orflab基因荧光权重探针在5'端起第20个碱基(t)标标记bhq1淬灭基团,在5'端起第52个碱基(t)标记bhq1淬灭基团;
81、所述新型冠状病毒n基因荧光权重探针在5'端起第20个碱基(t)标标记bhq1淬灭基团;
82、所述人源性内参基因荧光权重探针在5'端标记bhq1淬灭基团;
83、所述荧光探针1在5'端起第15个碱基(t)标记fam荧光基团;
84、所述荧光探针2在5'端起第3个碱基(t)标记fam荧光基团;
85、所述荧光探针3在5'端起第15个碱基(t)标记hex荧光基团;
86、所述荧光探针4在5'端起第3个碱基(t)标记hex荧光基团。
87、试剂盒
88、一种快速联合检测新型冠状病毒、甲型流感病毒、乙型流感病毒试剂盒,包括试剂i和试剂ii;所述试剂i包括supermmlv reverse transcriptase、taq酶、mgcl2,dntps,10×buffer和权利要求10~12任一项所述的多重引物;所述试剂ii为10×buffer和所述的多重探针;所述试剂iii为等温扩增酶,mgcl2,10×buffer,dntp。
89、所述试剂i 中,taq聚合酶的浓度为0.03~0.05u/μl,mgcl2的浓度为4~5mm,dntps的浓度为0.15~0.25mm,所述甲型流感病毒m基因特异性引物对、乙型流感病毒ha基因特异性引物对、新型冠状病毒n基因特异性引物对、人源性内参基因特异性引物对的浓度均为0.3~0.5μm。
90、所述试剂ii中甲型流感病毒m基因特异性探针、乙型流感病毒ha基因特异性探针、新型冠状病毒n基因特异性探针、人源性内参基因特异性探针、所述荧光探针1至荧光探针4的浓度均为0.1~0.3μm。
91、所述试剂iii中为等温扩增酶的浓度为0.03~0.05u/μl,10×buffer(mg2+终浓度为60nmol/l),dntp的浓度为0.15~0.25mm。
92、本技术中,所述试剂盒还包括阴性质控品和阳性质控品,所述阴性质控品为生理盐水,所述阳性质控品为包括甲型流感病毒m基因目的片段的假病毒、乙型流感病毒ha基因目的片段的假病毒、新型冠状病毒orflab基因、n基因目的片段的假病毒和人源性内参基因目的片段。
93、其中,所述假病毒的浓度为1.0×102~1.0×104copies/μl。
94、所述试剂盒的试剂ipcr扩增条件为:42℃反转录30min,95℃5min,95℃20s变性,60℃1min退火,72℃30s延伸,热对流pcr反应50个循环,72℃10min,4℃保存;
95、试剂ii探针退火条件为:90℃2min,85℃1min,80℃1min,75℃1min,70℃1min,65℃1min,60℃1min,55℃1min,50℃1min,45℃1min,40℃1min,37℃5min,25℃5min,4℃保存;
96、试剂iii荧光pcr检测条件为:25℃,5s,500cycle。
97、本技术中各种酶的工作条件可由本领域技术人员通过常规方法确定,并且通常可涉及下列因素:温度,缓冲液的ph值,成分,浓度,离子强度等。备选地,可使用酶的制造商所推荐的条件。
98、本领域技术人员基于本技术所详细描述的原理,可对本发明技术方案的各种技术特征进行修饰、替换或组合,而不背离本发明的精神和范围。所有此类技术方案以及其变形都涵盖在本技术的权利要求书或其等同物的范围内。
99、发明的有益效果
100、与现有技术相比,本发明的技术方案具有以下有益效果:
101、(1)本发明的检测系统和检测方法提供一种权重探针,可以实现在少数种类和数量的荧光基团下实现对多种目标基因进行同时检测;
102、(2) 本发明可以使用1~2种荧光基团对4~6种靶核酸序列进行同时检测,克服了现有设备中荧光通道数量的限制,对多种目标基因,甚至是十几种、几十种都能在一个现有设备上同时检测;
103、(3) 仅使用两种荧光可标记检测5种基因,避免不同颜色的荧光光谱之间发生的串扰,还可降低检测成本;
104、(4) 将样本加于一孔中进行检测,即所有引物对和探针骨架均置于一个检测孔位中,将样本加入即可同时检测并区分甲流(m基因)、乙流(ha基因)、新冠(orflab基因、n基因)和内参(gadph基因),提高检测效率。
105、本发明提供了一种高效、低成本、简单的多重检测法。本发明方法能够检测的靶核酸序列的最大数目不受限于荧光基团的种类数,在少数孔内实现多位点检测。
- 还没有人留言评论。精彩留言会获得点赞!