作为Cdc7抑制剂的四并环类化合物的制作方法
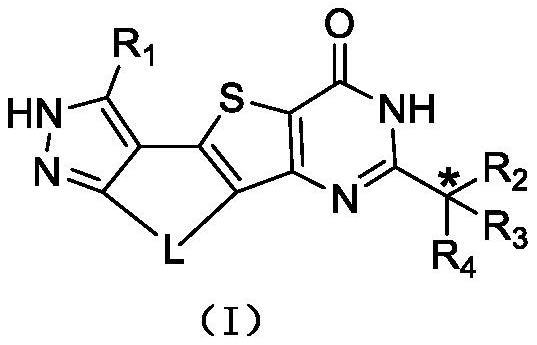
本技术涉及一类作为cdc7抑制剂的四并环类化合物,具体公开了式(i)所示化合物、其异构体或其药学上可接受的盐。
背景技术:
1、cdc7是丝氨酸/苏氨酸激酶,其最早于1974年在酿酒酵母中发现,此后科学家们在其他真核生物里也发现了与其同源的蛋白质。不同物种的cdc7在结构上都存在着一定差异,但它们之间的功能却极其相似,一方面是通过磷酸化dna复制起始物一个重要元件微染色体维持蛋白(mcm蛋白),从而激活mcm促进复制起始复合物的形成,另一方面也可作为细胞周期s期检验点的重要调控因子来控制细胞周期的顺利进行。
2、人类细胞里cdc7的同源蛋白——hucdc7是20世纪90年代后科学家们才发现的。hucdc7在人类几乎所有的组织细胞中均有表达,但人们发现,在人类多种肿瘤细胞里hucdc7均出现异常高表达,这种异常高表达与肿瘤的异常增殖、转移以及抗化疗药物性之间都显示出很高的相关性,因此hucdc7也就成为了目前肿瘤研究的重要标记和靶点。
3、hucdc7在正常细胞周期中表达水平是不变的,并且受到细胞周期中一些因子和辅助蛋白调控,因此处于一种动态平衡状态。在肿瘤细胞里由于细胞周期发生紊乱,hucdc7是处于异常表达和过度激活状态。hess等研究表明,由于hucdc7在多种肿瘤细胞里过表达,过表达的hucdc7可促进肿瘤细胞的重要标记mcm2的过度活化,因而促进了肿瘤细胞的异常增殖。同时,他们还发现hucdc7在所有转移肿瘤细胞里也都显示出高表达,这也提示hucdc7的异常高表达与肿瘤细胞的转移可能有密切的联系。nambiar等最近发现在多个皮肤黑色素瘤细胞系里hucdc7辅助蛋白ask也是呈高表达状态,这也进一步增强hucdc7在肿瘤细胞里的活性。此外,hucdc7的异常高表达和激活对肿瘤细胞化疗药物抗性也起到很关键的作用,tenca等用化疗药物hu和etoposide处理肿瘤细胞后发现hucdc7大量表达并具有很高的活性,研究指出hucdc7是通过磷酸化mcm2和mcm4的多个氨基酸位点来抑制二者活性从而减少肿瘤细胞受到的损伤。
4、tak-931是一种cdc7抑制剂,目前已经处在临床二期因此研制新一代代谢稳定的cdc7抑制剂,在临床上有需求。
5、
技术实现思路
1、本技术提供式(i)化合物、其异构体或其药学上可接受的盐,
2、
3、其中,
4、带“*”碳原子可为手性碳原子,以(r)或(s)单一对映体形式或富含一种对映体形式存在;
5、l选自-ch2-ch2-ch2-、-ch2-o-ch2-、-ch2-s-ch2-、-ch2-nh-ch2-、-nh-ch2-ch2-、-s-ch2-ch2-和-o-ch2-ch2-;
6、r1选自h、卤素、cn、c1-6烷基、c3-6环烷基、苯基和5-6元杂芳基,所述c1-6烷基、c3-6环烷基、苯基和5-6元杂芳基分别独立地任选被1、2或3个ra取代,所述5-6元杂芳基包含1、2或3个分别独立地选自o、s、n和nh的杂原子或杂原子团;
7、r2选自rb,r3选自nh2,r4选自h;
8、或者,r2选自rc,r3和r4连接形成一个任选被1、2或3个re取代的环a基团,所述环a基团选自c6-14芳基、5-14元杂芳基、5-12元杂环烯基和4-14元杂环烷基,所述c6-14芳基、5-14元杂芳基、5-12元杂环烯基和4-14元杂环烷基分别独立地包含1、2或3个独立地选自o、s、n和nrd的杂原子或杂原子团;ra分别独立地选自f、cl、br、i、oh、cn、nh2、-ch3和rb选自h和c1-6烷基,所述c1-6烷基任选被1、2或3个rbb取代;
9、rc选自h、f、cl、br、i和c1-3烷基;
10、rd选自h和c1-4烷基;
11、rbb选自-och3、-och2ch3、-o-ch(ch3)2、环丙基、环戊基、苯基、吡唑基、吡啶基、nh2、-nhch3和-n(ch3)2;
12、re选自f、cl、br、i、oh、cn、cooh、nh2、-nhch3、-n(ch3)2、-ch3、-ch2ch3、-cf3、-och3、-och2ch3、-o-ch(ch3)2、-c(=o)och3、-c(=o)ch3和-c(=o)ch2ch3。
13、在本技术的一些方案中,上述r1选自h、f、cl、br、i、cn、c1-3烷基、c3-5环烷基、苯基和6元杂芳基,所述c1-3烷基、c3-5环烷基、苯基和6元杂芳基分别独立地任选被1、2或3个ra取代,所述6元杂芳基包含1、2或3个选自n的杂原子。
14、在本技术的一些方案中,上述r1选自h、f、cl、br、i、cn、-ch3、-ch2ch3、环丙基、苯基和吡啶基,所述-ch3、-ch2ch3、环丙基、苯基和吡啶基分别独立地任选被1、2或3个ra取代。
15、在本技术的一些方案中,上述r1选自h、f、cl、br、i、cn、-ch3、-ch2ch3、-cf3、环丙基、苯基和吡啶基。
16、在本技术的一些方案中,上述r1选自h。
17、在本技术的一些方案中,上述ra选自f。
18、在本技术的一些方案中,上述rb选自h和c1-4烷基,所述c1-4烷基任选被1、2或3个rbb取代。
19、在本技术的一些方案中,上述rb选自h、甲基、乙基、异丙基、正丙基、正丁基和异丁基。
20、在本技术的一些方案中,上述rb选自c1-3烷基。
21、在本技术的一些方案中,上述rb选自异丙基。
22、在本技术的一些方案中,上述rc选自h、f和c1-3烷基。
23、在本技术的一些方案中,上述rc选自h、甲基、乙基和f。
24、在本技术的一些方案中,上述rc选自h和甲基。
25、在本技术的一些方案中,上述rd选自h、甲基、乙基、正丙基、异丙基和正丁基。
26、在本技术的一些方案中,上述rd选自h和c1-3烷基。
27、在本技术的一些方案中,上述rd选自h、甲基和异丙基。
28、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的c6-10芳基、5-9元杂芳基、5-7元杂环烯基和4-10元杂环烷基,所述c6-10芳基、5-9元杂芳基、5-7元杂环烯基和4-10元杂环烷基分别独立地包含1、2或3个独立地选自o、s、n和nrd的杂原子或杂原子团。
29、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的5-9元杂环烷基,所述5-9元杂环烷基包含1、2或3个独立地选自o、s、n和nrd的杂原子或杂原子团。
30、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的5元、6元、7元、8元杂环烷基,所述5元、6元、7元、8元杂环烷基包含1、2或3个独立地选自o、s、n和nrd的杂原子或杂原子团。
31、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的5-9元杂环烷基,所述5-9元杂环烷基包含1个选自n和nrd的杂原子或杂原子团。
32、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的5元、6元、7元、8元杂环烷基,所述5元、6元、7元、8元杂环烷基包含1个选自n和nrd的杂原子或杂原子团。
33、在本技术的一些方案中,上述环a基团选自5-9元杂环烷基,所述5-9元杂环烷基包含1、2或3个独立地选自n和nrd的杂原子或杂原子团。
34、在本技术的一些方案中,上述环a基团选自5-9元杂环烷基,所述5-9元杂环烷基包含1个选自n和nrd的杂原子或杂原子团。
35、在本技术的一些方案中,上述环a基团选自5元、6元、7元、8元杂环烷基,所述5元、6元、7元、8元杂环烷基包含1个选自n和nrd的杂原子或杂原子团。
36、在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的吡咯烷基、哌啶基、吗啉基、1-氮杂二环[2.2.2]辛烷基、1-氮杂二环[2.2.1]庚烷基、1-氮杂二环[3.2.2]壬烷基和氮杂环庚烷基,所述环a基团包含1个选自n和nrd的杂原子或杂原子团。
37、在本技术的一些方案中,上述环a基团选自吡咯烷基、哌啶基、吗啉基、1-氮杂二环[2.2.2]辛烷基、1-氮杂二环[2.2.1]庚烷基、1-氮杂二环[3.2.2]壬烷基和氮杂环庚烷基,所述环a基团包含1个选自n和nrd的杂原子或杂原子团。在本技术的一些方案中,上述环a基团选自任选被1、2或3个re取代的
38、在本技术的一些方案中,上述环a基团选自
39、在本技术的一些方案中,上述结构单元选自进一步选自
40、在本技术的一些方案中,上述结构单元选自且r3、r4和rc共同连接的碳原子为手性碳原子;进一步选自更进一步选自
41、在本技术的一些方案中,上述结构单元选自进一步选自
42、在本技术的一些方案中,上述结构单元选自且r3、r4和rc共同连接的碳原子为手性碳原子;进一步选自更进一步选自
43、在本技术的一些方案中,上述结构单元选自进一步选自
44、在本技术的一些方案中,上述结构单元选自且r3、r4和rc共同连接的碳原子为手性碳原子;进一步选自更进一步选自
45、在本技术的一些方案中,上述结构单元选自进一步选自又更进一步选自
46、在本技术的一些方案中,上述结构单元选自且r3、r4和rb共同连接的碳原子为手性碳原子;进一步选自更进一步选自又更进一步选自
47、
48、在本技术的一些方案中,上述l选自-ch2-ch2-ch2-、-ch2-o-ch2-、-ch2-s-ch2-和-ch2-nh-ch2-。
49、在本技术的一些方案中,上述l选自-ch2-ch2-ch2-。
50、在本技术的一些方案中,上述r1选自h、f、cl、br、i、cn、-ch3、-ch2ch3、环丙基、苯基和吡啶基,所述-ch3、-ch2ch3、环丙基、苯基和吡啶基分别独立地任选被1、2或3个ra取代,其他变量如本技术所定义。
51、在本技术的一些方案中,上述r1选自h、f、cl、br、i、cn、-ch3、-ch2ch3、-cf3、环丙基、苯基和吡啶基,其他变量如本技术所定义。
52、在本技术的一些方案中,上述r1选自h,其他变量如本技术所定义。
53、在本技术的一些方案中,上述rb选自h、甲基、乙基、异丙基、正丙基、正丁基和异丁基,其他变量如本技术所定义。
54、在本技术的一些方案中,上述rb选自异丙基,其他变量如本技术所定义。
55、在本技术的一些方案中,上述rc选自h、甲基、乙基和f,其他变量如本技术所定义。
56、在本技术的一些方案中,上述rc选自h和甲基,其他变量如本技术所定义。
57、在本技术的一些方案中,上述rd选自h、甲基、乙基、丙基、异丙基和正丁基,其他变量如本技术所定义。
58、在本技术的一些方案中,上述rd选自h、甲基和异丙基,其他变量如本技术所定义。
59、在本技术的一些方案中,上述环a基团选自5-9元杂环烷基,所述5-9元杂环烷基包含1个选自n和nrd的杂原子或杂原子团,其他变量如本技术所定义。
60、在本技术的一些方案中,上述环a基团选自其他变量如本技术所定义。
61、在本技术的一些方案中,上述结构单元选自进一步选自其他变量如本技术所定义。
62、在本技术的一些方案中,上述结构单元选自进一步选自
63、其他变量如本技术所定义。
64、在本技术的一些方案中,上述结构单元选自进一步选自其他变量如本技术所定义。
65、在本技术的一些方案中,上述结构单元选自进一步选自其他变量如本技术所定义。
66、在本技术的一些方案中,上述l选自-ch2-ch2-ch2-,其他变量如本技术所定义。
67、在本技术的一些方案中,上述式(i)化合物、其异构体或其药学上可接受的盐,其中,
68、带“*”碳原子可为手性碳原子,以(r)或(s)单一对映体形式或富含一种对映体形式存在;
69、l选自-ch2-ch2-ch2-;
70、r1选自h;
71、r2选自rb,r3选自nh2,r4选自h;
72、或者,r2选自rc,r3和r4连接形成一个环a基团,所述环a基团选自4-14元杂环烷基,所述4-14元杂环烷基分别独立地包含1、2或3个独立地选自n和nrd的杂原子或杂原子团;
73、rb选自c1-6烷基;
74、rc选自h和c1-3烷基;
75、rd选自h和c1-4烷基。
76、在本技术的一些方案中,上述化合物选自式(i-1)化合物和式(i-2)化合物、其异构体或其药学上可接受的盐,
77、
78、其中,
79、带“*”碳原子可为手性碳原子,以(r)或(s)单一对映体形式或富含一种对映体形式存在;r1和rc如本技术式(i)化合物所定义;环a基团如本技术式(i)化合物所定义;rb如本技术式(i)化合物所定义。
80、在本技术的一些方案中,结构单元的定义同上述结构单元的定义。
81、在本技术的一些方案中,上述化合物选自式(i-1a)化合物、式(i-1b)化合物、式(i-2a)化合物和式(i-2b)化合物、其异构体或其药学上可接受的盐,
82、
83、其中,
84、r1和rc如本技术式(i)化合物所定义,且rc与环a基团共同连接的碳原子为手性碳原子;环a基团如本技术式(i)化合物所定义;rb如本技术式(i)化合物所定义。
85、在本技术的一些方案中,结构单元的定义分别同上述结构单元的定义。
86、在本技术的一些方案中,上述化合物选自式(i-11)化合物、式(i-12)化合物、式(i-13)化合物、式(i-14)化合物、式(i-15)化合物和式(i-16)化合物、其异构体或其药学上可接受的盐,
87、
88、其中,
89、带“*”碳原子为手性碳原子,以(r)或(s)单一对映体形式或富含一种对映体形式存在;r1、rc和rd如本技术式(i)化合物所定义。
90、在本技术的一些方案中,上述化合物选自式(i-11a)化合物、式(i-11b)化合物、式(i-12a)化合物、式(i-12b)化合物、式(i-13a)化合物、式(i-13b)化合物、式(i-14a)化合物、式(i-14b)化合物、式(i-16a)化合物和式(i-16b)化合物、其异构体或其药学上可接受的盐,
91、
92、
93、其中,
94、r1、rc和rd如本技术式(i)化合物所定义。
95、在一些方案中,本技术包含上述定义的变量及其方案,以及它们的任意组合。本技术还提供下式化合物、其异构体或药学上可接受的盐,
96、
97、在本技术的一些方案中,上述化合物、其异构体或药学上可接受的盐,选自
98、
99、
100、本技术还提供一种药物组合物,其含有治疗有效量的上述化合物、其异构体或其药学上可接受的盐和药学上可接受的载体。
101、本技术还提供上述化合物、其异构体或其药学上可接受的盐或上述药物组合物在制备治疗cdc7抑制剂中的应用。
102、本技术还提供上述化合物、其异构体或其药学上可接受的盐或上述药物组合物在制备治疗肿瘤药物中的应用。
103、本技术还提供一种治疗由cdc7激酶介导的疾病的方法,包括对需要该治疗的哺乳动物,优选人类,给予治疗有效量的上述化合物、其异构体或其药学上可接受的盐或上述药物组合物。
104、本技术还提供上述化合物、其异构体或其药学上可接受的盐或上述药物组合物在治疗由cdc7激酶介导的疾病中的应用。
105、本技术还提供了一种用于治疗由cdc7激酶介导的疾病的上述化合物、其异构体或其药学上可接受的盐或上述药物组合物。
106、本技术还提供作为药物使用的上述化合物、其异构体或其药学上可接受的盐。在本技术的一些方案中,所述作为药物使用指作为治疗由cdc7激酶介导的疾病的药物。
107、在本技术的一些方案中,上述cdc7抑制剂是指治疗肿瘤的药物。
108、在本技术的一些方案中,上述肿瘤包括结直肠癌和胰腺癌。
109、在本技术的一些方案中,上述治疗肿瘤的药物是指治疗结直肠癌、胰腺癌的药物。
110、技术效果
111、本技术化合物作为cdc7抑制剂,在治疗肿瘤中具有较大的应用前景。本技术化合物对cdc7/dbf4有较强的抑制活性,本技术化合物还对colo205细胞显示出良好的抑制活性。此外,本技术化合物在小鼠中具有良好的auc0-last和生物利用度和显著的肿瘤抑制作用。因此,对cdc7激酶及其抑制剂的进一步深入研究有望为临床治疗肿瘤开辟新的途径。本技术化合物有望成为一类比同类产品治疗效果好,毒副作用低的新药。
112、定义和说明
113、除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
114、这里所采用的术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
115、术语“药学上可接受的盐”是指本技术化合物的盐,由本技术发现的具有特定取代基的化合物与相对无毒的酸或碱制备。当本技术的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的碱与这类化合物接触的方式获得碱加成盐。药学上可接受的碱加成盐包括钠、钾、钙、铵、有机胺或镁盐或类似的盐。当本技术的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的酸与这类化合物接触的方式获得酸加成盐。药学上可接受的酸加成盐的实例包括无机酸盐,所述无机酸包括例如盐酸、氢溴酸、硝酸、碳酸,碳酸氢根,磷酸、磷酸一氢根、磷酸二氢根、硫酸、硫酸氢根、氢碘酸、亚磷酸等;以及有机酸盐,所述有机酸包括如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸和甲磺酸等类似的酸;还包括氨基酸(如精氨酸等)的盐,以及如葡糖醛酸等有机酸的盐本技术的某些特定的化合物含有碱性和酸性的官能团,从而可以被转换成任一碱或酸加成盐。
116、本技术的药学上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
117、本技术的药学上可接受的盐可以利用本身已知的方法或其类似的方法,将其转变为游离态;例如将药学上可接受的酸加成盐或碱加成盐与化学剂量的适当的碱或酸反应制备。
118、本技术的化合物可以存在特定的几何或立体异构体形式。本技术设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本技术的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本技术的范围之内。
119、本技术带“*”碳原子可为手性碳原子,意指根据该碳原子在化合物结构中的连接情况,其为手性碳原子或者非手性碳原子。
120、除非另有说明,术语“对映异构体”或者“旋光异构体”是指互为镜像关系的立体异构体。
121、除非另有说明,术语“顺反异构体”或者“几何异构体”系由因双键或者成环碳原子单键不能自由旋转而引起。
122、除非另有说明,术语“非对映异构体”是指分子具有两个或多个手性中心,并且分子间为非镜像的关系的立体异构体。
123、除非另有说明,“(+)”表示右旋,“(-)”表示左旋,“(±)”表示外消旋。
124、除非另有说明,用楔形实线键和楔形虚线键表示一个立体中心的绝对构型,用直形实线键和直形虚线键表示立体中心的相对构型,用波浪线表示楔形实线键或楔形虚线键或用波浪线表示直形实线键或直形虚线键
125、除非另有说明,术语“富含一种异构体”、“异构体富集”、“富含一种对映体”或者“对映体富集”指其中一种异构体或对映体的含量小于100%,并且,该异构体或对映体的含量大于等于60%,或者大于等于70%,或者大于等于80%,或者大于等于90%,或者大于等于95%,或者大于等于96%,或者大于等于97%,或者大于等于98%,或者大于等于99%,或者大于等于99.5%,或者大于等于99.6%,或者大于等于99.7%,或者大于等于99.8%,或者大于等于99.9%。
126、可以通过的手性合成或手性试剂或者其他常规技术制备光学活性的(r)-和(s)-异构体以及d和l异构体。如果想得到本技术某化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如氨基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成氨基甲酸盐)。本技术的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(3h),碘-125(125i)或c-14(14c)。又例如,可用重氢取代氢形成氘代药物,氘与碳构成的键比普通氢与碳构成的键更坚固,相比于未氘化药物,氘代药物有降低毒副作用、增加药物稳定性、增强疗效、延长药物生物半衰期等优势。本技术的化合物的所有同位素组成的变换,无论放射性与否,都包括在本技术的范围之内。
127、当本文所述化合物含有烯属双键或其它几何不对称中心,除非另有规定,它们包括e、z几何异构体。同样地,所有的互变异构形式均包含在本技术范围之内,例如与为互变异构形式;再例如与三者为互变异构形式。
128、术语“被取代的”是指特定原子上的任意一个或多个氢原子被取代基取代,可以包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。当取代基为氧(即=o)时,意味着两个氢原子被取代。氧取代不会发生在芳香基上。术语“任选被取代的”是指可以被取代,也可以不被取代,除非另有规定,取代基的种类和数目在化学上可以实现的基础上可以是任意的。
129、当任何变量(例如r)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被0-2个r所取代,则所述基团可以任选地至多被两个r所取代,并且每种情况下的r都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
130、当一个取代基的键可以连接到一个环上的一个以上原子时,这种取代基可以与这个环上的任意原子相键合,例如,结构单元表示其取代基r可在环己基或者环己二烯上的任意一个位置发生取代。当所列举的取代基中没有指明其通过哪一个原子连接到被取代的基团上时,这种取代基可以通过其任何原子相键合,例如,吡啶基作为取代基可以通过吡啶环上任意一个碳原子连接到被取代的基团上。
131、当两个取代基的键可以连接到一个环上的同一个碳原子时,这种取代基可以与这个环上的任意一个相同的碳原子相键合,例如,结构单元表示两个取代基可以在哌啶环上任意一个相同的碳原子上发生取代,因此,结构单元包括但不包括例如的结构单元。当所列举的连接基团没有指明其连接方向,其连接方向是任意的,例如,中连接基团l为-m-w-,此时-m-w-既可以按与从左往右的读取顺序相同的方向连接环a和环b构成也可以按照与从左往右的读取顺序相反的方向连接环a和环b构成所述连接基团、取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
132、除非另有规定,当某一基团具有一个或多个可连接位点时,该基团的任意一个或多个位点可以通过化学键与其他基团相连。当该化学键的连接方式是不定位的,且可连接位点存在h原子时,则连接化学键时,该位点的h原子的个数会随所连接化学键的个数而对应减少变成相应价数的基团。所述位点与其他基团连接的化学键可以用直形实线键直形虚线键或波浪线表示。例如-och3中的直形实线键表示通过该基团中的氧原子与其他基团相连;中的直形虚线键表示通过该基团中的氮原子的两端与其他基团相连;中的波浪线表示通过该苯基基团中的1和2位碳原子与其他基团相连;表示该哌啶基上的任意可连接位点可以通过1个化学键与其他基团相连,至少包括这4种连接方式,即使-n-上画出了h原子,但是仍包括这种连接方式的基团,只是在连接1个化学键时,该位点的的h会对应减少1个变成相应的一价哌啶基。
133、除非另有规定,环上原子的数目通常被定义为环的元数,例如,“5-7元环”是指环绕排列5-7个原子的“环”。
134、除非另有规定,术语“c1-6烷基”用于表示直链或支链的由1至6个碳原子组成的饱和碳氢基团。所述c1-6烷基包括c1-5、c1-4、c1-3、c1-2、c2-6、c2-4、c6和c5烷基等;其可以是一价(如甲基)、二价(如亚甲基)或者多价(如次甲基)。c1-6烷基的实例包括但不限于甲基(me)、乙基(et)、丙基(包括n-丙基和异丙基)、丁基(包括n-丁基,异丁基,s-丁基和t-丁基)、戊基(包括n-戊基,异戊基和新戊基)、己基等。
135、除非另有规定,术语“卤素”本身或作为另一取代基的一部分表示氟、氯、溴或碘原子。
136、除非另有规定,“c3-6环烷基”表示由3至6个碳原子组成的饱和环状碳氢基团,其为单环和双环体系,其中碳原子可任选被氧化(即c=o)。所述c3-6环烷基包括c3-5、c4-5和c5-6环烷基等;其可以是一价、二价或者多价。c3-6环烷基的实例包括但不限于,环丙基、环丁基、环戊基、环己基等。
137、除非另有规定,术语“4-14元杂环烷基”本身或者与其他术语联合分别表示由4至14个环原子组成的饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,碳、氮和硫杂原子可任选被氧化(即c=o、no和s(o)p,p是1或2)。所述其包括单环、双环和三环体系,其中双环和三环体系包括螺环、并环和桥环。此外,就该“4-14元杂环烷基”而言,杂原子可以占据杂环烷基与分子其余部分的连接位置。所述4-14元杂环烷基包括4-12元、4-10元、5-10元、5-9元、5-8元、3-10元、3-8元、3-6元、3-5元、4-6元、5-6元、4元、5元和6元杂环烷基等。4-14元杂环烷基的实例包括但不限于氮杂环丁基、氧杂环丁基、硫杂环丁基、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基、高哌啶基、二氧杂环庚烷基、等。
138、除非另有规定,术语“5-12元杂环烯基”本身或者与其他术语联合分别表示包含至少一个碳-碳双键的由5至12个环原子组成的部分不饱和的环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,碳、氮和硫杂原子可任选被氧化(即c=o、no和s(o)p,p是1或2)。其包括单环、双环和三环体系,其中双环和三环体系包括螺环、并环和桥环,此体系的任意环都是非芳香性的。此外,就该“5-12元杂环烯基”而言,杂原子可以占据杂环烯基与分子其余部分的连接位置。所述5-12元杂环烯基包括5-10元、5-8元、5-6元、4-5元、4元、5元和6元杂环烯基等。5-12元杂环烯基的实例包括但不限于
139、除非另有规定,本技术术语术语“c6-14芳基”表示由6至14个碳原子组成的具有共轭π电子体系的环状碳氢基团,它可以是单环、稠合双环或稠合三环体系,其中各个环均为芳香性的。其可以是一价、二价或者多价,c6-14芳基包括c6-10、c6-9、c6-8、c12、c14、c10和c6芳基等。c6-14芳基的实例包括但不限于苯基、萘基(包括1-萘基和2-萘基等)、蒽基。
140、除非另有规定,本技术术语“5-14元杂芳基”表示由5至14个环原子组成的具有共轭π电子体系的环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,碳、氮和硫杂原子可任选被氧化(即c=o、no和s(o)p,p是1或2))。其可以是单环、稠合双环或稠合三环体系,其中各个环均为芳香性的。5-14元杂芳基可通过杂原子或碳原子连接到分子的其余部分。所述5-14元杂芳基包括5-12元、5-10元、5-8元、5-7元、5-6元、5元和6元杂芳基等。所述5-12元杂芳基的实例包括但不限于吡咯基(包括n-吡咯基、2-吡咯基和3-吡咯基等)、吡唑基(包括2-吡唑基和3-吡唑基等)、咪唑基(包括n-咪唑基、2-咪唑基、4-咪唑基和5-咪唑基等)、噁唑基(包括2-噁唑基、4-噁唑基和5-噁唑基等)、三唑基(1h-1,2,3-三唑基、2h-1,2,3-三唑基、1h-1,2,4-三唑基和4h-1,2,4-三唑基等)、四唑基、异噁唑基(3-异噁唑基、4-异噁唑基和5-异噁唑基等)、噻唑基(包括2-噻唑基、4-噻唑基和5-噻唑基等)、呋喃基(包括2-呋喃基和3-呋喃基等)、噻吩基(包括2-噻吩基和3-噻吩基等)、吡啶基(包括2-吡啶基、3-吡啶基和4-吡啶基等)、吡嗪基、嘧啶基(包括2-嘧啶基和4-嘧啶基等)、苯并噻唑基(包括5-苯并噻唑基等)、嘌呤基、苯并咪唑基(包括2-苯并咪唑基等)、苯并噁唑基、吲哚基(包括5-吲哚基等)、异喹啉基(包括1-异喹啉基和5-异喹啉基等)、喹喔啉基(包括2-喹喔啉基和5-喹喔啉基等)、喹啉基(包括3-喹啉基和6-喹啉基等)或苯并异喹啉基。
141、除非另有规定,术语“杂原子或杂原子团(即含有杂原子的原子团)”,包括碳(c)和氢(h)以外的原子以及含有这些杂原子的原子团,例如包括氧(o)、氮(n)、硫(s)、硅(si)、锗(ge)、铝(al)、硼(b)、-o-、-s-、=o、=s、-c(=o)o-、-c(=o)-、-c(=s)-、-s(=o)、-s(=o)2-,以及任选被取代的-c(=o)n(h)-、-n(h)-、-c(=nh)-、-s(=o)2n(h)-或-s(=o)n(h)-。
142、本技术的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本技术的实施例。
143、本领域合成路线规划中的一个重要考量因素是为反应性官能团(如本技术中的氨基)选择合适的保护基,例如,可参考greene's protective groups in organicsynthesis(4th ed).hoboken,new jersey:johnwiley&sons,inc.本技术引用的所有参考文献整体上并入本技术。
144、合成路线通式:
145、
146、其中,
147、r'为cl和
148、r2、r3和r4如式(i)化合物所述。
149、本技术所使用的溶剂可经市售获得。
150、本技术采用下述缩略词:dmf代表n,n-二甲基甲酰胺;dmso代表二甲亚砜;bid代表每日两次给药。
151、化合物依据本领域常规命名原则或者使用软件命名,市售化合物采用供应商目录名称。
- 还没有人留言评论。精彩留言会获得点赞!