一类氘代二氯苄基硫醚类化合物及其制备方法和用途
本发明涉及药物化学领域,具体地涉及一类氘代二氯苄基硫醚类化合物及其制备方法和用途。
背景技术:
1、机械门控阳离子通道piezo1作为生物机械传感器在多种生命过程中承担重要角色,并与多种疾病的发生发展密切相关,特别是在调控骨稳态、促进骨重塑过程中起着关键性的作用。研究表明,piezo1在多种骨细胞中高表达,它介导胞外机械信号向胞内电化学信号的转导过程,从而诱导细胞分化,促进骨的重塑。机制研究表明,间充质干细胞piezo1被机械力激活后,能够通过诱导erk1/2和p38的磷酸化上调骨形态发生蛋白bmp的表达,从而促进骨间充质干细胞向成骨细胞分化;同时,piezo1激活后引发的钙内流又可通过激活ppp3ca/nfat/yap1/ctnbb1信号通路促进间充质干细胞分化为成骨细胞。而成骨细胞piezo1被机械力激活后也将激发胞内信号反应,包括ca2+内流、camkii-creb的磷酸化、akt-gsk3β/β-catenin信号通路的激活以及促进2型和9型胶原蛋白(col2/9)的表达,最终促进成骨细胞的分化。此外,骨细胞piezo1被激活后,也将引发ca2+内流,并且通过诱导akt的磷酸化,抑制骨硬化蛋白sost的表达与激活yap1/wnt1/ptgs2-tnfrsf11b通路共同促进骨的生成。更为重要的是,多项研究表明骨质疏松患者piezo1表达量明显低于正常水平,piezo1下调将导致严重的骨丢失并引发骨折(nature 2018,554,481-486.)。以上结果表明,piezo1作为机械门控阳离子通道,在调控骨稳态、促进骨重塑过程中起着关键性的作用,特异性激活piezo1有望成为预防失重性骨丢失和骨质疏松靶向治疗的新策略!
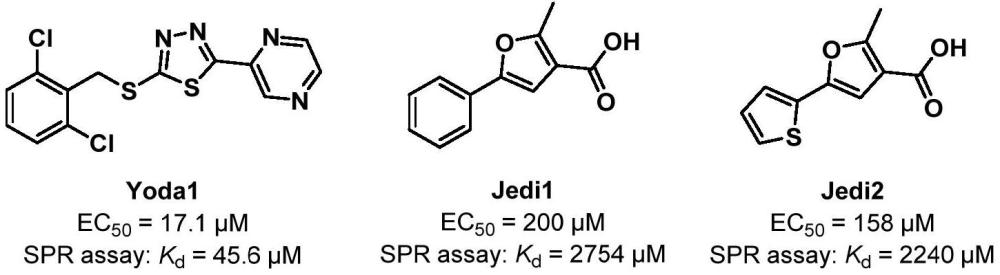
2、当前,靶向piezo1小分子激动剂的研究尚处于初期阶段。2015年,scripps研究所的syeda等通过高通量筛选发现了首个piezo1小分子激动剂yoda1(结构如下文所示),功能实验表明,yoda1能够选择性地激活鼠源和人源piezo1,其ec50值分别为17.1μm和26.6μm。随后的spr实验也证实,yoda1对piezo1蛋白具有一定亲和力,其kd值为45.6μm。在骨质疏松小鼠悬尾模型中,腹腔注射yoda1能够通过激活piezo1增加小鼠腿骨和胫骨的骨量,表现出一定的抗骨质疏松活性,且无明显的毒副作用(elife 2015,4,e07369.)。然而,该化合物溶解性差,仅限于腹腔给药,成药性也不理想。
3、
4、2018年,清华大学肖百龙课题组通过高通量筛选报道了两个羧酸甲基呋喃结构的piezo1小分子激动剂jedi1与jedi2(结构如上文所示),均能选择性地激活piezo1,ec50值分别为200μm和158μm。spr实验显示jedi1/2与piezo1蛋白结合力的kd值分别为2754μm与2240μm。细胞水平上,jedi1/2与yoda1联合使用能够产生协同增效的激活能力,表明两者不同的结合机制(nat.commun.2018,9,1300.)。遗憾的是,由于分子结构过于简单,细胞水平活性太弱,且作用机制不明确,jedi1/2未能进一步开发。
技术实现思路
1、本发明的目的在于提供一种式i所示化合物及其制备方法和其在预防和/或治疗骨质疏松等方面的用途。
2、本发明的第一方面,提供了一种化合物,所述化合物为式ⅰ所示的化合物、或其药学上可接受的盐或其外消旋体、异构体、或它们的混合物:
3、
4、其中:
5、各r1独立地选自下组:氢、卤素、氨基、羟基、巯基、氰基、-cooh、硝基、取代或未取代的c1-c8烷基、取代或未取代的c1-c8烷氧基、c1-c8烷基-(c=o)-o-、c1-c8烷基-nh-、c1-c8烷基-(c=o)-nh-;其中,所述取代指被选自下组的1、2或3个取代基取代:卤素、氨基、羟基、巯基、氰基、硝基、-cooh、-o-p(oh)2、-(p=o)-(o-c1-c6烷基)2;
6、m选自下组:0、1、2、3;
7、r2选自下组:氢、氘、取代或未取代的c1-c8烷基、取代或未取代的c3-c8环烷基;其中,所述取代指被选自下组的1、2或3个取代基取代:卤素、氨基、羟基、巯基、氰基;
8、x1、x2各自独立地选自下组:nh、o、s、se;
9、y、z各自独立地选自下组:ch、n;
10、a环选自下组:单环或并环的c6-c10芳基、单环或并环的含1、2或3个选自n、o或s的杂原子的5-10元杂芳基;
11、r3选自下组:氢、卤素、-nh2、氰基、-cooh、取代或未取代的c1-c8烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷基-nh-、取代或未取代的c2-c8烯基、取代或未取代的c2-c8炔基、取代或未取代的c3-c6环烷基、取代或未取代的含1、2或3个选自n、o或s的杂原子的4-10元杂环烷基、nh2-(c=o)-o-c1-c6亚烷基-、ch≡c-ch2-o-、c1-c6烷基-s(=o)2-o-、c1-c6烷基-s(=o)2-nh-;其中,所述取代指被选自下组的1、2或3个取代基取代:c1-c6烷基、卤代c1-c6烷基、羟基取代的c1-c6烷基、羟基、-(c=o)-o-c1-c6烷基、卤素、c1-c6烷氧基、羟基取代的c1-c6烷氧基、=o。
12、在另一优选例中,r1选自下组:氢、卤素、羟基、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基;其中,所述取代指被选自下组的1、2或3个取代基取代:卤素、-(p=o)-(o-c1-c6烷基)2;
13、m为1。
14、在另一优选例中,r1选自下组:氢、卤素;
15、m为1。
16、在另一优选例中,r2选自下组:氢、氘、c1-c6烷基。
17、在另一优选例中,x1、x2为s;
18、y、z为n。
19、在另一优选例中,a环为单环的含1、2或3个n杂原子的6元杂芳基。
20、在另一优选例中,a环选自下组:
21、在另一优选例中,r3选自下组:氢、卤素、-nh2、取代或未取代的c1-c6烷基-nh-、取代或未取代的含1、2或3个选自n、o或s的杂原子的4-10元杂环烷基;其中,所述取代指被选自下组的1、2或3个取代基取代:c1-c6烷基、卤代c1-c6烷基、羟基取代的c1-c6烷基、羟基、-(c=o)-o-c1-c6烷基、卤素、c1-c6烷氧基、羟基取代的c1-c6烷氧基、=o。
22、在另一优选例中,r3选自下组:取代或未取代的c1-c6烷基-nh-、取代或未取代的含1、2或3个选自n、o或s的杂原子的4-10元杂环烷基;其中,所述取代指被选自下组的1、2或3个取代基取代:羟基、-(c=o)-o-c1-c6烷基、卤素、羟基取代的c1-c6烷氧基、=o。
23、在另一优选例中,所述含1、2或3个选自n、o或s的杂原子的4-10元杂环烷基选自下组:
24、在另一优选例中,为
25、在另一优选例中,所述化合物选自下组:
26、
27、
28、本发明的第二方面,提供了一种药物组合物,包含药学上可接受的载体和一种或多种安全有效量的本发明第一方面所述化合物。
29、本发明的第三方面,提供了一种本发明第一方面所述化合物的用途,用于选自下组的用途:
30、1)用于制备药物,所述药物用于预防和/或治疗piezo1相关疾病;
31、2)用于激活piezo1的活性或提高piezo1的表达量。
32、在另一优选例中,所述药物为piezo1激动剂。
33、在另一优选例中,所述piezo1相关疾病选自下组:骨质疏松、失重性骨丢失、动脉粥样硬化、高血压、重症肌无力、自身免疫疾病、恶性肿瘤。
34、在另一优选例中,所述骨质疏松为piezo1表达量或活性降低的骨质疏松症。
35、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!