一种基于液滴微流控和流式细胞仪联用的丝状真菌高通量筛选方法及应用
本发明涉及一种基于液滴微流控和流式细胞仪联用的丝状真菌高通量筛选方法及应用,属于高通量筛选。
背景技术:
1、米曲霉广泛存在于自然界中并与人类生活息息相关。米曲霉具有强大的蛋白分泌能力和复杂的翻译后修饰系统,而且被美国食品药品监督管理局(fda)认为是安全的表达宿主,已广泛用于工业酶、蛋白制剂等重组蛋白的工业化生产。然而,大多数天然菌种具有产量低及对恶劣的工业条件耐受性弱等缺陷。目前,诱变筛选是菌种改良的直接而有效的手段之一。但传统的劳动密集型筛选方式的低效率阻碍了优良菌株的快速获得。因此,人们建立了一些基于流式细胞术或微流控技术的高通量筛选技术。
2、流式细胞术(flow cytometry)能够快速分析单个细胞的多个参数,并能以多种方式对靶细胞进行快速分类,是一种很有前途的高通量筛选技术。其中,facs(fluorescence-activated cell sorting)以其超高分选速度而闻名,对大肠杆菌的分选速度可达106个细胞/s。基于荧光蛋白gfp,facs可用于曲霉孢子早期萌发阶段的筛选,但并不适用于丝状形态的曲霉的高通量筛选。此外,工业生物技术中的大多数目标产品是细胞外产品,不仅可以避免细胞内反馈抑制,也便于下游加工。而facs只能用于分析产生与目标化合物相关的荧光信号的细胞内或膜结合产物,而用于分析细胞外产物具有挑战性。
3、微流体是一种在微升到皮升尺度上操纵流体的技术,克服了传统流式细胞仪的局限性。微流体技术通常使用微流控芯片(芯片具有生物和化学实验室的基本功能),因此被称为“芯片上的实验室”。基于微流控芯片技术,开发了一种基于液滴的微流控系统,用于独立的单细胞分析。它可以将曲霉的孢子包埋在微液滴中,类似于一个微型培养室,经过孵化培养后再直接或间接通过荧光信号进行筛选。然而,对于曲霉的筛选仍然具有一定的挑战性。因为曲霉极性生长的菌丝可能会戳破微液滴导致筛选失败,在生长的菌丝戳破液滴之前实现目标蛋白的检测是必要的。而不同曲霉的生长速度及不同重组蛋白的积累时间是不一样的,这在很大程度上限制了此筛选系统的普适性。此外,曲霉的异核体特性会对高产菌株的纯化分离和优良特性的稳定性带来巨大影响,这也阻碍了曲霉的工业化应用。因此,建立适应米曲霉等丝状真菌的体外筛选系统,同时加快异核体菌株后续的纯化分离对于米曲霉等丝状真菌的应用具有重大意义。
技术实现思路
1、本发明为解决流式细胞术和微流体技术存在的技术缺陷,建立适应米曲霉等丝状真菌的体外筛选系统,同时加快异核体菌株后续的纯化分离,提供了一种基于液滴微流控和流式细胞仪联用的丝状真菌高通量筛选方法及应用,本发明的具体技术方案如下:
2、本发明的第一个目的是提供一种基于微流控和流式细胞仪联用的丝状真菌高通量筛选方法,所述丝状真菌高通量筛选方法包括如下步骤:
3、(1)基于丝状真菌菌株的孢子或原生质体构建突变体文库;
4、(2)设计并制作液滴微流控生成芯片,所述液滴微流控生成芯片的通道深和宽均为200-250μm;
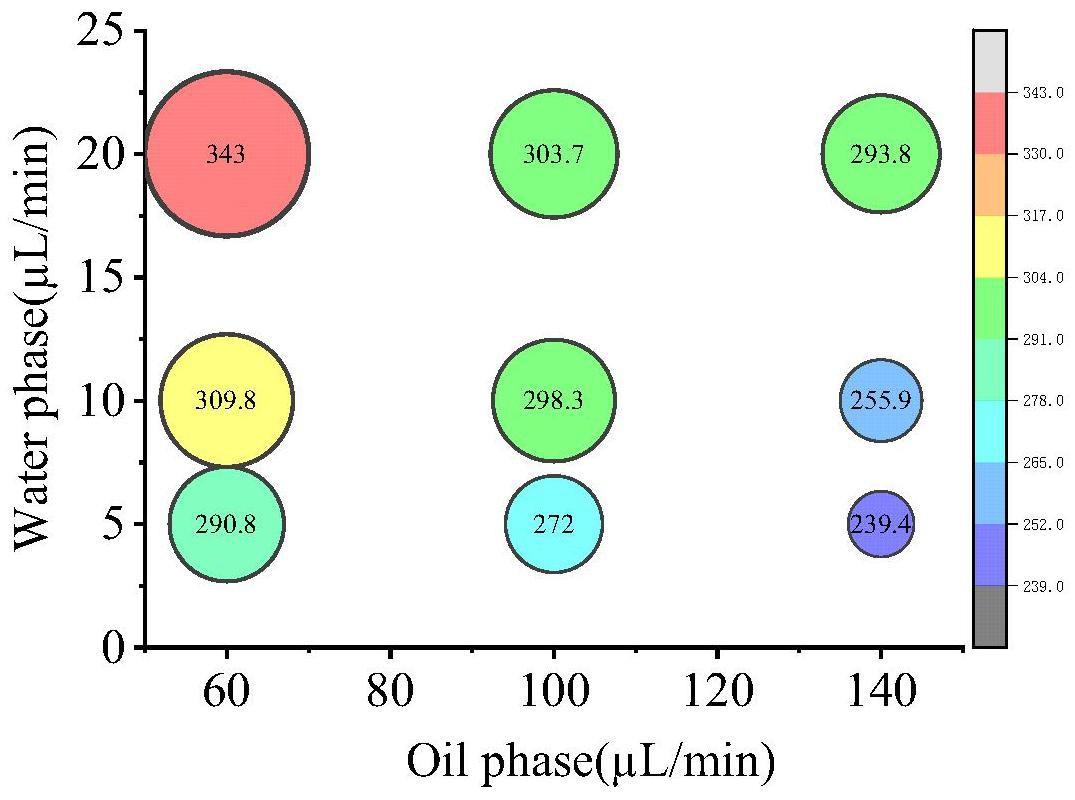
5、(3)控制水相流速为5-20μl/min,油相流速为50-150μl/min,可生成均匀稳定的大液滴,液滴的直径为200-350μm,30℃条件下可以稳定存留120h;所述水相体系为含有一定浓度步骤(1)获得的丝状真菌孢子或原生质体的培养基,包含一定浓度的荧光底物;油相体系为包含2%(w/w)pico-surftm的novectm7500;
6、(4)将步骤(3)生成的大液滴置于孵育箱中30±2℃静置培养,菌丝生长产生的目标产物会积累或催化荧光底物而积累荧光,相同培养条件下荧光的强弱体现酶活力的高低情况;
7、(5)分选时,利用微量注射泵将静止培养后的液滴注射到步骤(2)获得的液滴微流控生成芯片中,将488nm的蓝色激光对准筛选芯片的检测点,采集每个液滴的荧光信号,调整荧光阈值将荧光强度最高的3‰左右的液滴筛选出来,电压设置为20khz、1200-1500vpp、10-20ms;
8、(6)将步骤(5)筛选的液滴全部涂布至察氏培养基上,培养成熟后洗脱获得新鲜的孢子悬液,然后,使用血球计数板将孢子悬液浓度调整至105cfu/ml,再利用流式细胞仪将丝状真菌单孢子分选至96孔浅孔板中进行振荡发酵24h-48h,利用荧光底物检测突变体的酶活力积累情况,挑选高产菌株;
9、(7)将步骤(6)获得的高产菌株进行摇瓶发酵,检测目标产物的产量,验证高产菌株。
10、在本发明的一种实施方式中,步骤(1)所述突变体文库的构建采用常压室温等离子体诱变技术(artp),诱变条件设定为:孢子或原生质体悬液用量为10μl,载片与等离子体发生器射流出口间距为2mm,功率为120w,通气量10slm,诱变时间为150-180s。
11、在本发明的一种实施方式中,步骤(1)所述原生质体经混合酶液酶解制得,混合酶液配方为(w/v):1%纤维素酶、1%蜗牛酶、0.5%溶菌酶、0.5%溶壁酶,余量为水。酶解的条件为:酶液:湿菌丝=10ml:1.5g,ph 6.0、30℃酶解1.5-2h。
12、在本发明的一种实施方式中,步骤(3)所述培养基配方为(w/v):2%葡萄糖、0.5%胰蛋白胨、0.1%酵母粉、0.1% nano3、0.05% kh2po4、0.05% mgso4·7h2o、0.001%feso4·7h2o,余量为水。
13、在本发明的一种实施方式中,步骤(3)所述培养基中的孢子或原生质体浓度根据泊松分布中的λ值计算获得;所述原生质体需要在高渗条件下预培养3-6h完成再生后再进行包埋。
14、在本发明的一种实施方式中,步骤(3)所述水相体系中还包含终浓度为50ug/ml的dq淀粉底物。
15、在本发明的一种实施方式中,步骤(4)所述静止培养的时间为20-24h。
16、在本发明的一种实施方式中,步骤(5)所述分选的目标产物可以是胞内积累的,也可以是胞外分泌的。
17、在本发明的一种实施方式中,分选时,油相流速为5-10μl/min,液滴流速为1-2μl/min。在此条件下,富集的速率为10000-20000个/h,且富集的阳性效率达到50%以上。
18、在本发明的一种实施方式中,步骤(6)所述发酵的培养基配方为(w/v):2%葡萄糖、0.5%胰蛋白胨、0.1%酵母粉、0.1% nano3、0.05% kh2po4、0.05% mgso4·7h2o、0.001%feso4·7h2o;发酵条件为:30℃、220rpm培养24h。
19、在本发明的一种实施方式中,步骤(7)所述摇瓶发酵的条件为:30℃、220rpm培养72h。
20、在本发明的一种实施方式中,检测淀粉酶发酵酶活力的方法为dns法。
21、在本发明的一种实施方式中,复筛的高产阳性率为95%以上。
22、本发明的第二个目的是提供上述方法在筛选分泌表达的酶蛋白的高产菌株,或筛选丝状真菌内源的整合位点和启动子,或实现丝状真菌的高通量筛选和高效纯化分离中的应用。
23、本发明的有益效果:
24、本发明方法基于微流控技术和流式细胞术提供了一种适合米曲霉等丝状真菌等的高通量筛选方法。此方法不仅可以筛选分泌表达酶蛋白的高产菌株而不局限于胞外产物,还可以筛选米曲霉内源的整合位点和启动子。利用此方法可以高效地实现曲霉等丝状真菌的高通量筛选和高效纯化分离(见表1)。大微液滴的稳定环境可以实现曲霉孢子的萌发、生长、产酶和催化反应等连续过程,进而可以筛选前中期的发酵产物,通过积累的荧光信号强度就能筛选出阳性菌株。使用流式细胞仪的单孢子分选可以实现米曲霉的快速纯化分离和优良特性的稳定验证。筛选效率极大地提高的同时,也避免了曲霉操作困难的问题。
- 还没有人留言评论。精彩留言会获得点赞!