一种基于PSMA的CAR基因修饰的免疫细胞及其联合雄激素受体抑制剂的应用的制作方法
本发明属于药物制备,具体涉及一种基于前列腺特异性膜抗原(prostate specific membrane antigen,psma)的嵌合抗原受体(chimeric antigenreceptor,car)基因修饰的免疫细胞及其和雄激素受体抑制剂在制备治疗psma表达阳性的疾病的药物中的应用。
背景技术:
1、随着肿瘤免疫学理论和临床技术的发展,嵌合抗原受体t细胞疗法 (chimericantigen receptor t-cell immunotherapy,car-t)成为目前最有发展前景的肿瘤免疫疗法之一。一般,嵌合抗原受体car由一个肿瘤相关抗原结合区、胞外铰链区、跨膜区域以及胞内信号转导区组成。通常,car包含抗体的单链片段可变 (sing le cha in f ragmentvariable,scfv)区或对肿瘤相关抗原(tumor associated antigen,taa)具有特异性的结合结构域,其通过铰链和跨膜区与t细胞信号传导分子的胞质结构域偶联。最常见的淋巴细胞活化部分包括与t细胞效应物功能触发(例如cd3ζ)部分串联的t细胞共刺激结构域。car介导的过继性免疫疗法允许car-t移植的t细胞以非hla限制性方式直接识别靶肿瘤细胞上的taa。
2、前列腺特异性膜抗原(prostate specific membrane antigen,psma)是明确的、高限制性前列腺癌相关细胞膜抗原。psma在前列腺癌细胞中的表达比正常前列腺上皮表达高1000倍(su等,cancer res.199544:1441-1443)。随着前列腺癌的进展,psma的表达也随之提高,并且在转移性疾病、激素难治性病症 和 高 级 病 变 中 达 到 最 高(israeli等 cancer res.1994,54:1807-1811;wright等,urologic oncology:seminars andoriginal investigations(《内分泌肿瘤学:研讨会和原始调查》)19951:18-28 ;wright等,urology199648:326-332;sweat等,urology199852:637-640)。且psma在去势抵抗性前列腺癌中显著过表达,其过表达与高肿瘤分级、疾病进展和复发、临床预后较差和患者生存期缩短相关。另外,psma在其它各种实体瘤的新血管系统中大量表达,该实体瘤包括膀胱癌、胰腺癌、黑素瘤、肺癌和肾癌,但psma在正常的新血管系统中不表达(chang 等,urology57:801-805;divgi等,clin.cancer res.19984:2729-3279)。已显示psma是免疫学方法,例如疫苗或单克隆抗体定向疗法的重要靶标。与作为分泌蛋白(psa,前列腺酸性磷酸酶)的其它前列腺限制性分子不同,psma是不被分泌的完整细胞表面膜蛋白,这使其成为免疫疗法的理想靶标。
3、前列腺癌是男性患癌的主要原因,并且是癌引发的死亡的第二大原因。目前用于前列腺癌的治疗方法主要包括手术、放射和激素治疗。然而,大部分肿瘤细胞通常因对雄激素不敏感而导致耐药。鉴于psma的物理特性及其表达模式与前列腺癌进展相关,psma是包含前列腺癌在内的多种癌症靶向治疗的理想靶点,也是car研究的热点。已有超过10项psma嵌合抗原受体细胞治疗进入临床研究,但由于肿瘤血管系统和细胞外基质等恶性组织的特定性阻碍了car-t细胞的渗透,car-t用于实体瘤治疗处于探索阶段。截至目前暂无有效的psma car-t疗法应用于psma阳性肿瘤患者治疗,靶向psma治疗肿瘤仍然面临挑战。故需要更有效的治疗方法,或改进现有靶向psma相关治疗方法的疗效以满足前列腺癌及其他psma阳性癌症患者治疗需求。
技术实现思路
1、本发明的目的在于提供一种基于psma的嵌合抗原受体基因修饰的免疫细胞及其和雄激素受体抑制剂的应用。本发明所述免疫细胞联合雄激素受体抑制剂能够实现psma表达阳性的疾病的有效治疗。
2、本发明提供了一种基于前列腺特异性膜抗原的嵌合抗原受体基因修饰的免疫细胞,所述嵌合抗原受体包括能够结合前列腺特异性膜抗原的抗原结合结构域,以及与所述抗原结合结构域串联的跨膜结构域、共刺激信号传导结构域、铰链区和信号肽;所述抗原结合结构域选自scfv、fab、fab’和f(ab’)2中的任意一种;
3、所述scfv的氨基酸序列如(i)、(ii)或(iii)所示:
4、(i)具有如seq id no.1所示的氨基酸序列;
5、(ii)与seq id no.1所示氨基酸序列具有90%以上同源性且具有结合前列腺特异性膜抗原功能的氨基酸序列;
6、(iii)seq id no.1所示的氨基酸序列经修饰、取代、缺失或添加一个或两个以上氨基酸获得的具有结合前列腺特异性膜抗原功能的氨基酸序列。
7、优选的是,所述跨膜结构域选自cd8、cd28、cd33、cd37、cd5、cd16、icos、cd9、cd22、cd134、cd137、cd154、cd19、cd45、cd4和cd3ε的跨膜结构域中的一种或两种以上;;所述cd8包括cd8α。
8、所述共刺激信号传导结构域选自cd27、cd3ζ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b、cd66d、cd2、cd4、cd5、cd28、cd30、cd40、cd134、cd137、icos、cd154、4-1bb、ox40、cd7、light、nkg2c和b7-h3的细胞内结构域中的一种或两种以上;
9、所述铰链区包括igg1铰链区和/或cd8α铰链区;
10、所述信号肽包括cd8α信号肽。
11、优选的是,所述跨膜结构域为cd8α的跨膜结构域,所述cd8α的跨膜结构域的氨基酸序列如seq id no.3所示;
12、所述共刺激信号传导结构域为串联的cd3ζ的细胞内结构域和4-1bb的细胞内结构域,所述cd3ζ的细胞内结构域的氨基酸序列如seq id no.7所示,所述4-1bb的细胞内结构域的氨基酸序列如seq id no.5所示;
13、所述铰链区为cd8α铰链区,所述cd8α铰链区的氨基酸序列如seq id no.9所示;
14、所述信号肽为cd8α信号肽,所述cd8α信号肽的氨基酸序列如seq id no.11所示。
15、优选的是,所述嵌合抗原受体的氨基酸序列如seq id no.13所示。
16、优选的是,编码所述嵌合抗原受体的基因的核苷酸序列如seq id no.14所示。
17、本发明还提供了上述技术方案所述免疫细胞的制备方法,包括以下步骤:
18、将表达所述嵌合抗原受体的病毒感染未经修饰的细胞,得到所述免疫细胞。
19、本发明还提供了上述技术方案所述的免疫细胞或上述技术方案所述制备方法制备得到的免疫细胞联合雄激素受体抑制剂在制备治疗psma表达阳性的疾病的药物中的应用。
20、本发明还提供了一种治疗psma表达阳性的疾病的药物组合物,所述药物组合物包括上述技术方案所述的免疫细胞或上述技术方案所述制备方法制备得到的免疫细胞和雄激素受体抑制剂。
21、优选的是,所述psma表达阳性的疾病包括癌症;所述癌症包括前列腺癌、结直肠癌、胃癌、透明细胞肾癌、膀胱癌或肺癌。
22、优选的是,所述雄激素受体抑制剂包括阿帕鲁胺、瑞维鲁胺和恩扎鲁胺、醋酸阿比特龙、比卡鲁胺、达罗他胺、卡巴他赛、氟他胺、醋酸环丙孕酮、地加瑞克、多西他赛、醋酸戈舍瑞林、醋酸亮丙瑞林、盐酸米托蒽醌、泼尼松、二氯化镭223和sipuleucel-t中的一种或两种以上。
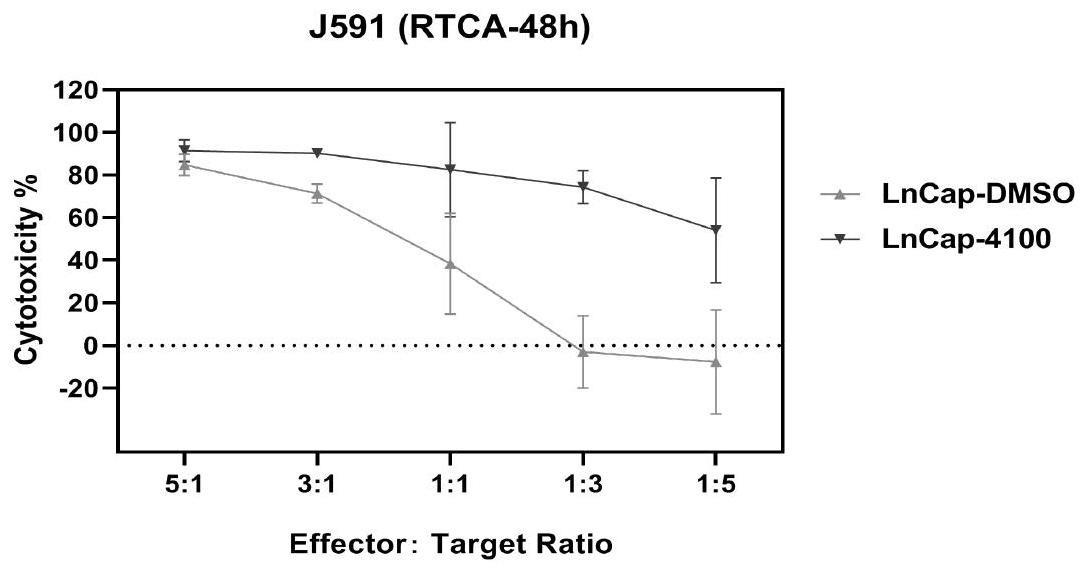
23、本发明提供了一种基于psma的嵌合抗原受体基因修饰的免疫细胞。本发明所述基于psma的嵌合抗原受体基因修饰的免疫细胞中嵌合抗原受体相比于其他嵌合抗原受体和其他肿瘤抗原有更好的效果。本发明所述基于psma的嵌合抗原受体基因修饰的免疫细胞联合雄激素受体抑制剂(如阿帕鲁胺、瑞维鲁胺和/或恩扎鲁胺)组合可用于治疗表达psma的实体肿瘤,克服car-t在psma阳性实体肿瘤疗效的局限性,进一步扩大car-t的治疗领域;同时为雄激素剥夺治疗后进展的前列腺癌患者提供了一种新的有希望的治疗方法。
24、本发明的有益效果是:
25、1)本发明的嵌合抗原受体能特异性的识别肿瘤表面psma抗原,通过雄激素受体抑制剂(如阿帕鲁胺、瑞维鲁胺和/或恩扎鲁胺)预先治疗使肿瘤细胞上调psma表达,使得更多的car-t细胞能够到达肿瘤病灶处,从而提高car-t细胞对肿瘤细胞的杀伤活性。相较于单独施用car-t或雄激素受体抑制剂治疗相比,该联合用药方案具有更好的治疗效果,更容易缓解疾病。
26、2)本发明提供的car-t与雄激素受体抑制剂(如阿帕鲁胺、瑞维鲁胺和/或恩扎鲁胺)组合用于psma阳性实体肿瘤治疗。可对接受了雄激素剥夺治疗后去势抵抗性前列腺癌仍进展的表达psma的患者进行治疗,解决去势抵抗性前列腺癌患者雄激素受体抑制剂耐药的临床需求(具体的,使用雄激素受体抑制剂进行雄激素剥夺治疗后未死亡的细胞(雄激素受体抑制剂耐药细胞),采用car-t细胞进行后续治疗可有效杀死耐药的癌细胞)。本发明提供的psma嵌合抗原受体细胞及其与雄激素受体抑制剂(如阿帕鲁胺、瑞维鲁胺和/或恩扎鲁胺)组合具有良好的肿瘤治疗应用前景。
- 还没有人留言评论。精彩留言会获得点赞!