一种多取代三嗪烷类化合物的合成方法与流程
本发明属于药物合成,具体涉及一种多取代三嗪烷类化合物的合成方法。
背景技术:
1、三嗪烷类化合物s-217622(ia,ensitrelvir)是日本盐野义公司开发的非肽类小分子3cl蛋白抑制剂,体外实验对sars-cov-2、sars、mers和人冠状病毒hcov-229e等均有抑制活性,对sars-cov-2的变异的有效,对奥密克戎毒株的抑制活性更强,目前,s-217622正在进行2-3期临床试验。中国专利公布了s-217622的氘代衍生物,其药理活性和药代动力学性质与s-217622相比都有一定提高。
2、
3、盐野义公司在biorxiv上公开了s-217622的合成工艺(上图,yuto unoh,etal.discovery of s-217622,a non-covalent oral sars-cov-2 3cl proteaseinhibitor clinical candidate for treating covid-19.biorxiv2022.01.26.477782.,文献1),以乙硫基甲脒和异氰酸异丁酯为起始物料构建三嗪烷环,经与2,4,5-三氟苄溴进行烷基化反应引入2,4,5-三氟苄基,三氟乙酸脱叔丁基,在先后用烷基化和取代反应引入三氮唑片段和吲唑亚胺药效团,得到目标化合物s-217622。该工艺路线不长,但存在最后两步关键步骤收率较低,取代反应引入吲唑亚胺的反应过程中产生有污染臭味的乙硫醇,导致生产成本较高和安全环保问题。
4、基于此,特提出本发明。
技术实现思路
1、本发明所要解决的技术问题是为了克服现有技术中三嗪烷类化合物制备方法中收率等的缺陷:为此,而提供了一种多取代三嗪烷类化合物的合成方法。本发明的制备方法可以大幅提升多取代三嗪烷类化合物的收率且成本低和操作简单;采用本发明的制备方法制得的产品对sars-cov-2 3cl蛋白酶抑制活性佳、肝微粒代谢佳或药代动力学佳。
2、本发明通过下述技术方案解决上述技术问题:
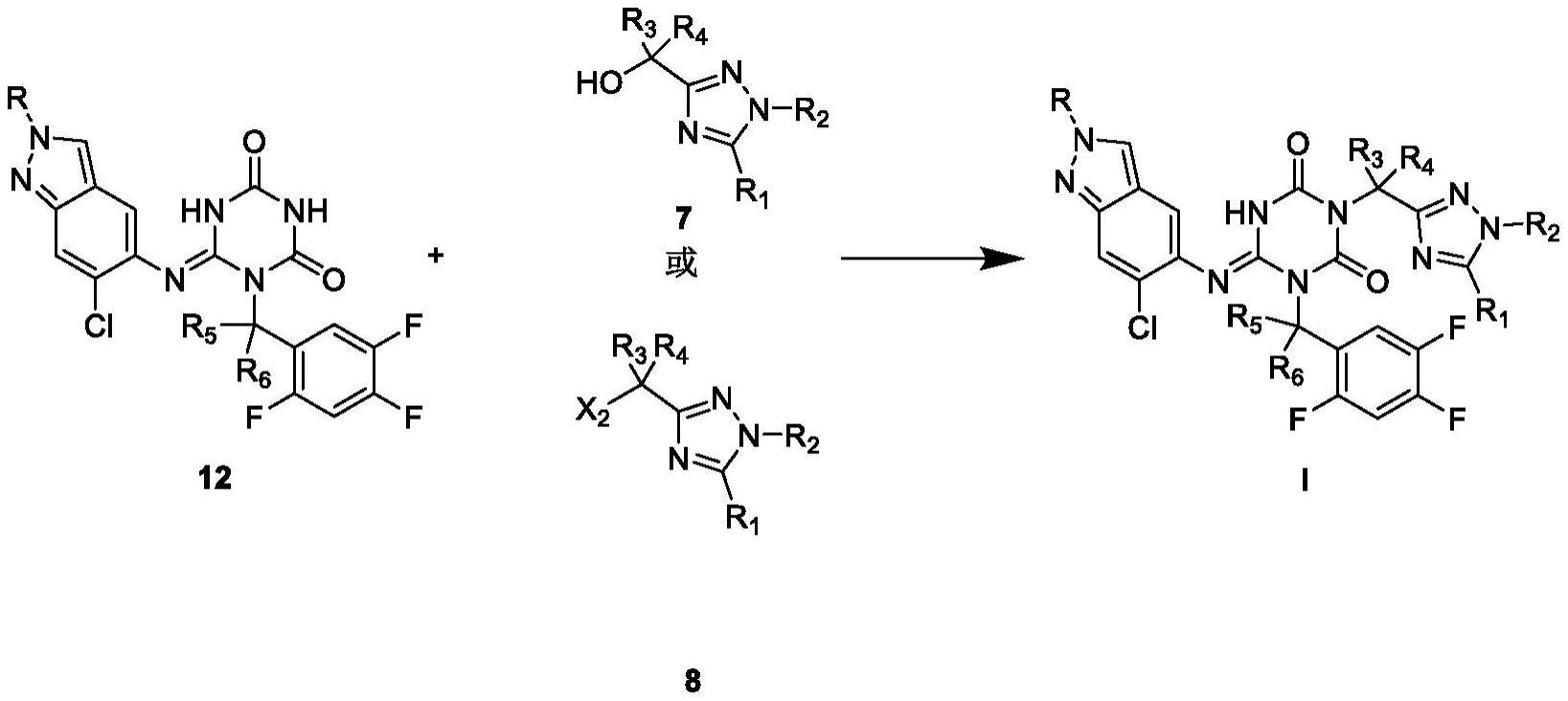
3、本发明提供了一种式i化合物的制备方法,其包括如下步骤;在溶剂中,将化合物12和化合物7进行如下光延反应,得到式i化合物;
4、
5、其中,r和r2独立地为c1-4烷基或被1个或多个氘代的c1-4烷基;
6、r1、r3、r4、r5和r6独立地为h或氘。
7、r和r2中,所述的c1-4烷基和所述的被1个或多个氘取代的c1-4烷基中的c1-4烷基独立地优选为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基,例如甲基。
8、r和r2中,所述的被1个或多个氘取代的c1-4烷基优选为被3个氘取代的c1-4烷基,例如cd3。
9、本发明中,所述的化合物12优选为
10、本发明中,所述的化合物7优选为
11、本发明中,所述的化合物i优选为
12、本发明中,所述的光延反应条件和操作为本领域此类反应常规的条件和操作。本发明特别优选如下条件和操作;
13、本发明中,所述的溶剂优选为酰胺类溶剂,进一步优选为n,n-二甲基甲酰胺(dmf)和/或n,n-二甲基乙酰胺。所述的溶剂的用量可不做具体限定,只要不影响反应进行即可。所述的溶剂与所述的化合物12的体积质量比优选为3-25ml/g,例如7.6ml/g或11.3ml/g。
14、本发明中,所述的化合物7与所述的化合物12的摩尔比优选为(1-1.1):1,例如1.1:1。
15、本发明中,所述的光延反应优选在三苯基膦和偶氮试剂存在下进行。
16、其中,所述的三苯基膦与所述的化合物12的摩尔比优选为(1.2-1.5):1,例如1.2:1。
17、其中,所述的偶氮试剂可以为光延反应所用常规的偶氮类化合物,优选为偶氮二甲酸异丙酯(diad)、偶氮二甲酸乙酯(dead)、偶氮二甲酸甲酯和偶氮二甲酸叔丁酯中的一种或多种,优选偶氮二甲酸异丙酯(diad)。
18、其中,所述的偶氮类化合物与所述的化合物12的摩尔比优选为(1.2-1.5):1。
19、所述的光延反应的温度优选为室温。
20、所述的脱保护反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物12不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如24h。
21、所述的光延反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规反应步骤,例如萃取(例如采用二氯甲烷萃取)、洗涤、干燥、浓缩和柱层析。
22、所述的式i化合物的制备方法还可包括所述的化合物12的制备方法,所述的化合物12制备方法优选方法i、方法ii或方法iii、:
23、方法i:
24、所述的化合物12制备方法包括如下步骤:在脱保护试剂存在下,将化合物11进行如下式的脱保护反应,得到所述的12化合物;
25、
26、r、r5和r6的定义同前所述;
27、方法ii:
28、所述的化合物12制备方法包括如下步骤:在三氟醋酸存在下中,将所述的化合物5和所述的化合物10进行如下反应,得到所述的12化合物;
29、
30、其中,x1为卤素(优选为f、cl、br或i,例如cl);r、r5和r6的定义同前所述;
31、方法iii:
32、所述的化合物12制备方法包括如下步骤:在溶剂中,将所述的化合物14和所述的化合物10进行如下反应,得到所述的12化合物;
33、
34、其中,x1为卤素(优选为f、cl、br或i,例如cl);r、r5和r6的定义同前所述。
35、方法i中,所述的脱保护试剂可以为本领域常规的脱保护试剂,例如三氟醋酸。
36、方法i中,所述的脱保护试剂与所述的化合物11的摩尔比可以为本领域常规的摩尔比,优选为≥10:1。
37、方法i中,所述的化合物11优选为
38、方法i中,所述的脱保护试剂可以在溶剂存在或不存在下进行。当所述的反应在溶剂存在下进行时,所述的溶剂可以为卤代烃类溶剂,例如二氯甲烷。
39、方法i中,所述的脱保护反应的温度优选为10-70℃,例如室温。
40、方法i中,所述的脱保护反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物11不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如24h。
41、方法i中,所述的脱保护反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规后处理步骤,例如浓缩、打浆、过滤和干燥。
42、方法ii中,所述的化合物5优选为
43、方法ii中,所述的化合物10优选为
44、方法ii中,所述的反应可以在溶剂存在下或者不存在下进行反应。当所述的反应在溶剂存在下进行反应时,所述的溶剂可以为羧酸类溶剂(如乙酸)、芳香烃(如甲苯)、卤代烷(如二氯甲烷、二氯乙烷、和氯仿等)、醇类溶剂(例如乙醇、丙醇、叔丁醇或戊醇)、腈类溶剂(例如乙腈)、醚类溶剂(例如四氢呋喃、二氧六环或乙二醇二甲醚)、砜类溶剂(例如二甲亚砜)和酰胺类溶剂(例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺和n-甲基吡咯烷酮)中一种或多种。
45、方法ii中,所述的化合物10与所述的化合物5的摩尔比可以为本领域常规的摩尔比,优选(1.05-1.2):1,例如1.1:1。
46、方法ii中,所述的反应的温度优选为60-120℃,例如60-80℃。
47、方法ii中,所述的反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物5不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如24h。
48、方法iii中,所述的化合物14优选为
49、方法iii中,所述的化合物10优选为
50、方法iii中,所述的反应的条件和操作可以为本领域常规的条件和操作,优选如下的条件和操作:
51、方法iii中,所述的溶剂可以为本领域反应常用的溶剂,优选为醇类溶剂(例如乙醇、丙醇、叔丁醇或戊醇)、腈类溶剂(例如乙腈)、醚类溶剂(例如四氢呋喃、二氧六环或乙二醇二甲醚)、砜类溶剂(例如二甲亚砜)和酰胺类溶剂(例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺和n-甲基吡咯烷酮)中一种或多种,更优选为醇类溶剂(例如叔丁醇)。
52、方法iii中,所述的化合物13优选为
53、方法iii中,所述的化合物10优选为
54、方法iii中,所述的化合物10与所述的化合物14的摩尔比可以为本领域常规的摩尔比,优选(1-1.2):1,例如1.1:1。
55、方法iii中,所述的反应的温度优选为80-120℃,例如60-80℃。
56、方法iii中,所述的反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物14不再反应或者消失作为反应的终点。所述的反应时间可为1-8h,例如3h。
57、所述的化合物12的制备方法还可包括所述的化合物11(方法i中)的制备方法,所述的化合物11的制备方法优选为方法a或方法b:
58、方法a:
59、所述的化合物11的制备方法包括如下步骤:在溶剂中,将所述的化合物5和所述的化合物10进行如下反应,得到所述化合物11;
60、
61、x1、r5、r6和r定义均同前所述;
62、方法b:
63、所述的化合物11的制备方法包括如下步骤:在溶剂中,将所述的化合物13和所述的化合物10进行如下反应,得到所述化合物11;
64、
65、x1、r5、r6和r定义均同前所述。
66、方法a中,所述的化合物5优选为
67、方法a中,所述的化合物10优选为
68、方法a中,所述的化合物10与所述的化合物5的摩尔比可以为本领域常规的摩尔比,优选(1.05-1.2):1;所述的反应的其他条件和操作均同所述的方法ii中其他条件和操作。
69、方法a中,所述的化合物11的制备方法还可包括所述的化合物5的制备方法,所述的化合物5的制备方法包括如下步骤:在碱存在下,将化合物3和化合物4在溶剂中进行如下的烷基化反应,得到所述的化合物5;
70、
71、x3为卤素;r5和r6的定义均同前所述。
72、x3中,所述的卤素优选为f、cl、br或i,例如br。
73、其中,所述的碱可以为本领域常规的碱,优选为叔胺碱(例如三乙胺或二异丙基乙基胺)、碱金属碳酸盐(例如碳酸钾)、碱金属碱(例如氢氧化钠或氢氧化钾)、叔丁醇碱金属盐(例如叔丁醇钾或叔丁醇钠)、双(三甲基硅基)氨基锂(lhmds)、双(三甲基硅基)氨基钾(khmds)和氢化钠中一种或多种,更优选为叔胺碱(例如二异丙基乙基胺)和/或碱金属碳酸盐(例如碳酸钾)。
74、其中,所述的碱与所述的化合物3的摩尔比可以为本领域常规的摩尔比,优选(1.2-1.5):1,例如1.2:1。
75、其中,所述的化合物4与所述的化合物3的摩尔比可以为本领域常规的摩尔比,优选(1.1-1.2):1,例如1.1:1。
76、其中,所述的反应的温度优选为10-120℃,例如60℃。
77、所述的反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物3不再反应或者消失作为反应的终点。所述的反应时间可为3-12h,例如8h。
78、所述的反应结束后的后处理步骤可以为此类反应所用的常规后处理步骤,例如调节ph值、萃取、饱和食盐水洗涤、干燥、浓缩和柱层析。
79、所述的化合物5的制备方法还可包括所述的化合物3的制备方法,所述的化合物3的制备方法包括如下步骤:在有机碱存在下,在溶剂中,将化合物1、化合物2和1,1'-羰基二咪唑(cdi)进行如下环化反应,得到所述的化合物3;
80、所述的化合物2为叔丁胺(t-bunh2)或异氰酸叔丁酯(t-bunco);
81、
82、所述的环化反应的条件和操作可以为本领域此类反应常规的条件和操作,本发明特别优选如下条件和操作:
83、所述的有机碱优选为叔胺碱(例如三乙胺和/或二异丙基乙基胺)、吡啶和n,n-二甲基苯胺和1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)中的一种或多种,例如1,8-二氮杂双环[5.4.0]十一碳-7-烯。
84、所述的有机碱与所述的化合物1的摩尔比,优选为(2.0-2.5):1,例如2.3:1或2.4:1。
85、所述的1,1'-羰基二咪唑与所述的化合物1的摩尔比,优选为(2.0-2.5):1,例如2.2:1。
86、所述的环化反应的温度优选为30-115℃,例如50℃。
87、所述的环化反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物1不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如过夜。
88、所述的环化反应结束后的后处理步骤可以为此类反应所用的常规后处理步骤,例如冷却、调节ph值(例如盐酸调至ph值为1-2)、过滤、水洗和干燥。
89、方法b中,所述的化合物13优选为
90、方法b中,所述的化合物10优选为
91、方法b中,所述的溶剂优选为醇类溶剂和乙酸的混合溶剂,进一步优选为叔丁醇和乙酸。所述的醇类溶剂与乙酸的体积比优选为(2-7):1,例如5:1。
92、方法b中,所述的化合物10与所述的化合物13的摩尔比可以为本领域常规的摩尔比,优选(1-1.2):1,例如1.1:1;所述的反应的其他条件和操作均同所述的方法iii中其他条件和操作。
93、本发明还提供了一种式i化合物的制备方法,其包括如下步骤;在碱性试剂中,在溶剂中,将化合物12和化合物8进行如下烷基化反应,得到式i化合物;
94、
95、其中,x2为卤素;r、r1、r2、r3、r4、r5和r6的定义均同前所述。
96、本发明中,所述的化合物12优选为
97、本发明中,所说的式i化合物的制备方法优选包括上述的化合物12的制备方法;所述的化合物12的制备方法的条件和操作均同前所述。
98、本发明中,所述的化合物8优选为
99、本发明中,所述的化合物i优选为
100、本发明中,所述的烷基化反应条件和操作可以为本领域此类反应常规的条件和操作。本发明特别优选如下条件和操作;
101、本发明中,所述的溶剂优选为腈类溶剂(例如乙腈)、醚类溶剂(例如二氧六环)和酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma)或n-甲基吡咯烷酮(nmp))中的一种或多种,更优选为酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)或n,n-二甲基乙酰胺(dma))。所述的溶剂的用量可不做具体限定,只要不影响反应进行即可。所述的溶剂与所述的化合物12的体积质量比优选为5-30ml/g,例如7.6ml/g。
102、本发明中,所述的碱性试剂优选为碱金属碳酸盐(例如碳酸钾或碳酸钠和/或碳酸铯)和/或叔胺碱(例如二异丙基乙基胺),更优选为碱金属碳酸盐(例如碳酸钾)。
103、本发明中,所述的化合物碱性试剂与所述的化合物12的摩尔比优选为(1.5-3):1,例如2.5:1。
104、本发明中,所述的化合物8与所述的化合物12的摩尔比优选为(1-1.2):1,例如1.1:1。
105、所述的烷基化反应的温度优选为50-100℃,更优选70-80℃。
106、所述的烷基化反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物12不再反应或者消失作为反应的终点。所述的反应时间可为2-8h,例如5h。
107、所述的烷基化反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规反应步骤,例如萃取(例如采用二氯甲烷萃取)、洗涤、干燥、浓缩和柱层析。
108、本发明还提供了一种化合物11的制备方法,其为方法i或方法ii:
109、所述的方法i包括如下步骤:在溶剂中,将所述的化合物5和所述的化合物10进行如下反应,得到所述化合物11;
110、
111、所述的方法ii包括如下步骤:在溶剂中,将所述的化合物13和所述的化合物10进行如下反应,得到所述化合物11;
112、
113、其中,x1、r、r5和r6的定义均同前所述,所述的反应的条件和操作均同前所述。
114、本发明还提供了一种化合物12的制备方法,其为方法i、方法ii或方法iii、:
115、方法i:
116、所述的化合物12制备方法包括如下步骤:在脱保护试剂存在下,将化合物11进行如下式的脱保护反应,得到所述的12化合物;
117、
118、r、r5和r6的定义同前所述;
119、方法ii:
120、所述的化合物12制备方法包括如下步骤:在三氟醋酸存在下中,将所述的化合物5和所述的化合物10进行如下反应,得到所述的12化合物;
121、
122、其中,x1为卤素(优选为f、cl、br或i,例如cl);r、r5和r6的定义同前所述;
123、方法iii:
124、所述的化合物12制备方法包括如下步骤:在溶剂中,将所述的化合物14和所述的化合物10进行如下反应,得到所述的12化合物;
125、
126、其中,x1为卤素(优选为f、cl、br或i,例如cl);r、r5和r6的定义同前所述。
127、方法i至iii中的反应的条件和操作均同前所述。
128、本发明还提供了一种如下式的化合物:
129、
130、其中,r、r1、r2、r3、r4、r5和r6的定义均同前所述。
131、所述的化合物优选如下任一化合物:
132、
133、本发明提供了一种式i化合物的制备方法,其包括如下步骤:在溶剂中,将化合物9和化合物10进行如下取代化反应,得到式i化合物;
134、
135、其中,x1为卤素;
136、r和r2独立地为c1-4烷基或被1个或多个氘代的c1-4烷基;
137、r1、r3、r4、r5和r6独立地为h或氘。
138、x1中,所述的卤素优选为f、cl、br或i,例如cl。
139、r和r2中,所述的c1-4烷基和所述的被1个或多个氘取代的c1-4烷基中的c1-4烷基独立地优选为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基,例如甲基。
140、r和r2中,所述的被1个或多个氘取代的c1-4烷基优选为被3个氘取代的c1-4烷基,例如cd3。
141、本发明中,所述的化合物9优选为例如
142、本发明中,所述的化合物10优选为例如
143、本发明中,所述的化合物i优选为例如
144、本发明中,所述的取代化反应条件和操作可以为本领域此类反应常规的条件和操作。本发明特别优选如下条件和操作;
145、本发明中,所述的溶剂优选为醇类溶剂(例如叔丁醇)、腈类溶剂(例如乙腈)、醚类溶剂(例如二氧六环或乙二醇二甲醚)、砜类溶剂(例如二甲亚砜)和酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)和/或n,n-二甲基乙酰胺(dma)或n-甲基吡咯烷酮(nmp))中的一种或多种,更优选为醇类溶剂(例如叔丁醇)和/或腈类溶剂(例如乙腈)。所述的溶剂的用量可不做具体限定,只要不影响反应进行即可。所述的溶剂与所述的化合物9的体积质量比优选为8-15ml/g,例如11.9ml/g。
146、本发明中,所述的化合物10与所述的化合物9的摩尔比优选为(1-1.2):1,例如1.1:1。
147、所述的取代反应的温度优选为50-100℃,例如60℃-90℃。
148、所述的取代反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物10不再反应或者消失作为反应的终点。所述的反应时间可为2-16h,例如5-10h。
149、所述的取代反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规反应步骤,例如浓缩和柱层析。
150、所述的式i化合物的制备方法还可包括所述的化合物9的制备方法,所述的化合物9的制备方法优选方法1或方法2:
151、方法1:
152、所述的化合物9的制备方法包括如下步骤:在溶剂中,将化合物6和化合物7进行如下光延反应(mitsunobu反应),得到所述的化合物9;
153、
154、r1、r2、r3、r4、r5和r6的定义同前所述;
155、方法2:
156、所述的化合物9的制备方法包括如下步骤:在碱性试剂存在下,在溶剂中,将化合物6和化合物9进行如下的烷基化反应,得到所述的化合物9;
157、
158、其中,x2为卤素(f、cl、br或i,例如cl);r1和r2的定义同前所述。
159、方法1中,所述的化合物7优选为
160、方法1中,所述的光延反应条件和操作可以为本领域此类反应常规的条件和操作。本发明特别优选如下条件和操作;
161、方法1中,所述的溶剂可以为卤代烷类溶剂、醚类溶剂和酰胺类溶剂中的一种或多种,优选为醚类溶剂和酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)或n,n-二甲基乙酰胺),更优选酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)或n,n-二甲基乙酰胺)。所述的溶剂的用量可不做具体限定,只要不影响反应进行即可。所述的溶剂与所述的化合物6的体积质量比优选为2-8ml/g,例如5ml/g。
162、方法1中,所述的化合物7与所述的化合物6的摩尔比优选为(1-1.1):1,例如1:1。
163、方法1中,所述的光延反应优选在三苯基膦和偶氮试剂存在下进行。
164、其中,所述的三苯基膦与所述的化合物6的摩尔比优选为(1.2-1.5):1,例如1.2:1。
165、其中,所述的偶氮试剂优选为偶氮二甲酸异丙酯(diad)、偶氮二甲酸乙酯(dead)、偶氮二甲酸甲酯和偶氮二甲酸叔丁酯中的一种或多种,优选偶氮二甲酸异丙酯(diad)。
166、其中,所述的偶氮试剂与所述的化合物6的摩尔比优选为(1.2-1.5):1,例如1.3:1。
167、方法1中,所述的光延反应的温度优选为室温。
168、方法1中,所述的光延反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物6不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如12h。
169、方法1中,所述的光延反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规反应步骤,例如萃取(例如采用二氯甲烷萃取)、洗涤、干燥、浓缩和柱层析。
170、方法2中,x2中,所述的卤素优选为f、cl、br或i,例如cl。
171、方法2中,所述的化合物8优选为
172、方法2中,所述的烷基化反应条件和操作可以为本领域此类反应常规的条件和操作。本发明特别优选如下条件和操作;
173、方法2中,所述的溶剂优选为腈类溶剂(例如乙腈)、醚类溶剂(例如二氧六环)和酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma)和n-甲基吡咯烷酮(nmp))中的一种或多种,更优选为酰胺类溶剂(例如n,n-二甲基甲酰胺(dmf)或n,n-二甲基乙酰胺(dma))。所述的溶剂的用量可不做具体限定,只要不影响反应进行即可。所述的溶剂与所述的化合物6的体积质量比优选为2-8ml/g,例如5ml/g。
174、方法2中,所述的碱性试剂优选为碱金属碳酸盐(例如碳酸钾、碳酸钠和碳酸铯等)和/或叔胺碱(例如三乙胺、二异丙基乙基胺和二甲基苯胺等),更优选为碱金属碳酸盐(例如碳酸钾)。
175、方法2中,所述的碱性试剂与所述的化合物6的摩尔比优选为(1-3):1,例如2.5:1。
176、方法2中,所述的化合物8与所述的化合物6的摩尔优选为(1-1.2):1,例如1.1:1。
177、方法2中,所述的烷基化反应的温度优选为50-100℃,更优选70-80℃,例如60℃。
178、方法2中,所述的烷基化反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物6不再反应或者消失作为反应的终点。所述的反应时间可为2-8h,例如5h。
179、方法2中,所述的烷基化反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规反应步骤,例如萃取(例如采用二氯甲烷萃取)、洗涤、干燥、浓缩和柱层析。
180、所述的化合物9的制备方法还可包括所述的化合物6的制备方法,所述的化合物6的制备方法包括如下步骤:在脱保护试剂存在下,将化合物5进行如下式的脱保护反应,得到所述的化合物6;
181、
182、其中,r5和r6独立地为h或氘。
183、所述的脱保护试剂可以为本领域常规的脱保护试剂,例如三氟醋酸。
184、其中,所述的脱保护试剂与所述的化合物6的摩尔比可以为本领域常规的摩尔比,优选为≥10:1。
185、所述的脱保护反应可以在溶剂存在或不存在下进行。当所述的脱保护反应在溶剂存在下进行时,所述的溶剂可以为卤代烃类溶剂,例如二氯甲烷。
186、所述的脱保护反应的温度优选为10-70℃,例如室温。
187、所述的脱保护反应的进程可以采用本领域常规的监测方法进行监测(例如tlc、hnmr、hplc),以所述的化合物5不再反应或者消失作为反应的终点。所述的反应时间可为5-24h,例如24h。
188、所述的脱保护反应结束后,还进一步包括后处理步骤。所述的后处理步骤可以为此类反应所用的常规后处理步骤,例如浓缩、打浆、过滤,干燥和柱层析等。
189、所述的化合物6的制备方法还可包括所述的化合物5的制备方法,所述的化合物5的制备方法的条件和操作均同前所述。
190、本发明还提供了一种化合物9的制备方法,其包括如下步骤:在溶剂中,将化合物6和化合物7进行如下光延反应,得到所述的化合物9;
191、
192、其中,r1、r2、r3、r4、r5和r6的定义同前所述;所述的光延反应的条件和操作均同前所述。
193、本发明还提供了一种化合物9的制备方法,其包括如下步骤:在碱性试剂存在下,在溶剂中,将化合物6和化合物9进行如下的烷基化反应,得到所述的化合物9;
194、
195、其中,x2、r1、r2、r3、r4和r5的定义同前所述,所述的烷基化反应的条件和操作均同前所述。
196、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
197、本发明中中间体13a、14a、4b,7b,7c,7d,8b,8c,8d,10b和14b为自制,其他所用试剂和原料均市售可得。
198、本发明的积极进步效果在于:采用本发明的本发明的制备方法可以大幅提升多取代三嗪烷类化合物的收率且成本低和操作简单;采用本发明的制备方法制得的产品对sars-cov-2 3cl蛋白酶抑制活性佳、肝微粒代谢佳或药代动力学佳。
- 还没有人留言评论。精彩留言会获得点赞!