RVG-Exo-miR-3059-5p在治疗脑卒中的用途
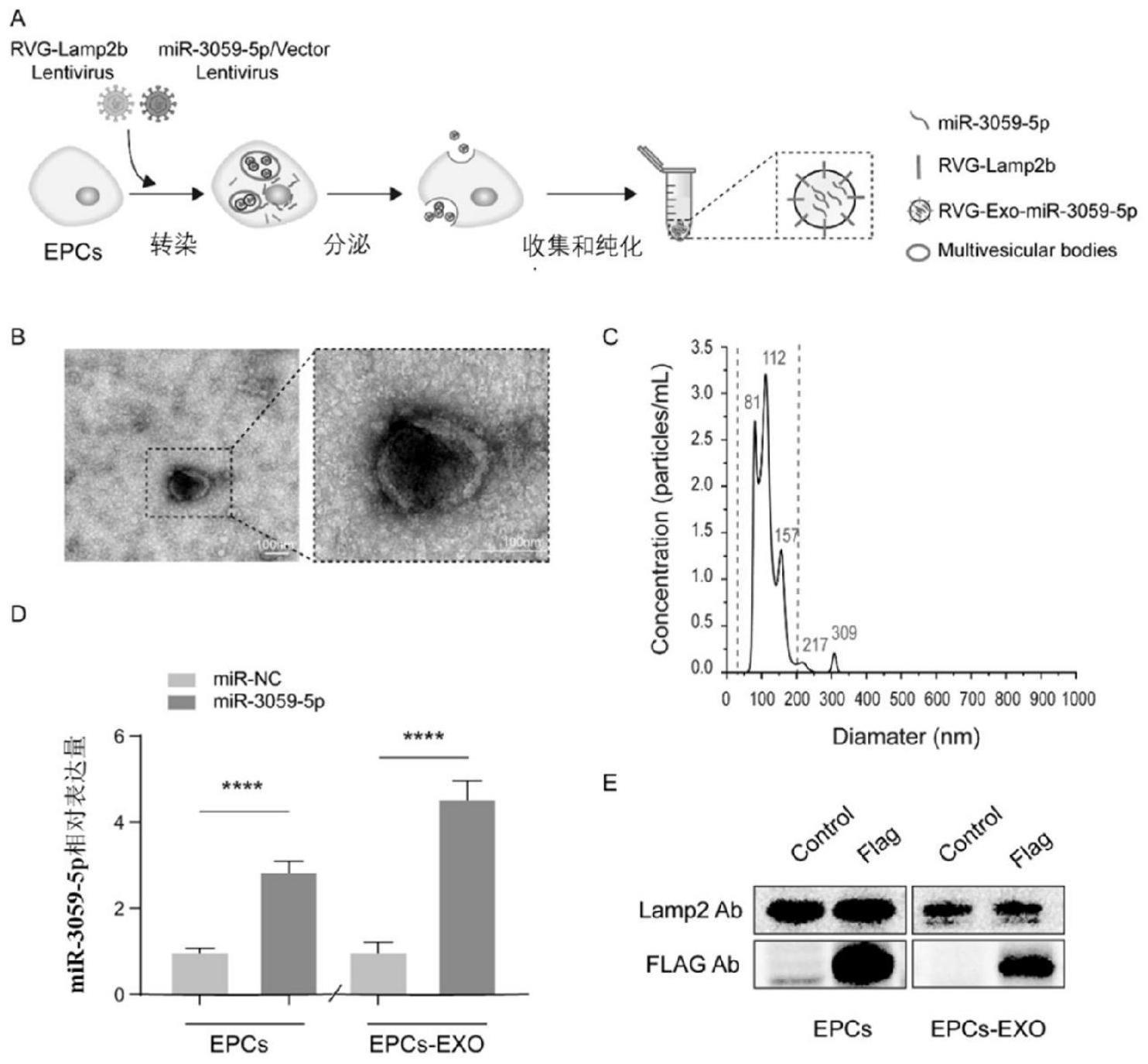
本发明属于生物医药领域,涉及rvg-exo-mir-3059-5p在治疗脑卒中的用途。
背景技术:
1、以mirna为代表的基因药物治疗是一种新兴的疾病治疗策略,可以通过特异性调节靶向基因的表达,实现对疾病的精准和个性化治疗。然而,由于mirna带负电,很难进入细胞,而且在体内半衰期短、稳定性差,容易被循环中的rna酶降解,如何将治疗性mirna有效地递送至脑病变部位是一项极大的挑战。为了解决这一问题,研究人员进行了很多尝试,例如将化学修饰引入mirna或利用合成的纳米颗粒作为载体进行运输,但大多因为制备或纯化过程复杂、自身毒性及免疫原性等问题而无法进行临床转化。外泌体作为生物纳米载体,在递送mirna方面具有其独特的优势。首先,外泌体是从生物体液或细胞中分离提取,具有更低的毒性和免疫原性;其次,纳米特性赋予其穿透深层组织的能力和较长的循环时间;此外,脂质双层膜结构可以保护装载在其内部的治疗分子,实现循环中的稳定运输。因此,外泌体可以作为mirna药物递送的理想载体。但是,在经静脉系统注射后,外泌体往往主要分布在肝、肺、脾等器官,脑内有效浓度很低。要提高外泌体在脑组织的有效浓度,必须解决其靶向性问题。
2、基因工程是对外泌体进行靶向性修饰最常用的技术之一,该过程是将靶向性配体或多肽的基因序列与编码外泌体表面跨膜蛋白的基因序列相融合,用上述融合质粒转染亲本细胞,使其分泌表面具有靶向配体的工程化外泌体。狂犬病毒糖蛋白(rabies virusglycoprotein,rvg)是广受认可的一类脑组织靶向肽,可通过与烟碱型乙酰胆碱受体结合特异性地靶向神经细胞和脑血管内皮细胞。溶酶体相关膜蛋白2b(lysosome-associatedmembrane protein 2b,lamp2b)是外泌体膜上高丰度表达的一类跨膜蛋白。alvarez-erviti等人开创性地利用基因工程技术将rvg-lamp2b融合质粒转染到树突状细胞中,得到表面携带rvg的工程化外泌体、经小鼠尾静脉注射后,这类外泌体可以特异性地将sirna递送到小鼠脑神经元、小胶质细胞和少突胶质细胞,导致目标基因敲低。从此,rvg-lamp2b融合质粒被广泛应用于介导外泌体的脑组织靶向递送。
技术实现思路
1、为了解决现有技术中存在的技术问题,本发明的目的在于利用基因工程技术对epcs-exo进行脑靶向性修饰和mir-3059-5p药物负载,制备可特异性靶向脑组织的基因修饰外泌体以治疗脑卒中。
2、本发明提供了一种基因修饰的细胞,所述基因修饰的细胞表达mir-3059-5p。
3、优选地,所述基因修饰的细胞表达组织靶向蛋白和mir-3059-5p。
4、优选地,所述细胞分泌膜结构。
5、可用于本发明的细胞可以是原核生物或真核生物。优选地,所述细胞是真核细胞,例如酵母细胞、植物细胞、昆虫细胞或哺乳动物细胞。
6、可用于本发明的产生膜结构的细胞可以称为源细胞,是指可以是能够在合适的条件下产生膜结构的任何类型的细胞,例如在悬浮培养中或在贴壁培养中或任何在其他类型的培养系统中。根据本发明的源细胞还可以包括在体内产生外泌体的细胞。根据本发明的源细胞可以选自宽范围的细胞和细胞系,其可以在悬浮或贴壁培养物中生长或适于悬浮生长。本发明的源细胞可以选自包含以下的群组:间充质干细胞或基质细胞(可从例如骨髓、脂肪组织、华顿氏胶、围产期组织、胎盘、牙芽、脐带血、皮肤组织等获得)、成纤维细胞、羊膜细胞(并且更具体地任选地表达各种早期标记物的羊膜上皮细胞),髓样抑制细胞、m2极化的巨噬细胞、脂肪细胞、内皮细胞、成纤维细胞等。特别感兴趣的细胞系包括人脐带内皮细胞(huvec)、人胚胎肾(hek)细胞、内皮细胞系(诸如微血管或淋巴内皮细胞)、红细胞、红系祖细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术获得的或来自胎盘的任何细胞、来自气道或肺泡的上皮细胞、成纤维细胞、内皮细胞等。此外,免疫细胞(诸如b细胞、t细胞、nk细胞、巨噬细胞、单核细胞、树突细胞(dc))也在本发明的范围内,并且基本上任何类型的能够产生膜结构的细胞也涵盖在本文中。通常,膜结构基本上可以源自任何细胞源,无论是原代细胞源还是永生化的细胞系。膜结构来源的源细胞可以是任何胚胎、胎儿和成人体细胞干细胞类型,包括诱导的多能干细胞(ipsc)和通过任何方法获得的其他干细胞。当治疗神经系统疾病时,人们可以考虑利用例如原代神经元、星形胶质细胞、少突胶质细胞、小胶质细胞和神经祖细胞作为源细胞。源细胞可以是待治疗的患者的同种异体、自体或甚至异种性质,即细胞可以来自患者自身或来自不相关的、匹配的或不匹配的供体。在某些情况下,从医学角度来看,同种异体细胞可能是优选的,因为它们可以提供免疫调节作用,该免疫调节作用可能无法从患有某种适应症的患者的自体细胞中获得。例如,在治疗炎性或退行性疾病的背景下,同种异体msc或ae作为产生外泌体的细胞源可能非常有益,这是因为它们的膜结构并且特别是它们的外泌体的固有的免疫调节作用。特别感兴趣的细胞系包括人脐带内皮细胞(huvec)、人胚胎肾(hek)细胞(诸如hek293细胞、hek293t细胞、无血清hek293细胞、悬浮hek293细胞)、内皮细胞系(诸如微血管或淋巴内皮细胞)、红细胞、红系祖细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术获得的或来自胎盘的任何细胞、气道或肺泡上皮细胞、成纤维细胞、内皮细胞、上皮细胞等。
7、所述组织靶向蛋白可通过与组织细胞上的受体结合特异性地靶向该组织。
8、常见的组织靶向蛋白包括:靶向脑缺血区域的环肽(rgdyk)、靶向神经元的rvg、靶向缺血心肌的cstsmlkac肽和靶向心肌细胞的wlseagpvvtvralrgtgsw肽。
9、在本发明的具体实施方案中,所述组织靶向蛋白是rvg,可通过与烟碱型乙酰胆碱受体结合特异性地靶向神经细胞和脑血管内皮细胞。
10、优选地,所述基因修饰的细胞是基因修饰的epc细胞。
11、优选地,所述mir-3059-5p包括pri-mir-3059-5p、pre-mir-3059-5p、成熟mir-3059-5p。
12、本发明提供了一种膜结构,所述膜结构包含前面所述的mir-3059-5p。
13、进一步,所述膜结构包含前面所述的组织靶向蛋白和前面所述的mir-3059-5p。
14、所述组织靶向蛋白与所述膜结构的跨膜蛋白连接。
15、跨膜蛋白可以包括但不限于:cd9、cd53、cd63、cd81、cd54、cd50、flot1、flot2、cd49d、cd71、cd133、cd138、cd235a、alix、aardc1、syntenin-1、syntenin-2、lamp2b、tspan8、syndecan-1、syndecan-2、syndecan-3、syndecan-4、tspan14、cd37、cd82、cd151、cd231、cd102、notch1、notch2、notch3、notch4、dll1、dll4、jag1、jag2、cd49d/itga4、itgb5、itgb6、itgb7、cd11a、cd11b、cd11c、cd18/itgb2、cd41、cd49b、cd49c、cd49e、cd51、cd61、cd104、fc受体、白介素受体、免疫球蛋白、mhc-i或mhc-ii成分、cd2、cd3ε、cd3ζ、cd13、cd18、cd19、cd30、cd34、cd36、cd40、cd40l、cd44、cd45、cd45ra、cd47、cd86、cd110、cd111、cd115、cd117、cd125、cd135、cd184、cd200、cd279、cd273、cd274、cd362、col6a1、agrn、egfr、gapdh、glur2、glur3、hla-dm、hspg2、l1cam、lamb1、lamc1、lfa-1、lgals3bp、mac-1α、mac-1β、mfge8、slit2、stx3、tcra、tcrb、tcrd、tcrg、vti1a、vti1b、其它外泌体多肽及其任何组合组成的组。
16、本发明的膜结构包括外泌体、微囊泡(mv)或从内泌体、内溶酶体和/或溶酶体途径或从亲代细胞的质膜分泌的任何其他类型的囊泡。一般而言,本发明涉及由细胞分泌、产生和/或衍生的任何类型的囊泡结构,包括但不限于外泌体、囊泡、微囊泡、微颗粒、内体来源的囊泡、多囊泡体或凋亡小体。
17、在本发明的具体实施方案中,所述膜结构是外泌体。
18、本发明提供了一种制备前面所述的基因修饰的细胞的方法,所述方法包括将表达前面所述的组织靶向蛋白的载体和表达前面所述的mir-3059-5p的载体导入细胞中。
19、本发明提供了一种制备前面所述的膜结构的方法,所述方法包括前面所述的制备所述基因修饰的细胞的方法。
20、进一步,所述方法还包括培养经前面所述的方法获得的基因修饰的细胞,获取其上清,分离纯化所述膜结构。
21、本领域技术人员将理解如何分离根据本发明制备的外泌体。通常,从细胞上清液中收集外泌体,并且可以根据周知的方案通过差速离心或密度离心来分离。可以将包含外源物质的外泌体与不包含外源物质的外泌体分离,并且可以获得外泌体的亚群。可以使用标准方法从外泌体中分离本发明的外源物质。
22、本发明的“载体”是用作将外来遗传物质转移到细胞中的寡核苷酸分子(dna或rna)。载体可以是用于在细胞中表达外源遗传物质的表达载体。这样的载体可以包括启动子序列,其与编码要表达的基因序列的核苷酸序列可操作地连接。载体还可以包括终止密码子和表达增强子。本领域已知的任何合适的载体、启动子、增强子和终止密码子可用于本发明。合适的载体包括质粒、二元载体、病毒载体和人工染色体(例如酵母人工染色体)。
23、可以通过使用任何合适的技术将前面所述的载体引入细胞中,所述技术的实例包括但不限于电穿孔、孵育、细胞活化和转染、脂质转染、脂质递送、脂质体递送、聚合物转染、聚合物递送、通过肽递送(即但不限于阳离子肽、两亲性肽、细胞穿透肽)、钙或镁沉淀和离子沉淀(也称为dna-磷酸钙沉淀)。
24、可用于本发明的病毒包括但不限于腺病毒、腺相关病毒、慢病毒、逆转录病毒。
25、进一步,所述病毒是慢病毒。
26、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备预防或治疗脑卒中的药物中的应用。
27、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备预防或治疗脑卒中诱发的脑损伤的药物中的应用。
28、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备改善脑卒中患者预后的药物中的应用。
29、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备改善脑卒中患者恢复期运动协调功能的药物中的应用。
30、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备改善脑卒中患者海马突触可塑性的药物中的应用。
31、本发明提供了前面所述的基因修饰的细胞,或前面所述的膜结构在制备改善脑卒中患者恢复期神经认知功能的药物中的应用。
32、进一步,脑卒中是缺血性脑卒中。
33、本发明所述的膜结构和组合物可以通过多种途径施用或配制以用于施用,包括但不限于耳、颊、结膜、皮肤、牙科、电渗析、宫颈内、窦内、气管内、肠内、硬膜外、羊膜外、体外、血液透析、浸润、间质、腹内、羊膜内、动脉内、关节内、胆管内、支气管内、囊内(intrabursal)、心内、软骨内、尾内(intracaudal)、海绵体内、腔内、脑内、侧脑室内、脑池内、角膜内、冠内(牙科)、冠状动脉内、海绵体内(intracorporus cavernosum)、皮内、椎间盘内、导管内、十二指肠内、硬膜内、表皮内、食管内、胃内、牙龈内、回肠内、病变内、腔内、淋巴管内、髓内、脑膜内、肌内、眼内、卵巢内、心包内、腹膜内、胸膜内、前列腺内、肺内、窦内、脊柱内、滑膜内、腱内、睾丸内、鞘内、胸内、小管内、瘤内、鼓室内、子宫内、血管内、静脉内、静脉推注、静脉滴注、心室内、膀胱内、玻璃体内、离子电渗疗法、冲洗、喉、鼻、鼻胃、封闭敷裹技术、眼科、口腔、口咽、其他、肠胃外、经皮、关节周、硬膜外、神经周、牙周、直肠、呼吸(吸入)、眼球后、软组织、蛛网膜下、结膜下、皮下、舌下、粘膜下、局部、透皮、经粘膜、经胎盘、经气管、经鼓室、输尿管、尿道、和/或阴道给药,和/或上述给药途径的任何组合。本发明的组合物可以配制成液体或固体形式。可以配制流体制剂通过注射到人体或动物体的选定区域来给药。
- 还没有人留言评论。精彩留言会获得点赞!