高效可控RNA递送系统
本发明属于生物医学,具体地,本发明涉及一种高效可控rna递送系统,更具体地,本发明涉及一种融合蛋白、分离的核酸、表达载体、重组细胞、包装病毒的方法、病毒颗粒、核酸递送系统、递送核酸的方法、药物组合物及其用途。
背景技术:
1、胞外囊泡(extracellular vesicle,ev)是指由活细胞释放的、具有单层膜结构的微小囊泡,包括微囊泡(microvesicle)和病毒样颗粒(exosome)。表达了病毒蛋白(如hiv病毒gag蛋白)的ev也被称为病毒样颗粒(virus-like particle,vlp)。基于ev的药物递送工具近年来发展迅速。
2、内源性病毒是存在于人类和其他动物基因组上的一类序列,通常和逆转录病毒具有极高的相似性,一般认为它们是演化过程中感染并整合到宿主基因组上后被驯服的逆转录病毒。已有研究报道小鼠的arc蛋白和果蝇的darc1蛋白表现出与病毒极其相似的行为,它们能够形成类似病毒衣壳的结构,识别并包裹自身rna,在神经元中以ev的形式释放,被下游细胞接收并翻译出蛋白。arc和darc1这种跨细胞转移行为被证明在神经系统发育中发挥作用。
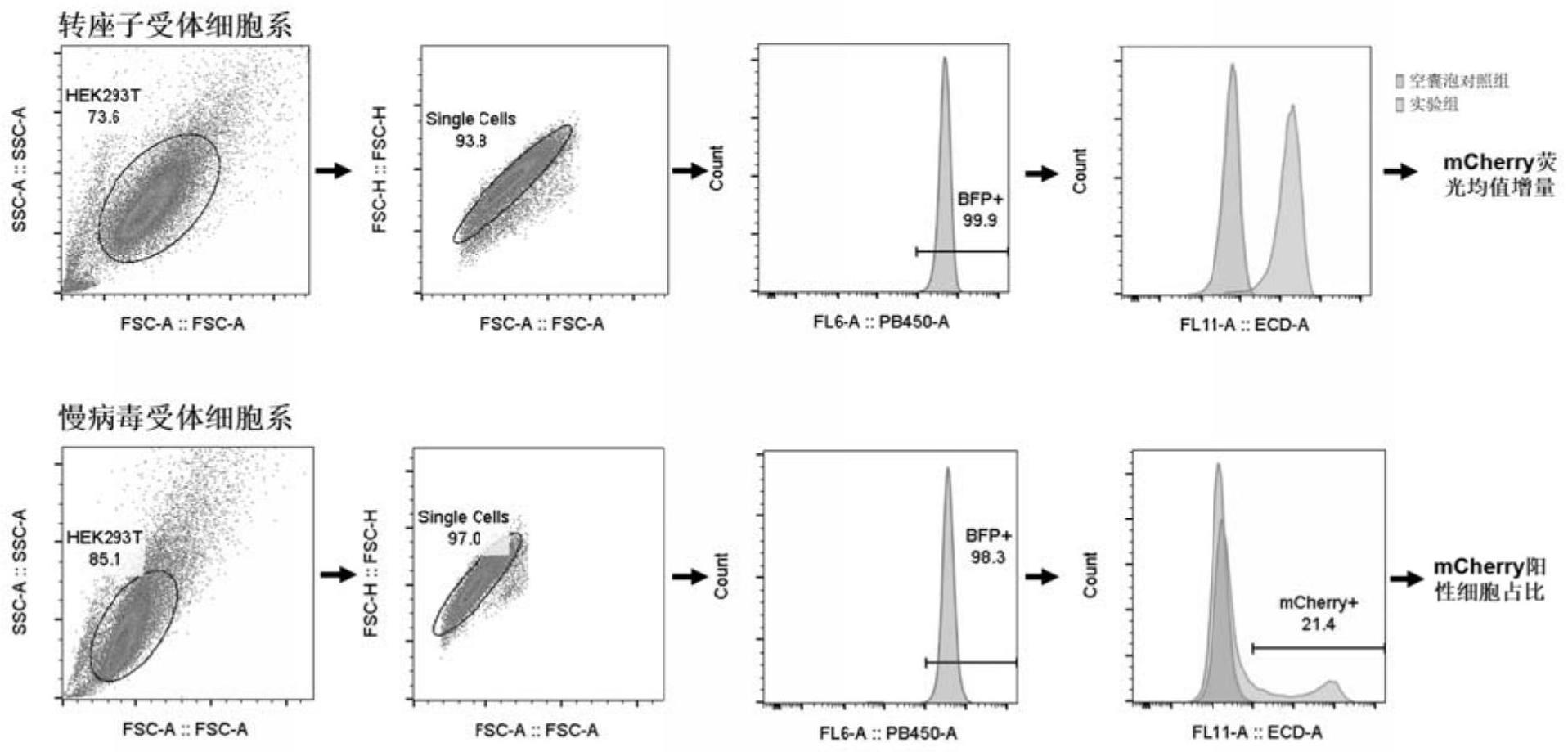
3、2021年,张锋团队基于类似的思路,筛查了小鼠和人基因组中的大量内源性病毒,使用其中分泌能力最强的peg10蛋白设计了rna递送系统send(原版send系统)。peg10可以特异性结合带有其自身rna上3’非翻译区和5’非翻译区(3’utr,5’utr)的rna,并将其包裹进peg10蛋白自身多聚化形成的衣壳中,以vlp形式释放。释放的vlp可以用超速离心法收集,并且经过促融蛋白(vsv-g、syncytin等)修饰后的vlp能够被受体细胞摄取,使vlp包裹的rna能够在细胞中表达。send系统已被证明可以递送cas9和grna,在基因治疗领域具有可能的应用前景,可能成为目前商业化的脂质体/慢病毒载体的竞争者。张锋团队检测send递送效率所用的主要是cre-dio报告系统,受体细胞含有dio-gfp元件,当send系统将cre(环化重组酶)的mrna递送到受体细胞并表达出cre重组酶时,dio元件被cre重组,将反向gfp调整为正向,受体细胞产生绿色荧光,以gfp阳性细胞占比来表征send递送效率。
4、但目前send系统递送效率较低,例如:在cre-dio检测系统下,send最高效率约为60%;除cre-dio系统外,张锋团队采用二代测序方法统计受体细胞特定位点的成功编辑率(indel%),验证send对cas9和grna的递送效率,鼠源send效率约30%,人源peg10约40%;send系统与成熟的慢病毒载体对比,效率仅有后者的四分之一至五分之一。
5、此外,send系统在转入供体细胞后即持续表达,vlp的生产和释放是持续不断的,但在实际临床应用中,许多情况下期望能够实现靶向给药或定时给药。send系统的vlp释放步骤面临不可控的问题。
6、因此,本领域亟需开发一种高效可控的rna递送系统。
技术实现思路
1、本技术是基于发明人对以下事实和问题的发现和认识作出的:
2、已有研究表明send系统可以将rna递送至靶细胞内部,通过靶向特定位点进行相关疾病的治疗。但由于rna递送效率低以及vlp释放不可控问题给精准治疗带来了巨大的挑战。为此,本发明通过构建高效、精准的核酸递送系统,以解决高效给药、靶向给药困难的问题。
3、本发明旨在至少在一定程度上解决相关技术中的技术问题之一。
4、在本发明的第一方面,本发明提出了一种融合蛋白。根据本发明的实施例,所述融合蛋白转移蛋白和递送增强因子;所述转移蛋白与递送增强因子相连。发明人发现,所述融合蛋白可以跨细胞递送rna,可用于基因治疗领域,通过将rna递送到特定的细胞或组织中,从而提高治疗效果,并降低对健康细胞的负面影响。
5、根据本发明的实施例,上述融合蛋白可以进一步包括下列技术特征至少之一:
6、根据本发明的实施例,所述转移蛋白包括peg10蛋白、arc蛋白、darc1蛋白中的至少之一。
7、根据本发明的实施例,所述转移蛋白包括peg10蛋白;优选仅包括peg10蛋白的第一个读码框的peg10蛋白。发明人经实验验证发现,相比于包含第一读码框和第二读码框的peg10蛋白,仅包含第一个读码框的peg10蛋白的rna递送效率具有显著优势。
8、根据本发明的实施例,所述转移蛋白c端可以连接货物蛋白,所述货物蛋白包括ms2。
9、根据本发明的实施例,所述递送增强因子的c端与所述转移蛋白的n端相连。
10、根据本发明的实施例,所述递送增强因子与所述转移蛋白之间包括修饰位点。
11、根据本发明的实施例,所述修饰位点包括甘氨酸-色氨酸连接肽、核外运信号中的至少之一。
12、根据本发明的实施例,所述递送增强因子包括酰基化标签、小分子受体、经典膜蛋白信号肽及穿膜区中的至少之一。发明人发现,添加酰基化标签、小分子受体、经典膜蛋白合成通路等方法均可以将peg10蛋白锚定在细胞膜上。通过将能够多聚化的peg10 rf1锚定上膜,可以有效使得peg10蛋白装载到ev之中,其中酰基化标签效果最好。
13、根据本发明的实施例,所述递送增强因子为酰基化标签。
14、根据本发明的实施例,所述酰基化标签包括myr-tag、yes1-tag、lyn-tag、lm-tag、hiv gag-tag、nef-tag、gap43-tag、src-tag、fen-tag中的至少之一。
15、根据本发明的实施例,所述酰基化标签为myr-tag。发明人通过对9个酰基化标签进行筛选,最终得出,使用myr-tag作为酰基化标签rna递送效率最高。
16、根据本发明的实施例,所述融合蛋白n端进一步与跨膜结构域c端相连。
17、根据本发明的实施例,所述跨膜结构域进一步与胞外阻遏蛋白相连。发明人发现通过将包含阻遏蛋白的融合蛋白在重组细胞中进行表达,通过控制阻遏蛋白与转移蛋白分离,可达到控制药物定时发挥作用的效果,为避免rna药物连续刺激引起的毒副作用提供了新的解决途径。
18、根据本发明的实施例,所述阻遏蛋白包括egfp蛋白、轴突蛋白1b胞外区、cd4胞外区中的至少之一。
19、根据本发明的实施例,所述阻遏蛋白不低于140个氨基酸。发明人通过实验发现,诱发胞外囊泡装载抑制效应与结构域类型无关,仅与大小相关。进一步验证发现,阻遏蛋白包含较大胞外区(不低于140个氨基酸)时,peg10功能才能得到抑制。
20、根据本发明的实施例,所述递送增强因子与所述跨膜结构域之间包括修饰位点。
21、根据本发明的实施例,所述修饰位点包括cibn,hvol1中的至少之一。
22、根据本发明的实施例,所述阻遏蛋白的n端进一步与膜定位信号肽c端相连。
23、根据本发明的实施例,所述膜定位信号肽选自igκ信号肽、vsvg信号肽、轴突蛋白3b信号肽中的至少之一。
24、根据本发明的实施例,所述膜定位信号肽选自igκ信号肽、vsvg信号肽、轴突蛋白3b信号肽中的至少之一。根据本发明的实施例,发明人选取了经典膜蛋白最n端的信号肽(轴突蛋白3b信号肽),通过信号转导,调控peg10蛋白锚定上膜。
25、根据本发明的实施例,所述融合蛋白进一步包括酶切位点,所述酶切位点位于所述阻遏蛋白与所述跨膜结构域之间,或位于所述跨膜结构域与所述融合蛋白之间。发明人对原版send系统进行改进,通过在胞外添加阻遏蛋白及蛋白酶切割位点,通过控制胞外阻遏蛋白的切除,或将带有酰基化标签的peg10蛋白从带有阻遏物的膜蛋白上切割下来,并以脂锚定方式重新上膜,最终实现含有peg10蛋白及其货物rna的胞外囊泡的可控释放。
26、根据本发明的实施例,所述酶切位点受到光敏感蛋白控制,仅在特定波长光照下能够被对应蛋白酶切割。发明人经实验验证发现经470nm蓝光照射后可以通过蛋白酶切割,恢复融合蛋白的rna递送功能。
27、根据本发明的实施例,所述酶切位点包括tev蛋白酶酶切位点和mmp蛋白酶酶切位点的至少之一。
28、根据本发明的实施例,所述胞外阻遏物选择egfp蛋白,所述具有阻遏蛋白具有如seq id no:1所示的氨基酸序列,
29、ypydvpdyanpgtmvskgeelftgvvpilveldgdvnghkfsvsgegegdatygkltlkficttgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdtlvnrielkgidfkedgnilghkleynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdnhhlstqsalskdpnekrdhmvllefvtaagitlgmdelykggsgggs(seq id no:1)。
30、根据本发明的实施例,所述跨膜结构域具有如seq id no:2所示的氨基酸序列,
31、tepgirrvpgaseviresssttgmvvgivaaaalcilillyamykyrnrdgggsgggs(seq id no:2)。
32、根据本发明的实施例,所述膜定位信号肽具有如seq id no:3所示的氨基酸序列,
33、mhlriharrspprrpawtlgiwflfwgcivssvwsqlssnvasssstssspgsh(seq id no:3)。
34、根据本发明的实施例,所述融合蛋白具有seq id no:4所示的氨基酸序列,
35、mgcinskrkdmaaaggssncpppppppppnnnnnnntpkspgvpdaeddderrhdelpedinnfdedmnrqfenmnlldqvellaqsyslldhlddfddddedddfdpepdqdelpeysddddlelqgaaaapipnffsdddcledlpekfdgnpdmlgpfmyqcqlfmekstrdfsvdrirvcfvtsmligraarwataklqrctylmhnytafmmelkhvfedpqrreaakrkirrlrqgpgpvvdysnafqmiaqdldwtepalmdqfqeglnpdiraelsrqeapktlaalitacihierrlardaaakpdpspralvmppnsqtdptepvggarmrlskeekerrrkmnlclycgngghfadtcpakasknsppgnspapldykddddk(seq id no:4)。
36、在本发明的第二方面,本发明提出了一种分离的核酸。根据本发明的实施例,所述分离的核酸编码本发明第一方面所述的融合蛋白。根据本发明实施例的分离的核酸编码的融合蛋白具有更强的特异性、更长的半衰期和更高的效力,能够在较少的用药剂量下,有效治疗或预防癌症,其毒副作用低,具有更高的安全性。
37、根据本发明的实施例,上述分离的核酸可以进一步包括下列技术特征至少之一:
38、根据本发明的实施例,所述分离的核酸为dna或rna。
39、在本发明的第三方面,本发明提出了一种表达载体。根据本发明的实施例,所述表达载体携带本发明第二方面所述的分离的核酸。根据本发明实施例,所述表达载体可在适合的受体细胞中高效表达所述融合蛋白,所述融合蛋白具有更强的特异性、更长的半衰期和更高的效力,其毒副作用低,具有更高的安全性。
40、根据本发明的实施例,上述表达载体可以进一步包括下列附加技术特征至少之一:
41、根据本发明的实施例,所述表达载体进一步包括:启动子,所述启动子与本发明第二方面所述的分离的核酸可操作地连接。
42、根据本发明的实施例,所述启动子选自cmv,ef-1α,rsv的至少之一。
43、根据本发明的实施例,所述表达载体是非致病性病毒载体。
44、根据本发明的实施例,所述非致病性病毒选自反转录病毒、慢病毒和腺病毒相关病毒中的至少之一。
45、在本发明的第四方面,本发明提出了一种重组细胞。根据本发明的实施例,所述重组细胞表达本发明第一方面所述的融合蛋白或携带本发明第二方面所述的分离的核酸、本发明第三方面所述的表达载体。根据本发明的一些具体实施例,所述重组细胞在合适条件下可高效并大量表达融合蛋白,所述融合蛋白具有更强的特异性、更长的半衰期和更高的效力,能够在较少的用药剂量下,将核酸药物递送到靶细胞,实现疾病的有效治疗或预防,其毒副作用低,具有更高的安全性。
46、根据本发明的实施例,上述重组细胞可以进一步包括下列技术特征至少之一:
47、根据本发明的实施例,所述重组细胞为hek293ft、hek293t或bhk细胞。
48、根据本发明的实施例,所述重组细胞为hek293ft细胞。
49、在本发明的第五方面,本发明提出了一种包装病毒的方法。根据本发明的实施例,所述方法包括将本发明第四方面所述的重组细胞在适于蛋白表达的条件下进行培养处理,将培养处理产物进行所述阻遏蛋白去除处理,以便获得所述病毒。发明人发现,根据本发明实施例所述的包装病毒的方法可以短时间内培养获得大量高纯度病毒,并可以实现病毒的可控包装和释放。
50、在本发明的第六方面,本发明提出了一种包装病毒的方法。根据本发明的实施例,所述方法包括将本发明第四方面所述的重组细胞在适于蛋白表达的条件下进行培养处理,将培养处理产物进行融合蛋白切除处理,以便获得所述病毒。发明人发现,根据本发明实施例所述的包装病毒的方法可以短时间内培养获得大量高纯度病毒,并可以实现病毒的可控包装和释放。
51、根据本发明的实施例,上述两种包装病毒的方法可以进一步包括下列技术特征至少之一:
52、根据本发明的实施例,所述融合蛋白进一步包括酶切位点,所述酶切位点位于所述阻遏蛋白与所述跨膜结构域之间,或位于所述跨膜结构域与所述融合蛋白之间。
53、根据本发明的实施例,所述阻遏蛋白去除处理包括将所述培养处理产物在培养过程中给予蛋白酶处理。蛋白酶处理后,融合蛋白发生断裂,断裂后的转移蛋白脱离阻遏蛋白的控制,成为能够有效装载进入胞外囊泡的形式。
54、根据本发明的实施例,所述胞内区切除处理包括将所述培养处理产物与适于切割所述酶切位点的蛋白酶进行接触。蛋白酶处理后,带有酰基化标签的转移蛋白被切除,成为游离态,经胞内酰基转移酶修饰,再次以脂锚定方式上膜,成为能够有效进入胞外囊泡的形态。
55、在本发明的第七方面,本发明提出了一种病毒颗粒。根据本发明的实施例,所述病毒颗粒通过本发明第五方面或第六方面所述的方法包装获得。根据本发明的实施例,所述经由病毒包装获得的病毒颗粒,获取方法简单,易操作,耗时短,成本低。
56、在本发明的第八方面,本发明提出了一种核酸递送系统。根据本发明的实施例,所述系统包括本发明第一方面所述的融合蛋白、本发明第二方面所述的分离的核酸、本发明第三方面所述的表达载体、本发明第四方面所述的重组细胞以及本发明第七方面所述的病毒颗粒。根据本发明的实施例,所述核酸递送系统具有下述优点:
57、1)高效输送:核酸递送系统可以将基因药物准确地输送到目标细胞内。相较于传统的化学药物,它可以具有更高的精确性和效率;
58、2)治疗性更强:基因疾病的治疗通常需要针对患者的基因进行特异性的干预,而核酸递送系统具有更为特异的治疗性。它可以通过靶向特定基因、调节基因表达等多种方式来治疗基因疾病;
59、3)安全性高:相较于传统药物,基因药物的安全性更高,毒副反应相对较少。此外,核酸递送系统可以减小基因药物的不良反应,使药物的治疗效果更加显著;
60、4)可持续性强:基因疾病的治疗通常需要长期的干预和治疗,核酸递送系统可以通过多次投药等方式实现治疗的可持续性。
61、在本发明的第九方面,本发明提出了一种递送核酸的方法。根据本发明的实施例,所述方法包括将本发明第八方面所述的核酸递送系统与待递送核酸进行接触。根据本发明的实施例,采用本方法递送核酸可以显著提升核酸递送效率,提升了药物在细胞中发挥作用的速度,在治疗或预防癌症方面可以更快达到预期疗效。
62、根据本发明的实施例,上述递送核酸的方法可以进一步包括下列附加技术特征至少之一:
63、根据本发明的实施例,所述待递送核酸包括核酸药物,mrna和grna中的至少之一。
64、需要说明的是,本技术所述的待递送核酸包括但不限于mrna和grna,由于不同核酸具有不同的优点,具体取决于所治疗的基因疾病、肿瘤类型和治疗方案等,所以需要在临床治疗中有选择的使用核酸药物、mrna、grna等进行治疗,以达到最佳治疗效果。
65、在本发明的第十方面,本发明提出了一种递送核酸的方法。根据本发明的实施例,所述方法包括在本发明第八方面所述的核酸递递送系统中同时表达受体结合缺陷型促融蛋白与靶向膜表位抗原的多肽。用以实现核酸特异性递送。
66、根据本发明的实施例,所述膜表位抗原为cd3。根据本发明的实施例,利用受体结合缺陷型促融蛋白(vsvg突变体)共表达特异性抗体(cd3单克隆抗体),可以实现目标特异性货物递送。
67、在本发明的第十一方面,本发明提出了一种药物组合物。根据本发明的实施例,所述药物组合物包括本发明第八方面所述的核酸递送系统与待递送核酸药物。如前所述,根据本发明的实施例所述融合蛋白能够高效、可控的在细胞中发挥功能,并且不会造成毒副作用。因此,包含上述物质的药物组合物同样可以有效在细胞中产生治疗效果,并且不会造成毒副作用。
68、根据本发明的实施例,上述药物组合物可以进一步包括下列附加技术特征至少之一:
69、根据本发明的实施例,所述药物组合物进一步包括:药学上可接受的载体或赋形剂。
70、在本发明的第十二方面,本发明提出了一种药物组合物在制备药物中的用途。根据本发明的实施例,所述药物用于治疗或预防疾病。根据本发明的实施例,所述融合蛋白与待递送核酸药物可以用于制备药物,用于治疗或预防肿瘤等疾病。
71、根据本发明的实施例,上述药物组合物在制备药物中的用途可以进一步包括下列附加技术特征至少之一:
72、根据本发明的实施例,所述疾病包括:肿瘤、免疫治疗、单基因突变以及多基因突变的遗传病。
73、在本发明的第十三方面,本发明提出了一种基因编辑系统。根据本发明实施例,所述系统包括:本发明第一方面所述的融合蛋白或本发明第二方面所述的分离的核酸或本发明第三方面所述的表达载体或本发明第四方面所述的重组细胞或本发明第七方面所述的病毒颗粒或本发明第八方面所述的核酸递送系统或本发明第十一方面所述的药物组合物。根据本发明的实施例,所述基因编辑系统可作为一种基因编辑的手段,具有高效、准确以及可编程等优点。
74、在本发明的第十四方面,本发明提出了一种基因编辑方法。根据本发明的实施例,包括将待编辑基因与本发明第一方面所述的融合蛋白或本发明第二方面所述的分离的核酸或本发明第三方面所述的表达载体或本发明第四方面所述的重组细胞或本发明第七方面所述的病毒颗粒或本发明第八方面所述的核酸递送系统或本发明第十一方面所述的药物组合物或本发明第十三方面所述的基因编辑系统进行接触处理。通过所述接触处理对所述基因进行编辑。
75、根据本发明的实施例,所述待编辑基因存在于细胞中。
- 还没有人留言评论。精彩留言会获得点赞!