一种并环化合物的制备、应用及用途的制作方法
本发明属于药物化学领域,具体地,本发明涉及一种并环化合物的制备、应用及用途。
背景技术:
1、补体系统是先天免疫系统的具有决定性的组成部分,包括一组通常以非活性状态存在的蛋白质。这些蛋白质以三个活化途径被组织:经典途径、凝集素途径和旁路途径。来自微生物的分子、抗体或细胞组份能活化这些途径,从而导致被称为c3-转变酶和c5-转变酶的蛋白酶复合物的形成。经典途径是钙/镁依赖性级联,其通常通过形成抗原-抗体复合物被活化。它还能被与配体复合的c-反应蛋白的结合和被许多病原体(包括革兰氏阳性细菌)以抗体-非依赖性方式被活化。旁路途径是镁依赖性级联,其通过c3在某些敏感表面(例如,酵母和细菌的细胞壁多糖,以及某些生物聚合物材料)上的沉积和活化而被活化。
2、目前关于治疗与增加的补体活性相关的疾病或障碍的研究还较少,需要越来越多的相关研究。
技术实现思路
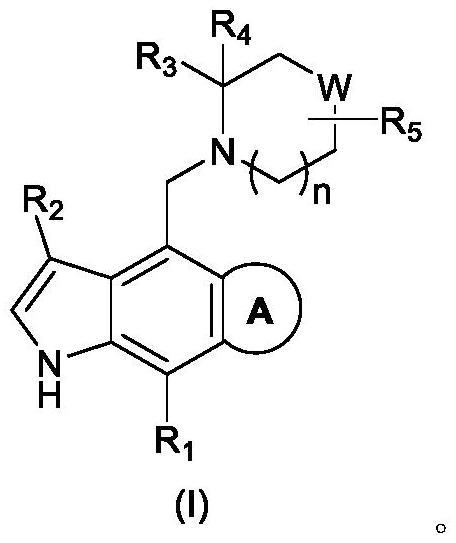
1、在本发明的一方面,本发明公开了式(i)所示化合物、其光学异构体或其药学上可接受的盐,
2、
3、其中,环a选自3-9元杂环基、c3-9环烯基、苯基、5-9元杂芳基和氧代5-9元杂芳基,所述3-9元杂环基、c3-9环烯基、苯基、5-9元杂芳基或氧代5-9元杂芳基任选被1、2或3个ra取代;
4、ra选自f、cl、br、i、cn、oh、c1-6烷基、c1-6杂烷基、c3-6环烷基和3-6元杂环基,所述c1-6烷基、c1-6杂烷基、c3-6环烷基或3-6元杂环基任选被1、2或3个f、cl、br、i、cn、oh或c1-6烷基取代;
5、r1选自h、oh、cn、f、cl、br、i、c1-6烷基、c1-6杂烷基和c3-6环烷基,所述c1-6烷基、c1-6杂烷基或c3-6环烷基任选被1、2或3个oh、cn、f、cl、br、i或c1-6烷基取代;
6、r2选自h、oh、cn、f、cl、br、i、c1-6烷基、c1-6杂烷基、苯基和5-6元杂芳基,所述c1-6烷基、c1-6杂烷基苯基或5-6元杂芳基任选被1、2或3个oh、cn、f、cl、br、i或c1-6烷基取代;
7、r3选自苯基、萘基和5-9元杂芳基,所述苯基、萘基或5-9元杂芳基任选被1、2或3个-c(=o)oh、oh、cn、f、cl、br、i或取代;
8、r4、r5分别独立地选自h、c1-6烷基和c1-6杂烷基,所述c1-6烷基或c1-6杂烷基任选被1、2或3个oh、cn、f、cl、br或i取代;
9、w选自o、s和c(r6r7);
10、r6、r7分别独立地选自h、c1-6烷基和c1-6杂烷基,所述c1-6烷基或c1-6杂烷基任选被1、2或3个oh、cn、f、cl、br或i取代;
11、或r6、r7连接在一起,形成3-6元杂环基或c3-6环烷基,所述3-6元杂环基或c3-6环烷基任选被1、2或3个oh、cn、f、cl、br或i取代;
12、n选自0、1或2;
13、所述c1-6杂烷基3-9元杂环基、3-6元杂环基、5-9元杂芳基或5-6元杂芳基包含1、2、3或4个独立选自-o-、-nh-、-n=、-s-、-c(=o)-、-c(=o)o-、-s(=o)-、-s(=o)2-和n的杂原子或杂原子团。
14、在本发明的另一方面,本发明公开了式(ii)所示化合物、其光学异构体或其药学上可接受的盐,
15、
16、其中,环a、r1、r2、r3、r6、r7如本发明所定义。
17、在本发明的另一方面,式(iii)、(iii-1)、(iii-2)所示化合物、其光学异构体或其药学上可接受的盐,
18、
19、其中,环a、r1、r2、r6、r7如本发明所定义。
20、r3a选自-c(=o)oh、oh、cn、f、cl、br、i和
21、在本发明的一些方案中,上述r1选自h、oh、cn、f、cl、br、i、c1-4烷基、c1-4烷氧基和c3-4环烷基,所述c1-4烷基、c1-4烷氧基或c3-4环烷基任选被1、2或3个oh、cn、f、cl、br、i或c1-4烷基取代,其余变量如本发明所定义。
22、在本发明的一些方案中,上述r1选自甲基,其余变量如本发明所定义。
23、在本发明的一些方案中,上述r3选自苯基和5-6元杂芳基,所述苯基或5-6元杂芳基任选被1、2或3个-c(=o)oh、oh、cn、f、cl、br、i或取代,其余变量如本发明所定义。
24、在本发明的一些方案中,上述r3选自其余变量如本发明所定义。
25、在本发明的一些方案中,上述w选自o、s、其余变量如本发明所定义。
26、在本发明的一些方案中,上述r6、r7分别独立地选自h、c1-3烷基和c1-3烷氧基,所述c1-3烷基或c1-3烷氧基任选被1、2或3个oh、cn、f、cl、br或i取代;或r6、r7连接在一起,形成3-4元杂环基或c3-4环烷基,所述3-4元杂环基或c3-4环烷基任选被1或2个oh、cn、f、cl、br或i取代,其余变量如本发明所定义。
27、在本发明的一些方案中,上述r6、r7分别独立地选自h、或r6、r7连接在一起,形成其余变量如本发明所定义。
28、在本发明的一些方案中,上述环a选自5-6元杂环基、c5-6环烯基、苯基、5-6元杂芳基和氧代5-6元杂芳基,所述5-6元杂环基、c5-6环烯基、苯基、5-6元杂芳基或氧代5-6元杂芳基任选被1、2或3个ra取代,其余变量如本发明所定义。
29、在本发明的一些方案中,上述环a选自
30、
31、
32、
33、所述
34、
35、任选被1或2个ra取代,其余变量如本发明所定义。
36、在本发明的一些方案中,上述ra选自f、cl、br、i、cn、oh、c1-3烷基、c1-3烷氧基和c3-6环烷基,其余变量如本发明所定义。
37、在本发明的一些方案中,上述ra选自f、cl、br、i、cn、oh、甲基、och3和环丙基,其余变量如本发明所定义。
38、在本发明的一些方案中,上述环a选自
39、
40、
41、其余变量如本发明所定义。
42、在本发明的另一方面,本发明公开了下式化合物、其光学异构体或其药学上可接受的盐,其选自:
43、
44、
45、
46、
47、
48、
49、
50、在本发明的另一方面,本发明公开了下式化合物、其光学异构体或其药学上可接受的盐,其选自:
51、
52、
53、
54、
55、
56、
57、
58、定义和说明
59、除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
60、如本发明中,采用的短语“至少一个”在提及一个或多个要素的列表时应理解为意指至少一个选自所述要素列表中的任一个或多个要素的要素,但不必包括所述要素列表内具体列出的每一个要素中的至少一者,并且不排除所述要素列表中的要素的任何组合。这个定义还允许,可以任选地存在除短语“至少一个”指代的所述要素列表内具体确定的要素以外的要素,不论与那些具体确定的要素相关还是不相关。
61、这里所采用的术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
62、术语“药学上可接受的盐”是指本发明化合物的盐,由本发明发现的具有特定取代基的化合物与相对无毒的酸或碱制备。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的碱与这类化合物的中性形式接触的方式获得碱加成盐。药学上可接受的碱加成盐包括钠、钾、钙、铵、有机胺或镁盐或类似的盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在溶液或合适的惰性溶剂中用足够量的酸与这类化合物的中性形式接触的方式获得酸加成盐。药学上可接受的酸加成盐的实例包括无机酸盐,所述无机酸包括例如盐酸、氢溴酸、硝酸、碳酸,碳酸氢根,磷酸、磷酸一氢根、磷酸二氢根、硫酸、硫酸氢根、氢碘酸、亚磷酸等;以及有机酸盐,所述有机酸包括如乙酸、丙酸、异丁酸、三氟乙酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸和甲磺酸等类似的酸;还包括氨基酸(如精氨酸等)的盐,以及如葡糖醛酸等有机酸的盐。本发明的某些特定的化合物含有碱性和酸性的官能团,从而可以被转换成任一碱或酸加成盐。
63、本发明的药学上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
64、当任何变量(例如r)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被0-2个r所取代,则所述基团可以任选地至多被两个r所取代,并且每种情况下的r都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。例如,可以选自等。
65、不在两个字母或符号之间的短横(“-”)表示取代基的连接位点。例如,c1-6烷基羰基-指通过羰基与分子的其余部分连接的c1-6烷基。然而,当取代基的连接位点对本领域技术人员来说是显而易见的时候,例如,卤素取代基,“-”可以被省略。
66、当基团价键上带有虚线时,例如在中,该虚线表示该基团与分子其它部分的连接点。当单键上带有时,例如在中,该虚线代表单键或者不存在,也意味着代表了单键或者双键
67、术语“被取代的”或“被…取代”是指特定原子上的任意一个或多个氢原子被取代基取代,可以包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。术语“任选被取代的”或“任选被…取代”是指可以被取代,也可以不被取代,除非另有规定,取代基的种类和数目在化学上可以实现的基础上可以是任意的。
68、当任何变量(例如r)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被1、2或3个r’所取代,则所述基团可以任选地1个或2个或3个r’所取代,并且每种情况下的r’都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
69、当其中一个变量选自单键时,表示其连接的两个基团直接相连,比如中l1代表单键时表示该结构实际上是
70、当所列举的取代基中没有指明其通过哪一个原子连接到被取代的基团上时,这种取代基可以通过其任何原子相键合,例如,吡啶基作为取代基可以通过吡啶环上任意一个碳原子连接到被取代的基团上。
71、当所列举的连接基团没有指明其连接方向,其连接方向是任意的,例如,中连接基团l为-ch2o-,此时-ch2o-既可以按与从左往右的读取顺序相同的方向连接苯基和环戊基构成也可以按照与从左往右的读取顺序相反的方向连接苯基和环戊基构成所述连接基团、取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
72、除非另有规定,环上原子的数目通常被定义为环的元数,例如,“3-6元环”是指环绕排列3-6个原子的“环”。
73、除非另有规定,术语“c1-6烷基”用于表示直链或支链的由1至6个碳原子组成的饱和碳氢基团。所述c1-6烷基包括c1-5、c1-4、c1-3、c1-2、c2-6、c2-4、c6和c5烷基等;其可以是一价(如ch3)、二价(-ch2-)或者多价(如次)。c1-6烷基的实例包括但不限于ch3、等。
74、除非另有规定,术语“c1-4烷基”用于表示直链或支链的由1至4个碳原子组成的饱和碳氢基团。所述c1-4烷基包括c1-2、c1-3、c3-4和c2-3烷基等;其可以是一价(如ch3)、二价(-ch2-)或者多价(如次)。c1-4烷基的实例包括但不限于ch3、等。
75、除非另有规定,“c2-6烯基”用于表示直链或支链的包含至少一个碳-碳双键的由2至6个碳原子组成的碳氢基团,碳-碳双键可以位于该基团的任何位置上。所述c2-6烯基包括c2-4、c2-3、c4、c3和c2烯基等;其可以是一价、二价或者多价。c2-6烯基的实例包括但不限于乙烯基、丙烯基、丁烯基、戊烯基、己烯基、丁间二烯基、戊间二烯基、己间二烯基等。
76、除非另有规定,“c2-3烯基”用于表示直链或支链的包含至少一个碳-碳双键的由2至3个碳原子组成的碳氢基团,碳-碳双键可以位于该基团的任何位置上。所述c2-3烯基包括c3和c2烯基;所述c2-3烯基可以是一价、二价或者多价。c2-3烯基的实例包括但不限于等。
77、除非另有规定,“c2-6炔基”用于表示直链或支链的包含至少一个碳-碳三键的由2至6个碳原子组成的碳氢基团,碳-碳三键可以位于该基团的任何位置上。其可以是一价、二价或者多价。所述c2-6炔基包括c2-3、c2-4、c2-5、c3-4、c3-5、c3-6、c4-5、c4-6、c5-6、c6、c5、c4、c3和c2炔基。c2-6炔基的实例包括但不限于等。
78、除非另有规定,“c2-3炔基”用于表示直链或支链的包含至少一个碳-碳三键的由2至3个碳原子组成的碳氢基团,碳-碳三键可以位于该基团的任何位置上。其可以是一价、二价或者多价。所述c2-3炔基包括c3和c2炔基。c2-3炔基的实例包括但不限于等。
79、术语“氧代”是指与碳原子或另一元素,包括与吡啶环的氮双键合以形成吡啶n-氧化物的氧原子。例如术语“氧代5-6元杂芳基”包括但不限于
80、术语“杂烷基”本身或者与另一术语联合,表示由一定数目碳原子和至少一个杂原子或杂原子团组成的,稳定的直链或支链的烷基原子团或其组合物。在一些实施方案中,杂原子选自b、o、n和s,其中氮和硫原子任选地被氧化,氮杂原子任选地被季铵化。在另一些实施方案中,杂原子团选自-c(=o)o-、-c(=o)-、-c(=s)-、-s(=o)、-s(=o)2-、-c(=o)n(h)-、-n(h)-、-c(=nh)-、-s(=o)2n(h)-和-s(=o)n(h)-。在一些实施方案中,所述杂烷基为c1-6杂烷基;在另一些实施方案中,所述杂烷基为c1-3杂烷基。杂原子或杂原子团可以位于杂烷基的任何内部位置,包括该烷基与分子其余部分的连接位置,但术语“烷氧基”属于惯用表达,是指通过一个氧原子连接到分子的其余部分的那些烷基基团。杂烷基的实例包括但不限于-och3、-och2ch3、-och2ch2ch3、-och2(ch3)2、-ch2-ch2-o-ch3、-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)(ch2ch3)、-ch2-ch2-nh-ch3、-ch2-ch2-n(ch3)-ch3、-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2、-ch2-s-ch2-ch3、-ch2-ch2、-s(=o)-ch3、-ch2-ch2-s(=o)2-ch3、和至多两个杂原子可以是连续的,例如-ch2-nh-och3。
81、除非另有规定,术语“c1-6烷氧基”表示通过一个氧原子连接到分子的其余部分的那些包含1至6个碳原子的烷基基团。所述c1-6烷氧基包括c1-4、c1-3、c1-2、c2-6、c2-4、c6、c5、c4和c3烷氧基等。c1-6烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(包括正丙氧基和异丙氧基)、丁氧基(包括n-丁氧基、异丁氧基、s-丁氧基和t-丁氧基)、戊氧基(包括n-戊氧基、异戊氧基和新戊氧基)、己氧基等。
82、除非另有规定,术语“c1-3烷氧基”表示通过一个氧原子连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c1-3烷氧基包括c1-3、c1-2、c2-3、c1、c2和c3烷氧基等。c1-3烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(包括正丙氧基和异丙氧基)等。
83、除非另有规定,术语“c1-6烷氨基”表示通过氨基连接到分子的其余部分的那些包含1至6个碳原子的烷基基团。所述c1-6烷氨基包括c1-4、c1-3、c1-2、c2-6、c2-4、c6、c5、c4、c3和c2烷氨基等。c1-6烷氨基的实例包括但不限于-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)ch2ch3、-n(ch2ch3)(ch2ch3)、-nhch2ch2ch3、-nhch2(ch3)2、-nhch2ch2ch2ch3等。
84、除非另有规定,术语“c1-3烷氨基”表示通过氨基连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c1-3烷氨基包括c1-3、c1-2、c2-3、c1、c2和c3烷氨基等。c1-3烷氨基的实例包括但不限于-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)ch2ch3、-nhch2ch2ch3、-nhch2(ch3)2等。
85、除非另有规定,术语“c1-6烷硫基”表示通过硫原子连接到分子的其余部分的那些包含1至6个碳原子的烷基基团。所述c1-6烷硫基包括c1-4、c1-3、c1-2、c2-6、c2-4、c6、c5、c4、c3和c2烷硫基等。c1-6烷硫基的实例包括但不限于-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2等等。
86、除非另有规定,术语“c1-3烷硫基”表示通过硫原子连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c1-3烷硫基包括c1-3、c1-2、c2-3、c1、c2和c3烷硫基等。c1-3烷硫基的实例包括但不限于-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2等。
87、除非另有规定,“c3-6环烷基”表示由3至6个碳原子组成的饱和环状碳氢基团,其为单环和双环体系,所述c3-6环烷基包括c3-5、c4-5和c5-6环烷基等;其可以是一价、二价或者多价。c3-6环烷基的实例包括,但不限于,环丙基、环丁基、环戊基、环己基等。
88、除非另有规定,本发明术语“环烯基”是指环状烯基。“c3-9环烯基”包括c3-8、c3-7、c3-6、c3-5、c3-4、c4-9、c4-8、c4-7、c4-6、c4-5、c5-9、c5-8、c5-7、c5-6、c3、c4、c5、c6、c7、c8、c9环烯基。环烯基的实例包括但不限于环戊烯基和环己烯基。“c5-6环烯基”包括c5、c6环烯基。环烯基的实例包括但不限于环戊烯基和环己烯基。式(i)所示化合物中环a选自c3-9环烯基时,其不饱和键与苯基共享两个碳原子,即当环a选自环丁烯基时,其结构为
89、除非另有规定,术语“3-9元杂环基”本身或者与其他术语联合分别表示由3至9个环原子组成的饱和或部分不饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。其包括单环和双环体系,其中双环体系包括螺环、并环和桥环。此外,就该“3-9元杂环基”而言,杂原子可以占据杂环基与分子其余部分的连接位置。所述3-9元杂环基包括3-8元、3-7元、3-6元、3-5元、3-4元、4-5元、4-6元、4-7元、4-8元、4-9元、5-6元、5-7元、5-8元、5-9元、6-7元、6-8元、6-9元、7-8元、3元、4元、5元、6元、7元、8元和9元杂环基等。3-9元杂环基的实例包括但不限于氮杂环丁基、氧杂环丁基、硫杂环丁基、1,3-二氧戊烷、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基或高哌啶基等。
90、除非另有规定,术语“3-6元杂环基”本身或者与其他术语联合分别表示由3至6个环原子组成的饱和或部分不饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。其包括单环和双环体系,其中双环体系包括螺环、并环和桥环。此外,就该“3-6元杂环基”而言,杂原子可以占据杂环基与分子其余部分的连接位置。所述3-6元杂环基包括4-6元、5-6元、4元、5元和6元杂环基等。3-6元杂环基的实例包括但不限于氮杂环丁基、氧杂环丁基、硫杂环丁基、1,3-二氧戊烷、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基或高哌啶基等。
91、除非另有规定,术语“5-6元杂环基”本身或者与其他术语联合分别表示由5至6个环原子组成的饱和或部分不饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。其包括单环和双环体系,其中双环体系包括螺环、并环和桥环。此外,就该“5-6元杂环基”而言,杂原子可以占据杂环基与分子其余部分的连接位置。所述5-6元杂环基包括5元和6元杂环基等。5-6元杂环基的实例包括但不限于1,3-二氧戊烷、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基或高哌啶基等。
92、除非另有规定,本发明术语“5-9元杂芳环”和“5-9元杂芳基”可以互换使用,术语“5-9元杂芳基”表示由5至9个环原子组成的具有共轭π电子体系的单环基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子。其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。5-9元杂芳基可通过杂原子或碳原子连接到分子的其余部分。所述5-9元杂芳基包括5-8元、5-7元、5-6元、6-9元、6-8元、6-7元、5元和6元杂芳基。所述5-9元杂芳基的实例包括但不限于吡咯基(包括n-吡咯基、2-吡咯基和3-吡咯基等)、吡唑基(包括2-吡唑基和3-吡唑基等)、咪唑基(包括n-咪唑基、2-咪唑基、4-咪唑基和5-咪唑基等)、噁唑基(包括2-噁唑基、4-噁唑基和5-噁唑基等)、三唑基(1h-1,2,3-三唑基、2h-1,2,3-三唑基、1h-1,2,4-三唑基和4h-1,2,4-三唑基等)、四唑基、异噁唑基(3-异噁唑基、4-异噁唑基和5-异噁唑基等)、噻唑基(包括2-噻唑基、4-噻唑基和5-噻唑基等)、呋喃基(包括2-呋喃基和3-呋喃基等)、噻吩基(包括2-噻吩基和3-噻吩基等)、吡啶基(包括2-吡啶基、3-吡啶基和4-吡啶基等)、吡嗪基或嘧啶基(包括2-嘧啶基和4-嘧啶基等)。
93、除非另有规定,本发明术语“5-6元杂芳环”和“5-6元杂芳基”可以互换使用,术语“5-6元杂芳基”表示由5至6个环原子组成的具有共轭π电子体系的单环基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子。其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。5-6元杂芳基可通过杂原子或碳原子连接到分子的其余部分。所述5-6元杂芳基包括5元和6元杂芳基。所述5-6元杂芳基的实例包括但不限于吡咯基(包括n-吡咯基、2-吡咯基和3-吡咯基等)、吡唑基(包括2-吡唑基和3-吡唑基等)、咪唑基(包括n-咪唑基、2-咪唑基、4-咪唑基和5-咪唑基等)、噁唑基(包括2-噁唑基、4-噁唑基和5-噁唑基等)、三唑基(1h-1,2,3-三唑基、2h-1,2,3-三唑基、1h-1,2,4-三唑基和4h-1,2,4-三唑基等)、四唑基、异噁唑基(3-异噁唑基、4-异噁唑基和5-异噁唑基等)、噻唑基(包括2-噻唑基、4-噻唑基和5-噻唑基等)、呋喃基(包括2-呋喃基和3-呋喃基等)、噻吩基(包括2-噻吩基和3-噻吩基等)、吡啶基(包括2-吡啶基、3-吡啶基和4-吡啶基等)、吡嗪基或嘧啶基(包括2-嘧啶基和4-嘧啶基等)。
94、除非另有规定,cn-n+m或cn-cn+m包括n至n+m个碳的任何一种具体情况,例如c1-12包括c1、c2、c3、c4、c5、c6、c7、c8、c9、c10、c11、和c12,也包括n至n+m中的任何一个范围,例如c1-12包括c1-3、c1-6、c1-9、c3-6、c3-9、c3-12、c6-9、c6-12、和c9-12等;同理,n元至n+m元表示环上原子数为n至n+m个,例如3-12元环包括3元环、4元环、5元环、6元环、7元环、8元环、9元环、10元环、11元环、和12元环,也包括n至n+m中的任何一个范围,例如3-12元环包括3-6元环、3-9元环、5-6元环、5-7元环、5-10元环、6-7元环、6-8元环、6-9元环和6-10元环等。
95、术语“离去基团”是指可以被另一种官能团或原子通过取代反应(例如亲和取代反应)所取代的官能团或原子。例如,代表性的离去基团包括三氟甲磺酸酯;氯、溴、碘;磺酸酯基,如甲磺酸酯、甲苯磺酸酯、对溴苯磺酸酯、对甲苯磺酸酯等;酰氧基,如乙酰氧基、三氟乙酰氧基等等。
96、术语“保护基”包括但不限于“氨基保护基”、“羟基保护基”或“巯基保护基”。术语“氨基保护基”是指适合用于阻止氨基氮位上副反应的保护基团。代表性的氨基保护基包括但不限于:甲酰基;酰基,例如链烷酰基(如乙酰基、三氯乙酰基或三氟乙酰基);烷氧基羰基,如叔丁氧基羰基(boc);芳基甲氧羰基,如苄氧羰基(cbz)和9-芴甲氧羰基(fmoc);芳基甲基,如苄基(bn)、三苯甲基(tr)、1,1-二-(4'-甲氧基苯基)甲基;甲硅烷基,如三甲基甲硅烷基(tms)和叔丁基二甲基甲硅烷基(tbs)等等。术语“羟基保护基”是指适合用于阻止羟基副反应的保护基。代表性羟基保护基包括但不限于:烷基,如甲基、乙基和叔丁基;酰基,例如链烷酰基(如乙酰基);芳基甲基,如苄基(bn),对甲氧基苄基(pmb)、9-芴基甲基(fm)和二苯基甲基(二苯甲基,dpm);甲硅烷基,如三甲基甲硅烷基(tms)和叔丁基二甲基甲硅烷基(tbs)等等。
97、本领域技术人员应当理解的是,一些式(i)化合物可以包含一个或多个手性中心,因此存在两个或更多个立体异构体。因此,本发明的化合物可以以单个立体异构体(例如对映异构体、非对映异构体)及其任意比例的混合物例如外消旋物的形式存在,以及在适当的情况下,可以以其互变异构体和几何异构体的形式存在。
98、本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本发明要求保护的范围之内。
99、本文所用的术语“立体异构体”指具有相同化学构成、但在原子或基团的空间排列方面不同的化合物。立体异构体包括对映异构体、非对映异构体和构象异构体等。
100、本文所用的术语“对映异构体”指化合物的彼此是不可重叠的镜像的两种立体异构体。
101、本文所用的术语“非对映异构体”指具有两个或更多个手性中心并且其分子彼此不是镜像的立体异构体。非对映异构体具有不同的物理性质,例如熔点、沸点、光谱性质或生物活性。非对映异构体的混合物可以用高分辨率分析方法例如电泳和色谱例如hplc分离。
102、立体化学定义和惯例可遵循s.p.parker编辑,mcgraw-hill dictionary ofchemical terms(1984)mcgraw-hill book company,new york;和eliel,e.和wilen,s.,“stereochemistry of organic compounds”,john wiley&sons,inc.,new york,1994。许多有机化合物以光学活性形式存在,即,它们具有旋转平面偏振光的平面的能力。在描述光学活性化合物时,前缀d和l或者r和s用于表示分子关于其手性中心的绝对构型。前缀d和l或者(+)和(-)用于表示化合物旋转平面偏振光的符号,其中(-)或l表示该化合物是左旋的。带有(+)或d的前缀的化合物是右旋的。对于给定的化学结构,除了它们彼此互为镜像之外,这些立体异构体是相同的。特定的立体异构体也可以称为对映异构体,这类异构体的混合物通常称为对映异构体混合物。对映异构体的50:50混合物被称为外消旋混合物或外消旋物,其可以出现在化学反应或方法中没有立体选择性或立体特异性的情况中。术语“外消旋混合物”和“外消旋物”指不具有光学活性的两种对映异构体的等摩尔混合物。
103、外消旋混合物可以以其本身的形式使用或者拆分成单个异构体使用。通过拆分可以得到立体化学上的纯的化合物或者富集一种或多种异构体的混合物。分离异构体的方法是众所周知的(参见allinger n.l.和eliel e.l.,"topics in stereochemistry",第6卷,wiley interscience,1971),包括物理方法,例如使用手性吸附剂的色谱法。可以由手性前体制备得到手性形式的单个异构体。或者,可以通过与手性酸(例如10-樟脑磺酸、樟脑酸、α-溴樟脑酸、酒石酸、二乙酰基酒石酸、苹果酸、吡咯烷酮-5-羧酸等的单个对映异构体)形成非对映异构体盐而由混合物化学分离得到单个异构体,将所述的盐分级结晶,然后游离出拆分的碱中的一个或两个,任选地重复这一过程,从而得到一个或两个基本上不包含另一种异构体的异构体,即光学纯度以重量计为例如至少91%、92%、93%、94%、95%、96%、97%、98%、99%或99.5%的所需的立体异构体。或者,如本领域技术人员所熟知的,可以将外消旋物共价连接到手性化合物(辅助物)上,得到非对映异构体。
104、本发明的化合物可以存在特定的。除非另有说明,术语“互变异构体”或“互变异构体形式”是指在室温下,不同官能团异构体处于动态平衡,并能很快的相互转化。若互变异构体是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(proton tautomer)(也称质子转移互变异构体(prototropictautomer))包括通过质子迁移来进行的互相转化,如酮-烯醇异构化和亚胺-烯胺异构化。价键异构体(valencetautomer)包括一些成键电子的重组来进行的相互转化。其中酮-烯醇互变异构化的具体实例是戊烷-2,4-二酮与4-羟基戊-3-烯-2-酮两个互变异构体之间的互变。
105、本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(3h),碘-125(125i)或c-14(14c)。又例如,可用重氢取代氢形成氘代药物,氘与碳构成的键比普通氢与碳构成的键更坚固,相比于未氘化药物,氘代药物有降低毒副作用、增加药物稳定性、增强疗效、延长药物生物半衰期等优势。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。
106、“任选”或“任选地”指的是随后描述的事件或状况可能但不是必需出现的,并且该描述包括其中所述事件或状况发生的情况以及所述事件或状况不发生的情况。
107、本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
108、本发明所使用的溶剂可经市售获得。
109、化合物依据本领域常规命名原则或者使用软件命名,市售化合物采用供应商目录名称。
110、本发明所公开化合物可能有一个或多个手性中心,每个手性中心各自独立的具有r构型或者s构型。本发明所公开部分化合物手性中心标记为*r,*s,r*,或s*,表示该化合物该手性中心绝对构型未经鉴定,但是该化合物已经过手性拆分且该手性中心为单一构型的手性中心,该化合物为单一构型对映异构体单体,或单一构型的非对映异构体单体,或该手性中心构型单一的非对映异构体混合物(例如:其它手性中心构型未被拆分)。当本发明所公开化合物手性中心其绝对构型(r构型,或者s构型)未经鉴定时,该类化合物可根据其在相应色谱柱条件下(例如色谱柱型号,色谱柱填充物,色谱柱尺寸,流动相等)所对应保留时间(rt)予以确认。
111、在下述实施例中更具体地解释本发明。然而,应当理解,这些实施例是为了举例说明本发明,而并不是以任何方式限制本发明的范围。下列实施例中如未注明具体条件的实验方法,通常按照这类反应的常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。除非另外说明,否则液体的比为体积比。
112、本文所用的未具体定义的技术和科学术语具有本发明所属领域的技术人员通常理解的含义。
- 还没有人留言评论。精彩留言会获得点赞!