一种佐米曲普坦中间体的制备方法与流程
本发明属于医药化工领域,具体涉及一种佐米曲普坦中间体的制备方法。
背景技术:
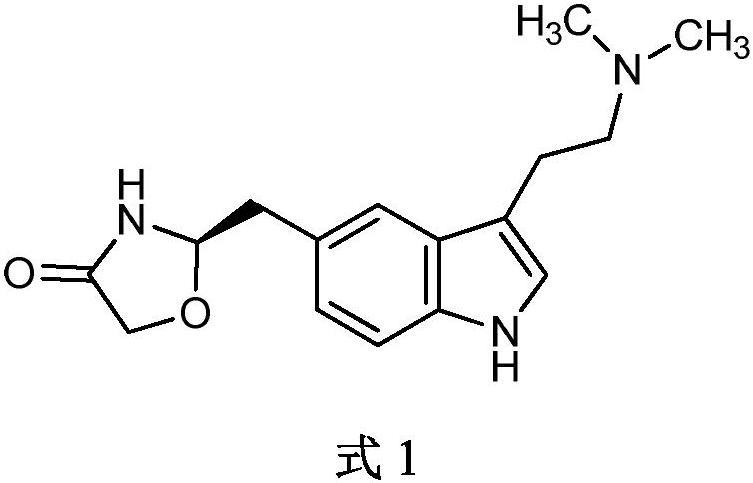
1、佐米曲普坦(zolmitriptan),化学名称为:(s)-4-[[3-[2-(二甲氨基)乙基]吲哚-5-基]甲基]-2-噁唑烷酮,分子式c16h21n3o2,分子量287.36,具有式1所示的化学结构:
2、
3、佐米曲普坦(zolmitriptan)是由英国威康(wellcom)公司最先开发,用于伴有或不伴有先兆症状的中、重度偏头痛的急性治疗。1991年12月12日首次获得佐米曲普坦专利(us 5466699)。后转让给英国捷利康(zenece)公司生产,1997年3月在英联邦首次上市,商品名为zomig。1997年11月被fda批准在美国上市。随即在欧盟成员国,如德国、荷兰和丹麦等均有销售。上市剂型有片剂、分散片、含片、胶囊剂等。
4、佐米曲普坦是一种新型、高效、特异性治疗急性偏头痛的药物,是高选择性的5-ht1b/1d受体激动剂,通过激动5-ht1受体引起血管收缩并抑制神经肽的释放,从而缓解偏头痛的发作。药理学研究结果显示:佐米曲普坦不但可以控制脑外周血流,而且可作用于大脑的疼痛中枢,从而起到治疗偏头痛的作用。
5、目前国内外多篇专利及文献报道了佐米曲普坦的合成方法。现有佐米曲普坦的合成路线较多,大多以l-苯丙氨酸或4-硝基-l-苯丙氨酸为起始物料,经7-9步反应得到目标化合物。相关合成路线汇总如下:
6、合成路线一:
7、
8、该路线以4-硝基-l-苯丙氨酸为起始物料,首先与meoh和socl2反应成酯,再经nabh4还原,得到相应的醇;醇与光气在碱性条件下关环,得到化合物5;化合物5经h2/pd/c还原硝基得到化合物6;化合物6经重氮化得到化合物7;化合物7与4-氯丁醛缩乙二醇发生重排反应生成吲哚环氨基化合物,该化合物与nabh3cn/hcho反应得到目标化合物1。
9、合成路线二:
10、
11、该路线以l-苯丙氨酸为起始物料,首先在硫酸催化下与硝酸发生硝化反应,生成化合物2。化合物2在路易斯酸三氟化硼催化下,使用了昂贵的三氟化硼二甲硫醚反应,生成化合物4。化合物4与光气环合得化合物5。再经h2/pd/c还原、重氮化得到化合物7。化合物7与3-氰基二乙缩丙醛发生缩合反应,然后在对甲苯磺酸作用下环合生成吲哚化合物,最后在h2/pd/c催化作用下与二甲胺反应生成目标化合物1。
12、合成路线三:
13、
14、该路线以l-苯丙氨酸为起始物料,首先在hno3与h2so4的作用下进行对位硝化得到化合物2,化合物2与meoh和socl2反应得到酯化产物3,经nabh4还原得到羟基化合物4。与固体光气(三光气)进行环合反应得化合物5。水合肼还原硝基得化合物6;再经重氮化反应得到化合物7。化合物7与4-(二甲氨基)丁醛缩二乙醇发生费歇尔(fischer)吲哚合成反应制得目标化合物1。
15、在以上合成路线中,均经过不同方法或条件制备得到相同结构的中间体化合物2和中间体化合物4;上述化合物是制备佐米曲普坦的重要结构片段,是制备佐米曲普坦的重要中间体。
16、但上述制备中间体化合物2即4-硝基-l-苯丙氨酸的方法存在浓硫酸和浓硝酸的用量较大,废酸产生量大,不利于绿色环保,成本较高;反应温度较低,反应条件苛刻,耗能高,反应周期长,进一步增加了成本;本步硝化反应选择性较差,邻位副产物较多,纯化步骤繁琐,目标产物收率和纯度较低。上述制备中间体化合物4即4-硝基-l-苯丙胺醇的方法选用将硝化后的l-苯丙氨酸先酯化后还原的方法,氨基酸的酯化一般为盐酸或氯化亚砜催化酯化,两者均为强酸性且易挥发,对设备及人员极不友好,后处理产生较多的酸性废液,产生大量的危废,不符合当今绿色生产的要求;且有大量杂质产生,目标产物收率和纯度低。现有文献中也报道了α-氨基酸一步还原为α-氨基醇的方法,但目标产物反应程度差,收率较低,杂质较多,纯度较低;并且为获得符合要求的产品需进行多次纯化进一步降低了产品收率,提高了产品生产成本,且多次纯化也造成大量溶媒的使用,进一步增加了有机溶剂的处理压力,不利于环保及废液处理。
17、为了解决上述问题,提出本发明。
技术实现思路
1、针对现有技术存在的不足,本发明提供一种佐米曲普坦中间体的制备方法。本发明制备中间体化合物2即4-硝基-l-苯丙氨酸的方法减少了浓硫酸或混酸(浓硫酸和浓硝酸)的用量,降低了强酸性废液的产生量,降低了成本的同时,更利于绿色安全环保;反应条件温和,易于实现和控制,制备周期短,纯化简单,耗能低,进一步降低了成本;反应选择性好,副产物少,目标产物收率和纯度高。本发明制备中间体化合物4即4-硝基-l-苯丙胺醇的方法安全、绿色环保、减少了废液的产生、成本低;杂质少,纯化步骤简单,目标产物收率和纯度高。
2、本发明的技术方案如下:
3、一种佐米曲普坦中间体4-硝基-l-苯丙氨酸的制备方法,包括步骤:以硫酸水溶液为溶剂,以浓硝酸或发烟硝酸为硝化试剂,于微通道反应器中,l-苯丙氨酸经硝化反应得到4-硝基-l-苯丙氨酸。
4、根据本发明优选的,硫酸水溶液的质量分数为75%~98%,优选75~85%。
5、根据本发明优选的,浓硝酸或发烟硝酸中,硝酸的质量分数64~97%。
6、根据本发明优选的,硫酸水溶液与l-苯丙氨酸的质量比为1~5∶1,优选1~2∶1。
7、根据本发明优选的,硝化试剂浓硝酸或发烟硝酸与l-苯丙氨酸的摩尔比为1~2∶1;优选为1∶1。
8、根据本发明优选的,硝化反应温度为-5~30℃,优选5~20℃。
9、根据本发明优选的,硝化反应时间为20秒~300秒,优选28秒~60秒。
10、根据本发明,所述微通道反应器可市购获得。
11、根据本发明优选的,4-硝基-l-苯丙氨酸的制备方法包括步骤:将l-苯丙氨酸溶于硫酸水溶液中得到l-苯丙氨酸溶液;将l-苯丙氨酸溶液和浓硝酸或发烟硝酸分别同时通入微通道反应器中,l-苯丙氨酸经硝化反应得到佐米曲普坦中间体4-硝基-l-苯丙氨酸。
12、优选的,l-苯丙氨酸溶液的流速为0.5-2ml/min;浓硝酸或发烟硝酸的流速为0.3-1ml/min;优选的,l-苯丙氨酸溶液的流速为1ml/min;浓硝酸或发烟硝酸的流速为0.6ml/min。
13、根据本发明优选的,硝化反应所得反应液的后处理方法包括步骤:将反应液通入至10℃以下的水中,充分混合均匀后,经过滤、洗涤、干燥得4-硝基-l-苯丙氨酸。
14、一种佐米曲普坦中间体4-硝基-l-苯丙胺醇的制备方法,包括步骤:于溶剂中、在还原剂存在下,上述所得4-硝基-l-苯丙氨酸(化学名:(s)-2-氨基-3-(4-硝基苯基)丙酸)经还原反应制备得到4-硝基-l-苯丙胺醇(化学名:(s)-2-氨基-3-(4-硝基苯基)丙醇)。
15、根据本发明优选的,所述溶剂由溶剂a和溶剂b组成;
16、所述溶剂a为四氢呋喃、甲基四氢呋喃、甲醇或乙醇中的一种或两种以上的组合;优选的,所述溶剂a为四氢呋喃;
17、所述溶剂b为甲苯、二甲苯或二氧六环中的一种或两种以上的组合;优选的,所述溶剂b为甲苯;
18、溶剂a与溶剂b的体积比为1∶0.5~10,优选1∶1~4。
19、优选的,溶剂a和溶剂b在4-硝基-l-苯丙氨酸加入前加入,或,溶剂a在4-硝基-l-苯丙氨酸加入前加入、溶剂b在4-硝基-l-苯丙氨酸加入后加入。
20、根据本发明优选的,4-硝基-l-苯丙氨酸的质量和溶剂的体积比为0.01-0.1g/ml。
21、根据本发明优选的,所述还原剂为硼氢化钠、硼氢化钾、硼氢化钠-路易斯酸、硼氢化钾-路易斯酸、硼氢化钾-碘、硼氢化钠-碘、硼氢化钠-h2so4或硼氢化钾-h2so4中的一种。
22、优选的,所述路易斯酸为氯化铝、氯化锌、氯化锂、氯化镍、氯化钯或氯化钙中的一种或两种以上的组合。
23、优选的,硼氢化钠-路易斯酸、硼氢化钾-路易斯酸中,硼氢化钠或硼氢化钾与路易斯酸的摩尔比为1~6∶1,优选为2~4∶1,更优选2∶1;硼氢化钾-碘、硼氢化钠-碘中,硼氢化钠或硼氢化钾与碘的摩尔比为1~3∶1,优选1~1.5∶1,更优选1.1∶1;硼氢化钠-h2so4、硼氢化钾-h2so4中,硼氢化钠或硼氢化钾与h2so4的摩尔比为1~3∶1,优选1~1.5∶1,更优选1.1∶1。
24、根据本发明优选的,4-硝基-l-苯丙氨酸与还原剂的摩尔比为1∶1~8。
25、根据本发明优选的,4-硝基-l-苯丙氨酸可一次性加入反应体系中,或者分批次加入反应体系中。
26、根据本发明优选的,4-硝基-l-苯丙氨酸的制备方法同上。
27、根据本发明优选的,佐米曲普坦中间体4-硝基-l-苯丙胺醇的制备方法包括步骤:
28、将还原剂、4-硝基-l-苯丙氨酸加入溶剂a中;然后加入溶剂b,经反应得到佐米曲普坦中间体4-硝基-l-苯丙胺醇;
29、或,将还原剂加入溶剂a中,分批加入4-硝基-l-苯丙氨酸;然后加入溶剂b,经反应得到佐米曲普坦中间体4-硝基-l-苯丙胺醇。
30、优选的,将还原剂、4-硝基-l-苯丙氨酸加入溶剂a中后还包括加热回流的步骤;加热回流反应温度为60℃~66℃,反应时间为1-5h。
31、优选的,分批加入4-硝基-l-苯丙氨酸之前,还可包括加热回流的步骤;或者,分批加入4-硝基-l-苯丙氨酸之后,还可包括加热回流的步骤;加热回流反应温度为60℃~66℃,反应时间为1-5h。
32、优选的,加入溶剂b后的反应温度为66℃~140℃,优选80~100℃;反应时间为2~24h,优选6~12h。
33、优选的,分批加入4-硝基-l-苯丙氨酸时,分2-4批次加入,5-15分钟加完。
34、根据本发明优选的,4-硝基-l-苯丙氨酸经还原反应所得反应液的后处理方法包括步骤:
35、反应液搅拌冷却至室温后,滴加水淬灭,过滤,水相用甲苯或乙酸乙酯萃取,合并有机相,有机相经无水硫酸镁或无水硫酸钠干燥,过滤,减压浓缩至干即得4-硝基-l-苯丙胺醇;
36、或,反应液搅拌冷却至室温后,冰水冷却至0~10℃,过滤去除固体;向所得滤液中滴加氢氧化钠水溶液,过滤去除生成的固体;所得滤液分液,水相用甲苯或乙酸乙酯萃取,合并有机层,有机相经无水硫酸镁或无水硫酸钠干燥,过滤,滤液减压浓缩至干即得4-硝基-l-苯丙胺醇;
37、或,反应液搅拌冷却至室温后,冰水冷却至0~10℃,过滤去除固体;所得滤液经水洗、分液,有机层经减压浓缩至干即得4-硝基-l-苯丙胺醇。
38、本发明合成路线如下:
39、
40、本发明的技术特点:
41、4-硝基-l-苯丙氨酸的制备:
42、经研究改进,本发明调整了溶剂浓硫酸的浓度和用量,减少了溶剂浓硫酸或混酸(浓硫酸和浓硝酸)的用量,由常规3-4倍量降低至1-2倍量,避免产生大量的强酸性废液,绿色环保,成本低。
43、同时通过优化比例减少了硝化试剂的使用,通过采用微通道反应器,将硝化用硝酸摩尔量减小为1∶1,将硝化反应温度进行了稳定良好的控制,在较高的、温和的、易于实现的反应温度下反应,反应周期短,同时能够将硝化温度失控危险得到完全控制,反应安全、绿色环保、进一步降低成本。
44、经工艺改进后,硝化产物异构体得到有效控制,通过文献报道的工艺制备的硝化产物中含有10%~20%左右的邻硝基异构体,经工艺改进后,使用本发明方法无需纯化或经简单后处理即可获得高纯度的对位硝化产物(即4-硝基-l-苯丙氨酸),反应选择性好,产物纯度可达97%以上,异构体大幅度减小至3.5%以内。该纯度下无需进一步精制,可直接用于反应。
45、l-苯丙氨酸的硝化反应收率最高的为佳木斯大学张玲论文《佐米曲普坦合成工艺研究》,披露收率为68%,其它现有文献报道收率均不超过60%。本发明改进后的工艺提高了硝化产物的生产效率和收率,由于避免了硝化异构体的产生,收率由不足60%提高至88%以上,缩短了生产时间,降低了生产成本,减少了大量酸性危废的排放和处理。
46、硝化反应为向有机化合物分子中引入硝基的反应过程,该反应过程机理主要分为两种,对于脂肪族化合物的硝化一般通过自由基历程来实现,反应历程比较复杂,不同体系也会不同;对芳香族化合物其反应历程是典型的亲电取代反应。在反应中硝酸的羟基被质子化,脱水形成硝酰正离子(no2+),然后与苯环进行亲电芳香取代反应,并脱去一分子氢离子。常用硝化试剂为浓硝酸、发烟硝酸,浓硫酸及浓硫酸与硝酸的混酸为常用的脱水剂,强酸性物料的存在对反应设备的要求严格。硝化反应中放热焓变大,为强放热反应,巨大多数反应热超过600j/g,反应非常剧烈,极易失控造成冲料或爆炸事故,因此硝化反应也被列为危险监管工艺。为控制反应速率,及时导出反应产生的热量,硝化反应需要进行降温控制,温度的难以控制也不可避免的产生硝化异构体或多硝基的产物,从而使产物纯度降低,成本升高。本发明使用微通道反应器后可使硝化试剂与反应原料的接触时间和浓度获得有效控制,增大了散热面积,反应后的产物及时导出淬灭;本发明通过采用微通道反应器,有效抑制了副反应的发生,提高了反应的选择性和转化率。同样的,由于接触反应的物料量减少,有效控制了反应的放热,使反应更加安全可控。
47、4-硝基-l-苯丙胺醇的制备:
48、由硝化后的4-硝基-l-苯丙氨酸制备4-硝基-l-苯丙胺醇的方法,总结国内外文献报道,4-硝基-l-苯丙胺醇的制备均选用将硝化后的4-硝基-l-苯丙氨酸先酯化后还原的方法,氨基酸的酯化一般为盐酸或氯化亚砜催化酯化,两者均为强酸性且易挥发,对设备及人员极不友好,后处理产生较多的酸性废液,产生大量的危废,不符合当今绿色生产的要求。
49、根据文献披露,wo9118897a1中4-硝基-l-苯丙胺醇制备两步收率仅为37.0%;张玲、曲有乐、周淑晶发表的《佐米曲普坦的合成及工艺改进》披露的两步收率约为79.4%,目前为现有技术中的最高收率。但使用《佐米曲普坦的合成及工艺改进》披露的工艺进行了制备,发现按照其报道方法并不能重复,产出4-硝基-l-苯丙胺醇的单步收率仅为40.2%,且由于其还原工艺中使用了大量的氢氧化钠溶液中和上步4-硝基-l-苯丙氨酸的盐,有大量杂质产生,4-硝基-l-苯丙胺醇的纯度很低;两步法制备4-硝基-l-苯丙胺醇的收率仅有约55~67%。
50、查询文献,4-硝基-l-苯丙胺醇制备中尚未有文献报道使用硼氢化钠/硼氢化钾+路易斯酸将硝化后的l-苯丙氨酸一步还原为硝基-l-苯丙胺醇。
51、发明人尝试将不同还原方法应用于α-氨基酸一步还原为α-氨基醇的制备,在实验中发现,按照文献制备,由于还原溶剂体系的限制,即使延长反应时间至3天,仍不能完全反应,产物收率很低仅为约40%,在所得产物中含有大量未反应的物料,造成产品收率低,质量差。为获得符合要求的产品需进行多次纯化,进一步降低了产品收率,提高了产品生产成本,且多次纯化也造成大量溶媒的使用,进一步增加了有机溶剂的处理压力,不利于环保及废液处理。
52、综合各种信息,本发明将4-硝基-l-苯丙氨酸在一步法还原时加入高沸点溶剂甲苯或二甲苯等,提高了其反应温度,使反应能量进一步提升,并在短时间内完全反应,由4-硝基-l-苯丙氨酸全部一步还原为4-硝基-l-苯丙胺醇,转化率得到大幅度提升,收率提升到80~90%。同时由于不再进行酯的制备,避免了hcl及氯化亚砜等强酸性易挥发物料的使用,减少了对环境的影响,对设备的腐蚀,同时对操作人员友好,减少了废液的产生,有利于环保,践行了绿色化学的理念。
53、在制备中发现,由于硝基的存在,当简单的以四氢呋喃或醇类为溶剂,以硼氢化钠/硼氢化钾+路易斯酸体系还原时,4-硝基-l-苯丙氨酸反应程度较低,不能完全反应,大量未反应的4-硝基-l-苯丙氨酸的残留使4-硝基-l-苯丙胺醇收率低,仅有不足40%。本发明对工艺进行了改进,在反应初始阶段或反应进行一段时间后,反应体系中增加适量的甲苯或二甲苯,适度提高反应温度;继续反应一段时间后4-硝基-l-苯丙氨酸反应完全,4-硝基-l-苯丙胺醇的收率提高至80~90%。
54、本发明有益效果如下:
55、1、本发明4-硝基-l-苯丙氨酸的制备方法通过使用微通道反应器减少了浓硫酸、硝化试剂的用量,降低了强酸性废液的产生量,降低了成本的同时,更利于绿色安全环保;反应条件温和,易于实现和控制,制备周期短,纯化简单,耗能低,进一步降低了成本;反应选择性好,副产物少,目标产物收率和纯度高,适宜工业化生产。
56、2、本发明4-硝基-l-苯丙胺醇的制备中,将酯化、还原为醇两步反应简化为一步,减少了制备时间;方法安全、绿色环保、减少了三废的产生(尤其是盐酸气体的中和排放)、成本低;杂质少,纯化步骤简单,目标产物收率和纯度高,适宜工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!