HPK1抑制剂及其在医药上的应用的制作方法
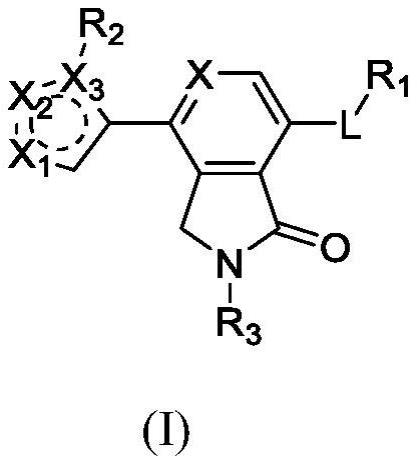
本发明涉及医药,具体涉及式(i)化合物、其立体异构体、互变异构体、氘代物或药用盐,其制备方法,含有该化合物的药用组合物,及其作为治疗癌症药物的用途。
背景技术:
1、造血祖细胞激酶1(hpk1),又称丝裂原活化蛋白激酶激酶激酶激酶1(mitogen-activated protein kinase kinase kinase kinase 1,map4k1),是丝/苏氨酸激酶亚家族ste20中的一员,其家族成员还包括map4k2(gck)、map4k3(glk)、map4k4(hgk)、map4k5(khs)和map4k6(mink)。hpk1是b细胞、t细胞、树突状细胞活化反应的负调节因子,抑制其表达可以针对性的提高机体抗肿瘤免疫力,其主要表达在造血细胞中,如t细胞、b细胞、树突状细胞、巨噬细胞、肥大细胞、嗜中性粒细胞中。
2、在t细胞中,hpk1通过tcr信号通路调控t细胞激活方面的作用。tcr活化之后,hpk1与t细胞受体蛋白相互作用,被酪氨酸激酶zap70和lck磷酸化,同时会磷酸化slp-76受体蛋白,负调节tcr信号,从而抑制t细胞激活和增殖。研究发现hpk1可以参与许多信号级联反应,包括makp信号通路、fas诱导的细胞凋亡通路及nf-κb信号通路。而且,hpk1还能抑制ap-1,ap-1在肿瘤形成和发展中促进细胞的增殖、抑制分化、促进肿瘤细胞侵袭与转移等方面发挥作用。
3、因此,靶向hpk1的药物成为当前药物研发热点领域之一,已有品种进入临床阶段。但目前针对造血祖细胞激酶(hpk1)靶点尚未有上市药物。本发明将提供一种新型结构的小分子hpk1抑制剂,具有良好的抗肿瘤活性。
技术实现思路
1、本发明提供一种通式(i)所示的化合物、其立体异构体、互变异构体、氘代物或药用盐:
2、
3、其中,
4、l选自键、nh、o或s;
5、r1选自c3-14环烷基、3-14元杂环基、c6-18芳基或5-18元杂芳基,所述c3-14环烷基、3-14元杂环基、c6-18芳基或5-18元杂芳基任选地进一步被一个或多个ra取代;ra独立地选自h、羟基、氰基、卤素、c1-6烷基、c1-6卤代烷基、-c0-3亚烷基-orb、-oc(=o)c1-6烷基、-c0-3亚烷基-srb、-c0-3亚烷基-n(rb)2、-c0-3亚烷基-s(=o)rb、-c0-3亚烷基-s(=o)2rb、-c0-3亚烷基-srb、-c0-3亚烷基-s(rb)5、-c0-3亚烷基-c(=o)rb、-c0-3亚烷基-c(=o)orb、-c0-3亚烷基-c(=o)n(rb)2、c2-6烯基、c2-6炔基、-c0-3亚烷基-c3-14环烷基、-c0-3亚烷基-(3-14元杂环烷基)、-c0-3亚烷基-c6-18芳基或-c0-3亚烷基-(5-18元杂芳基),所述c1-6烷基、c1-6卤代烷基、c2-6烯基、c2-6炔基、-c0-3亚烷基-c3-14环烷基、-c0-3亚烷基-(3-14元杂环烷基)、-c0-3亚烷基-c6-18芳基或-c0-3亚烷基-(5-18元杂芳基)任选地进一步被一个或多个rb取代,每个rb独立地为h、卤素、羟基、氰基、c1-6烷基、c3-6环烷基或c1-6卤代烷基;
6、r2选自h、卤素、c1-6烷基、c1-6烷氧基、卤代烷基、羟基、羟基烷基、-(ch2)0-3n(rb)2、c3-14环烷基、3-14元杂环基、c6-18芳基、5-18元杂芳基、-(ch2)0-3-c3-14环烷基、-(ch2)0-3-3-14元杂环基、-(ch2)0-3-c6-18芳基、-(ch2)0-3-5-18元杂芳基、-c0-3亚烷基-c(=o)-c3-14环烷基、-c0-3亚烷基-c(=o)-3-14元杂环基、-c0-3亚烷基-c(=o)-c6-18芳基或-c0-3亚烷基-c(=o)-5-18元杂芳基,所述c1-6烷基、c1-6烷氧基、卤代烷基、羟基烷基、c3-14环烷基、3-14元杂环基、c6-18芳基、5-18元杂芳基、-(ch2)0-3-c3-14环烷基、-(ch2)0-3-3-14元杂环基、-(ch2)0-3-c6-18芳基、-(ch2)0-3-5-18元杂芳基、-c0-3亚烷基-c(=o)-c3-14环烷基、-c0-3亚烷基-c(=o)-3-14元杂环基、-c0-3亚烷基-c(=o)-c6-18芳基或-c0-3亚烷基-c(=o)-5-18元杂芳基任选进一步被一个或多个rc所取代;
7、rc独立地选自卤素、c1-6烷基、c1-6烷氧基、卤代烷基、氰基、氨基、硝基、羟基、羟基烷基、-c0-3亚烷基-c(=o)rb、-c0-3亚烷基-c(=o)n(rb)2、-(ch2)0-3n(rb)2、-o(ch2)0-3c3-14环烷基、-o(ch2)0-3-3-14元杂环基、c3-14环烷基、3-14元杂环基、c6-18芳基和5-18元杂芳基中的一个或多个取代基所取代;
8、r3选自h、c1-6烷基或卤代烷基;
9、x选自cra或n;
10、x1选自c(r4)n或nr4;
11、x2选自c(r5)n或nr5;
12、x3选自c或n;
13、n选自1或2;
14、r4选自不存在、h、卤素、c1-6烷基、c3-6环烷基或c1-6卤代烷基;
15、r5选自不存在、h、卤素、c1-6烷基、c3-6环烷基、c1-6卤代烷基,或当r2选自c3-14环烷基、3-14元杂环基、c6-14芳基、5-14元杂芳基、-(ch2)0-3-c3-14环烷基、-(ch2)0-3-3-14元杂环基、-(ch2)0-3-c6-18芳基、-(ch2)0-3-5-18元杂芳基、-c0-3亚烷基-c(=o)-c3-14环烷基、-c0-3亚烷基-c(=o)-3-14元杂环基、-c0-3亚烷基-c(=o)-c6-18芳基或-c0-3亚烷基-c(=o)-5-18元杂芳基时,其取代基rc与r5形成5-10元环烷基或杂环烷基;所述5-10元环烷基或杂环烷基被一个或多个rd所取代;
16、rd独立地选自卤素、c1-6烷基、c1-6烷氧基、卤代烷基、氰基、氨基、硝基或羟基。
17、一些实施方式中,式(i)化合物选自式(ia)或(ib)所示的化合物:
18、
19、r1、r2、r3、r5、x或l的定义同式(i)的定义。
20、一些实施方式中,式(i)中的l选自键或nh,优选为nh。
21、一些实施方式中,式(i)中的r1选自c3-14环烷基、3-14元杂环基、c6-18芳基或5-18元杂芳基,所述c3-14环烷基、3-14元杂环基、c6-18芳基或5-18元杂芳基任选地进一步被一个或多个ra取代;ra独立地选自h、羟基、氰基、卤素、c1-6烷基、c1-6卤代烷基、-c0-3亚烷基-n(rb)2、-c0-3亚烷基-c3-14环烷基、-c0-3亚烷基-(3-14元杂环烷基)、-c0-3亚烷基-c6-18芳基或-c0-3亚烷基-(5-18元杂芳基)。
22、一些实施方式中,式(i)中的r1选自所述任选地进一步被一个或多个ra取代。
23、一些实施方式中,式(i)中的r1选自
24、一些实施方式中,式(i)中的r2选自-(ch2)0-3-c3-14环烷基、-(ch2)0-3-3-14元杂环基、-(ch2)0-3-c6-18芳基、-(ch2)0-3-5-18元杂芳基、-c0-3亚烷基-c(=o)-c3-14环烷基、-c0-3亚烷基-c(=o)-3-14元杂环基、-c0-3亚烷基-c(=o)-c6-18芳基或-c0-3亚烷基-c(=o)-5-18元杂芳基,所述-(ch2)0-3-c3-14环烷基、-(ch2)0-3-3-14元杂环基、-(ch2)0-3-c6-18芳基、-(ch2)0-3-5-18元杂芳基、-c0-3亚烷基-c(=o)-c3-14环烷基、-c0-3亚烷基-c(=o)-3-14元杂环基、-c0-3亚烷基-c(=o)-c6-18芳基或-c0-3亚烷基-c(=o)-5-18元杂芳基任选进一步被一个或多个rc所取代。
25、一些实施方式中,式(i)中的r2选自所述任选进一步被一个或多个rc所取代。
26、一些实施方式中,式(i)中的r2选自
27、一些实施方式中,式(i)中的r3为h。
28、一些实施方式中,式(i)中的r4选自不存在或h。
29、一些实施方式中,式(i)中的r5选自h或c1-6烷基,优选为h或甲基。
30、一些实施方式中,式(i)中r2上的取代基rc与r5及进一步环合形成的杂芳环选自
31、一些实施方式中,式(i)化合物选自式(ia-1),
32、
33、其中,x选自ch或n;
34、所述r2选自所述任选进一步被一个或多个rc所取代,所述rc为h、卤素;
35、所述r3为h;
36、所述r5选自h或c1-6烷基,优选为h或甲基。
37、一些实施方式中,式(i)选自下列化合物、其互变异构体、氘代物或药用盐:
38、
39、本发明还提供了一种药物组合物,其中,所述药物组合物包含治疗有效量的至少一种式(i)所示的化合物、其立体异构体、互变异构体或药用盐。
40、本发明提供了结构式(i)所示化合物或其药物组合物在制备药物中的应用。
41、本发明化合物可以高效抑制hpk1蛋白功能,诱导t细胞中ifnγ等细胞因子的分泌,激活免疫系统。另一方面,该类化合物在各种属动物模型中,均具有优秀的口服吸收,在小鼠肿瘤模型上可显著抑制肿瘤细胞的生长,药效远高于目前处于临床阶段的hpk1抑制剂。其次,本发明化合物具有选择性强、毒性小、安全窗大的优点,未来有望取得更好的临床药效。
42、本发明进一步提供了所述应用的优选技术方案:
43、作为优选,所述应用为制备治疗和/或预防癌症药物中的应用。
44、作为优选,所述应用为制备用于治疗由hpk1介导的疾病的药物的应用。作为优选,所述疾病是癌症。
45、作为优选,所述癌症选自乳腺癌、多发性骨髓瘤、膀胱癌、子宫内膜癌、胃癌、宫颈癌、横纹肌肉瘤、非小细胞肺癌、小细胞肺癌、多形性肺癌、卵巢癌、食管癌、黑色素瘤、结肠直肠癌、肝细胞瘤、头颈部肿瘤、肝胆管细胞癌、骨髓增生异常综合征、恶性胶质瘤、前列腺癌、甲状腺癌、徐旺氏细胞瘤、肺鳞状细胞癌、苔藓样角化病、滑膜肉瘤、皮肤癌、胰腺癌、睾丸癌或脂肪肉瘤。
46、本发明还提供了一种治疗和/或预防疾病的方法,包括向治疗对象施用治疗有效量的至少任意一种结构式(i)所示化合物或含其的药物组合物。
47、本发明还提供了一种治疗和/或预防由hpk1介导的疾病的方法,包括向治疗对象施用治疗有效量的至少任意一种结构式(i)所示化合物或含其的药物组合物。
48、本发明还提供了一种治疗癌症的方法,包括向治疗对象施用治疗有效量的至少任意一种结构式(i)所示化合物或含其的药物组合物。
49、作为优选,在上述方法中,所述hpk1介导的疾病是癌症。
50、作为优选,在上述方法中,所述的癌症选自乳腺癌、多发性骨髓瘤、膀胱癌、子宫内膜癌、胃癌、宫颈癌、横纹肌肉瘤、非小细胞肺癌、小细胞肺癌、多形性肺癌、卵巢癌、食管癌、黑色素瘤、结肠直肠癌、肝细胞瘤、头颈部肿瘤、肝胆管细胞癌、骨髓增生异常综合征、恶性胶质瘤、前列腺癌、甲状腺癌、徐旺氏细胞瘤、肺鳞状细胞癌、苔藓样角化病、滑膜肉瘤、皮肤癌、胰腺癌、睾丸癌或脂肪肉瘤。
51、除非另有说明,所述结构通式中使用的一般化学术语具有通常的含义。
52、例如,除非另有说明,本发明所用的术语“卤素”是指氟、氯、溴或碘。
53、在本发明中,除非另有说明,“烷基”包括直链或支链的一价饱和烃基。例如,烷基包括甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、3-(2-甲基)丁基、2-戊基、2-甲基丁基、新戊基、正己基、2-己基、2-甲基戊基等。类似的,“c1-8烷基”中的“1-8”是指包含有1、2、3、4、5、6、7或8个碳原子的直链或支链形式排列的基团。
54、“烷氧基”是指前述的直链或支链烷基的氧醚形式,即-o-烷基。
55、术语“亚烷基”是指二价烷基连接基团。亚烷基在形式上是指两个c-h键替换为亚烷基与化合物其余部分的连接点的烷烃。类似的,c1-3亚烷基中的“c1-3”是指含有1、2或3个碳原子的亚烷基,包括但不限于亚甲基、1,2-亚乙基、1,3-亚丙基或1,2-亚异丙基。
56、在本发明中,“一”、“一个”、“该”、“至少一个”和“一个或多个”可互换使用。因此,例如,包含“一种”药学上可接受的赋形剂的组合物可以被解释为表示该组合物包括“一种或多种”药学上可接受的赋形剂。
57、术语“卤代烷基”是指一个或多个h已经被卤素原子置换的烷基。
58、术语“卤代烷氧基”是指-o-卤代烷基的基团。
59、术语“氧代”或“氧代基”是指呈二价取代基形式的氧原子,其与c连接时形成羰基,其与杂原子连接时形成亚砜基或砜基或n-氧化物基团。
60、本发明中,除另有说明,术语“芳香环”、“芳香族环”或“芳香族杂环”即为具有芳香族特征(具有(4n+2)个非定域π电子,其中n为整数)的多不饱和环的碳环或杂环。
61、术语“芳基”,在本发明中,除非另有说明,是指未取代或取代的包括碳环的原子的单环或稠环芳香基团。优选c6-18芳基,更优选芳基为c6-10的单环或双环的芳香环基团。优选为苯基、萘基。最优选为苯基。所述芳基环可以稠合于杂芳基、杂环基或环烷基上,其中与母体结构连接在一起的环为芳基环,非限制性实例包括但不限于苯并环戊基。
62、术语“杂环基”是指具有至少一个含有杂环子的环化烷基或环化烯基的环系统,所述杂原子选自n、o和/或s。所述杂环基可以包括单环或多环(例如具有2、3或4个稠合环、螺环、桥环等)。杂环基可以经由成环碳原子或成环杂原子与化合物其他部分相连接。优选3-14元杂环基,3-14元杂环基中的“3-14元”是指含有3-14个c、n、o或s的成环原子组成的杂环基;更优选3-8元杂环基,更更优选3-6元杂环基。其中氮或硫杂原子可以选择性地被氧化,并且氮杂原子可以选择性地被季铵化。这些杂环基的实例包括但不限于氮杂环丁烷基、吡咯烷基、哌啶基、哌嗪基、氧代哌嗪基、氧代哌啶基、四氢呋喃基、二氧戊环基、四氢咪唑基、四氢噻唑基、四氢恶唑基、四氢吡喃基、吗啉基、硫代吗啉基、硫代吗啉基亚砜、硫代吗啉基砜基和四氢恶二唑基。所述杂环基可以稠合于芳基、杂芳基或环烷基环上,其中与母体结构连接在一起的环为杂环基。
63、术语“杂芳基”,在本发明中,除非另有说明,是指具有至少一个杂原子的单环或多环(例如具有2、3或4个稠合环、螺环、桥环等)芳香族杂环,所述杂原子选自n、o和/或s,并且其中所述氮或硫杂原子可以选择性地被氧化,所述氮杂原子可以选择性地被季铵化。优选5-18元杂芳基,其中5-18元杂芳基中的“5-18元”是指含有5-18个c、n、o或s的成环原子组成的杂芳基。更优选的是5-10元杂芳基;更更优选的是5-6元杂芳基。杂芳基的实例包括但不限于噻吩基、呋喃基、咪唑基、异恶唑基、恶唑基、吡唑基、吡咯基、噻唑基、噻二唑基、三唑基、吡啶基、哒嗪基、吲哚基、氮杂吲哚基、吲唑基、苯并咪唑基、苯并呋喃基、苯并噻吩基、苯并异恶唑基、苯并噻唑基、苯并噻唑基、苯并噻二唑基、苯并三唑基腺嘌呤、喹啉基或异喹啉基。所述杂芳基可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环。
64、术语“环烷基”是指具有至少一个环化烷基的环系统。优选c3-14环烷基,其中的“c3-14”是指环烷基可以具有3、4、5、6、7、8、9、10、11、12、13或14个成环原子。环烷基可以包括单环和多环(例如具有2、3或4个稠合环、螺环、桥环等)。一些实施例中环烷基包括但不限于环丙基、环丁基、环戊基等;所述环烷基还可以稠合于芳基、杂环基或杂芳基环上,其中与母体结构连接在一起的环为环烷基。
65、术语“取代的”是指基团中的一个或多个氢原子分别被相同的或者不同的取代基所取代。典型的取代基包括但不限于卤素(f、cl、br或i)、c1-8烷基、c3-12环烷基、-or1、-sr1、=o、=s、-c(o)r1、-c(s)r1、=nr1、-c(o)or1、-c(s)or1、-nr1r2、-c(o)nr1r2、氰基、硝基、-s(o)2r1、-o-s(o2)or1、-o-s(o)2r1、-op(o)(or1)(or2);其中r1和r2独立地选自-h、c1-6烷基、c1-6卤代烷基或c3-6环烷基。在一些实施例中,取代基独立地选自包含-f、-cl、-br、-i、-oh、三氟甲氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、-sch3、-sc2h5、甲醛基、-c(och3)、氰基、硝基、-cf3、-ocf3、氨基、二甲基氨基、甲硫基、磺酰基和乙酰基的基团。
66、取代烷基的实例包括但不限于2,3-二羟基丙基、2-氨基乙基、2-羟乙基、五氯乙基、三氟甲基、甲氧基甲基、五氟乙基、苯基甲基、二恶茂基甲基和哌嗪基甲基。
67、取代烷氧基的实例包括但不限于2-羟基乙氧基、2-氟乙氧基、2,2-二氟乙氧基、2-甲氧基乙氧基、2-氨基乙氧基、2,3-二羟基丙氧基、环丙基甲氧基、氨基甲氧基、三氟甲氧基、2-二术语“药用盐”是指从药学上可接受的无毒的碱或酸制备的盐。
68、当一个连接基团的数量为0时,比如-(ch2)0-表示该连接基团为键,(r3)0表示该位置没有r3取代,(r5)0表示该位置没有r5取代。
69、术语“药用盐”是指从药学上可接受的无毒的碱或酸制备的盐。
70、当本发明提供的化合物是酸时,可以从药学上可接受的无毒的碱,包括无机碱和有机碱,方便地制得其相应的盐。从无机碱衍生的盐包括铝、铵、钙、铜(高价和低价)、三价铁、亚铁、锂、镁、锰(高价和低价)、钾、钠、锌之类的盐。特别优选铵、钙、镁、钾和钠的盐。能够衍生成药学上可接受的盐的无毒有机碱包括伯胺、仲胺和叔胺,也包括环胺及含有取代基的胺,如天然存在的和合成的含取代基的胺。能够成盐的其他药学上可接受的无毒有机碱,包括离子交换树脂以及精氨酸、甜菜碱、咖啡因、胆碱、n',n'-二苄乙二胺、二乙胺、2-二乙氨基乙醇、2-二甲胺基乙醇、乙醇胺、乙二胺、n-乙基吗啉、n-乙基哌啶、还原葡萄糖胺、氨基葡萄糖、组氨酸、异丙胺、赖氨酸,甲基葡萄糖胺、吗啉、哌嗪、哌啶、多胺树脂、普鲁卡因、氯普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺、氨丁三醇等。
71、当本发明提供的化合物是碱时,可以从药学上可接受的无毒的酸,包括无机酸和有机酸,方便制得其相应的盐。这样的酸包括,如,醋酸、苯磺酸、苯甲酸、樟脑磺酸、柠檬酸、乙磺酸、甲酸、富马酸、葡萄糖酸、谷氨酸、氢溴酸、盐酸、羟乙磺酸、乳酸、马来酸、苹果酸、扁桃酸、甲磺酸、黏酸、硝酸、扑酸、泛酸、磷酸、琥珀酸、硫酸、草酸、丙酸、乙醇酸、氢碘酸、高氯酸、环己氨磺酸、水杨酸、2-萘磺酸、糖精酸、三氟乙酸、酒石酸和对甲苯磺酸等。较优地,柠檬酸、氢溴酸、甲酸、盐酸、马来酸、磷酸、硫酸和酒石酸。更优地,甲酸和盐酸。
72、本发明化合物的药物前体包含在本发明的保护范围内。通常,所述药物前体是指很容易在体内转化成所需化合物的功能性衍生物。例如,本技术化合物的任何药学上可接受的盐、酯、酯的盐或其它衍生物,其在向受体施用后能够直接或间接地提供本技术的化合物或其具有药学活性的代谢物或残基。
73、本发明所述化合物可能含有一个或多个不对称中心,并可能由此产生非对映异构体和光学异构体。本发明包括所有可能的非对映异构体及其外消旋混合物、其基本上纯的拆分对映异构体、所有可能的几何异构体及其药用盐。
74、当式(i)所示化合物存在互变异构体时,除非特别声明,本发明包括任何可能的互变异构体和其药用盐,及它们的混合物。
75、当式(i)所示化合物用较重的同位素(例如氘)替代可能提供某些治疗优势,这是由于更大的代谢稳定性,例如增加体内半衰期或减少剂量要求。
76、术语“药物组合物”是指一种或多种本技术的化合物或其药用盐与药学上可接受的辅料组成的混合物。药物组合物的目的是有利于对有机体给予本技术的化合物。
77、在本发明中,“一”、“一个”、“该”、“至少一个”和“一个或多个”可互换使用。因此,例如,包含“一种”药学上可接受的辅料组成的混合物可以被解释为表示该药物组合物包括“一种或多种”药学上可接受的辅料。
78、术语“药学上可接受的辅料”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的那些辅料。合适的辅料是本领域技术人员熟知的,例如碳水化合物、蜡、水溶性和/或水可膨胀的聚合物、亲水性或疏水性材料、明胶、油、溶剂、水等。
79、本发明的药物组合物可通过将本技术的化合物与适宜的药学上可接受的辅料组合而制备,例如可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等。
80、给予本发明化合物或其药用盐或其药物组合物的典型途径包括但不限于口服、直肠、局部、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。
81、术语“治疗”一般是指获得需要的药理和/或生理效应。该效应根据部分或完全稳定或治愈疾病和/或由于疾病产生的副作用,可以是治疗性的。本文使用的“治疗”涵盖了对患者疾病的任何治疗,包括:(a)抑制疾病的症状,即阻止其发展;或(b)缓解疾病的症状,即,导致疾病或症状退化。
82、术语“有效量”意指(i)治疗或预防特定疾病、病况或障碍,(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状,或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的本技术化合物的用量。构成“治疗有效量”的本技术化合物的量取决于该化合物、疾病状态及其严重性、给药方式以及待被治疗的哺乳动物的年龄而改变,但可例行性地由本领域技术人员根据其自身的知识及本公开内容而确定。
83、合成方案1:
84、
85、步骤i:化合物i-1在pa催化剂如pd2(dba)3的作用下,经过buchwald偶联反应得到化合物i-2;
86、步骤ii:化合物i-2与在pa催化剂如pd2(dba)3的作用下进行硼酯化得到i-3;
87、步骤iii:化合物i-3与在金属催化剂如xphos-pd-g2或pdcl2(dppf)作用下,经过suzuki偶联反应引入即可得到化合物i,其中p为cl、br或i。
88、为使上述内容更清楚、明确,本发明将用以下实施例来进一步阐述本发明的技术方案。以下实施例仅用于说明本发明的具体实施方式,以使本领域的技术人员能够理解本发明,但不用于限制本发明的保护范围。本发明的具体实施方式中,未作特别说明的技术手段或方法等为本领域的常规技术手段或方法等。
89、除非另有说明,本发明所有的温度均指摄氏度。
90、实施例中使用了下列缩略语:
91、dmf:n,n-二甲基甲酰胺;
92、nbs:n-溴代丁二酰亚胺;
93、thf:四氢呋喃;
94、[pdcl2(dppf)]:[1,1'-双(二苯基膦)二茂铁]二氯化钯;
95、[pdcl2(dppf)]ch2cl2:[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷复合物;
96、ea:乙酸乙酯;
97、pe:石油醚;
98、dcm:二氯甲烷;
99、meoh:甲醇;
100、pd2(dba)3:三(二亚苄基丙酮)二钯;
101、xphos:2-二环己基磷-2,4,6-三异丙基联苯;
102、sphos:2-双环己基磷-2',6'-二甲氧基联苯;
103、bpo:过氧化(二)苯甲酰;
104、dmap:4-二甲氨基吡啶;
105、mscl:甲烷磺酰氯;
106、aibn:偶氮二异丁腈;
107、lda:二异丙基胺基锂;
108、xphos-pd-g2:氯(2-二环己基膦基-2',4',6'-三异丙基-1,1'-联苯基)[2-(2'-氨基-1,1'-联苯)]钯(ii);
109、tbaf:四丁基氟化铵;
110、lihmds:双三甲基硅基胶基锂;
111、tmscl:三甲基氯硅烷;
112、xantphos:4,5-双二苯基膦-9,9-二甲基氧杂蒽;
113、dioxane:二氧六环;
114、pd(oac)2:醋酸钯;
115、pcy3*hbf4:三环己基膦氟硼酸盐。
116、中间体m1的合成:
117、
118、步骤1:化合物m1-1的合成
119、在室温下,将3-氯-2-甲基苯甲酸(200.00g),碳酸钾(405.09g)加入到dmf(1300.00ml)中,在冰水浴下滴加碘甲烷(80.28ml),在室温下反应16h。向反应液中加入2000ml水,用1000ml ea萃取,重复3次,合并有机相,用饱和氯化钠水溶液洗涤六次,无水硫酸钠干燥,过滤,浓缩得到目标产物m1-1(213.00g,产率98.41%)。
120、步骤2:化合物m1-2的合成
121、在室温下,将化合物m1-1(103.00g),nbs(109.22g),bpo(2.70g)加入到氯仿(700.00ml)中,在90℃反应16h。向反应液中加入1000ml水,用1000ml dcm萃取,重复3次,合并有机相,用饱和氯化钠水溶液洗涤3次,无水硫酸钠干燥,过滤,浓缩得到目标产物m1-2(145.00g,产率98.63%)。
122、步骤3:化合物m1-3的合成
123、在冰水浴下,将化合物m1-2(350.00g)加到胺的甲醇(7m,1000.00ml)溶液中,在冰水浴下,反应1h。将反应液浓缩干,用水洗涤3次,烘干得到目标产物m1-3(213.80g,产率96.05%)。esi-ms m/z:167.9[m+h]+。
124、步骤4:化合物m1-4的合成
125、在室温下,将化合物m1-3(100.00g)加到浓硫酸(600.00ml)中,冰水浴条件下,滴加硝酸(50.00ml),在冰水浴下搅拌1h,再在室温下搅拌1h。将反应液缓慢倒入冰水中,过滤,用水洗涤滤饼三次,将滤饼烘干得到目标产物m1-4(116.08g,产率91.51%)。esi-ms m/z:213.0[m+h]+。
126、步骤5:化合物m1-5的合成
127、将化合物m1-4(244.00g)、氯化铵(368.68g)加入到乙醇(2500.00ml)和水(500.00ml)中,在65℃分批加入铁粉(320.51g),在65℃反应2h。将反应液趁热过滤,滤饼用ea洗涤六次,滤液浓缩,加入水产物析出,过滤,把滤饼用水洗涤3次,烘干,再用pe/ea=3/1打浆,过滤,烘干得到目标产物m1-5(162.00g,产率77.29%)。esi-ms m/z:183.0[m+h]+。
128、步骤6:化合物m1-6的合成
129、将化合物m1-5(129.00g)加入溴化氢(48%的水溶液,900.00ml)中,在-10℃下滴加亚硝酸钠(77.11g)的水(600.00ml)溶液,在-10℃下反应1h,再在室温下反应1h。将反应液倒入冰水中,产物析出,过滤,用水洗涤3次,烘干滤饼得到目标产物m1-6(143.00g,产率82.12%)。esi-ms m/z:247.9[m+h]+。
130、步骤7:化合物m1的合成
131、将化合物m1-6(143.00g)、dmap(7.09g)加入到thf(1300.00ml)中,在冰水浴下滴加二碳酸二叔丁酯(boc2o)(159.94ml),在室温下反应1h。将反应液加到水(1000.00ml)中淬灭,用8000ml ea萃取,重复3次,合并有机相,用饱和氯化钠水溶液洗涤3次,无水硫酸钠干燥,过滤,浓缩,用pe打浆,过滤,把滤饼烘干得到目标产物m1(185.00g,产率92.00%)。esi-ms m/z:289.9[m+h]+。
132、中间体m2的合成:
133、
134、步骤1:化合物m2-2的合成
135、在冰浴条件下,将二甲胺(2m/thf)(130.43ml)缓慢加至m2-1(40.00g)的thf(200ml)溶液中,室温下搅拌半小时,在冰浴下分批缓慢加入三乙酰氧基硼氢化钠(55.28g),室温反应过夜。将反应液过滤,滤液减压浓缩,柱层析纯化(pe:ea=20:1),得到化合物m2-2(30.38g,67%产率)。esi-ms m/z:259.0[m+h]+。
136、步骤2:化合物m2-3的合成
137、在室温下,将pdcl2(dppf)(8.58g)加至m2-2(30.38g),3,6-二氢-2h-吡喃-4-硼酸频哪醇酯(27.09g)和碳酸钾(48.61g)的dioxane(300ml)与水(60ml)的混合溶液中,置换氮气,升温至100℃,搅拌5小时。冷却反应液,加水稀释,用ea萃取,合并有机层,用饱和食盐水洗涤,经无水硫酸钠干燥,过滤,减压浓缩,柱层析纯化(pe:ea=10:1),得到化合物m2-3(30.00g,98%产率)。esi-ms m/z:263.2[m+h]+。
138、步骤3:化合物m2的合成
139、在室温下,将m2-3(30.00g)溶于乙醇(300ml),加入钯碳(1.22g),置换氢气,室温下搅拌2小时。将反应液过滤,滤液浓缩。将残余物溶于乙醇(300ml),加入钯碳(3.57g)和氢氧化钯(1.57g),置换氢气,升温至40℃,搅拌1小时。将反应液过滤,滤液浓缩,柱层析纯化(dcm:meoh=20:1),得到化合物m2(13.00g,50%产率)。esi-ms m/z:235.3[m+h]+。
140、中间体m3的合成:
141、
142、步骤1:化合物m3-1的合成
143、在室温下,将化合物m2(5.50g),m1(8.10g),xantphos(2.70g),pd2(dba)3(2.14g),碳酸铯(19.04g)加入到1,4-二氧六环(130ml)中,然后n2保护条件下,90℃反应2h,停止反应。反应液加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(dcm:meoh=19:1)分离得到目标产物m3-1(9.00g,产率76.79%)。esi-ms m/z:500.2[m+h]+。
144、步骤2:化合物m3的合成
145、在室温下,将化合物m3-1(9.00g),联硼酸频那醇酯(9.12g),pd2(dba)3(1.64g),sphos(1.47g),乙酸钾(5.29g)加入到1,4-二氧六环(130ml)中,然后n2保护条件下,90℃反应18h,停止反应。反应液趁热过滤,滤液重结晶得到目标产物m3(4.79g,产率45.01%)。esi-ms m/z:593.5[m+h]+。
146、中间体m4的合成:
147、
148、步骤1:化合物m4-1的合成
149、在室温下,将6-氨基吡啶-2-羧酸甲酯(10.00g)溶于acn(150ml)中,室温条件下,分批次加入nbs(12.87g),室温反应1h,停止反应。用10%的硫代硫酸钠溶液淬灭反应,旋蒸除去大部分溶剂,加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经pe/ea=3:1打浆,得到目标产物m4-1(10.52g,产率69.28%)。esi-ms m/z:231.2[m+h]+。
150、步骤2:化合物m4-2的合成
151、在室温下,将化合物m4-1(10.52g),二碳酸二叔丁酯(23.85g),dmap(1.11g)溶于thf(150ml)中,70℃反应3h,停止反应。旋蒸除去大部分溶剂,加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经柱层析(pe:ea=9:1)分离得到目标产物m4-2(13.50g,产率68.75%)。esi-ms m/z:431.1[m+h]+。
152、步骤3:化合物m4-3的合成
153、在室温下,将化合物m4-2(6.00g),3-呋喃硼酸(3.11g),双三苯基膦二氯化钯(490mg),磷酸钾(8.86g)溶于1,4-二氧六环(60ml)和水(15ml)中,然后n2保护条件下,90℃反应20min,停止反应。反应液加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(pe:ea=5:1)分离得到目标产物m4-3(5.72g,产率98.26%)。esi-ms m/z:418.1[m+h]+。
154、步骤4:化合物m4-4的合成
155、在室温下,将化合物m4-3(5.62g),10%湿pd(oh)2(7.92g),甲酸铵(3.39g),醋酸(3.3ml)溶于meoh(35ml)和thf(30ml)中,然后h2置换,40℃反应48h,停止反应。将反应液加硅藻土过滤,向反应液中加入饱和碳酸氢钠溶液,然后再用ea萃取3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到目标产物产物m4-4(5.43g,产率95.70%)。esi-ms m/z:423.1[m+h]+。
156、步骤5:化合物m4-5的合成
157、在室温下,将化合物m4-4(5.32g)溶于etoh(60.00ml)中,分批次加入硼氢化钠(2.86g),40℃反应3h,停止反应。加水淬灭反应,旋蒸除去乙醇,用dcm萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩得到目标产物m4-5(3.70,产率99.82%)。esi-ms m/z:295.1[m+h]+。
158、步骤6:化合物m4-6的合成
159、在室温下,将化合物m4-5(3.70g)溶于dcm(40.00ml)中,冰浴条件下缓慢滴加dipea(4.99g),保温反应10min,然后缓慢滴加mscl(2.21g),后移至室温反应1h,停止反应。加水淬灭反应,用dcm萃取3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到亮黄色液体粗品产物。之后将该粗品产物(2.63g)溶于acn(30.00ml)中,加入dipea(4.11g),二甲胺盐酸盐(1.15g),70℃反应2h,停止反应。浓缩除去大部分溶剂,加入水,用dcm萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经柱层析(pe:ea=3:1)分离得到目标产物产物m4-6(1.80g,产率79.31%)。esi-ms m/z:322.3[m+h]+。
160、步骤7:化合物m4的合成
161、在室温下,将化合物m4-6(1.80g)溶于dcm(20.00ml)中,冰浴条件下缓慢滴加tfa(8.44g),后移至室温反应3h,停止反应。旋蒸除去大部分溶剂,加入dcm稀释,用饱和碳酸氢钠溶液调节ph至8~9,用dcm萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩得到目标产物m4(880mg,产率75.18%)。esi-ms m/z:222.3[m+h]+。
162、中间体m5的合成:
163、
164、步骤1:化合物m5-1的合成
165、在室温下,将2-氯-3-甲基-5-溴吡啶(5.00g)溶于thf(50ml)中,然后n2保护条件下,-78℃条件下缓慢滴加lda(14.53ml,2m),保温反应40min,后缓慢通入co2,然后缓慢升至室温反应40min,停止反应。用饱和碳酸氢钠溶液淬灭反应,加入ea,分液,保留水相,有机相用水反萃2次,合并水相,用hcl调节ph至4,再用dcm/i-proh=3:1萃取5次,合并有机相,无水硫酸钠干燥,有机相浓缩得到状目标产物m5-1(2.83g,产率46.66%)。esi-ms m/z:250.5[m+h]+。
166、步骤2:化合物m5-2的合成
167、在室温下,将化合物m5-1(2.83g)溶于dmf(30ml)中,加入碳酸钾将(3.12g),氮气保护条件下缓慢滴加ch3i(2.41g),后室温反应16h,停止反应。加水淬灭反应,用ea萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经柱层析(pe:ea=20:1)分离得到目标产物m5-2(1.80g,产率60.23%)。esi-ms m/z:265.5[m+h]+。
168、步骤3:化合物m5-3的合成
169、在室温下,将化合物m5-2(1.50g)溶于ccl4(20ml)中,加入nbs(2.02g),aibn(90.00mg),氮气保护条件下,80℃反应16h,停止反应。加水淬灭反应,用dcm萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经柱层析(pe:ea=20:1)分离得到目标产物m5-3(1.80g,产率92.30%)。esi-ms m/z:344.4[m+h]+。
170、步骤4:化合物m5-4的合成
171、在室温下,将化合物m5-3(1.80g)溶于胺甲醇(20ml)中,室温反应2h,停止反应。反应液过滤,滤饼用甲醇洗涤,干燥得到状目标产物m5-4(1.28g,产率98.52%)。esi-ms m/z:397.2[m+h]+。
172、步骤5:化合物m5的合成
173、在室温下,将化合物m5-4(1.28g)溶于1,4-二氧六环(60ml)中,加入dmap(70mg),后缓慢滴加二碳酸二叔丁酯(1.40g),室温反应2h,停止反应。加水淬灭反应,用ea萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经柱层析(pe:ea=20:1)分离得到目标产物m5(1.57g,产率87.75%)。esi-ms m/z:347.3[m+h]+。
174、中间体m6的合成:
175、
176、在室温下,将化合物m4(254.67mg),m6(400.00mg),xantphos(66.60mg),pd2(dba)3(52.65mg),碳酸钾(477.16mg)加入到甲苯(8ml)中,然后n2保护条件下,90℃反应2h,停止反应。反应液加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(dcm:meoh=19:1)分离得到目标产物m6(425.00mg,产率75.68%)。esi-ms m/z:487.5[m+h]+。
177、中间体化合物m7合成
178、
179、步骤1:化合物m7-2的合成
180、在氮气保护和-78℃条件下,30分钟内向m7-1(1g)的thf(10ml)溶液中滴加lihmds(4.95ml,1m/thf),搅拌30分钟后加入tmscl(0.66ml),搅拌5分钟,在30分钟内滴加lihmds(9.67ml,1m/thf),升温至-30℃至-20℃,搅拌30分钟,加入双(2-溴乙基)醚(1.09g),逐渐升温至室温,搅拌过夜。将反应液用饱和氯化铵溶液淬灭,减压浓缩除去部分溶剂,用ea萃取,合并有机层,依次用1m hcl、水和饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,柱层析纯化(pe:ea=70:30-65:35),得到化合物m7-2(246mg,18%产率)。esi-ms m/z:281.99[m+h]+。
181、步骤2:化合物m7-3的合成
182、冰浴下,向m7-2的meoh(6ml)和thf(2ml)溶液中分批加入硼氢化钠(99mg),撤去冰浴,常温反应1小时。加水淬灭,减压浓缩除去部分溶剂,ea萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,得到化合物m7-3(217mg,88%产率)。esi-ms m/z:283.98[m+h]+。
183、步骤3:化合物m7-4的合成
184、冰浴下,向m7-3的dcm(5ml)溶液中滴加氯化亚砜(0.28ml),撤去冰浴,升温至40℃,反应1小时。减压浓缩,加少量甲醇溶解,用饱和碳酸氢钠溶液调ph至碱性,ea萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,柱层析纯化(pe:ea=85:15),得到化合物m7-4(148mg,64%产率)。esi-ms m/z:301.96[m+h]+。
185、步骤4:化合物m7-5的合成
186、常温下,将m7-4(148mg),碳酸钾(203mg)和碘化钾(16mg)溶于乙腈(5ml),加入二甲胺(2.45ml,2m/thf),升温至80℃,反应3小时。冷却,抽滤,滤液减压浓缩,柱层析纯化(dcm:meoh=95:5),得到化合物m7-5(85mg,56%产率)。esi-ms m/z:311.02[m+h]+。
187、步骤5:化合物m7-6的合成
188、常温下,将m7-5(85mg),二苯甲酮亚胺(59mg),pd2(dba)3(25mg),xantphos(32mg)和碳酸铯(267mg)溶于1,4-dioxane(5ml),置换氮气,升温至100℃,反应6小时。冷却,抽滤,滤液减压浓缩,柱层析纯化(dcm:meoh=92:8),得到化合物m7-6(86mg,77%产率)。esi-msm/z:412.25[m+h]+。
189、步骤6:化合物m7的合成
190、常温下,将m7-6(86mg)溶于meoh(2ml),加入盐酸(0.52ml,4m/1,4-dioxane),升温至50℃,反应1小时。冷却,减压浓缩,加少量甲醇溶解,用饱和碳酸氢钠溶液调ph至碱性,ea萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,柱层析纯化(pe:ea=92:8,1‰氨水),得到化合物m7(45mg,87%产率)。esi-ms m/z:248.15[m+h]+。
191、实施例1:化合物4-(5-苯甲酰基-1-甲基-1h-吡唑-4-基)-7-(6-(二甲氨基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)异吲哚-1-酮的合成
192、
193、步骤1:化合物1-1的合成
194、在室温下,将1-甲基吡唑(1.0g),加入到四氢呋喃(25.00ml)中,然后n2保护条件下,-78℃缓慢滴加入正丁基锂(5.4ml)(2.5m)反应体系中,回温至室温,保温反应1.5h,冰水浴条件下,滴加入溶于四氢呋喃(5.0ml)的苯乙酰氯(1.88g),室温反应12h,停止反应。向反应液中加入20ml h2o和20ml ea,然后再用ea 20ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(pe:ea=90:10~1:1)分离得到目标产物1-1(1.0g,产率44.09%)。esi-msm/z:187.21[m+h]+。
195、步骤2:化合物1-2的合成
196、在室温下,将化合物1-1(0.80g),碳酸钾(1.78g)加入到氯仿(30.00ml),然后n2保护条件下,缓慢分批次加入icl(2.09g),室温反应12h。向反应液中加入20ml饱和硫代硫酸钠溶液,然后再用dcm 40ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品柱层析(pe:ea=95:5~80:20)分离得到目标产物1-2(0.8g,产率59.66%)。esi-ms m/z:313.31[m+h]+。
197、步骤3:化合物1-3的合成
198、在室温下,将化合物1-2(63.23mg),中间体m3(100.00mg),[pdcl2(dppf)]ch2cl2(13.80mg),碳酸钠(53.67mg)加入到1,4-二氧六环(4.00ml)和水(0.50ml)中,然后n2保护条件下,80℃反应1h,停止反应。将反应液加硅藻土过滤,向反应液中加入10ml h2o和10mlea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到目标产物1-3(100.00mg,产率91.03%)。esi-ms m/z:651.23[m+h]+。
199、步骤4:化合物1的合成
200、在室温下,将化合物1-3(100.00mg)加入到二氯甲烷(5.00ml)中,然后n2保护条件下,冰水浴加入三氟乙酸(1.50ml),室温反应1h,停止反应。旋蒸除去反应溶剂,向反应液中加入10ml h2o和10ml dcm,然后加入naoh调节ph>12,然后再用dcm 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到粗品,粗品层析板(dcm:meoh(7m-nh3)=12:1)分离得到目标产物1(22.70mg,产率33.54%)。esi-ms m/z:551.43[m+h]+。1h nmr(500mhz,dmso-d6)δ9.74(s,1h),8.77(s,1h),8.20(d,j=8.6hz,1h),7.90(s,1h),7.59(t,j=9.8hz,3h),7.40(d,j=7.6hz,1h),7.24(t,j=7.6hz,2h),6.90(d,j=8.6hz,1h),6.78(d,j=8.3hz,1h),4.38(s,2h),3.98(s,3h),3.94(d,j=10.7hz,3h),3.47-3.40(m,4h),3.16-3.10(m,1h),2.17(s,6h),1.67-1.60(m,4h)。
201、实施例2:化合物4-(1-苄基-2-甲基-1h-咪唑-5-基)-7-(6-(二甲氨基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)异吲哚-1-酮的合成
202、
203、步骤1:化合物2-1的合成
204、在室温下,将2-甲基咪唑(1.0g),加入到四氢呋喃(15.00ml)中,然后n2保护条件下,冰水浴分批加入钠氢(0.63g)(60%)反应体系中,回温至室温,保温反应1h,将苄溴(3.12g)加入其中,升温至50℃反应1h,停止反应。向反应液中加入20ml h2o淬灭反应,然后再用ea 20ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=96:4~90:10)分离得到目标产物2-1(1.8g,产率85.81%)。esi-ms m/z:173.24[m+h]+。
205、步骤2:化合物2-2的合成
206、在室温下,将化合物2-1(1.80g),加入到二氯甲烷(50.00ml),然后n2保护条件下,缓慢分批次加入nbs(2.05g),室温反应1h。向反应液中加入20ml h2o淬灭反应,然后再用dcm 30ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品经柱层析(pe:ea=95:5~50:50)分离得到目标产物2-2(1.0g,产率38.10%)。esi-ms m/z:251.12,253.14[m+h]+。
207、步骤3:化合物2-3的合成
208、在室温下,将化合物2-2(35.38mg),中间体m3(70.00mg),xphos-pd-g2(9.28mg)、xphos(2.81mg)、k3po4(75.21mg)加入到1,4-二氧六环(4.00ml)和水(0.50ml)中,然后n2保护条件下,90℃反应1h,停止反应。将反应液加硅藻土过滤,向反应液中加入10ml h2o和10ml ea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到目标产物2-3(60.00mg,产率79.78%)。esi-ms m/z:637.53[m+h]+。
209、步骤4:化合物2的合成
210、在室温下,将化合物2-3(60.00mg)加入到二氯甲烷(5.00ml)中,然后n2保护条件下,冰水浴加入三氟乙酸(1.50ml),室温反应1h,停止反应。旋蒸除去反应溶剂,向反应液中加入10ml h2o和10ml dcm,然后加入naoh调节ph>12,然后再用dcm 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到粗品,粗品层析板(dcm:meoh(7m-nh3)=12:1)分离得到目标产物2(35.3mg,产率69.83%)。esi-ms m/z:537.46[m+h]+。1h nmr(500mhz,dmso-d6)δ9.87(s,1h),8.70(s,1h),8.50(d,j=8.0hz,1h),7.63(d,j=8.4hz,1h),7.29-7.26(m,3h),7.25–7.18(m,1h),7.03(s,1h),6.90(d,j=8.4hz,1h),6.85–6.80(m,2h),5.13(s,2h),4.17(s,2h),3.95(dd,j=10.5,3.9hz,2h),3.59(s,2h),3.44-3.40(m,2h),3.16-3.10(m,1h),2.27(s,9h),1.72-1.57(m,4h)。
211、实施例3:化合物7-(6-(二甲氨基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)-4-(5-(4-氟苯基)-1-甲基-1h-吡唑-4-基)异吲哚-1-酮的合成
212、
213、步骤1:化合物3-1的合成
214、在室温下,将5-溴-1-甲基吡唑(0.4g),对氟苯硼酸(0.45g),[pdcl2(dppf)]ch2cl2(0.2g),碳酸钾(1.03g)加入到1,4-二氧六环(5.00ml)和水(2.50ml)中,然后n2保护条件下,90℃反应1h,停止反应。向反应液中加入10ml h2o和10ml ea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到目标产物3-1(0.42g,产率95.96%)。esi-ms m/z:177.23[m+h]+。
215、步骤2:化合物3-2的合成
216、在室温下,将化合物3-1(0.42g),加入到二氯甲烷(10.00ml),然后n2保护条件下,缓慢分批次加入nbs(0.57g),室温反应1h。向反应液中加入20ml h2o淬灭反应,然后再用dcm 30ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品柱层析(pe:ea=95:5~50:50)分离得到目标产物3-2(0.57g,产率88.36%)。esi-ms m/z:255.12,257.14[m+h]+。
217、步骤3:化合物3-3的合成
218、在室温下,将化合物3-2(55.97mg),中间体m3(100.00mg),[pdcl2(dppf)]ch2cl2(13.80mg),碳酸钠(53.67mg)加入到1,4-二氧六环(4.00ml)和水(0.50ml)中,然后n2保护条件下,90℃反应1h,停止反应。将反应液加硅藻土过滤,向反应液中加入10ml h2o和10mlea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到目标产物3-3(80.00mg,产率73.97%)。esi-ms m/z:641.37[m+h]+。
219、步骤4:化合物3的合成
220、在室温下,将化合物3-3(60.00mg)加入到二氯甲烷(5.00ml)中,然后n2保护条件下,冰水浴加入三氟乙酸(1.50ml),室温反应1h,停止反应。浓缩除去反应溶剂,向反应液中加入10ml h2o和10ml dcm,然后加入naoh调节ph>12,然后再用dcm 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到粗品,粗品层析板(dcm:meoh(7m-nh3)=12:1)分离得到目标产物3(44.00mg,产率65.16%)。esi-ms m/z:541.28[m+h]+。1h nmr(500mhz,dmso-d6)δ9.84(s,1h),8.64(s,1h),8.40(d,j=8.5hz,1h),7.76(s,1h),7.60(d,j=8.5hz,1h),7.45-7.37(m,2h),7.35-7.26(m,2h),7.03(d,j=8.5hz,1h),6.85(d,j=8.4hz,1h),4.09(s,2h),3.98-3.92(m,2h),3.78(s,3h),3.55-3.47(m,2h),3.44-3.38(m,2h),3.18-3.12(m,1h),2.19(s,6h),1.70-1.57(m,4h)。
221、实施例4:化合物7-(6-(二甲氨基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)-4-(1-(4-氟苯基)-2-甲基-1h-咪唑-5-基)异吲哚-1-酮的合成
222、
223、步骤1:化合物4-1的合成
224、在室温下,将2-甲基咪唑(500.00mg),氧化亚铜(51.14mg),对氟苯硼酸(352.08mg)加入到甲醇(10.00ml)中,然后敞口室温反应2h,停止反应。反应液浓缩得到粗品,粗品经柱层析(pe:ea=90:10~40:60)分离得到目标产物4-1(400.00mg,产率63.53%)。esi-ms m/z:177.18[m+h]+。
225、步骤2:化合物4-2的合成
226、在室温下,将化合物4-1(400.00mg),加入到二氯甲烷(15.00ml),然后n2保护条件下,缓慢分批次加入nbs(383.87mg),室温反应1h。向反应液中加入20ml h2o淬灭反应,然后再用dcm 30ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品经柱层析(pe:ea=95:5~50:50)分离得到目标产物4-2(420.00mg,产率72.52%)。esi-ms m/z:255.14,257.23[m+h]+。
227、步骤3:化合物4-3的合成
228、在室温下,将化合物4-2(51.68mg),中间体m3(100.00mg),xphos-pd-g2(13.30mg)、xphos(4.00mg)、k3po4(107.49mg)加入到1,4-二氧六环(4.00ml)和水(0.50ml)中,然后n2保护条件下,90℃反应1h,停止反应。将反应液加硅藻土过滤,向反应液中加入10ml h2o和10ml ea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到目标产物4-3(80.00mg,产率73.97%)。esi-ms m/z:641.53[m+h]+。
229、步骤4:化合物4的合成
230、在室温下,将化合物4-3(80.00mg)加入到二氯甲烷(5.00ml)中,然后n2保护条件下,冰水浴加入三氟乙酸(1.50ml),室温反应1h,停止反应。浓缩除去反应溶剂,向反应液中加入10ml h2o和10ml dcm,然后加入naoh调节ph>12,然后再用dcm 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到粗品,粗品层析板(dcm:meoh(7m-nh3)=12:1)分离得到目标产物4(44.70mg,产率66.20%)。esi-ms m/z:541.43[m+h]+。1h nmr(500mhz,dmso-d6)δ9.84(s,1h),8.76(s,1h),8.29(d,j=8.6hz,1h),7.60(d,j=8.5hz,1h),7.54–7.46(m,2h),7.41-7.36(m,1h),7.31(td,j=7.7,1.4hz,1h),7.20(s,1h),6.84(d,j=8.5hz,1h),6.81(d,j=13.1hz,1h),4.43(d,j=18hz,1h),4.30(d,j=18hz,1h),3.97–3.90(m,2h),3.54-3.47(m,2h),3.41-3.38(m,2h),3.15-3.09(m,1h),2.18(s,9h),1.70–1.55(m,4h).
231、实施例5:化合物7-(6-(二甲氨基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)-4-(1-苯基-1h-咪唑-5-基)异吲哚-1-酮的合成
232、
233、步骤1:化合物5-1的合成
234、在室温下,将1-苯基咪唑(1.0g),加入到四氢呋喃(25.00ml)中,然后n2保护条件下,-78℃缓慢滴加入正丁基锂(3.05ml)(2.5m)反应体系中,回温至室温,保温反应1.5h,冰水浴条件下,滴加入溶于四氢呋喃(5.0ml)的tbscl(1.15g),室温反应12h,停止反应。向反应液中加入20ml h2o和20ml ea,然后再用ea 20ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(pe:ea=90:10~1:1)分离得到目标产物5-1(1.0g,产率55.79%)。esi-ms m/z:259.32[m+h]+。
235、步骤2:化合物5-2的合成
236、在室温下,将化合物5-1(1.00g),加入到二氯甲烷(40.00ml),然后n2保护条件下,缓慢分批次加入nbs(0.76g),室温反应1h。向反应液中加入20ml h2o淬灭反应,然后再用dcm 30ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品柱层析(pe:ea=95:5~50:50)分离得到目标产物5-2(0.88g,产率67.42%)。esi-ms m/z:337.12,339.14[m+h]+。
237、步骤3:化合物5-3的合成
238、在室温下,将化合物5-2(0.88g),加入到四氢呋喃(10.00ml),然后n2保护条件下,缓慢分批次加入tbaf(0.26ml)(1.0m),室温反应0.5h。向反应液中加入20ml h2o淬灭反应,然后再用ea 30ml萃取,重复3次,饱和氯化钠洗涤2次,有机相浓缩得到粗品,粗品柱层析(pe:ea=95:5~50:50)分离得到目标产物5-3(0.52g,产率89.36%)。esi-ms m/z:223.24,225.14[m+h]+。
239、步骤4:化合物5-4的合成
240、在室温下,将化合物5-3(45.19mg),中间体m3(100.00mg),[pdcl2(dppf)]ch2cl2(13.80mg),碳酸钠(53.67mg)加入到1,4-二氧六环(4.00ml)和水(0.50ml)中,然后n2保护条件下,90℃反应1h,停止反应。将反应液加硅藻土过滤,向反应液中加入10ml h2o和10mlea,然后再用ea 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,柱层析(dcm:meoh=95:5~90:10)分离得到浅目标产物5-4(70.00mg,产率68.12%)。esi-ms m/z:609.62[m+h]+。
241、步骤4:化合物5的合成
242、在室温下,将化合物5-4(70.00mg)加入到二氯甲烷(5.00ml)中,然后n2保护条件下,冰水浴加入三氟乙酸(1.50ml),室温反应1h,停止反应。旋蒸除去反应溶剂,向反应液中加入10ml h2o和10ml dcm,然后加入naoh调节ph>12,然后再用dcm 15ml萃取,重复3次,合并有机相,饱和氯化钠洗涤,有机相浓缩得到粗品,粗品层析板(dcm:meoh(7m-nh3)=12:1)分离得到目标产物5(41.70mg,产率71.29%)。esi-ms m/z:509.28[m+h]+。1h nmr(500mhz,dmso-d6)δ9.90(s,1h),8.72(s,1h),8.41(d,j=8.6hz,1h),8.00(d,j=1.0hz,1h),7.61(d,j=8.5hz,1h),7.47–7.43(m,1h),7.43-7.35(m,2h),7.31(d,j=1.1hz,1h),7.29-7.25(m,2h),6.97(d,j=8.6hz,1h),6.86(d,j=8.5hz,1h),4.24(s,2h),3.97-3.91(m,2h),3.55-3.46(m,2h),3.48-3.39(m,2h),3.17-3.10(m,1h),2.18(s,6h),1.71-1.56(m,4h)。
243、实施例6:化合物7-(6-(二甲氨基)甲基)-5-(四氢呋喃-3-基)吡啶-2-基)氨基)-4-(1-甲基-5-苯基-1h-吡唑-4-基)-2,3-二氢-1h-吡咯[3,4-c]吡啶-1-酮的合成
244、
245、步骤1:化合物6-1的合成
246、在室温下,将5-溴-1-甲基吡唑(1g),苯硼酸(1.14g),[pdcl2(dppf)]ch2cl2(0.3g),碳酸钾(2.56g)加入到1,4-二氧六环(20ml)和水(2.5ml)中,然后n2保护条件下,85℃反应1h,停止反应。反应液加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(pe:ea=5:1)分离得到目标产物6-1(1.1g,产率91.03%)。esi-ms m/z:159.1[m+h]+。
247、步骤2:化合物6-2的合成
248、在室温下,将化合物6-1(900mg)溶于二氯甲烷(10ml)中,然后缓慢加入nbs(1.52g),室温反应1h。向反应液中加入水,然后分液;再用10ml dcm萃取,重复3次,;合并有机相,饱和氯化钠洗涤两次,无水硫酸钠干燥,过滤,浓缩。浓缩物经柱层析(pe:ea=10:1)分离得到目标产物6-2(1.0g,产率74.25%)。esi-ms m/z:237.2[m+h]+。
249、步骤3:化合物6-3的合成
250、在室温下,将化合物6-2(300mg)溶于thf(10ml)中,然后n2保护条件下,-78℃条件下缓慢滴加正丁基锂(1.0ml,2.5m),保温反应1h;之后缓慢滴加硼酸三异丙酯(0.6ml),保温反应1h;后移至室温反应1h,停止反应。加水淬灭反应,用2m的naoh溶液调节ph至14,加入ea,分液,保留水相,有机相用水反萃2次,合并水相,用1m的hcl溶液调节ph至8~9,用dcm萃取3次,合并有机相,无水硫酸钠干燥,过滤,浓缩得到目标产物6-3(220mg,产率86.06%)。esi-ms m/z:203.2[m+h]+。
251、步骤4:化合物6-4的合成
252、在室温下,将化合物m6(72.00mg),6-3(38.70mg),xphospd g2(12.00mg),磷酸钾(94.00mg)加入到1,4-二氧六环(4ml)和水(1ml)中,然后n2保护条件下,90℃反应2h,停止反应。反应液加入水,用ea萃取3次,合并有机相,饱和氯化钠溶液洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(dcm:meoh=13:1)分离得到目标产物6-4(60.00mg,产率80.01%)。esi-ms m/z:609.5[m+h]+。
253、步骤5:化合物6的合成
254、在室温下,将化合物6-4(60.00mg)溶于dcm(5.00ml)中,缓慢滴加tfa(248.00mg),室温反应1h,停止反应。用饱和碳酸氢钠溶液调节ph至碱性,用dcm萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩,后经打浆得到目标产物6(31.60mg,产率63.20%)。esi-ms m/z:509.5[m+h]+。1h nmr(500mhz,dmso-d6)δ9.75(s,1h),9.37(s,1h),8.90(s,1h),7.85(s,1h),7.63(d,j=8.5hz,1h),7.45-7.43(m,3h),7.40-7.34(m,2h),6.94(d,j=8.5hz,1h),4.00-3.91(m,4h),3.84-3.73(m,5h),3.61(s,1h),3.50(dd,j=8.2,6.8hz,2h),2.29-2.22(m,1h),2.19(s,6h),1.89-1.83(m,1h).
255、实施例7:化合物4-(5,6-二氢苯并[f]吡唑[1,5-d][1,4]恶唑-1-基)-7-(6-(二甲胺基)甲基)-5-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)异吲哚-1-酮的合成
256、
257、步骤1:化合物7-1的合成
258、在室温下,将邻溴苯酚(3.50g),碳酸钾(6.99g),1,2二溴乙烷(19.00g)加入到乙腈(50ml)中,加热80度反应过夜。反应液冷却至室温,向反应液中加入100ml水,用ea(50ml)萃取,重复3次,合并有机相,用饱和氯化钠水溶液洗涤,无水硫酸钠干燥,过滤,浓缩得到目标产物7-1(4.40g,产率77.69%)。
259、步骤2:化合物7-2的合成
260、将原料咪唑(0.58g)溶解于无水thf(11ml)中,冰浴条件下,分批加入钠氢(0.43g,60%含量),加完后室温反应1小时。然后加入7-1(2.00g)和n,n二甲基丙烯基脲(4.32ml)的thf(11ml),加完后加热40度反应10小时。反应液冷却至室温,加ea(40ml)和水(40ml)稀释,ea萃取(50ml),重复3次,合并有机相,饱和盐水洗涤(50ml),重复4次,,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(pe:ea=5%-15%,)分离得到目标产物7-2(1.59g,产率83.32%)。
261、步骤3:化合物7-3的合成
262、将原料7-2(1.48g),pd(oac)2(0.12g),pcy3*hbf4(0.31g),乙酸钾(0.65g),加入dmf(80.00ml)中,加热140度反应过夜。反应液冷却至室温,加ea(100ml)和水(100ml)稀释,ea/thf=1:1萃取(100ml),重复4次,合并有机相,饱和盐水洗涤(50ml),重复4次,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(pe:ea=10%-15%)分离得到目标产物7-3(0.88g,产率85.30%)。
263、步骤4:化合物7-4的合成
264、将原料7-3溶解于乙腈(25.00ml)中,冰浴条件下0度,分批加入nbs(0.89g),然后0度反应0.5小时。反应液加ea稀释,加水,ea(25ml)萃取,重复2次,饱和盐水洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析(pe:ea=10%),分离得到目标产物7-4(1.1g,产率91.15%)。
265、步骤5:化合物7-5的合成
266、将原料7-4(53.7mg),m3(100.00mg),xphospdg2(13.30mg),xphos(4.00mg),k3po4(107.49mg),加入1,4-二氧六环(3.00ml),水(1.00ml)中,加热100度反应2小时。反应液直接浓缩,浓缩物经硅胶柱层析(dcm:ch3oh=3%-6%),分离得到目标产物7-5(81mg,产率73.74%)。
267、步骤6:化合物7的合成
268、在室温下,将化合物7-5(81.00mg)溶于dcm(3.00ml)中,缓慢滴加tfa(0.23ml),室温反应0.5h,停止反应。用饱和碳酸氢钠溶液调节ph至碱性,用dcm萃取3次,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,有机相浓缩,浓缩物经硅胶柱层析得目标产物7(46.70mg,产率68.12%)。esi-ms m/z:551.3[m+h]+。1h nmr(500mhz,dmso-d6)δ9.88(s,1h),8.60(s,1h),8.54(d,j=8.5hz,1h),7.75(s,1h),7.62(d,j=8.5hz,1h),7.37-7.32(m,1h),7.29(d,j=8.5hz,1h),7.23(dd,j=8.0,1.1hz,1h),7.01-6.97(m,2h),6.87(d,j=8.4hz,1h),4.60(t,j=5.3hz,2h),4.46(t,j=5.2hz,2h),4.07-4.01(m,2h),3.96-3.93(m,2h),3.54(s,2h),3.44-3.39(m,2h),3.17-3.12(m,1h),2.20(s,6h),1.68-1.59(m,4h)。
269、下述的实施例采用上述方法合成,或使用相应中间体的类似方法合成。
270、
271、
272、
273、实施例8:1h nmr(500mhz,dmso-d6)δ9.85(s,1h),8.64(s,1h),8.25(s,1h),7.76(s,1h),7.66-7.63(m,1h),7.48–7.42(m,3h),7.36–7.32(m,2h),7.07(d,j=8.5hz,1h),6.92-6.90(m,1h),4.06(s,2h),3.96-3.92(m,2h),3.78(s,3h),3.47-3.40(m,2h),3.29(s,2h),3.07-3.04(m,1h),2.50(s,6h),1.67–1.56(m,4h).
274、实施例10:1h nmr(500mhz,dmso-d6)δ9.83(s,1h),8.65(s,1h),8.39(d,j=8.6hz,1h),7.82(t,j=4.2hz,3h),7.59(d,j=8.0hz,3h),6.96(d,j=8.6hz,1h),6.83(d,j=8.4hz,1h),4.16(s,2h),3.94-3.92(m,2h),3.82(s,3h),3.50(s,2h),3.43-3.37(m,2h),3.15-3.12(m,1h),2.16(s,6h),1.70–1.56(m,4h).
275、实施例11:1h nmr(500mhz,dmso-d6)δ9.84(s,1h),8.67(s,1h),8.37(d,j=8.6hz,1h),7.82-7.79(m,2h),7.75–7.63(m,3h),7.59(d,j=8.5hz,1h),6.99(d,j=8.5hz,1h),6.84(d,j=8.5hz,1h),4.17(s,2h),3.97–3.91(m,2h),3.81(s,3h),3.51(s,2h),3.43-3.27(m,2h),3.15-3.10(m,1h),2.17(s,6h),1.70–1.56(m,4h).
276、实施例12:1h nmr(500mhz,dmso-d6)δ9.81(s,1h),8.69(s,1h),8.31(d,j=8.5hz,1h),7.85(s,1h),7.64-7.47(m,5h),6.87-6.82(m,2h),4.32(d,j=18.5hz,1h),4.14(d,j=18.0hz,1h),3.94(d,j=11.0hz,2h),3.68(s,3h),3.52–3.40(m,4h),3.17-3.10(m,1h),2.16(s,6h),1.66-1.56(m,4h).
277、实施例14:1h nmr(500mhz,dmso-d6)δ9.85(s,1h),8.74(s,1h),8.27(d,j=8.6hz,1h),7.60(d,j=8.5hz,1h),7.45(dd,j=8.3,6.4hz,2h),7.42–7.37(m,1h),7.32-7.27(m,2h),7.16(s,1h),6.82(t,j=8.9hz,2h),4.34(s,2h),3.95-3.92(m,2h),3.53(s,2h),3.44-3.38(m,2h),3.15-3.10(m,1h),2.22(s,3h),2.19(s,6h),1.69-1.55(m,4h).
278、对比化合物d1:
279、
280、对比化合物的合成参考专利wo2021050964中化合物i-792的具体合成步骤。
281、生物学测试
282、药理实验1:酶学活性检测(1mm atp体系)
283、(1)取adp-glotmkinase assay试剂盒(promega,cat.no.v9102),配制4×激酶缓冲液。
284、(2)化合物梯度稀释:待测化合物,3倍稀释,设置11个梯度浓度,每个浓度设置复孔检测。在384孔板中梯度稀释成相应100倍终浓度的溶液,然后用echo转移0.1μl到384孔反应板中待测。最小孔和最大孔中转移0.1μl的100% dmso。
285、(3)用4×激酶缓冲液配制hpk1酶工作液。
286、(4)在各孔中加5μl的hpk1酶工作液,最小孔中加5μl的1×激酶缓冲液,1000rpm离心1min,25℃孵育15min。
287、(5)孵育期间,用4×激酶缓冲液配置底物工作液。
288、(6)反应板各孔中加入5μl含有1mm atp的底物工作液,1000rpm离心1min,25℃孵育60min。
289、(7)孵育结束,每孔加入5μl adp glo试剂。1000rpm离心1min,25℃孵育60min。
290、(8)每孔加入10μl检测液,1000rpm离心1min,25℃孵育60min。
291、(9)用envision读数。
292、抑制率计算公式:
293、
294、最大孔:dmso对照孔的读值
295、最小孔:无酶孔读值
296、以浓度的log值作为x轴,百分比抑制率为y轴,采用分析软件graphpad prism 5的log(inhibitor)vs.response-variable slope拟合量效曲线,从而得出化合物对激酶结合抑制的ic50值。
297、实施例化合物对hpk1的酶学ic50数据参见表1。
298、表1
299、 化合物名称 <![cdata[ic<sub>50</sub>(nm)]]> 化合物名称 <![cdata[ic<sub>50</sub>(nm)]]> 3 19.80 17 12.54 4 4.42 19 8.58 5 5.27 20 26.19 8 10.60 21 11.37 12 16.40 24 3.53 14 2.63 25 34.87 18 14.88 29 14.83 15 22.36 30 17.40
300、药理实验2:人外周血单核细胞ifn-γ分泌检测
301、(1)取液氮冻存的人外周血单核细胞,37℃水浴解冻,加入5ml预热的rpmi-1640完全培养基(含10% fbs和青/链霉素),500g离心10分,弃上清;
302、(2)使用rpmi-1640完全培养基重悬细胞,调整密度为5×106cell/ml,接种在低吸附6孔板(corning,3471),37℃培养2天;
303、(3)收集培养的人外周血单核细胞,500g离心10分钟,弃上清;
304、(4)使用rpmi-1640完全培养基重悬细胞,调整密度为1×106cell/ml,接种在圆底96孔板(jet biofil,tcp-002-096),每孔100μl;
305、(5)每孔加入50μl待测化合物,37℃孵育30分钟;
306、(6)取人抗cd3/cd28磁珠(miltenyi,130-091-441),使用rpmi-1640完全培养基洗涤1次,调整密度至0.5×106bead/ml备用;
307、(7)化合物孵育结束后,每孔加入50μl人抗cd3/cd28磁珠,37℃培养3天;
308、(8)取细胞培养上清,使用human ifn-gamma duoset elisa试剂盒(r&d,dy285b-05)检测ifn-γ分泌量;
309、(9)以浓度的log值作为x轴,ifn-γ分泌量为y轴,采用分析软件graphpad prism5的log(agonist)vs.response-variable slope拟合量效曲线,从而得出化合物对人外周血单核细胞分泌ifn-γ达到达到半数诱导倍数时的ec50值,结果见表2。
310、表2
311、 化合物名称 <![cdata[ec<sub>50</sub>(nm)]]> 5 41.6 8 85.6 14 50.1 d1(对照) 429
312、ifn-γ是免疫细胞发挥抗肿瘤作用的关键细胞因子之一。实验结果表明,本发明化合物在体外可有效提高人外周血单核细胞的ifn-γ分泌水平,提示其具有促进免疫细胞杀灭肿瘤的活性。与对比化合物d1相比,本发明化合物在起效浓度ec50上具有明显的优势。
313、虽然本发明已通过其实施方式进行了全面的描述,但是值得注意的是,各种变化和修改对于本领域技术人员都是显而易见的。这样的变化和修改都应该包括在本发明所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!