一种体外制备的稳定的RNA分子及其在体内原位CAR治疗产品制备中的应用
本发明涉及一种体外制备的稳定的rna分子及其在体内原位car治疗产品制备中的应用,属于生物医药。
背景技术:
1、car(chimeric antigen receptor,嵌合抗原受体)的概念自1989年由科学家ggross提出,发展至今,将car分子通过基因工程手段体外转导入t细胞的car-t(嵌合抗原受体t细胞)疗法已经成为了一种重要的免疫疗法并获批应用于临床上白血病和淋巴瘤的治疗。但该疗法目前仍存在许多问题,在应用上程序繁琐,成本昂贵,通常需要与其他医疗手段联合进行治疗以达到较好效果,且目前针对实体瘤的治疗几乎没有效果。
2、多顺反子指能够同时编码多个多肽链的一个mrna分子,多存在于原核生物中,在真核生物中较少。目前广泛应用的载体多采用多顺反子表达方案,即利用内部核糖体进入位点(internal ribosome entry site,ires)或自剪切多肽2a(self-cleaving 2apeptide,2a)等元件来连接多个基因,实现在单个载体上表达多个基因的目的,该技术以dna质粒为载体,导入目的细胞中存在整合到基因组的风险。
3、rna疫苗技术,包括mrna疫苗技术和circular rna疫苗技术,是近几年取得重大突破的医学技术。虽然该项技术已经在感染性疾病、自身免疫病、遗传病以及癌症的预防和治疗中显示出广阔的应用前景,但是该技术仍然具有巨大的优化和提升空间。目前的rna技术都属于单顺反子rna技术,即一个rna分子只能翻译出一种多肽(单个蛋白亚基或者单个融合蛋白)。因此,在需要同时表达多个功能性蛋白的应用情形下(比如多价疫苗、联合给药等),当前的单顺反子rna技术则遭遇技术应用瓶颈。
4、近几年,免疫检查点抑制(icb)和嵌合抗原受体t细胞(car-t)免疫疗法已经成为重要的癌症治疗手段,但仍存在许多挑战。icb疗法的临床反应率很低,只有20%—30%,对大多数癌症患者几乎无效;car-t疗法虽然在治疗b淋巴瘤方面取得了巨大成功,但其仍存在三个严重问题:①耗时、耗资源、极其昂贵的个体化细胞治疗,而不是“现货型”药物;②仅对部分的血液肿瘤有效,对实体瘤几乎不能杀伤;③严重的副作用,比如细胞因子风暴和杀伤正常细胞等。因此,开发用于癌症治疗的前沿生物技术仍然是迫切所需的。
5、rna治疗技术具备可逆、可调控的优势,rna可以直接在细胞质中翻译蛋白发挥功能,不需要转运进细胞核内;且rna没有整合进基因组dna的安全风险。因此,rna治疗技术是开发体内原位car免疫疗法的一个重要契机。2020年11月,matthiasstephan团队将编码anti-cd19 car跨膜蛋白的mrna直接静脉重复输注进小鼠体内,治疗效果在小鼠模型上达到了过继性细胞疗法的疗效(parayath et al.,naturecommunications,2020)。2022年1月,joel g.rurik等报道了基于mrna技术的体内重编程car-t疗法,通过向体内t细胞靶向递送anti-fap-car mrna,清除了小鼠体内纤维化心肌细胞(rurik et al.,science,2022)。
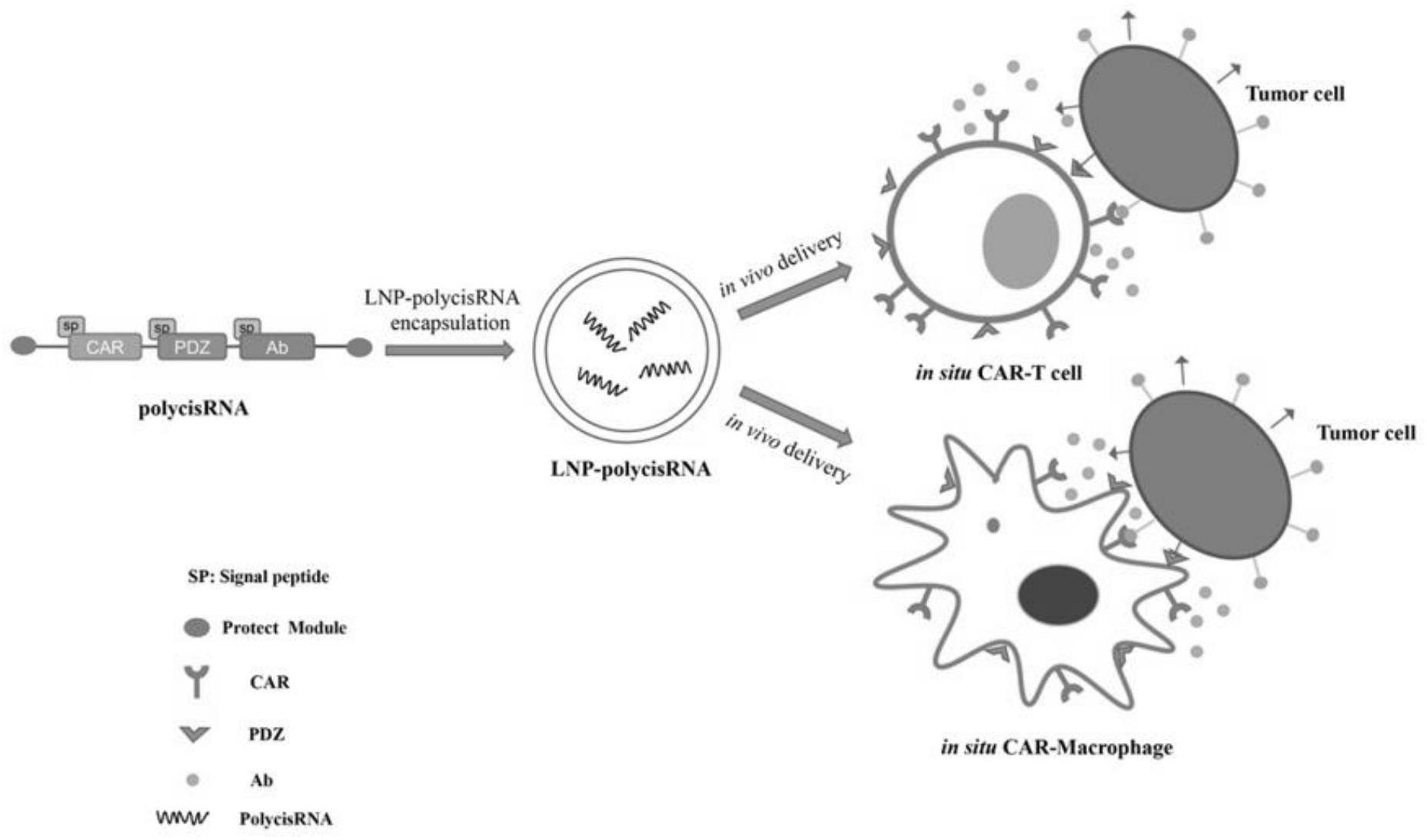
6、目前,car疗法常通过与多种功能蛋白联合治疗来提高其治疗效果,如细胞因子、单克隆抗体、疫苗、小分子靶向药物等,如果能将car分子与以上多个功能性蛋白在同一个rna分子上同时在体表达、协同作用,将有助于提高car疗法的靶向性、肿瘤杀伤效果,有效提高实体瘤治疗响应率。但由于促炎、促免疫细胞浸润的细胞因子与pdz结构域都是属于跨膜或者分泌蛋白,采用当前的单顺反子rna技术在同一个rna分子上进行编码受到技术限制。当前的单顺反子rna技术不能应用于同时表达多个功能性蛋白用于免疫治疗的主要原因在于:(1)脂纳米颗粒(lnp)对rna分子进行包裹时是随机过程、且一个lnp颗粒包裹的rna分子数目有限;因此,当用lnp对多种单顺反子rna进行包封时,制备的lnp-rna药物批次的平行性、稳定性和有效性都会收到严重制约。(2)由于哺乳动物细胞中分泌型蛋白和膜蛋白分选的特殊机制(信号肽的引导和切割),用一个rna分子翻译一种融合蛋白(各蛋白亚基由2a连接而成)的策略仅仅适用于胞质蛋白、核内蛋白或单个跨膜蛋白与其他胞质蛋白的组合,不能适用于多个分泌蛋白或跨膜蛋白的融合翻译;然而应用于疫苗的抗原、治疗性抗体、细胞因子、嵌合抗原受体(car)等大多数功能性蛋白都是分泌蛋白或膜蛋白。基于以上原因,开发多顺反子rna技术,即利用一个rna分子同时翻译出多个功能性分泌蛋白或膜蛋白,是当前底层rna技术研究领域所迫切需要的,并且其未来在疾病的治疗中都极具应用开发前景。
7、此外,在体内环境中,mrna半衰期短、稳定性差,裸露的mrna直接进入体内容易被体内广泛存在的rna酶降解;而环状rna虽然比mrna稳定,但容易引起机体产生免疫原性,影响治疗效果,限制了其在医学治疗中的应用。并且,mrna在体外制备时,需要额外添加5’端帽子结构以及3’端polya尾,而环状rna虽然不需要加帽加尾,但需要进行环化反应,制备工艺程序繁琐,在生产上严重制约了生产效率,并增加了生产成本。
技术实现思路
1、为了解决上述问题,本发明提供一种体外制备的稳定的rna分子及其在体内原位car治疗产品制备中的应用。
2、本发明的第一个目的是提供一种体外制备的稳定的rna分子,所述rna分子包括:
3、编码目的蛋白的区域;以及,
4、设置在所述目的蛋白的编码区上游的ires序列;以及,
5、设置在所述rna分子两端的保护性rna二级结构。
6、进一步地,所述保护性rna二级结构为小核仁rna(snorna)序列或/和triplex序列。
7、进一步地,所述小核仁rna序列选自h/aca box snornas、c/d box snornas、小卡扎尔体rna(scarnas)中的一种或多种。
8、进一步地,所述triplex序列为具有三螺旋结构的rna序列。
9、进一步地,所述rna分子还包括:
10、5’端设置在保护性rna二级结构之后的5’utr序列,以及,3’端设置在保护性rna二级结构之前的3’utr序列。
11、进一步地,所述目的蛋白为一个或多个。
12、进一步地,所述目的蛋白为一种或多种抗体;或,一种或多种抗原;或,一种或多种基因编辑酶;或,一种或多种调节因子;或,一种或多种荧光蛋白。
13、进一步地,所述目的蛋白包括:人凝血因子ix(hfix)、肺表面活性蛋白b抗体(sp-b)、血管内皮生长因子a(vegf-a)、甲基丙二酸单酰辅酶a变位酶(hmut)、人促红细胞生成素(hepo)、囊性纤维化跨膜传导调节因子(cftr)、cas9内切酶、cpf1、锌指核酸酶(zfn)、转录激活剂样效应子核酸酶(talens)、抗hiv抗体、fbr cd19和cd22双特异性抗体、fbr cd3和cldn6双特异性抗体、gaussia荧光素酶(glue)、firefly荧光素酶(flue)、增强型绿色荧光蛋白(egfp)。
14、进一步地,所述目的蛋白为多个时,每个目的蛋白的编码区上游的ires序列均不相同。
15、进一步地,所述ires来自以下病毒的ires序列:陶拉综合征病毒、铁人三项瘤病毒、泰勒脑脊髓炎病毒、猿猴病毒40、红火火蚁病毒1、禾谷缢管蚜病毒、网状内皮组织增生症病毒、富曼脊髓灰质炎病毒1、克什米尔蜂病毒、人鼻病毒2、人免疫缺陷病毒1型、himetobip病毒、丙型肝炎病毒、甲型肝炎病毒、gb肝炎病毒、口蹄疫病毒、人肠道病毒71、马鼻炎病毒、脑心肌炎病毒、果蝇c病毒、蟋蟀麻痹病毒、牛病毒性腹泻病毒1、黑蜂王细胞病毒、蚜虫致死性麻痹病毒、禽类脑脊髓炎病毒、急性蜜蜂麻痹病毒、木槿褪绿环斑病毒、经典猪瘟病毒、猿猴小核糖核酸病毒、芜菁皱缩病毒、柯萨奇病毒b3或柯萨奇病毒a。
16、进一步地,在目的蛋白为多个时,多个目的蛋白的编码区上游的ires序列为不同序列。
17、进一步地,5’utr序列选自rna结合蛋白家族或ythdf家族;3’utr序列选自人α-珠蛋白1(hba1)、人α-珠蛋白2(hba2)小鼠α-珠蛋白、人β-珠蛋白、xrrna或apt-eif4g。
18、本发明的第二个目的是提供所述体外制备的稳定的rna分子的制备方法,包括如下步骤:
19、s1、分别扩增rna聚合酶启动子、保护性rna二级结构序列、5’utr序列、3’utr序列、ires序列和目的蛋白的编码基因序列,连接到空载体上得到表达载体;
20、s2、将s1步骤得到的表达载体经过酶切线性化,经过体外转录合成所述rna分子。
21、进一步地,所述方法还包括采用递送系统封装所述rna分子。
22、进一步地,所述递送系统包括脂质纳米颗粒、脂质体、脂质复合物、高分子材料、胶束、多肽、鱼精蛋白中的一种或多种。
23、本发明的第三个目的是提供所述体外制备的稳定的rna分子的应用,所述应用包括疫苗产品制备或体内原位car治疗产品制备中的应用。
24、本发明的polycisrna有效解决了以下问题:
25、(1)目前个体化过继细胞治疗中因异体移植免疫排斥引发的耗时、耗资源、成本极其昂贵的制约问题:基于本发明的多顺反子rna技术,可以开发出iscar-t/iscar-m“现货型”新型免疫疗法,以多顺反子rna为载体,在体内原位直接生成car-免疫细胞,并通过多种效应蛋白协同作用,增强疗效;因mrna的特性使开发的免疫疗法避免了个体化治疗复杂的过程,并具有剂量-时间依赖性疗效特性,临床安全性很高。
26、(2)本发明针对mrna结构进行改造,去除5’帽子结构和3’polya尾且保留mrna蛋白翻译功能,并依赖snorna序列或triplex序列提高mrna稳定性,在生产过程中仅需以dna为模板进行体外转录即可得到产品,无需加帽加尾或环化环节,极大的节约了生产时间,降低了生产成本。
27、(3)本发明仅以一个mrna分子表达多种效应蛋白,不同于以单顺反子rna表达不同蛋白所需的多个mrna分子,在成药过程中避免了药物成分均一性问题,提高了安全性和药物批次平行性,为后期临床应用提供了保障。
28、本发明的有益效果是:
29、本发明重新设计了mrna,在mrna两端添加保护性rna二级结构来保护mrna不被rna外切酶切割,提高rna的稳定性,并使用ires来替代5’端m7g帽子结构招募核糖体启动蛋白翻译,使mrna保留翻译功能,增加其稳定性,而不需要在其两端分别加帽加尾,极大地降低mrna制备的成本、并提高mrna体外生产的效率。此外,本发明在此基础上,构建了多顺反子rna平台,使用ires来分别表达多个蛋白序列,弥补了单顺反子rna技术不能同时表达多个功能性蛋白的不足。
- 还没有人留言评论。精彩留言会获得点赞!