免疫风险评分模型在预测子宫内膜癌预后及治疗响应性中的应用
本发明属于肿瘤诊断标志,具体涉及检测基因标签组表达量试剂在制备子宫内膜癌预后预测试剂中的应用。
背景技术:
1、子宫内膜癌(ucec)是发生于子宫内膜的上皮性肿瘤,与雌激素分泌过剩、肥胖和lynch综合征等因素相关,发病率高和预后差使ucec成为了妇女健康的巨大威胁。ucec经典的治疗方式包括手术、放疗、化疗、激素治疗和靶向治疗等,近年来,免疫治疗为晚期子宫内膜癌患者带来了新的希望,研究者们发现免疫联合治疗可能为晚期ucec患者带来更大的生存获益。免疫治疗在ucec中的显著有效性源于多方面。一方面,ucec肿瘤免疫微环境(time)中存在大量的免疫细胞浸润,其在肿瘤发展中发挥关键作用,并影响肿瘤患者的免疫治疗疗效及预后。另一方面,ucec细胞具有较高的基因错配修复缺陷发生率。msi-h/dmmr的肿瘤亚型常伴随高肿瘤突变负荷(tmb),且免疫细胞浸润及pd-1/pd-l1表达增加,从而更能从免疫治疗中获益。免疫治疗作为晚期子宫内膜癌日益重要的治疗方式,微卫星状态、tmb均有着较强的免疫治疗疗效指向作用并指导临床决策。但现有的分子分型方法并无法完美区分不同免疫治疗响应性的人群,建立更精细化的分子分型是时代所趋。
2、免疫检查点抑制剂(icis)主要通过阻断抑制性免疫受体和活化功能失调的t细胞两种手段发挥作用,其中cd8+t细胞参与适应性免疫过程,支撑免疫治疗的成功进行,是抗肿瘤免疫反应中最强大的效应物。研究证实肿瘤浸润免疫细胞密度在ucec中具有很强的预测价值,相同亚组之间的不同生存结局或许可以通过肿瘤之间t细胞浸润的显著性差异来阐明。因此,我们根据这一方向构建的预测模型以期更为精确地评估患者的风险分层和治疗敏感性。
技术实现思路
1、本发明的目的在于提及一种用于预测子宫内膜癌不良预后及治疗响应性的联合诊断标签,该标签对子宫内膜癌的不良预后及治疗响应性有很好的预测价值。
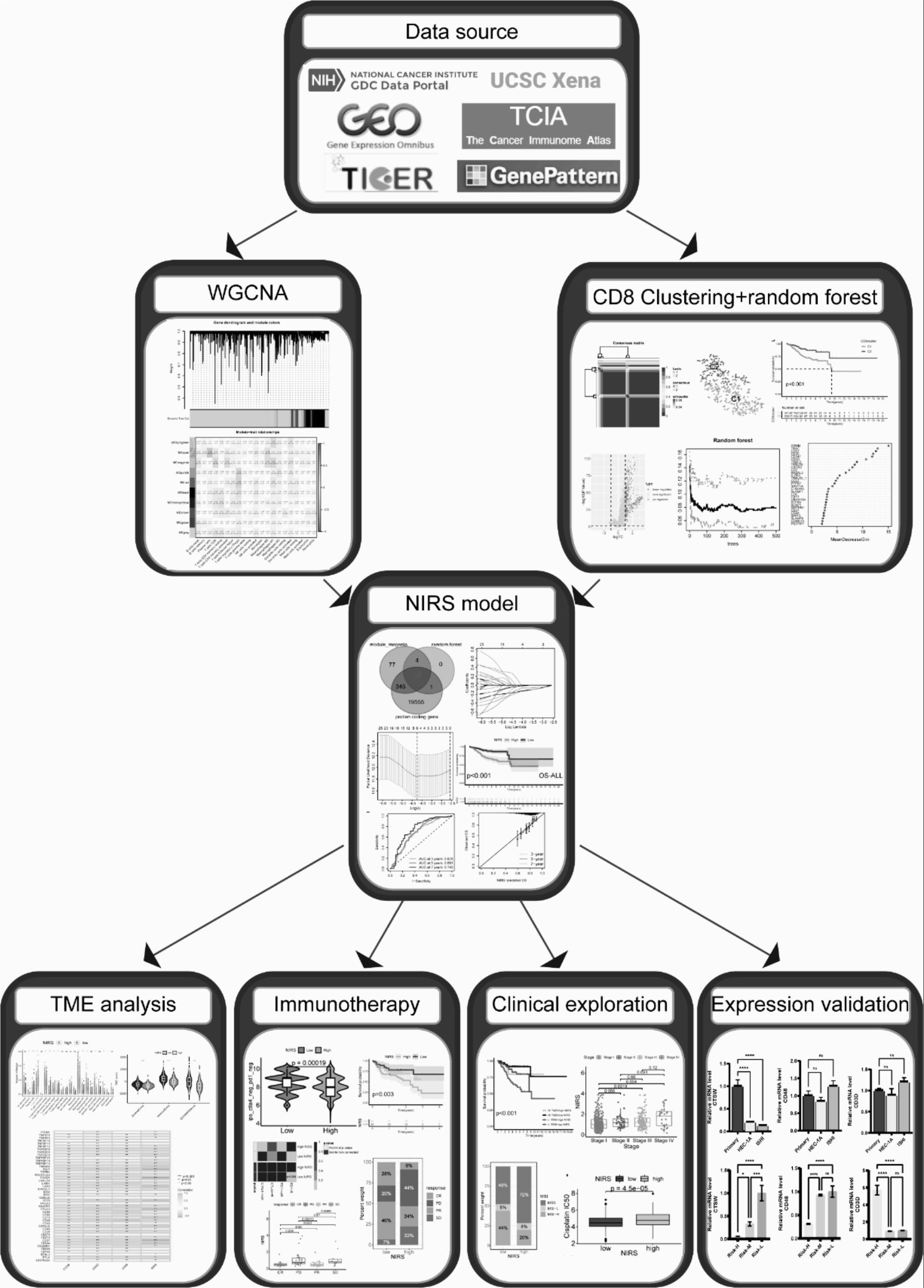
2、我们选择cd8+t细胞作为研究对象来构建预测系统。应用cibersort和ssgsea算法分别来评估ucec患者time中免疫细胞的浸润水平,wgcna算法探索ucec中与cd8+t细胞表达高度相关的基因,nmf和随机森林算法对不同cd8+t细胞相关簇的degs进行聚类和特征筛选。最后通过单因素cox回归、lasso回归和多因素cox回归构建了由ctsw、cd48和cd3d以上3个系统基因组成的免疫评分系统nirs,用于ucec患者的预后及疗效预测并指导个体化治疗。
3、本发明的技术方案是:
4、本发明公开了检测基因标签组表达量试剂在制备子宫内膜癌预后预测试剂中的应用,所述检测基因标签组由cd48、cd3d和ctsw共3个基因标签组成。
5、本发明还公开了检测基因标签组表达量试剂在制备子宫内膜癌疗效预测试剂中的应用,所述基因标签由cd48、cd3d和ctsw共3个基因标签组成。
6、优选的,所述风险评分 = nirs = 3.23×exp[(-0.338)×ctsw+(-0.494)×cd3d+(0.647)×cd48],公式中基因名称代表该基因的表达值。风险评分越高,预示预后可能越差,对免疫检查点抑制剂的响应性可能越差,需要采取更积极的治疗方式及复查,但使用免疫检查点抑制剂可能获益不大。
7、优选的,所述检测基因标签组表达量试剂为抗人cd48、cd3d和ctsw共3个抗体。
8、本发明还提供了cd48的抑制剂或cd3d的抑制剂或ctsw的抑制剂在制备子宫内膜癌治疗试剂中的应用,所述抑制剂为sirna。
9、进一步的所述cd48的抑制剂为si-cd48,具体序列为序列seq id no.2和seq idno.3所示。cd3d的抑制剂为si-cd3d,具体序列为序列seq id no.5和seq id no.6所示。ctsw的抑制剂为si-ctsw,具体序列为序列seq id no.8和seq id no.9所示。
10、下面对本发明做进一步的解释和说明:
11、(1)我们基于56719个基因的ucec表达谱建立了wgcna以探索与免疫细胞密切相关的基因。对544例ucec样本进行聚类并剔除了游离的样本,根据拟合指数和平均连通性的变化趋势将softpower(β)=18(scale free r^2=0.8510)的值确定为最佳软阈值(图3a),得到基因相关性矩阵,将表达相近的基因聚集在一起并构成一个模块,进行动态剪切模块识别(图3b),建立了层次聚类树并合并相似度高的模块,最终得到10个模块(图 3d)。发现品红色模块和cd8+t细胞之间的相关性最高,选择品红色模块进行进一步分析,该模块中有464个基因(图3c)。
12、(2)我们基于cd8+t细胞的基因表达谱对tcga-ucec队列进行了nmf聚类和亚型识别。将所有样本分为c1和c2两个簇(图4a),发现c1和c2亚组间的预后、临床生物学特征、免疫浸润有显著不同(图4b-g)。为了进一步筛选影响ucec患者免疫学特征和预后的关键分子,我们对两个亚型患者的基因表达谱进行了差异分析,并选择了在两组间存在显著差异表达的370个基因进行随机森林特征筛选(图5a),当建立116棵树时,所有样本的误差达到最小,基于基尼系数法为差异基因赋予重要性评分,选择评分大于1的基因为疾病特征基因(图5b, c)。为进一步识别与ucec中cd8+t细胞密切相关的特征基因,我们将经筛选得到的43个差异基因与品红色模块基因和蛋白编码基因集相交,最终获得38个相关基因(图5d)。对这38个基因进行单因素cox回归分析筛选,显示37个基因与ucec患者的os密切相关(图5e)。
13、(3)为了建立ucec预后预测模型,我们基于tcga数据库对筛选得到的差异基因进行了lasso 回归分析和多因素回归cox分析(图6a, b),并构建了由3个基因(cd48、cd3d和ctsw)组成的风险模型,并将这些基因的系数用于计算免疫风险评分(nirs)。nirs = 3.23×exp[(-0.338)×ctsw+(-0.494)×cd3d+(0.647)×cd48],公式中基因名称代表该基因的表达值。患者依照分数中位数被分为低风险组或高风险组(图6i)。接着我们评估了nirs 对预后的预测作用,我们发现随着风险评分的增加,高风险患者的os和pfs显着低于低风险患者(p<0.001)(图6c-f)。roc曲线显示该风险评分具有很强的预测能力,在3年,5年和7年中os的auc分别为0.676、0.691和0.745,预测能力随着年限增长而提升(图6g)。校正曲线的结果显示nirs预测的os与实际情况具有较高的契合度(图6h)。最后,我们通过单因素和多因素cox回归分析发现临床分期(p<0.001),病理分级(p=0.015)和nirs(p=0.043)是影响ucec预后的独立因素(图6j, k)。
14、(4)为了进一步说明nirs对ucec免疫治疗效果的预测效能,接下来我们分析了高nirs和低nirs组免疫浸润丰度、免疫检查点表达水平、免疫抑制剂响应性、肿瘤突变负荷、微卫星状态及错配修复蛋白表达水平之间的差异。应用cibersort和ssgsea两种算法对样本中常见的免疫细胞的浸润丰度进行了评估。均显示低nirs组cd8+t细胞的浸润水平显著高于高nirs组,且相关性分析显示nirs与cd8+t细胞之间存在最强的负相关性(图7a-d)。接下来,我们使用estimate包对肿瘤免疫微环境进行评分,低nirs组患者的基质评分、免疫评分和综合性estimate评分均显著高于高nirs组患者提示低nirs组肿瘤免疫微环境中的基质成分和免疫成分较高nirs组含量更高(图7e)。接下来我们比较了高nirs组和低nirs组患者之间pd-1,pd-l1,ctla-4,lag-3,tim-3和tigit六种临床研究最常应用的免疫检查点的表达水平,发现低nirs组患者以上靶点的表达水平均显著高于高nirs组患者(图8b)。此外,基于tcia数据库分析了不同nirs分组的患者对抗pd-1和抗ctla-4治疗的响应性差异。结果显示,低nirs组的患者4种ips评分均显著高于高nirs组(p<0.001),说明低nirs组患者对抗pd-1和抗ctla-4的响应性均高于高nirs组患者(图9a-d)。应用于外部验证的免疫治疗队列同样也证实低nirs组患者对免疫治疗具有更好的疗效(图9e-l)。我们利用“maftools” r包对ucec患者进行了突变分析,结果显示高nirs组肿瘤突变负荷较高(图10b, c)。此外,nirs与四个错配修复蛋白的表达量均呈正相关(图10e, f)。基于tcia数据库我们分析了tcga-ucec队列中msi状态与nirs的相关性,发现高nirs组患者mss的比例高于低nirs组患者,而msi-h的比例低于低nirs组患者(图10g),且mss的患者伴随着更高的nirs评分(图10h)。
15、(5)为了探索nirs与临床重要预后特征之间的潜在关联,我们统计了nirs与临床分期和病理分级在两组间的分布比例,结果显示高nirs组中g3和iii-iv期患者比例较低nirs组占比更高(图11a, c);g3的患者nirs评分明显高于g1和g2的患者,且stage iii和stage iv的患者nirs评分显著高于stage i的患者(图11b, d)。基于oncopredict算法进一步预测了不同nirs分组患者的常规化疗药物、靶向药物和内分泌治疗药物的敏感性, 显示低nirs组患者对顺铂(p<0.00001),多西他赛(p=0.0001),拓扑替康(p<0.00001),替西罗莫司(p=0.026),奥拉帕利(p=0.00026)和他莫昔芬(p<0.00001)更敏感;而对于紫杉醇(p=0.37)而言,两组的预测药物敏感性没有显著差别(图11i-p)。
16、(6)为了验证3个系统基因在ucec和正常样本间的表达水平差异及它们之间的相互关系,我们首先应用qrt-pcr比较hec-1a,ishi肿瘤细胞和原代子宫内膜上皮细胞的mrna表达差异(图13a-c),结果显示原代细胞中ctsw的表达水平均显著高于hec-1a和ishi癌细胞株。为进一步验证目的基因在不同的临床风险的ucec患者中是否同样存在表达差异,选择危险因素从低到高排布的三例ucec癌组织通过qrt-pcr进行mrna表达水平的对比(图13d-f),我们发现ctsw和cd48的表达在risk-h, risk-m和risk-l组间表达呈现从低到高的阶梯状分布,这与我们前期的预测结果呈现出一致的趋势。最后,将三个靶基因分别在ucec细胞系中敲低表达后,显示三者之间的表达水平存在显著的协同作用(图14d-o)。
17、与现有技术相比,本发明的优势是:
18、这项研究描述了一种免疫风险评分nirs,旨在预测ucec患者的预后和他们对免疫治疗的响应性。我们使用cibersort、加权基因共表达网络分析(wgcna)、非负矩阵分解(nmf)和随机森林算法来筛选与cd8+t细胞相关的模块和关键相关基因,并确定了三个基因(cd3d、cd48和ctsw)用于构建了nirs。结果表明,高nirs组的免疫细胞浸润丰度、免疫检查点表达水平、免疫治疗响应性和基因突变负荷均低于低nirs组,证实低nirs评分的患者具有更好的免疫应答。除免疫治疗以外,nirs同样对部分ucec的常规化疗、靶向治疗和内分泌治疗药物的疗效具有预测作用,显示低nirs组患者对顺铂(p<0.00001),多西他赛(p=0.0001),拓扑替康(p<0.00001),替西罗莫司(p=0.026),奥拉帕利(p=0.00026)和他莫昔芬(p<0.00001)更敏感;而对于紫杉醇(p=0.37)而言,两组的预测药物敏感性没有显著差别。同样地,nirs可以与其它临床预测指标联合评估ucec患者的预后,roc曲线显示该风险评分具有很强的预测能力,在3年,5年和7年中os的auc分别为0.676、0.691和0.745,预测能力随着年限增长而提升。单因素和多因素cox回归分析发现临床分期(p<0.001),病理分级(p=0.015)和nirs(p=0.043)是影响ucec预后的独立因素,且高nirs组中g3和iii-iv期患者比例较低nirs组占比更高;g3的患者nirs评分明显高于g1和g2的患者,且stage iii和stageiv的患者nirs评分显著高于stage i的患者。以上结果表明nirs是ucec免疫治疗应答和患者预后的良好预测指标,检测基因标签组表达量试剂可以用于制备子宫内膜癌预后预测试剂以及疗效预测试剂。
19、此外,三个模型基因cd48、cd3d和ctsw在癌细胞和正常细胞,以及不同危险分数的患者癌组织中表达均有显著差异,因此,均可作为靶位点应用于子宫内膜癌治疗试剂中,也就是提示cd48的抑制剂或cd3d的抑制剂或ctsw的抑制剂在制备子宫内膜癌治疗试剂中的应用,所述抑制剂为sirna。
20、以下结合附图和具体实施方式对本发明的详细结构作进一步描述。
- 还没有人留言评论。精彩留言会获得点赞!