结晶形式的氘代拟肽化合物及其用途的制作方法
本技术涉及结晶形式的氘代拟肽化合物及其具体晶型,含有其的药物组合物及制备作为预防和/或治疗病毒性疾病的药物中的用途。
背景技术:
1、新型冠状病毒(severe acute respiratory syndrome coronavirus 2,sars-cov-2,简称新冠病毒)引发的急性呼吸道传染病造成了新型冠状病毒感染疫情(coronavirus disease 2019,covid-19,简称新冠病毒感染),该病毒具有高传染性和高致病性。
2、在靶向病毒复制周期的特异性抗新冠病毒小分子抑制剂中,主要蛋白酶mpro(又称3clpro)抑制剂的研究最为广泛,其中一类为模拟天然多肽底物的拟肽类抑制剂,主要根据主要蛋白酶mpro的底物多肽序列改造而得。
3、2021年11月辉瑞公司宣布抗新冠病毒口服药paxlovid可将患严重疾病风险的成年人住院或死亡的几率降低89%,其主要活性成分为pf-07321332,通过抑制3cl蛋白酶来限制病毒繁殖。paxlovid目前临床试验剂量为每日两次,每次300毫克pf-07321332与100毫克利托那韦同时服用。
4、该药物化合物存在以下缺陷:1.每天需要服药两次,药物依从性有待进一步提高;2.联合用药增加不良反应风险;3.pf-07321332需要与强效cyp3a4抑制剂利托那韦同时服用,限制其它药物的使用范围。较高的服用剂量和利托那韦本身容易引起多种不良反应,强效cyp酶抑制作用也限制了大量cyp酶代谢底物类药物的使用,给治疗方法带来诸多限制,极大增加患者风险。
技术实现思路
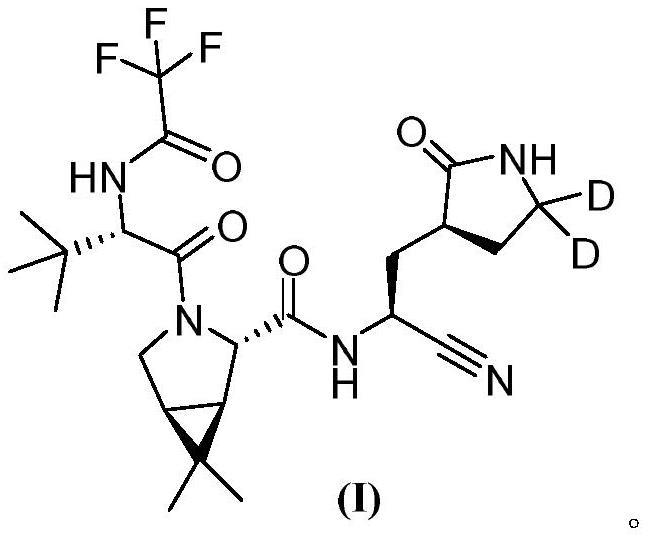
1、第一方面,本技术提供了结晶形式的式(i)所示化合物,
2、
3、本技术的一些方案中,所述结晶形式的式(i)所示化合物,其具有≥96%的化学纯度;优选地,其具有≥97%的化学纯度;进一步优选地,其具有≥98%的化学纯度;进一步优选地,其具有≥98.5%的化学纯度。
4、在一些实施方案中,所述结晶形式的式(i)所示化合物,其为晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):11.8,12.7,15.6,18.3。
5、进一步地,所述晶型a,其中,11.8°±0.2°(2θ角)处的衍射峰具有20%~70%的相对峰强度。
6、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
7、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 11.8 20-70 15.6 30~100 12.7 80~100 18.3 50~80
8、。
9、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):11.8,12.7,15.6,18.3,20.4。
10、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
11、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 11.8 20-70 18.3 50~80 12.7 80~100 20.4 30~70 15.6 30~100
12、。
13、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):11.8,12.7,15.6,18.3,19.8,20.4。
14、进一步地,所述晶型a,其中,11.8°±0.2°(2θ角)处的衍射峰具有20%~70%的相对峰强度,19.8±0.2°(2θ角)处的衍射峰具有25%~60%的相对峰强度。
15、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
16、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 11.8 20-70 18.3 50~80 12.7 80~100 19.8 25~60 15.6 30~100 20.4 30~70
17、。
18、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):11.8,12.7,15.6,17.3,18.3,19.8,20.4。
19、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
20、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 11.8 20-70 18.3 50~80 12.7 80~100 19.8 25~60 15.6 30~100 20.4 30~70 17.3 5~50
21、。
22、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):11.8,12.7,15.6,17.3,18.3,19.8,20.4,22.2。
23、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
24、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 11.8 20-70 18.3 50~80 12.7 80~100 19.8 25~60 15.6 30~100 20.4 30~70 17.3 5~50 22.2 15~50
25、。
26、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.8,12.7,15.6,17.3,18.3,19.8,20.4,22.2。
27、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
28、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 7.6 5~50 15.6 30~100 20.4 30~70 9.7 9~40 17.3 5~50 22.2 15~50 11.8 20-70 18.3 50~80 12.7 80~100 19.8 25~60
29、。
30、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.8,12.7,15.6,17.3,18.3,19.8,20.4,20.9,22.2。
31、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
32、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 7.6 5~50 15.6 30~100 20.4 30~70 9.7 9~40 17.3 5~50 20.9 10~40 11.8 20-70 18.3 50~80 22.2 15~50 12.7 80~100 19.8 25~60
33、。
34、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.8,12.7,15.6,17.3,17.8,18.3,19.8,20.4,20.9,21.6,22.2。
35、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
36、
37、
38、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.4,11.8,12.1,12.7,15.6,17.3,17.8,18.3,19.8,20.4,20.9,21.6,22.2。
39、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
40、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 7.6 5~50 15.6 30~100 20.4 30~70 9.7 9~40 17.3 5~50 20.9 10~40 11.4 9~35 17.8 10~40 21.6 3~30 11.8 20-70 18.3 50~80 22.2 15~50 12.1 5~40 19.8 25~60 12.7 80~100
41、。
42、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.4,11.8,12.1,12.7,15.6,17.3,17.8,18.3,19.8,20.4,20.9,21.6,22.2,23.5,24.6。
43、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
44、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 7.6 5~50 15.6 30~100 20.9 10~40 9.7 9~40 17.3 5~50 21.6 3~30 11.4 9~35 17.8 10~40 22.2 15~50 11.8 20-70 18.3 50~80 23.5 5~35 12.1 5~40 19.8 25~60 24.6 5~40 12.7 80~100 20.4 30~70
45、。
46、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.6,9.7,11.4,11.8,12.1,12.7,15.6,17.3,17.8,18.3,18.7,19.8,20.4,20.9,21.6,22.2,23.5,24.6。
47、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):
48、 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 峰位置(2θ)° 相对强度% 7.6 5~50 15.6 30~100 20.4 30~70 9.7 9~40 17.3 5~50 20.9 10~40 11.4 9~35 17.8 10~40 21.6 3~30 11.8 20-70 18.3 50~80 22.2 15~50 12.1 5~40 18.7 5~30 23.5 5~35 12.7 80~100 19.8 25~60 24.6 5~40
49、。
50、本技术的一些方案中,所述晶型a,使用cu-kα辐射,其具有基本上如图1所示的x-射线粉末衍射图谱。
51、本技术的一些方案中,所述晶型a,其差示扫描量热曲线在196±5℃处有吸热峰。
52、本技术的一些方案中,所述晶型a,其差示扫描量热曲线在192±5℃处开始出现吸热信号。
53、本技术的一些方案中,所述晶型a,其差示扫描量热曲线在196±5℃有吸热峰,在336±5℃处出现放热的峰值。
54、本技术的一些方案中,所述晶型a,其具有基本上如图2所示的dsc图谱。
55、本技术的一些方案中,所述晶型a,其具有≥96%的化学纯度;优选地,其具有≥97%的化学纯度;进一步优选地,其具有≥98%的化学纯度;进一步优选地,其具有≥99%的化学纯度;进一步优选地,其具有≥99.5%的化学纯度。
56、在一些实施方案中,所述结晶形式的式(i)所示化合物,其为晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.2,12.6,16.9,18.5。
57、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.2,11.8,12.6,16.9,18.5。
58、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.2,11.8,12.6,14.2,16.9,18.5。
59、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在下列2θ角处的衍射峰(±0.2°):7.2,11.8,12.6,14.2,16.0,16.9,18.5。
60、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):7.2,11.8,12.6,14.2,16.0,16.9,18.5,19.2。
61、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):7.2,11.4,11.8,12.6,14.2,16.0,16.9,18.5,19.2,23.7。
62、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):7.2,10.5,11.4,11.8,12.6,14.2,16.0,16.9,18.5,19.2,22.2,23.7,25.3。
63、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):7.2,10.5,11.4,11.8,12.6,14.2,16.0,16.9,18.5,19.2,19.9,20.8,22.2,23.7,25.3。
64、本技术的一些方案中,所述晶型b,使用cu-kα辐射,其具有基本上如图3所示的x-射线粉末衍射图谱。
65、本技术的一些方案中,所述晶型b,其差示扫描量热曲线在131±5℃处出现吸热的峰值。
66、本技术的一些方案中,所述晶型b,其差示扫描量热曲线在117±5℃处开始出现吸热信号。
67、本技术的一些方案中,所述晶型b,其差示扫描量热曲线在131±5℃处出现吸热的峰值,在335±5℃处出现放热的峰值。
68、本技术的一些方案中,所述晶型b,其具有基本上如图4所示的dsc图谱。
69、在一些实施方案中,所述结晶形式的式(i)所示化合物,其为晶型c,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):6.9,12.5,13.8,16.4,16.8,18.5,19.0,20.2,21.6。
70、本技术的一些方案中,所述晶型c,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):6.9,11.9,12.5,12.7,13.8,16.4,16.8,18.5,19.0,20.2,21.6。
71、本技术的一些方案中,所述晶型c,使用cu-kα辐射,其x-射线粉末衍射图谱包含在以下2θ角处的衍射峰(±0.2°):6.9,11.9,12.5,12.7,13.8,16.1,16.4,16.8,18.5,19.0,20.2,20.7,21.6。
72、本技术的一些方案中,所述晶型c,使用cu-kα辐射,其具有基本上如图7所示的x-射线粉末衍射图谱。
73、本技术的一些方案中,所述晶型c,其差示扫描量热曲线在112±5℃处出现吸热的峰值。第二方面,本技术提供了一种结晶组合物,包含如第一方面所述的结晶形式的式(i)化合物。
74、本技术的一些方案中,所述结晶组合物,包含式(i)化合物的晶型a、晶型b中的一种或多种。
75、本技术的一些方案中,所述晶型a占所述结晶组合物重量的10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、91%以上、
76、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上或99.5%以上。
77、优选地,所述晶型a占所述结晶组合物重量的50%以上、60%以上、70%以上、80%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上或99.5%以上。
78、本技术的一些方案中,所述晶型b占所述结晶组合物重量的50%以上、60%以上、70%以上、80%以上、90%以上或95%以上。
79、第三方面,本技术提供了一种药物组合物,包含固体形式的式(i)所示化合物。
80、本技术的一些方案中,所述药物组合物,包含固体形式的式(i)所示化合物以及药学上可接受的载体。
81、本技术的一些方案中,所述药物组合物,包含式(i)所示化合物的晶型a、晶型b、无定型中的一种或多种。
82、第四方面,本技术提供了一种药物组合物,包含如第一方面所述的结晶形式的式(i)所示化合物。
83、本技术的一些方案中,所述药物组合物,包含式(i)所示化合物的晶型a、晶型b中的一种或多种。
84、本技术的一些方案中,所述药物组合物,包含如第一方面所述的结晶形式的式(i)所示化合物,以及药学上可接受的载体。
85、本技术的一些方案中,所述药物组合物,包含式(i)所示化合物的晶型a、晶型b中的一种或多种,以及药学上可接受的载体。
86、第五方面,本技术提供了一种药物组合物,包含如第二方面所述的结晶组合物。
87、本技术的一些方案中,所述药物组合物,包含如第二方面所述的结晶组合物,以及药学上可接受的载体。
88、本技术的一些方案中,上述(第三、四、五方面)药物组合物,还包括其他组分,所述其他组分选自以下其它治疗剂中的一种、两种或多种,其中所述其它治疗剂选自:plpro(papain-like protease)抑制剂、主蛋白酶(mpro/3clpro)抑制剂、rdr-p(rna依赖性rna聚合酶)抑制剂、cyp3a4抑制剂等。
89、本技术的一些方案中,所述plpro抑制剂选自:阿匹莫德、eidd-2801、利巴韦林、伐昔洛韦、β-胸苷、阿司帕坦、氧烯洛尔、多西环素、醋奋乃静、碘普胺、核黄素、瑞普特罗、2,2′-环胞苷、氯霉素、氯苯甘油氨酯、左羟丙哌嗪、头孢孟多、氟尿苷、替吉环素、培美曲塞、l(+)-抗坏血酸、谷胱甘肽、橙皮素、腺苷蛋氨酸、马索罗酚、异维a酸、丹曲林、柳氮磺吡啶抗细菌药、水飞蓟宾、尼卡地平、西地那非、桔梗皂苷、白杨素、新橙皮苷、黄芩苷、sugetriol-3,9-二乙酸酯、(-)-表没食子儿茶素没食子酸酯、phaitanthrin d、2-(3,4-二羟基苯基)-2-[[2-(3,4-二羟基苯基)-3,4-二氢-5,7-二羟基-2h-1-苯并吡喃-3-基]氧基]-3,4-二氢-2h-1-苯并吡喃-3,4,5,7-四醇、2,2-二(3-吲哚基)-3-吲哚酮、(s)-(1s,2r,4as,5r,8as)-1-甲酰氨基-1,4a-二甲基-6-亚甲基-5-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢萘-2-基-2-氨基-3-苯基丙酸酯、白皮杉醇(piceatannol)、迷迭香酸和木兰醇。
90、本技术的一些方案中,所述3clpro抑制剂选自:赖甲环素、氯己定、阿夫唑嗪、西司他丁、法莫替丁、阿米三嗪、普罗加胺、奈帕芬胺(nepafenac)、卡维地洛、氨普那韦、替吉环素、孟鲁司特、胭脂红酸、含羞草氨酸、黄素、叶黄素、头孢匹胺、非奈西林、坎沙曲、尼卡地平、戊酸雌二醇、吡格列酮、考尼伐坦、替米沙坦、多西环素、土霉素、5-((r)-1,2-二硫杂环戊烷-3-基)戊酸(1s,2r,4as,5r,8as)-1-甲酰氨基-1,4a-二甲基-6-亚甲基-5-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢萘-2-基酯、betulonal、白杨素-7-o-β-葡萄糖醛酸苷、穿心莲内酯苷、2-硝基苯甲酸(1s,2r,4as,5r,8as)-1-甲酰氨基-1,4a-二甲基-6-亚甲基-5-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢萘-2-基酯、2β-羟基-3,4-裂环-木栓烷内酯-27-酸(s)-(1s,2r,4as,5r,8as)-1-甲酰氨基-1,4a-二甲基-6-亚甲基-5-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢萘-2-基-2-氨基-3-苯基丙酸酯、isodecortinol、啤酒甾醇、橙皮苷、新橙皮苷、andrograpanin、苯甲酸2-((1r,5r,6r,8as)-6-羟基-5-(羟基甲基)-5,8a-二甲基-2-亚甲基十氢萘-1-基)乙酯、大波斯菊苷(cosmosiin)、cleistocaltone a,2,2-二(3-吲哚基)-3-吲哚酮、biorobin、格尼迪木素、phyllaemblinol、3,3′-二-o-没食子酸茶黄素酯、迷迭香酸、kouitchensid e i、齐墩果酸、豆甾-5-烯-3-醇、脱乙酰基centa picrin和berchemol。
91、本技术的一些方案中,所述rdrp抑制剂选自:伐昔洛韦、氯己定、头孢布烯、非诺特罗、氟达拉滨、伊曲康唑、头孢呋辛、阿托伐醌、鹅去氧胆酸、色甘酸、泮库溴铵、可的松、替勃龙、新生霉素、水飞蓟宾、伊达比星溴隐亭、地芬诺酯、苄基青霉噻唑g(benzylpenicilloylg)、达比加群酯、betulonal、格尼迪木素、2β,30β-二羟基-3,4-裂环-木栓烷内酯-27-内酯,14-脱氧-11,12-二脱氢穿心莲内酯、gniditrin、3,3′-二-o-没食子酸茶黄素酯、(r)-((1r,5as,6r,9as)-1,5a-二甲基-7-亚甲基-3-氧代-6-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢-1h-苯并[c]氮杂环庚三烯-1-基)甲基2-氨基-3-苯基丙酸酯、2β-羟基-3,4-裂环-木栓烷内酯-27-酸、2-(3,4-二羟基苯基)-2-[[2-(3,4-二羟基苯基)-3,4-二氢-5,7-二羟基-2h-1-苯并吡喃-3-基]氧基]-3,4-二氢-2h-1-苯并吡喃-3,4,5,7-四醇、phyllaemblicin b、14-羟基香附烯酮(14-hydroxycyperotundone)、穿心莲内酯苷、2-((1r,5r,6r,8as)-6-羟基-5-(羟基甲基)-5,8a-二甲基-2-亚甲基十氢萘-1-基)乙基苯甲酸酯、穿心莲内酯、sugetriol-3,9-二乙酸酯、黄芩苷、5-((r)-1,2-二硫杂环戊烷-3-基)戊酸(1s,2r,4as,5r,8as)-1-甲酰氨基-1,4a-二甲基-6-亚甲基-5-((e)-2-(2-氧代-2,5-二氢呋喃-3-基)乙烯基)十氢萘-2-基酯、1,7-二羟基-3-甲氧基呫吨酮、1,2,6-三甲氧基-8-[(6-o-β-d-吡喃木糖基-β-d-吡喃葡萄糖基)氧基]-9h-呫吨-9-酮,和1,8-二羟基-6-甲氧基-2-[(6-o-β-d-吡喃木糖基-β-d-吡喃葡萄糖基)氧基]-9h-呫吨-9-酮、8-(β-d-吡喃葡萄糖基氧基)-1,3,5-三羟基-9h-呫吨-9-酮。
92、本技术的一些方案中,上述(第三、四、五方面)药物组合物,还包括另外的治疗剂,所述另外的治疗剂包括地奥司明、橙皮苷、mk-3207、维奈托克、双氢麦角汀、勃拉嗪、r428、ditercalinium、依托泊苷、替尼泊苷、uk-432097、伊立替康、lumacaftor、维帕他韦、eluxadoline、ledipasvir、洛匹那韦/利托那韦+利巴韦林、alferon和泼尼松。可用在本发明的方法中的其它额外药剂包括地塞米松、阿奇霉素、瑞德西韦、波普瑞韦、尤米诺韦、法维拉韦、利托那韦、奈非那韦、达芦那韦、新冠病毒中和抗体、法匹拉韦、iii型干扰素、ii型干扰素、i型干扰素、金花清感颗粒、连花清瘟胶囊、疏风解毒胶囊、透解祛瘟颗粒、化湿败毒颗粒、宣肺败毒颗粒、清肺排毒汤、新冠病毒感染1号方、新冠病毒感染2号方、新冠病毒感染3号方、喜炎平注射液、血必净注射液、热毒宁注射液、痰热清注射液、醒脑静注射液、参附注射液、生脉注射液或参麦注射液。
93、第六方面,本技术提供了如第一方面所述的结晶形式的式(i)所示化合物、如第二方面所述的结晶组合物、或前述(第三、四、五)药物组合物作为药物或在制备药物中的应用。
94、本技术的一些方案中,所述药物具有抗病毒的作用。
95、本技术的一些方案中,所述药物用于预防和/或治疗病毒性疾病。
96、本技术的一些方案中,所述药物用于预防和/或治疗由具有3c样蛋白酶的病毒引起的症状或疾病。
97、本技术的一些方案中,所述药物用于预防和/或治疗由具有主要蛋白酶mpro的病毒引起的症状或疾病。
98、本技术的一些方案中,所述药物用于预防和/或治疗由sars-cov-2感染引起的症状或疾病。
99、本技术的一些方案中,所述由sars-cov-2引起的症状或疾病选自:伴有发热、发冷、头痛、味觉减退、肌肉痛、全身感到倦怠的类感冒症状,或咽痛、流鼻涕、鼻塞、咳嗽、痰的呼吸道炎症,腹痛、呕吐、腹泻的胃肠症状,深部气道和肺泡损伤为特征的炎性反应、肺部纤维化、肺渗出性反应肺炎症状,进而伴有急性脑病、肾损伤、肝损伤、心力衰竭或心肌炎并发症。
100、定义和说明
101、除非另有说明,本文所用的下列术语和短语旨在含有下列含义。一个特定的短语或术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。
102、本技术提及的“固体形式的式(i)所示化合物”是指呈固体形态的式(i)所示化合物,包括式(i)所示化合物的结晶形式和无定型。
103、本技术提及的“结晶形式的式(i)所示化合物”是指呈结晶形态的式(i)所示化合物,包括式(i)所示化合物的无水且无溶剂形式、水合物形式和溶剂合物形式。所述结晶形式优选为无水且无溶剂形式或水合物形式;进一步优选为无水且无溶剂形式。
104、术语“溶剂化物”或“溶剂合物”是指化学计量比或非化学计量比的溶剂分子与本技术的式(i)所示化合物所形成的缔合物,包括同时含有水分子和一种或多种其它溶剂分子的缔合物,及仅含一种或多种其它溶剂分子的缔合物。例如,甲基叔丁基醚溶剂化物,优选为甲基叔丁基醚溶剂化物(计量比为1:1)。
105、术语“水合物”是指化学计量比或非化学计量比的水分子与本技术的式(i)所示化合物所形成的缔合物。
106、所述“无水且无溶剂形式”是指晶胞或晶格中不含水分子或溶剂分子,或者水分子或溶剂分子以非分子间力结合的方式与式(i)所示化合物共存,例如吸附的方式。
107、术语“结晶组合物”指的是一种固体形式,其包含本技术提及的晶型a、晶型b中的一种、两种或多种。而且,除了本技术的晶型以外,结晶组合物还可以任选地包含其它晶型或其它无定型形式的式(i)所示化合物或其盐,或者除了这些物质以外的杂质。本领域技术人员应当理解,结晶组合物中各成分的含量之和应当为100%。
108、所述“室温”为本领域常规意义上的室温温度,一般为10~30℃,优选25℃±5℃。
109、在x-射线粉末衍射图谱中,术语“基本上”或者“基本上如图所示”是指基本上纯净的某种晶型,其粉末x-射线衍射图谱中至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少96%,或至少97%,或至少98%,或至少99%的峰出现在所给图谱中。进一步的,当产品中某种晶型的含量逐渐降低时,其x-射线粉末衍射图谱中的一些归属于该晶型的衍射峰可能会由于仪器的检测灵敏度的因素而变少。此外,对任何给定的晶型而言,峰的位置可能存在轻微误差,这在晶体学领域中也是公知的。例如,由于分析样品时温度的变化、样品移动或仪器的标定等,峰的位置可以移动,2θ值的测定误差有时约为±0.3°,通常约为±0.2°。因此,在确定每种晶型结构时,应该将此误差考虑在内,术语“基本上”或者“基本上如附图所示”也意图涵盖衍射峰位中的这样的差异性,是指±0.3°,优选±0.2°。
110、在dsc图谱中,术语“基本上”或者“基本上如图所示”是指对于同种化合物的同种晶型,在连续的分析中,热转变起始温度、吸热峰峰值温度、放热峰峰值温度、熔点等的误差典型的在约8℃,通常在约5℃,通常约在3℃之内。当描述某个化合物具有某一给定的热转变起始温度、吸热峰峰值温度、放热峰峰值温度、熔点等时,指的是该温度±5℃。
111、在本文使用的术语“预防”是指当用于疾病或病症(例如病毒性疾病)时,与未施用化合物或药物(例如,本技术要求保护的组合产品)的受试者相比,所述化合物或药物能降低受试者体内的医学病症症状的频率或推迟其发病。
112、在本文中使用的术语“治疗”是指减轻、缓解或改善疾病或病症的症状,改善潜在的代谢引起的症状,抑制疾病或症状,例如阻止疾病或病症的发展、缓解疾病或病症、引起疾病或病症的消退、缓解疾病或病症引起的病况、或阻止疾病或病症的症状。
113、本技术的药物组合物可以采用本领域的常规方法制备得到。
114、在本技术的上下文中,术语“药学上可接受的载体”或“赋形剂”或“药学上可接受的辅料”或“药用可接受的辅料”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的那些辅料。术语“药用可接受的辅料”包括:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏着剂、抗氧剂、螯合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂等。本领域技术人员可根据实际需要选择具体的药用可接受的辅料。有关辅料的知识是本领域技术人员众所周知的,例如可以参考《药剂学》(崔福德主编,第5版,人民卫生出版社,2003)。
115、词语“包括(comprise)”或“包含(comprise)”及其英文变体例如comprises或comprising应理解为开放的、非排他性的意义,即“包括但不限于”。
116、在本技术的范围中,任一特征的各种选项可以与其它特征的各种选项相互组合,从而构成许多不同的实施方案。本技术意欲包括由所有技术特征的各种选项所组成的所有可能的实施方案。
117、本技术的中间体化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本技术的实施例。
118、本技术具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本技术的化学变化及其所需的试剂和物料。为了获得本技术的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
119、下面会通过实施例具体描述本技术,这些实施例并不意味着对本技术的任何限制。
120、本技术所使用的所有试剂、溶剂是市售的,无需进一步纯化即可使用。
121、技术效果
122、本技术提供的结晶形式的式(i)所示化合物,以及具体晶型,它们具有以下一种或多种有益效果:
123、(1)本发明得到的式(i)化合物晶型具有良好的性状,便于称量、转移、分离、纯化和储存。
124、(2)本发明得到的式(i)化合物晶型具有良好的结晶度;
125、(3)本发明得到的式(i)化合物晶型可操作性能优良,例如,易于纯化、过滤和分离,特别是晶型a,其制备简便,收率高;
126、(4)优选晶型具备良好的物理稳定性和化学稳定性,特别是晶型a,纯度高,可直接作为原料药使用,具有良好的药用前景;
127、(5)优选晶型具备良好的溶解度;
128、(6)优选晶型引湿性低,符合原料药存储的要求。
- 还没有人留言评论。精彩留言会获得点赞!