本发明涉及生物,特别涉及ifitm3基因的应用。
背景技术:
1、病毒是严格的细胞内寄生生物,在感染宿主细胞的过程中,细胞会表达一系列不同的宿主蛋白来发挥不同的功能进而抑制病毒的复制,这些蛋白被称为抗病毒宿主因子,是先天固有抗病毒免疫的重要组成部分,同时病毒也能够劫持宿主的一些蛋白来逃逸宿主的抗病毒作用,起到促进病毒复制的作用,这些宿主蛋白被称促病毒宿主因子。
2、冠状病毒属于尼多病毒目冠状病毒科,包含4个属,分别为阿尔法、贝塔、伽马和德尔塔四个属,其中属于贝塔冠状病毒属的sars-cov、mers-cov、sars-cov-2是本世纪暴发的三次冠状病毒疫情的病原体,给人类健康和社会经济带来了巨大的损失;属于阿尔法冠状病毒属的猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)、猪传染性胃肠炎病毒(tgev)和德尔塔冠状病毒属的pdcov主要感染猪群的消化道,给养猪业带来了巨大的经济损失;其中,sads-cov可感染人的原代肺和肝脏细胞,具有潜在跨种传播感染人的风险,而pdcov已有报道可感染小孩,因此sads-cov和pdcov都具有潜在感染人类造成流行的风险。属于阿尔法冠状病毒属的hcov-nl63、hcov-229e和属于贝塔冠状病毒属的hcov-oc43与hcov-hku1是引起常规感冒的主要病原体。
3、干扰素诱导跨膜蛋白(interferon inducible transmembraneproteins,ifitms)是一类小分子跨膜蛋白,在人类中包括ifitm1、ifitm2、ifitm3、ifitm5和ifitm10,主要由病毒感染后产生的干扰素应答信号所诱导表达,定位在细胞质膜、内体膜以及溶酶体膜上,之前的多项研究表明ifitm3可以有效抑制多种有囊膜和无囊膜病毒进入宿主细胞,包括埃博拉病毒、寨卡病毒、流感病毒、水疱性口炎病毒,但对于腺病毒、巨细胞病毒等病毒进入宿主细胞却没有作用。ifitm3在冠状病毒感染中的作用具有多样性,研究表明ifitm3的敲低能够增强hcov-nl63、hcov-229e、sars-cov和mers假病毒的入侵,然而ifitm3能够增强hcov-oc43病毒的入侵,同样的在sars-cov-2的研究中ifitms也表现出抑制感染和增强感染的两面性,在293t-ace2细胞中,ifitm3的过表达能够抑制sars-cov-2的感染和入侵,而在生理性相关的calu3中敲低ifitms特别是敲低ifitm2后却能够明显抑制sars-cov的感染。
4、但到目前为止,尚未有报道ifitm3在冠状病毒如猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)和猪德尔塔冠状病毒(pdcov)等感染中的作用。
5、对于冠状病毒如猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)和猪德尔塔冠状病毒(pdcov),一方面在养猪业造成巨大损失,一方面具有较大生物安全风险。但目前仍缺乏抑制这类病毒的感染复制的有效率策略;此外,用于不同冠状病毒如pedv和sads-cov的感染的敏感细胞较少,且多面临病毒感染复制效率低下、病毒培养的滴度较低等难题,这为冠状病毒临床毒株的分离和培养、毒种繁殖制备、弱毒疫苗生产、抗病毒药物的筛选、病毒感染复制机理研究等带来不便或者增加研发成本。
技术实现思路
1、有鉴于此,本发明提供了ifitm3基因的应用。本发明提供了抑制或者增强冠状病毒包括猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)和猪德尔塔冠状病毒(pdcov)的细胞感染效率的方法。本发明提供敲除ifitm3基因的细胞系,抑制冠状病毒的感染复制,提供一种新的抗病毒策略;而提高ifitm3的基因表达,增强冠状病毒的感染复制,可显著提高临床毒株分离成功率,提高毒种的培养和繁殖效率,增强疫苗生产产量,利于抗病毒药物筛选效率,有助于冠状病毒感染复制机理研究。
2、为了实现上述发明目的,本发明提供以下技术方案:
3、本发明提供了ifitm3基因在以下任意项中的应用:
4、(i)、制备敲除或敲低ifitm3基因的细胞;和/或
5、(ii)、制备过表达ifitm3基因的细胞;和/或
6、(iii)、制备抗病毒的产品;和/或
7、(iv)、制备调节病毒感染率的产品;和/或
8、(v)、制备提高临床病毒株分离成功率的产品;和/或
9、(vi)、制备提高病毒毒种的培养或繁殖效率的产品;和/或
10、(vii)、制备病毒;和/或
11、(viii)、生产弱毒疫苗;和/或
12、(ix)、制备用于筛选抗病毒药物的产品;和/或
13、(x)、研究病毒感染复制机理;和/或
14、(xi)、建立重组病毒感染动物模型。
15、在本发明的一些具体实施方案中,所述应用包括所述ifitm3基因的过表达在以下任意项中的应用:
16、(i)、制备过表达ifitm3基因的细胞;和/或
17、(ii)、制备提高病毒感染率的产品;和/或
18、(iii)、制备提高临床病毒株分离成功率的产品;和/或
19、(iv)、制备提高病毒毒种的培养或繁殖效率的产品;和/或
20、(v)、制备病毒;和/或
21、(vi)、生产弱毒疫苗;和/或
22、(vii)、制备用于筛选抗病毒药物的产品;和/或
23、(viii)、研究病毒感染复制机理;和/或
24、(ix)、建立重组病毒感染动物模型。
25、在本发明的一些具体实施方案中,所述应用包括所述ifitm3基因的敲除或敲低在以下任意项中的应用:
26、(i)、制备敲除或敲低ifitm3基因的细胞;和/或
27、(ii)、制备抗病毒的产品;和/或
28、(iii)、制备降低病毒感染率的产品;和/或
29、(iv)、生产弱毒疫苗。
30、在本发明的一些具体实施方案中,所述ifitm3基因具有如seq id no.6所示的核苷酸序列。
31、在本发明的一些具体实施方案中,所述病毒包括冠状病毒。
32、在本发明的一些具体实施方案中,所述冠状病毒包括猪流行性腹泻病毒pedv、猪急性腹泻病毒sads-cov或猪德尔塔冠状病毒pdcov中的任意一种或多种。
33、本发明还提供了细胞,包括ifitm3基因过表达的细胞或ifitm3基因敲除或敲低的细胞。
34、在本发明的一些具体实施方案中,所述细胞的来源包括人、猪或非洲绿猴中的任意一种或多种。
35、在本发明的一些具体实施方案中,所述细胞包括ipec-j2细胞、hala细胞或huh7细胞中的任意一种或多种。
36、本发明还提供了所述细胞的制备方法,所述ifitm3基因过表达细胞的制备方法包括如下步骤:
37、步骤1、构建ifitm3表达载体;
38、步骤2、将步骤1获得的ifitm3表达载体包装为表达ifitm3慢病毒;
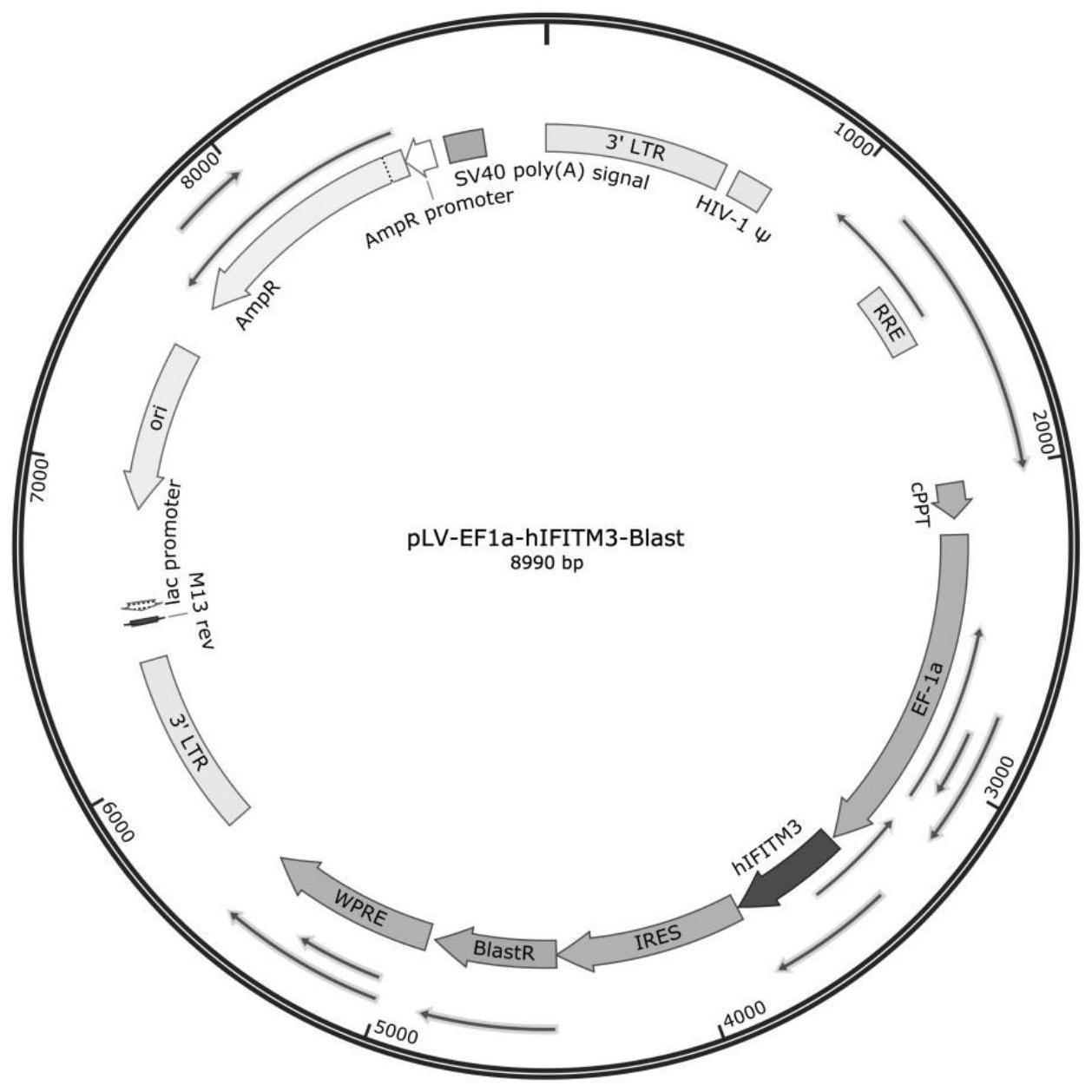
39、步骤3、将步骤2包装得到的表达ifitm3慢病毒转导至细胞,筛选获得所述细胞;或
40、所述ifitm3基因敲除或敲低细胞的制备方法包括如下步骤:
41、步骤1、将靶向敲除或敲低基因的sgrna与慢病毒载体连接,获得靶向敲除或敲低ifitm3的基因敲除或敲低载体;
42、步骤2、将步骤1获得的所述基因敲除或敲低载体包装为基因敲除或敲低慢病毒;
43、步骤3、将步骤2包装得到的基因敲除或敲低慢病毒转导至细胞,筛选获得所述细胞;
44、在本发明的一些具体实施方案中,所述步骤1获得的基因敲除或敲低载体:慢病毒包装质粒pspax:慢病毒包装质粒pmd2.g为2:2:1。
45、在本发明的一些具体实施方案中,所述sgrna具有如seq id no.5所示的核酸序列。
46、在本发明的一些具体实施方案中,所述ifitm3表达载体包括plv-ef1a-hifitm3-blast。
47、在本发明的一些具体实施方案中,所述慢病毒载体包括lenticrisprv2。
48、本发明还提供了调节冠状病毒感染率的方法,基于如下任意项调节冠状病毒感染率:
49、(i)、ifitm3基因的过表达;和/或
50、(ii)、ifitm3基因的敲除或敲低;和/或
51、(iii)、所述细胞;和/或
52、(iv)、所述制备方法制得的细胞。
53、在本发明的一些具体实施方案中,所述调节冠状病毒感染率的方法包括提高冠状病毒感染率的方法或降低冠状病毒感染率的方法。
54、在本发明的一些具体实施方案中,所述提高冠状病毒感染率的方法包括基于如下任意项以提高冠状病毒感染率:
55、(i)、ifitm3基因的过表达;和/或
56、(ii)、所述细胞;和/或
57、(iii)、所述制备方法制得的细胞。
58、在本发明的一些具体实施方案中,所述降低冠状病毒感染率的方法包括基于如下任意项以降低冠状病毒感染率:
59、(i)、ifitm3基因的敲除或敲低;和/或
60、(ii)、所述细胞;和/或
61、(iii)、所述制备方法制得的细胞。
62、在本发明的一些具体实施方案中,所述冠状病毒包括冠状病毒包括猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)或猪德尔塔冠状病毒(pdcov)中任意一种或多种。
63、本发明包括但不限于取得了如下有益效果:
64、本发明提供了抑制或者增强冠状病毒包括猪流行性腹泻病毒(pedv)、猪急性腹泻病毒(sads-cov)和猪德尔塔冠状病毒(pdcov)的细胞感染效率的方法。通过靶向ifitm3基因,敲低或敲除基因的表达,可有效抑制冠状病毒的感染复制;而提高ifitm3基因的表达,增强冠状病毒的感染,可应用于临床毒株的分离和培养、毒种繁殖制备、弱毒疫苗生产、抗病毒药物的筛选、病毒感染复制机理研究等。
