KRAS抑制剂、其制备方法及应用与流程
本公开涉及医药领域,特别涉及一种具有kras抑制作用的化合物、药物组合物、其用途及制备方法。
背景技术:
1、kirsten大鼠肉瘤2病毒癌基因同源物(kras)是一种是小gtp酶并且是ras家族的成员。kras蛋白结合gdp时处于失活状态;当细胞外的生长分化因子等将信号传递到kras蛋白时,增强蛋白与gtp结合并使之成为激活状态,从而激活kras及下游信号(nature reviewcancer 3:11-22,2003)。ras-raf-mek-erk以及ras-pi3k-akt等信号通路调节多个细胞过程,包括细胞增殖,分化和存活等。kras突变可以持续激活下游细胞信号,促进细胞增殖、迁移和抗凋亡,诱导肿瘤的发生。
2、kras突变和肿瘤形成和发展关系密切。kras在恶性肿瘤中的作用在30多年前就已被观察到(例如,参见santos等人,(1984)science223:661-664)。人类所有肿瘤中约有20%的肿瘤存在kras的异常表达,且在25-30%的肺腺癌中检测到kras突变(例如,参见samatarand poulikakos(2014)nat rev dmg disc 13(12):928-942doi:10.1038/nrd428)。80%的kras突变发生在第12位密码子,引起单个氨基酸的替换,其中最主要的是g12c和g12d。krasg12c突变是指蛋白的第12位甘氨酸突变为半胱氨酸,肿瘤的发生频率依次为胰腺癌(57%)、结直肠癌(35%)、胆管癌(28%)、小肠癌(17%)、肺癌(16%)、子宫内膜癌(15%)和卵巢癌(14%)等(seminars in cancer biology.2019jun 27.pii:s1044-579x(18)30060-9)。kras g12d突变是指蛋白的第12位甘氨酸突变为天冬氨酸,肿瘤的发生频率依次为胰腺癌(25.0%)、结肠癌(13.3%)、直肠癌(10.1%)、非小细胞肺癌(4.1%)和小细胞肺癌(1.7%)等(例如,参见the aacr project genie consortium,(2017)cancer discovery;7(8):818-831.datasetversion 4)。除了g12c,g12d以外,kras还有其他多个突变,例如g12v,g12a,g12r,g12s,g13d,y96d等。不同kras突变在不同类型的癌细胞中的发生频率也有所不同。
3、由于在各种肿瘤类型中发现了kras频繁突变,使其成为医药行业热门的抗癌靶点(参见mecormick(2015)clin cancer res.21(8):1797-1801)。开发kras小分子抑制剂通常分为三种方法:(i)竞争性配体阻止gtp结合;(ii)通过别构调节(allosteric modulation)将kras g12c锁在失活状态;(iii)通过蛋白-蛋白相互作用抑制剂破坏kras与其效应蛋白和guanine nucleotide exchange factors(gefs)(如son of sevenless(sos),raf,andpi3k)等。
4、过往几十年的靶向kras的药物研发大多以失败告终,所以kras曾被认为不能成药(undmggable)。但是近年来伴随着生物学及蛋白结构,包括对突变型和野生型kras蛋白不同结构的比较研究的突破进展,靶向kras g12c的小分子抑制剂已经在临床取得成功。amgen的first-in-classkras g12c抑制剂amg 510已经于2021年5月28日获得美国fda批准上市,用于治疗带有kras g12c突变的局部晚期或转移性非小细胞肺癌。mirati及国内外多家生物制药公司也在研发靶向kras的药物,但是绝大部分是针对kras g12c或kras g12d突变。如上所述,除了kras g12c或krasg12d突变外,kras还有其他多个突变,例如g12v,g12a,g12r,g12s,g13d,y96d等。这些kras突变在多种类型的癌症的形成和发展中发挥重要作用。因此,研发靶向这些kras突变的药物十分迫切。另外,随着靶向kras g12c药物的成功上市,我们预期接受治疗的癌症病人将会产生耐药。因此,针对这些未满足临床需求,研发对抗耐药机制的创新型靶向kras多种突变的新一代广谱kras抑制剂具有重要意义。
技术实现思路
1、本发明的一方面,提供一种结构新颖的取代的稠环芳香化合物,其作为kras突变的选择性及广谱抑制剂,具有较高的抑制活性。
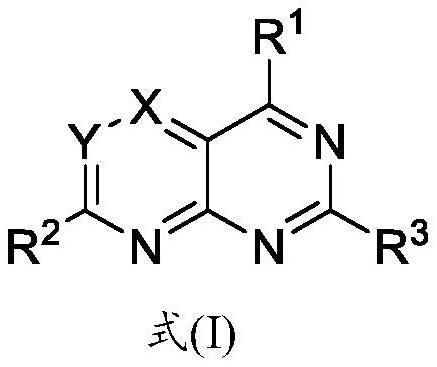
2、本发明的一方面,提供一种式(i)化合物、其药学上可接受的盐、立体异构体、溶剂合物或其前药:
3、
4、式(i)中,x、y选自-cr4或n,且x和y不同时为-cr4或n,其中r4选自-h、-d、卤素、-cf3、-oh、-cn、-nrarb、-c(o)ora、c1-6烷氧基、c1-6烷基、c2-6烯基或c2-6炔基:
5、r1为
6、r5、r6各自独立地为-h、-d、卤素、-cf3、-oh、=o、-cn、-nrarb、-c(o)ora或c1-6烷氧基,每一个取代位置的r7各自独立地选自-h、-d、卤素、-cf3、-oh、-cn、-nrarb、、-c(o)ora、c1-6烷氧基、c1-6烷基、c2-6烯基或c2-6炔基,p任选地为0、1、2、3、4、5或6;
7、代表没有化学键或单键或双键;
8、w选自n、c、o或s原子;
9、n任选为0、1或2;
10、m、q各自独立地任选为0或1;
11、r2选自5至6元单环杂芳基、c6-10芳基、8至10元双环杂芳基;
12、r3选自h、d、-c1-3烷氧基-c3-9环烷基、-c1-3烷氧基-3至9元杂环烷基、-c1-3烷氧基-5至6元单环杂芳基、-c1-3烷氧基-c6-10芳基或-c1-3烷氧基-8至10元双环杂芳基;
13、且所述的c1-6烷氧基、c1-6烷基、c2-6烯基、c2-6炔基、c3-9环烷基、3至9元杂环烷基、5至6元单环杂芳基、c6-10芳基或8至10元双环杂芳基任选地被0、1、2或3个独立地选自卤素、甲基、乙基、丙基、异丙基、乙烯基、1-烯丙基、2-烯丙基、乙炔基、丙炔基、三氟甲基、氨基、羟基、羧基、-c(o)nrarb的
14、取代基取代;
15、所述ra、rb各自独立地为h、d、c1-6烷基、-c1-3烷基-c3-9环烷基或-c1-3烷基-3至9元杂环烷基;
16、所述杂环烷基、单环杂芳基、双环杂芳基具有至少一个选自n、o和s的杂原子作为环原子;
17、所述卤素选自f、cl、br或i。
18、在一实施方案中,式(i)中,r1选自其中r5、r6、r7、ra、n、p、w的定义同前所述。
19、在一实施方案中,式(i)中,r2为其中,每一个取代位置的r8、r9各自独立地选自卤素、甲基、乙基、丙基、异丙基、乙烯基、1-烯丙基、2-烯丙基、乙炔基、丙炔基、三氟甲基、氨基、羟基、羧基、-c(o)nrarb,所述卤素优选为氟,g、f各自独立地任选为0、1、2或3,g、f各自独立地优选为0、1或2。
20、在一实施方案中,式(i)中,r3为其中d任选为1、2或3,a环选自c3-9环烷基、3至9元杂环烷基、5至6元单环杂芳基、c6-10芳基或8至10元双环杂芳基。
21、在一优选的实施方案中,式(i)中,r1选自以下结构:
22、
23、在一优选的实施方案中,式(i)中,r2选自以下结构:
24、
25、在一优选的实施方案中,式(i)中,r3选自以下结构:
26、
27、在一实施方案中,式(i)所述的化合物如式(ⅱ-a)、式(ⅱ-b)、式(ⅱ-c)或式(ⅱ-d)所示,
28、
29、式中,r2、r3、r4、r5、r6、r7、ra、rb、m、n、q、p的各自定义如前所述。
30、在一优选的实施方案中,式(i)所述的化合物如式(ⅱ-e)、式(ⅱ-f)、式(ⅱ-g)、式(ⅱ-h)或式(ⅱ-i)所示,
31、
32、
33、r2、r3、r4、r5、r6、r7、ra、rb、m、n、q、p的定义如前所述。
34、在一实施方案中,式(i)所述的化合物如式(ⅲ-a)或式(ⅲ-b)所示,
35、
36、r1、r2、r4、r5、r6、r7、m、n、q、p的定义如前所述,d、a环的定义如前所述。
37、在一优选实施方案中,式(i)所述的化合物如式(ⅲ-c)、式(ⅲ-d)、式(ⅲ-e)、式(ⅲ-f)、式(ⅲ-g)、式(ⅲ-h)、式(ⅲ-i)、式(ⅲ-j)、式(ⅲ-k)或式(ⅲ-l)所示,
38、
39、
40、r1、r2、r4、r5、r6、r7、m、n、q、p的定义如前所述,d、a环的定义如前所述。
41、在一优选实施方案中,所述化合物如式(ⅲ-m)、式(ⅲ-n)、式(ⅲ-o)或式(ⅲ-p)所示,
42、
43、
44、r1、r2、r4、r5、r6、r7、m、n、q、p的定义如前所述,d、a环的定义如前所述。
45、在一实施方案中,所述药学上可接受的盐包括但不限于盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、碳酸盐、乙酸盐、三氟乙酸盐、丙酸盐、甲磺酸盐、乳酸盐、苯磺酸盐、对甲苯磺酸盐、丁二酸盐、马来酸盐、富马酸盐、酒石酸盐、枸橼酸盐或苹果酸盐中任意一种或组合。
46、在一实施方案中,式(ⅰ)化合物包括但不限于以下所列结构,或其药学上可接受的盐、立体异构体、溶剂合物或其前药:
47、
48、
49、本发明的另一方面,提供一种上述化合物或其药学上可接受的盐、立体异构体、溶剂合物或其前药的制备方法,包括如下步骤,
50、
51、(1)化合物(i-1)与化合物(r1'h)经过取代反应,生成化合物(i-2),所述r1'h选自r1或boc取代的r1;
52、(2)所述化合物(i-2)与化合物经过suzuki偶联反应,生成化合物(m-a),所述r2h选自r2或保护基取代的r2;
53、(3)所述化合物(m-a)与化合物(r3h)经过偶联反应,生成化合物(m-b);
54、(4)所述化合物(m-b)在酸性条件下脱保护基,生成化合物(m);
55、所述r1、r2、r3的定义如前所述。
56、本发明的另一方面,提供一种药物组合物,所述组合物包含根据上述化合物、其药学上可接受的盐、立体异构体、溶剂合物、其前药、或上述方法制备得到的化合物和药学上可接受的辅料。
57、在一实施方案中,所述药物组合物中还包含另一种治疗癌症或免疫疾病的药物。
58、本发明的另一方面,提供一种上述化合物、其药学上可接受的盐、立体异构体、溶剂合物、其前药、或上述的方法制备得到的化合物在制备治疗癌症、免疫疾病或癌症患者预后评估的试剂盒中的用途。
59、本发明的另一方面,提供一种上述药物组合物在制备治疗癌症、免疫疾病或癌症患者预后评估的试剂盒中的用途。
60、在一实施方案中,所述用途为在与kras突变相关的疾病中的用途。
61、在一实施方案中,所述癌症包括但不限于胰腺癌、结直肠癌、肺癌、胆管癌、子宫内膜癌和卵巢癌等。
62、在一优选的实施方案中,所述癌症包括但不限于胰腺癌、结直肠癌、肺癌、胆管癌、小肠癌、子宫内膜癌和卵巢癌等。
63、在一实施方案中,所述免疫疾病为kras介导的免疫疾病。
64、本发明的另一方面,提供一种上述化合物、其药学上可接受的盐、立体异构体、溶剂合物、其前药、或上述的方法制备得到的化合物在制备kras抑制剂中的用途。
65、本发明的另一方面,提供一种上述药物组合物在制备kras抑制剂中的用途。
66、优选地,所述kras抑制剂为kras g12d抑制剂。
67、本发明的另一方面,提供一种抑制生物样品中的kras突变的方法,其包含使所述生物样品与根据上述化合物、其药学上可接受的盐、立体异构体、溶剂合物、其前药、或上方法制备得到的化合物、上述药物组合物接触。
- 还没有人留言评论。精彩留言会获得点赞!