一种人类ALK-E13;A20融合基因检测用DNA标准品及其制备方法、应用与流程
本发明属于生物,具体涉及一种人类alk-e13;a20融合基因检测用dna标准品及其制备方法、应用。
背景技术:
1、间变性淋巴瘤激酶(alk)融合基因型肺癌已成为继表皮生长因子(egfr)突变型肺癌之后的又一个肺癌分子亚型,具有明确的分子靶点、靶点检测技术及上市的靶向药物。
2、间变性淋巴瘤激酶(alk)是最新的酪氨酸激酶靶点之一,在大约5%的nsclc患者中被发现。alk重排的阳性率大约为3~5%,在腺癌、从未吸烟或少量吸烟的患者中eml4-alk融合的几率更高一种。alk是一种融合基因,属于跨膜受体酪氨酸激酶。eml4-alk融合基因定位于2号染色体的短臂上(2p21和2p23),其5’端为eml4的片段,3’端为alk的片段,由倒置后的eml4基因片段与残余的alk片段连接。eml4-alk的信号转导通路为pi3-k/akt、stat3/5、ras-mek和plc-γ/pip2等,这些通路与细胞存活、增殖和迁移密切相关。它已被证明在体内和体外都参与了肿瘤的发生和发展。在nsclc中,eml4与alk基因的融合点不同,有超过15种变异类型,其中v1(eml4 exon 13;alk exon 20-e13;a20)和v3a/v3b(eml4 exon6ins33;alk exon 20)是最常见的融合形式。eml4-alk基因融合可促使alk基因引起致癌融合蛋白的表达,引起基因表达和信号的激活和失调,进而促使表达这些蛋白的肿瘤细胞增殖和存活。
3、2011年,美国食品和药品管理局(fda)批准克唑替尼用于治疗间变型淋巴瘤激酶(alk)基因重排的非小细胞肺癌。克唑替尼是一种小分子酪氨酸激酶受体抑制剂,靶向分子包括alk、肝细胞生长因子受体(hgfr,c-met)和ros1。eml4-alk融合基因阳性患者不能从egfr-tki的基础治疗中受益,表现为原发耐药。而针对eml4-alk融合基因阳性的患者,使用克唑替尼等针对alk基因的小分子抑制剂可以获得良好的临床治疗效果。因此在使用针对alk基因的小分子抑制剂前,需进行eml4-alk融合基因突变的检测。
4、体外诊断试剂作为预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病预测的重要工具,其质量控制非常重要。体外诊断试剂标准物质对于控制体外诊断试剂产品质量、保证临床检测结果准确度,起着十分关键的作用。由于存在很多制约因素,现阶段诊断试剂国家标准物质供应尚不能完全满足注册、生产和质量控制的需要。
技术实现思路
1、为了解决以上问题,本发明的目的是提供一种人类alk-e13;a20融合基因突变检测用dna标准品产品,该产品标准品准确度高、均匀度良好。本发明首次建立了人类alk融合基因突变检测用dna标准品产品。
2、本发明还提供了人类alk-e13;a20融合基因突变检测用dna标准品产品的制备方法。
3、本发明为了实现上述目的所采用的技术方案为:
4、本发明提供了一种人类alk(e13;a20)融合基因突变检测用dna标准品,所述alk(e13;a20)融合基因的序列(如seq id no.1所示)为:
5、tgacttgcttctttcacttagttttttttgttttgttttgtttgtttgttttttgagatggagtttcactcttgttgcccaggctggagtgcagtggtctgatttttagctttgcatttactttaaatcatgcttcaattaaagacacaccttctttaatcattttattagtatttc。
6、本发明所制备的人类alk(e13;a20)融合基因突变检测用dna标准品,具体为:
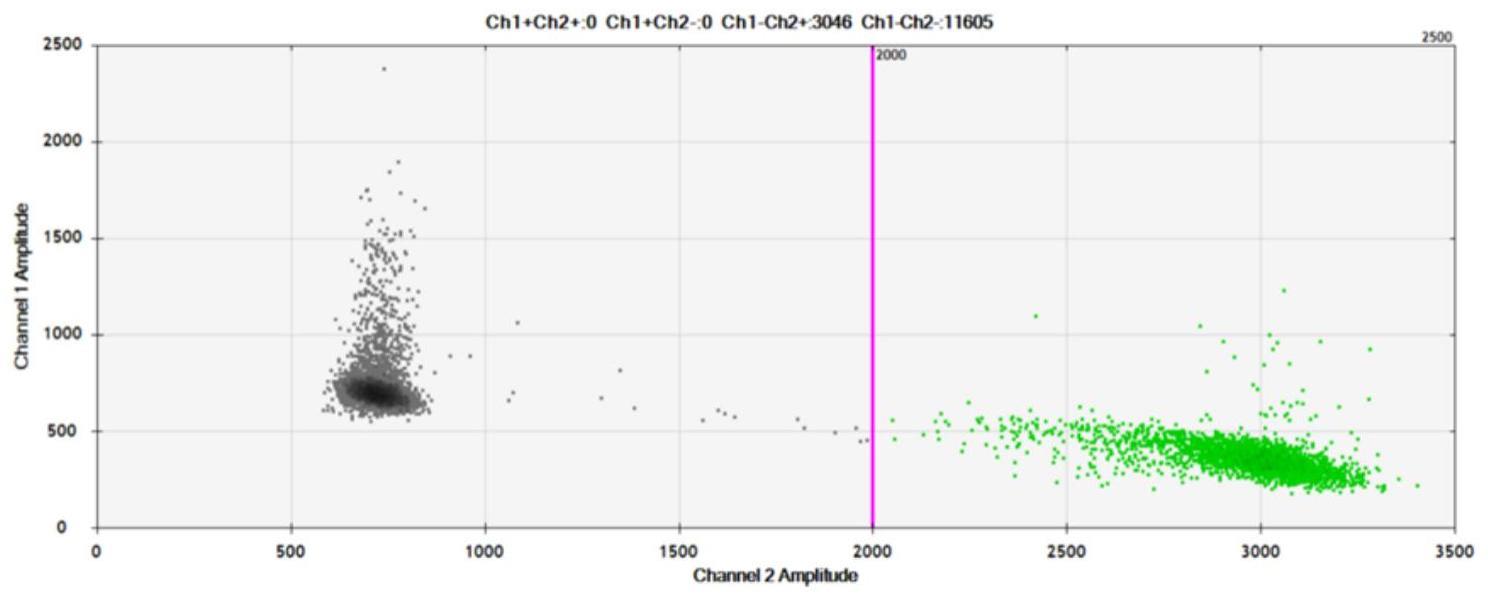
7、
8、本发明制备的上述人类alk(e13;a20)融合基因突变检测用dna标准品中:具体的,
9、所述ncih3122 gdna的基因序列(如seq id no.2所示)为:
10、atataaatggagtcatacaatgtgtggtcttttatgacttgcttctttcacttagttttttttgttttgttttgtttgtttgttttttgagatggagtttcactcttgttgcccaggctggagtgcagtggtctgatttttagctttgcatttactttaaatcatgcttcaattaaagacacaccttctttaatcattttattagtatttctaagtatgatggaaaggttcagagctcaggggaggatat;
11、所述hek293 gdna的序列(如seq id no.3所示)为:gtgtggtcttttatgacttgcttctttcacttagttttttttgttttgttttgtttgtttgttttttgagatggagtttcactcttgttgcccaggctggagtgcagtggtgcgatttcggctcactgaacctccgcctcccaggttcaagcgattctc。
12、进一步的,所述标准品测定用引物探针组为:
13、检测位点上游引物(如seq id no.4所示):
14、5’ttgagatggagtttcactcttgttg 3’
15、检测位点下游引物(如seq id no.5所示):
16、5’aaggtgtgtctttaattgaagcatg 3’
17、检测位点探针-fam(如seq id no.6所示):
18、5’aggctggagtgcagtggtctgatt 3’-bhq1
19、内参上游引物(如seq id no.7所示):
20、5’aaccaccagaacattgttcgc 3’
21、内参下游引物(如seq id no.8所示):
22、5’gtctctcggaggaaggacttga 3’
23、内参探针-vic(如seq id no.9所示):
24、5’gcattggggtgagcctgcaat 3’-bhq1。
25、本发明还提供了一种人类alk(e13;a20)融合基因突变检测用dna标准品的制备方法,包括以下步骤:
26、(1)提取含有alk(e13-a20)融合基因的ncih3122细胞系基因组dna以及野生型hek293细胞系基因组dna作为模板,通过sanger测序对alk(e13-a20)基因融合位点和野生型细胞系基因组dna进行测序验证;
27、(2)对eml4-akl融合位置碱基序列进行分析,设计引物探针;
28、(3)采用数字pcr的方法对ncih3122细胞系dna和hek293野生型细胞系dna的alk(e13;a20)融合基因突变频率进行测定,分别重复3次,取3次测定的平均值,作为ncih3122细胞系的突变频率;
29、(4)按照不同比例将ncih3122细胞系dna和hek293野生型细胞系dna进行混合,分别获得1%、2%和5%突变频率的alk(e13;a20)融合基因dna标准品,采用数字pcr法进行基因突变频率验证,以及进行标准品均匀性验证。
30、进一步的,所述数字pcr的扩增体系为:
31、 反应试剂 规格 用量 2xdroplet pcr supermix for probes(no dutp) 2x 10μl 检测位点上游引物 20μm 0.8μl 检测位点下游引物 20μm 0.8μl 检测位点探针-fam 10μm 0.5μl 内参上游引物 20μm 0.8μl 内参下游引物 20μm 0.8μl 内参探针-vic 10μm 0.5μl dna模板 - 25ng <![cdata[dd h<sub>2</sub>o]]> - up to 20μl
32、。
33、本发明的有益效果为:
34、(1)本发明制备的人类alk融合基因突变检测用dna标准品产品,产品标准品准确度高、均匀度良好。本发明首次建立了人类alk融合基因突变检测用dna标准品产品;
35、(2)本发明中alk(e13;a20)融合基因突变检测定量标准品,量值准确,适用性好。可用于数字pcr或其他方法的验证和性能评估。
- 还没有人留言评论。精彩留言会获得点赞!