杂环并苯环类化合物及其制备方法和用途与流程
本发明属于医药领域,具体地,本发明涉及一种杂环并苯环类化合物及其制备方法和用途。
背景技术:
1、微管是真核细胞中细胞骨架的重要组成部分,在维持细胞形态、信号传递、细胞器运输、细胞运动、细胞分裂和有丝分裂等多种细胞功能中发挥着重要作用。
2、微管由两种类型的微管蛋白亚基,即α-微管蛋白和β-微管蛋白组成,α-微管蛋白和β-微管蛋白形成微管蛋白异二聚体,是微管装配的基本单位。微管靶向剂(microtubule-targeting agents,mtas)能破坏微管的动力学稳定性和结构,干扰有丝分裂纺锤体的形成,诱导细胞周期阻滞于g2/m期,促使细胞凋亡。
3、微管参与很多重要的细胞过程,已成为治疗过度增殖性疾病最重要的药物靶点之一,美国fda批准的几种微管靶向剂如长春花碱和紫杉烷类化合物被广泛用于治疗多实体肿瘤和血液系统恶性肿瘤,但微管靶向药物的耐药性和剂量限制性毒性限制了其临床疗效。双靶点抑制剂与单靶点药物相比克服了耐药性,可以改善治疗效果,已成为研究热点,如:微管蛋白-src双靶点抑制剂、微管蛋白-受体酪氨酸激酶(receptor tyrosine kinasesinhibitor,rtk)双靶点抑制剂、微管蛋白-组蛋白去乙酰化酶(histone deacetylasesinhibitor,hdac)双靶点抑制剂等。
4、光化性角化病(actinic keratosis,ak)是一种与长时间暴露在紫外线下有关的皮肤病,在美国ak是皮肤科医生第二常见的疾病,特征是突变的角质形成细胞不受控制的增殖,其被认为是一种癌前病变,如果不及时治疗,20%的病例可能会发展为皮肤鳞状细胞癌(scc)。目前微管蛋白-src双靶点抑制剂tirbanibulin临床上局部治疗ak效果显著,已被fda批准上市,这表明开发新的具有更好效果的微管蛋白-src双靶点抑制剂局部治疗ak可能是一个有潜力的方向。
5、目前开发新的可抑制微管蛋白聚合或src激酶的化合物对于包括光化性角化病在内的众多疾病的治疗具有积极意义。
技术实现思路
1、本发明的目的是提供一种与现有技术完全不同的杂环并苯环类化合物。本发明的杂环并苯环类化合物对皮肤鳞状癌细胞具有良好的抑制细胞增殖作用,尤其是体内代谢快以及对皮肤刺激性小。
2、在本发明的第一方面,提供了式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药:
3、
4、其中,
5、环b为饱和、不饱和或部分饱和的5-6元杂环;
6、y为未取代或被一个或多个r1取代的c1-c6烷基;所述r1选自卤素、羟基、氨基、c1-c6烷基、c1-c6卤代烷基和c1-c6烷氧基;当r1为多个时,所述r1相同或不同;
7、z为c3-c8环烷基、3-11元杂环烷基、6-10元芳基或5-10元杂芳基,其中,所述c3-c8环烷基、3-11元杂环烷基、6-10元芳基、5-10元杂芳基任选地被一个或多个r2取代;当r2为多个时,所述r2相同或不同;
8、r2各自独立地选自卤素、羟基、氨基、氰基、羰基、氧代(=o)、羧基、c1-c6烷基、c2-c6烯基、c2-c6炔基、c1-c6卤代烷基、c1-c6烷基-oh、c1-c6烷基-c(=o)-、c1-c6烷基氰基、c1-c6烷氧基、c1-c6卤代烷氧基、c1-c6烷氧羰基、c1-c6烷氧基c1-c6烷基、c1-c6烷氧基-c(=o)-c1-c6烷基、c3-c8环烷基、c3-c8卤代环烷基、c3-c8环烷基羰基、c3-c8环烷基-c1-c6烷基-羰基、c3-c8环烷氧基、c3-c8卤代环烷氧基、任选具有1或2个c1-c6烷基基团的氨基羰基基团,c1-c6烷基磺酰基基团、任选具有1或2个c1-c6烷基基团的氨基磺酰基、c1-c6烷基磺酰基氨基基团和任选具有1或2个c1-c6烷基基团的氨基;
9、q为未取代或被一个或多个r3所取代的6-10元芳基、未取代或被一个或多个r3所取代的5-10元杂芳基;
10、所述杂芳基的杂原子为n、o或s,杂原子个数为1、2或3个;
11、所述r3各自独立地选自卤素、氰基、c1-c6烷基、c1-c6卤代烷基、c1-c6烷氧基、c3-c8环烷基、c3-c8卤代环烷基、c3-c8环烷氧基和c3-c8卤代环烷氧基;或者,当r3为多个时,被取代的6-10元芳基或5-10元杂芳基与r3一起形成含o饱和杂环;
12、ra、rb和rc不存在,或分别独立地为卤素、羟基、氰基、羰基、氧代(=o)、c2-c6烯基、c1-c6烷基、c2-c6炔基、c1-c6卤代烷基、c1-c6烷基-oh、c1-c6烷基-c(=o)-、c3-c8环烷基、c3-c8卤代环烷基、c1-c6烷氧基、c1-c6卤代烷氧基、-coo-c1-c6烷基或-c(o)nr4r5;其中,所述r4和r5各自独立地为氢或c1-c6烷基;
13、m、n、p、q分别独立地为0、1、2或3。
14、在本发明中,所述的如式i所示的化合物中某些取代基的定义可如下所述,未提及的取代基的定义均如上任一方案所述。
15、在本发明一优选实施方案中,各上述杂环、上述的杂芳基和各上述的杂环烷基中的杂原子独立地选自n、o和s中的一种,个数可以为1、2或3个。
16、较佳地,当所述杂原子含有s原子时,s原子上的孤对电子不被o原子取代形成
17、在本发明一优选实施方案中,上述的含o饱和杂环可以为3-11元含o饱和杂环。
18、在本发明一优选实施方案中,环b中,所述的饱和、不饱和或部分饱和的5-6元杂环为5-6元的杂芳环或5-6元的杂烯环,杂原子选自n、o和s中的一种或多种,个数为1、2或3个。
19、在本发明一优选实施方案中,环b为含有1、2或3个杂原子的饱和、不饱和或部分饱和的5-6元杂环;
20、较佳地,所述杂原子选自n、o和s的杂原子;当杂原子为多个时,所述杂原子相同或不同;
21、较佳地,环b为二氢呋喃(例如表示通过此处与苯环形成并环)、呋喃(例如表示通过此处与苯环形成并环)、二氢噻吩(例如表示通过此处与苯环形成并环)、噻吩(例如表示通过此处与苯环形成并环)、吡咯、二氢吡咯、咪唑、二氢咪唑、噁唑、二氢噁唑、噻唑、二氢噻唑、哌啶、四氢吡啶、吗啉、哌嗪、六氢嘧啶、四氢嘧啶、三嗪烷、四氢三嗪烷、四氢吡喃、二氢吡喃、四氢噻喃或二氢噻喃;
22、更佳地,环b为二氢呋喃、呋喃、二氢噻吩或噻吩。
23、在本发明一优选实施方案中,y中,所述未取代或被一个或多个r1取代的c1-c6烷基中的c1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。
24、在本发明一优选实施方案中,y为未取代或被甲基取代的c1-c6烷基;
25、较佳地,y为甲基。
26、在本发明一优选实施方案中,z为未取代或者被r2取代的3-11元饱和杂环;
27、所述r2为c1-c6烷基或c3-c8环烷基-c1-c6烷基-羰基,所述取代为1个或2个;当取代基为2个时,所述取代基相同或不同;
28、较佳地,所述3-11元饱和杂环具有1至3个选自n、o和s的杂原子。
29、在本发明一优选实施方案中,z为未取代或者被r2取代的5-10元饱和杂环;
30、所述5-10元饱和杂环为单环、并环、螺环或桥环。
31、在本发明一优选实施方案中,z为未取代或者被r2取代的5-8元单环、6-10元螺环、6-10元桥环或8-10元并环。
32、在本发明一优选实施方案中,z中,所述的3-11元杂环烷基为5、6、7或8元饱和的单环的杂环,6、7、8、9或10元饱和的螺环或桥环的杂环,或者8、9或10元饱的并环的杂环,具有1至3个选自n、o和s的杂原子,例如、6、7或8元饱和的单环的杂环。
33、较佳地,所述5、6、7或8元饱和的单环的杂环为吗啉基、1,4-氧杂庚烷基、氮杂环丁烷基、吡咯烷基或哌嗪基,例如吗啉基。
34、在本发明一优选实施方案中,r2中,所述卤素为氟、氯或溴,例如氟。
35、在本发明一优选实施方案中,r2中,所述c1-c6烷基和所述c3-c8环烷基-c1-c6烷基-羰基中的c1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
36、在本发明一优选实施方案中,r2中,所述c1-c6烷氧基为甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基或叔丁氧基,例如甲氧基。
37、在本发明一优选实施方案中,r2中,所述c3-c8环烷基-c1-c6烷基-羰基中的c3-c8环烷基为环丙烷基、环丁烷基、环戊烷基或环己烷基,例如环丙烷基。
38、较佳地,r2各自独立地选自卤素、c1-c6烷基、c1-c6烷氧基和c3-c8环烷基-c1-c6烷基-羰基。
39、较佳地,r2各自独立地选自氟、甲基、甲氧基和个数为1或2个。
40、在本发明一优选实施方案中,z为
41、较佳地,z为
42、在本发明一优选实施方案中,q中,所述未取代或被一个或多个r3所取代的6-10元芳基中的6-10元芳基为苯基或萘基,例如苯基。
43、在本发明一优选实施方案中,q中,所述未取代或被一个或多个r3所取代的5-10元杂芳基为5-6元杂芳基,所述5-6元杂芳基杂原子为n、o或s中的一种或多种,杂原子个数为1、2或3个。
44、在本发明一优选实施方案中,r3中,所述卤素为氟、氯或溴,例如氟。
45、在本发明一优选实施方案中,q为未取代或被r3取代的苯基、未取代或被r3所取代的5-6元杂芳基;
46、所述杂芳基的杂原子为n、o或s,杂原子个数为1、2或3个;
47、所述的r3取代为一个或多个取代,所述的r3各自独立地选自氢、卤素、氰基、c1-c6烷基、c1-c6烷氧基;或者,当r3为多个时,被取代的苯基或5-6元杂芳基与r3一起形成含o饱和杂环;
48、较佳地,q为未取代或被r3所取代的苯基;
49、较佳地,q为未取代或被氟所取代的苯基。
50、在本发明一优选实施方案中,q为
51、在本发明一优选实施方案中,ra中,所述卤素为氟、氯或溴,例如氟或氯。
52、在本发明一优选实施方案中,ra中,所述c1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
53、在本发明一优选实施方案中,ra中,所述c2-c6炔基为乙炔基、丙炔基或丁炔基,例如
54、在本发明一优选实施方案中,ra不存在,或分别独立地为卤素、羟基、氰基、c1-c6烷基、c1-c6氘代烷基、c2-c6炔基或c1-c6卤代烷基;
55、较佳地,ra不存在,或分别独立地为卤素、氰基、c1-c6烷基或c2-c6炔基;
56、较佳地,ra不存在,或分别独立地为氟、氯、氰基、甲基或丙炔基。
57、在本发明一优选实施方案中,rb不存在,或分别独立地为卤素、羟基、氰基、c1-c6烷基、c1-c6氘代烷基、c2-c6炔基或c1-c6卤代烷基;
58、较佳地,rb不存在,或分别独立地为卤素、氰基或c1-c6烷基;
59、较佳地,rb不存在,或为氟。
60、在本发明一优选实施方案中,rc中,所述c1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
61、在本发明一优选实施方案中,rc不存在,或分别独立地为卤素、羟基、c1-c6烷基、c1-c6氘代烷基、c1-c6卤代烷基或c1-c6烷氧基;
62、较佳地,rc不存在,或分别独立地为卤素或c1-c6烷基;
63、较佳地,rc不存在或为甲基。
64、在本发明一优选实施方案中,为
65、
66、在本发明一优选实施方案中,
67、在本发明一优选实施方案中,所述的如式i所示的化合物具有式i-1所示结构:
68、
69、其中,虚线表示可选的双键(为双键或单键);
70、当虚线不表示双键(即为单键)时,x1和x2分别独立地为c、nh、o或s;x1与x2中至少一个不为c;
71、当虚线表示双键时,x1为c,x2为nh、o或s;
72、ra、rb、rc、y、z、q、m、n、p和q的定义如本发明第一方面中所述。
73、较佳地,x1为c。
74、更佳地,x1为c,x2为o或s。
75、在本发明一优选实施方案中,所述的如式i所示的化合物具有结构:
76、
77、其中,x1和x2分别独立地为c、nh、o或s;x1与x2中至少一个不为c;
78、ra、rb、rc、y、z、q、m、n、p和q的定义如本发明第一方面中所述。
79、在本发明一优选实施方案中,所述的如式i所示的化合物具有式ii-1所示结构:
80、
81、较佳地,具有结构:
82、
83、其中,ra、rb、rc、y、z、q、m、n、p和q的定义如本发明第一方面中所述。
84、更佳地,所述式ii-1、式ii-1a和式ii-1b中,rc为不存在或c1-c6烷基;z为吗啉基;q为苯基。
85、最佳地,为
86、rb为不存在。
87、在本发明一优选实施方案中,所述的如式i所示的化合物具有式ii-2所示结构:
88、其中,ra、rb、rc、y、z、q、m、n、p和q的定义如本发明第一方面中所述。
89、在本发明一优选实施方案中,所述的如式i所示的化合物具有式ii-3所示结构:
90、其中,ra、rb、rc、y、z、q、m、n、p和q的定义如本发明第一方面中所述。
91、在本发明一优选实施方案中,所述的式ii-1为具有式ii-1c所示结构:
92、
93、式ii-1c中,n为0或1;p为0或1;ra和rc各自独立地为甲基、氟、氯或氰基。
94、较佳地,所述式ii-1c为具有式ii-1c-1或ii-1c-2所示结构
95、
96、其中,n为0或1;p为0或1;ra和rc各自独立地为甲基、氟、氯或氰基。
97、在本发明一优选实施方案中,所述的如式i所示的化合物选自下列任一化合物:
98、
99、在本发明一优选实施方案中,所述的如式i所示的化合物为:中在手性分离或手性分析中先出峰的化合物;
100、或者,中在手性分离或手性分析中后出峰的化合物。
101、所述手性分离和手性分析条件特别优选如下检测参数:
102、检测参数1:色谱柱:chiralcel od;流动相a:co2,流动相b:meoh和含有0.05%二乙胺的乙腈(例如meoh与乙腈的体积比为2:1);
103、更优选地,分离梯度为40%的meoh和含有0.05%二乙胺的乙腈的混合溶液的超临界流体二氧化碳;流速:3ml/min;检测器:pdacolumn;柱温:35℃;柱压:100bar。
104、检测参数2:色谱柱:chiralcel od-3 50×4.6mm i.d.,3μm;流动相a:超临界流体二氧化碳,流动相b:含有0.05%二乙胺的乙醇;所述先出峰的化合物的保留时间为1.204min;所述后出峰的化合物的保留时间为2.010min;
105、更优选地,梯度洗脱:含有0.05%二乙胺的乙醇的超临界流体二氧化碳,其比例由从5%到40%;流速:3ml/min;检测器:pdacolumn;柱温:35℃;柱压:100bar;
106、上述检测条件中的%均为体积百分比。
107、本领域技术人员根据上述检测参数,相应的选择和调整手性分析或者分离的条件,即可得到上述先出峰的化合物和上述后出峰的化合物,如采用高效液相法制备时,可采用上述检测参数中的高效液相分离条件,也可采用其他分离条件,只要获得的产物的检测参数与上述检测参数一致即可。
108、在本发明一优选实施方案中,所述的如式i所示的化合物为下列任一化合物:
109、
110、本发明第二方面,提供一种药物组合物,其特征在于,所述药物组合物包括:本发明第一方面中所述的式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药;和药学上可接受的载体。
111、本发明第三方面,提供了如本发明第一方面中所述的式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药的用途,或本发明第二方面所述的药物组合物的用途,所述用途包括:抑制微管蛋白聚合或src激酶;和/或,预防和/或治疗微管蛋白聚合介导或src激酶相关的疾病;和/或,制备用于抑制微管蛋白聚合或src激酶,和/或预防和/或治疗微管蛋白聚合介导或src激酶相关的疾病的药物、药物组合物或制剂。
112、较佳的,所述微管蛋白聚合介导或src激酶相关的疾病包括:肿瘤、皮肤疾病和/或其它疾病的一种、两种或更多种。
113、较佳地,所述肿瘤包括但不限于:实体瘤、肉瘤、血液系统癌症,亚型有乳腺癌、卵巢癌、前列腺癌、子宫颈癌、睾丸癌、结肠癌、结肠直肠癌、肝癌、非小细胞肺癌、鳞状细胞癌、小细胞肺癌、胃癌、胃肠道间质瘤、胰腺癌、膀胱癌、生殖细胞瘤、肥大细胞瘤、肥大细胞增多症、胶质母细胞瘤、神经母细胞瘤、星形细胞瘤、黑色素瘤、b细胞淋巴瘤、t细胞淋巴瘤、缓慢进展淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、急性髓细胞性白血病、急性淋巴细胞性白血病、慢性髓细胞性白血病、慢性淋巴细胞性白血病、骨髓瘤和/或骨髓增生异常综合症
114、较佳地,所述皮肤疾病包括但不限于:光化性角化病、银屑病、异位性皮炎、牛皮癣、白癜风、玫瑰疹和/或系统性红斑狼疮。
115、较佳地,所述其他疾病包括但不限于:自身免疫型糖尿病、糖尿病视网膜病变、肝纤维化、肺纤维化(包括特发性肺纤维化等)、肾纤维化、阿尔茨海默病、帕金森病、亨廷顿舞蹈症、肌萎缩侧索硬化、脊髓小脑退行性病变、动脉粥样硬化、贫血、镰刀形红细胞贫血症、地中海贫血症、骨关节炎、类风湿性关节炎、疟疾、锥形虫病、蠕虫病、原虫感染、多发性硬化症、狼疮、哮喘、过敏性鼻炎和/或炎性肠病。
116、在本发明第四方面,提供一种抑制微管蛋白聚合或src激酶,或预防和/或治疗微管寡聚化或src激酶相关的疾病的方法,包括步骤:给需要的对象施用本发明第一方面所述的式i所示化合物、其互变异构体、立体异构体、水合物、溶剂化物、药学上可接受的盐或前药。
117、在本发明第五方面,提供一种如本发明第一方面中所述的式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药的用途,或本发明第二方面所述的药物组合物的用途,所述的用途为制备治疗和/或预防光化性角化病的药物。
118、所述的光化性角化病优选为鳞状皮肤癌。
119、在本发明第六方面,提供一种治疗和/或预防上述的防光化性角化病的治疗方法,其包括给需要的对象施用如本发明第一方面中所述的式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药的用途,或本发明第二方面所述的药物组合物。
120、在本发明第七方面,提供一种上述式i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药的制备方法,其包括如下步骤:
121、在碱性试剂(例如碳酸钠)和钯催化剂(例如四(三苯基膦)钯)存在下,将化合物ii和化合物ii在溶剂中进行suzuki反应,得到所述式i所示化合物;
122、
123、其中,x3为卤素(例如溴),环b、ra、rb、rc、y、z、q、m、n、p和q的定义如上所述。
124、在本发明第八方面,提供一种式ii所示化合物或式iv所示化合物:
125、
126、其中,x4为卤素(例如氯、溴、碘),环b、ra、rc、n、p和q的定义如上所述。
127、所述的式ii所示化合物优选为
128、所述的式iv所示化合物优选为
129、本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
130、术语和定义
131、除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当属于本技术说明书记载的范围内。
132、除非另有定义,否则本文所有科技术语具有的涵义与权利要求主题所属领域技术人员通常理解的涵义相同。除非另有说明,本文全文引用的所有专利、专利申请、公开材料通过引用方式整体并入本文。如果本文对术语有多个定义,以本章的定义为准。
133、应理解,上述简述和下文的详述为示例性且仅用于解释,而不对本发明主题作任何限制。在本技术中,除非另有具体说明,否则使用单数时也包括复数。必须注意,除非文中另有清楚的说明,否则在本说明书和权利要求书中所用的单数形式包括所指事物的复数形式。还应注意,除非另有说明,否则所用“或”、“或者”表示“和/或”。此外,所用术语“包括”以及其它形式,例如“包含”、“含”和“含有”并非限制性。
134、除非另有说明,否则采用本领域技术范围内的常规方法,如质谱、nmr、ir和uv/vis光谱法和药理学方法。除非提出具体定义,否则本文在分析化学、有机合成化学以及药物和药物化学的有关描述中采用的术语是本领域已知的。可在化学合成、化学分析、药物制备、制剂和递送,以及对患者的治疗中使用标准技术。例如,可利用厂商对试剂盒的使用说明,或者按照本领域公知的方式或本发明的说明来实施反应和进行纯化。通常可根据本说明书中引用和讨论的多个概要性和较具体的文献中的描述,按照本领域熟知的常规方法实施上述技术和方法。在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。
135、当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。举例而言,ch2o等同于och2。如本文所用,表示基团的连接位点。
136、本文所用的章节标题仅用于组织文章的目的,而不应被解释为对所述主题的限制。本技术中引用的所有文献或文献部分包括但不限于专利、专利申请、文章、书籍、操作手册和论文,均通过引用方式整体并入本文。
137、除前述以外,当用于本技术的说明书及权利要求书中时,除非另外特别指明,否则以下术语具有如下所示的含义。
138、本技术说明书和权利要求书记载的数值范围,当该数值范围被理解为“整数”时,应当理解为记载了该范围的两个端点以及该范围内的每一个整数。例如,“1~6的整数”应当理解为记载了0、1、2、3、4、5和6的每一个整数。当该数值范围被理解为“数”时,应当理解为记载了该范围的两个端点以及该范围内的每一个整数以及该范围内的每一个小数。例如,“1~10的数”应当被理解为不仅记载了1、2、3、4、5、6、7、8、9和10的每一个整数,还至少记载了其中每一个整数分别与0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9的和。
139、在本技术中,“取代”是指分子中的氢原子被其它不同的原子或基团所替换,或者是分子中原子的孤对电子被其它的原子或基团替换。例如s原子上的孤对电子可被o原子取代形成
140、在本技术中,“饱和的、部分饱和的或不饱和的”包括被氢饱和的取代基、完全被氢不饱和的取代基和部分被氢饱和的取代基。
141、在本技术中,在单独或作为其他取代基一部分时,术语“卤素”是指氟、氯、溴、碘。
142、如本文所用,在单独或作为其他取代基一部分时,术语"氰基"表示-cn。
143、如本文所用,在单独或作为其他取代基一部分时,术语"氨基"表示-nh2。
144、如本文所用,在单独或作为其他取代基一部分时,术语“烷基”意指仅由碳原子和氢原子组成、不含不饱和键、具有例如1至6个碳原子且通过单键与分子的其余部分连接的直链或支链的烃链基团。烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基,叔丁基,戊基,异戊基,新戊基和己基。烷基可以是未取代的或被一个或多个合适的取代基取代。烷基也可以是富含碳和/或氢的同位素(即氘或氚)的天然丰度烷基的同位素异构体。如本文所用,术语“烯基”表示无支链或支链的单价烃链,其含有一个或多个碳-碳双键。如本文所用,术语“炔基”是指无支链或支链的一价烃链,其含有一个或多个碳-碳三键。
145、在单独或作为其他取代基一部分时,术语“c1-c6烷基”应理解为表示具有1、2、3、4、5或6个碳原子的直链或支链饱和一价烃基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等或它们的异构体。特别地,所述基团具有1、2或3个碳原子(“c1-c3烷基”),例如甲基、乙基、正丙基或异丙基。
146、在单独或作为其他取代基一部分时,“卤代烷基”指包括具有特定数目的碳原子、被一或多个卤素取代的支链和直链的饱和脂族烃基(如-cvfw,其中v=1至3,w=1至(2v+1))。卤代烷基的实例包括,但不限于三氟甲基、三氯甲基、五氟乙基、五氯乙基、2,2,2-三氟乙基、七氟丙基和七氯丙基。
147、在单独或作为其他取代基一部分时,术语“环烷基”或“碳环基”是指一种环状烷基。术语“m-n元环烷基”或者“cm-cn环烷基”应理解为表示具有m至n个原子的饱和、不饱和或部分饱和的碳环。例如,“3-15元环烷基”或者“c3-c15环烷基”是指含有3至15,3至9,3至6或3至5个碳原子的环状烷基,它可能包含1至4个环。“5-8元环烷基”则含有5-8个碳原子。包括单环、二环、三环、螺环或桥环。未取代的环烷基的实例包括但不限于环丙基,环丁基,环戊基,环己基和金刚烷基,或者是双环烃基如十氢化萘环。环烷基可以被一个或多个取代基取代。在一些实施方案中,环烷基可以是与芳基或杂芳基稠合的环烷基。术语“c3-c6环烷基”应理解为表示饱和的一价单环或双环烃环,其具有3~6个碳原子,包括稠合或桥接的多环系统。例如环丙基、环丁基、环戊基、环己基。
148、在单独或作为其他取代基一部分时,术语“杂环烷基”是指其中一个或多个(在一些实施方案中为1至3个)碳原子被杂原子取代的环烷基,所述杂原子例如但不限于n、o、s和p。术语“m-n元杂环烷基”应理解为表示具有m至n个原子的饱和、不饱和或部分饱和的环,其中杂环原子选自n、o、s、p,优选地选自n、o或s。例如,术语“4-8元杂环烷基”或者“c4-c8杂环烷基”应理解为表示具有4至8个原子的饱和、不饱和或部分饱和的环,其中1、2、3、或4个环原子选自n、o、s、p,优选地选自n、o或s。“4-10元杂环基”则是表示具有4至10个原子的饱和、不饱和或部分饱和的环。在一些实施方案中,杂环烷基可以是与芳环基或杂芳环基稠合的杂环烷基。当诸如4-8元或4-10元的前缀用于表示杂环烷基时,碳的数目也意味着包括杂原子。包括单环、二环、三环、螺环或桥环。杂环烷基的示例为:吡咯烷基、四氢呋喃基、四氢吡喃基、四氢噻吩基、四氢吡啶基、四氢吡咯基、氮杂环丁烷基、噻唑烷基、唑烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、氮杂环庚烷基、二氮杂环庚烷基、氧氮杂环庚烷基等。术语“杂环烷基”可以和术语“杂烷环”、“杂环”、“杂环环烷烃”交换使用。
149、在单独或作为其他取代基一部分时,术语“部分饱和的杂环”是指具有杂原子的单环基团(该单环基团具有双键、但不具有芳香性),优选含有1个、2个或3个独立选自n、o和s的环杂原子的单环。部分饱和的杂环的示例为:二氢呋喃基、二氢噻吩基、二氢吡咯基、二氧杂环戊烯基、二氢咪唑基、二氢吡唑基、二氢噻唑基、二氢异噻唑基、二氢噁二唑基、二氢噻二唑基、二氢三唑基、二氢四唑基、四氢吡啶基、3,4-二氢-2h-吡喃、吡喃基、噻喃基、二氢吡啶基、二氢吡嗪基、二氢嘧啶基、噁嗪基、二氢四唑基等。
150、在单独或作为其他取代基一部分时,术语“烯基”是指指具有至少一个碳-碳sp2双键的二到四十个碳原子的直链或支链的一价烃基(例如c2-c6烯基,又例如c2-c4烯基),并且包括具有“顺式”和“反式”取向或者“e”和“z”取向的基团。烯基的实例包括但不限于乙烯基和烯丙基。
151、在单独或作为其他取代基一部分时,术语“炔基”是指具有至少一个碳-碳sp三键的二到四十个碳原子的直链或支链的单价烃基(例如c2-c6炔基,又例如c2-c4炔基)。炔基的实例包括但不限于乙炔基和丙炔基。
152、在单独或作为其他取代基一部分时,术语“烷氧基”是指基团-o-rx,其中,rx为如上文所定义的“烷基”。
153、在单独或作为其他取代基一部分时,术语“氧代”是指亚甲基上的两个氢被氧取代,也即亚甲基被羰基替代。
154、在单独或作为其他取代基一部分时,术语“芳基”是指具有6到20个碳原子的单环或多环碳环,其中至少一个环是芳香环。当其中一个环是非芳香环时,该基团可通过芳香环连接,也可通过非芳香环连接。芳基的实例包括但不限于:苯基、萘基、四氢萘基、2,3-二氢化茚基、联苯基、菲基、蒽基和苊基。
155、在单独或作为其他取代基一部分时,术语“杂芳环”是指单环或多环碳环,其中至少一个环原子为独立地选自氧、硫和氮的杂原子,其余的环原子为c,其中至少一个环是芳香环。该基团可为碳基团或杂原子基团(也即其可为c-连接的或n-连接的,只要其是可能的即可)。当其中一个环是非芳香环时,该基团可通过芳香环连接,也可通过非芳香环连接。杂芳基的实例包括但不限于:咪唑基、吖啶基、咔唑基、噌啉基、喹喔啉基、吡唑基、吲哚基、苯并三唑基、呋喃基、噻吩基、苯并噻吩基、苯并呋喃基、喹啉基、异喹啉基、噁唑基、异噁唑基、吲哚基、吡嗪基、哒嗪基、吡啶基、嘧啶基、吡咯基、n-甲基吡咯基和四氢喹啉。术语“杂芳环”可以和术语“杂芳香环”、“杂芳基”或“杂芳环基”交换使用。
156、在单独或作为其他取代基一部分时,术语“并环”指稠合的双环化合物,其中两个环共享两个相邻原子。换句话说,环共享一个共价键,即桥头原子直接连接(例如α-崖柏烯和萘烷)。并环的实例包括但不限于:
157、
158、在单独或作为其他取代基一部分时,术语“螺环”指单环之间共用一个碳原子(称螺原子)的多环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。根据环与环之间共用螺原子的数目将螺环烷基分为单螺环烷基、双螺环烷基或多螺环烷基,优选为单螺环烷基和双螺环烷基。螺环烷基的非限制性实例包括:
159、
160、也包含单螺环烷基与杂环烷基共用螺原子的螺环烷基,非限制性实例包括:
161、
162、术语“桥环”是指化合物中的任意两个环共用两不直接相连的碳原子的环烃,根据组成环的数目分为二环烃、三环烃、四环烃等。非限制性实例包括:
163、
164、在单独或作为其他取代基一部分时,“卤代烷基”指包括具有特定数目的碳原子、被一或多个卤素取代的支链和直链的饱和脂族烃基(如-cvfw,其中v=1至3,w=1至(2v+1))。卤代烷基的实例包括,但不限于三氟甲基、三氯甲基、五氟乙基、五氯乙基、2,2,2-三氟乙基、七氟丙基和七氯丙基。
165、术语“惰性溶剂”包括但不限于:甲苯、苯、水、甲醇、乙醇、异丙醇、乙二醇、n-甲基吡咯烷酮、二甲基亚砜、四氢呋喃二氯甲烷、三氯甲烷、1,2-二氯乙烷、乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二氧六环,或其组合物。
166、本文提供的化合物,包括可用于制备本文提供的化合物的中间体,其含有反应性官能团(例如但不限于羧基,羟基和氨基部分),还包括其保护的衍生物。“受保护的衍生物”是其中一个或多个反应性位点被一个或多个保护基团(也称为保护基团)封闭的那些化合物。合适的羧基部分保护基包括苄基,叔丁基等,以及同位素等。合适的氨基和酰氨基保护基包括乙酰基,三氟乙酰基,叔丁氧基羰基,苄氧基羰基等。合适的羟基保护基包括苄基等。其他合适的保护基团是本领域普通技术人员所熟知的。
167、在本技术中,“任选的”或“任选地”表示随后描述的事件或状况可能发生也可能不发生,且该描述同时包括该事件或状况发生和不发生的情况。例如,“任选地被取代的芳基”表示芳基被取代或未被取代,且该描述同时包括被取代的芳基与未被取代的芳基。
168、在本技术中,术语“盐”或“药学上可接受的盐”,包括药学上可接受的酸加成盐和药学上可接受的碱加成盐。术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
169、“药学上可接受的酸加成盐”是指能够保留游离碱的生物有效性而无其它副作用的,与无机酸或有机酸所形成的盐。“药学上可接受的碱加成盐”是指能够保持游离酸的生物有效性而无其它副作用的、与无机碱或有机碱所形成的盐。除了药学可接受的盐外,本发明还考虑其他盐。它们可以在化合物纯化中或在制备其它药学上课接受的盐中充当中间体或可用于本发明化合物的鉴别、表征或纯化。
170、术语“胺盐”是指用酸中和烷基伯胺、仲胺或叔胺得到的产物。所述酸包括本技术中所述的无机酸或有机酸。
171、术语“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体、非对应异构体和构象异构体。
172、依据原料和方法的选择,本发明化合物可以以可能的异构体中的一个或它们的混合物的形式存在,例如作为纯旋光异构体,或作为异构体混合物,如作为外消旋和非对映异构体混合物,这取决于不对称碳原子的数量。当描述具有光学活性的化合物时,使用前缀d和l或r和s来表示就分子中的手性中心(或多个手性中心)而言分子的绝对构型。前缀d和l或(+)和(–)是用于指定化合物所致平面偏振光旋转的符号,其中(–)或l表示化合物是左旋的。前缀为(+)或d的化合物是右旋的。
173、当将本发明式中与手性碳的键描写直成线时,应当理解为,手性碳的(r)和(s)两种构型和由此产生的其对映体纯的化合物和混合物两者包括在该通式范围内。本文中消旋体或者对映体纯的化合物的图示法来自maehr,j.chem.ed.1985,62:114-120。用楔形键和虚线键表示一个立体中心的绝对构型。
174、术语“互变异构体”是指因分子中某一原子在两个位置迅速移动而产生的官能团异构体。本发明化合物可表现出互变异构现象。互变异构的化合物可以存在两种或多种可相互转化的种类。质子移变互变异构体来自两个原子之间共价键合的氢原子的迁移。互变异构体一般以平衡形式存在,尝试分离单一互变异构体时通常产生一种混合物,其理化性质与化合物的混合物是一致的。平衡的位置取决于分子内的化学特性。例如,在很多脂族醛和酮如乙醛中,酮型占优势;而在酚中,烯醇型占优势。本发明包含化合物的所有互变异构形式。
175、在本技术中,“药物组合物”是指本发明化合物与本领域通常接受的用于将生物活性化合物输送至哺乳动物(例如人)的介质的制剂。该介质包括药学上可接受的载体。药物组合物的目的是促进生物体的给药,利于活性成分的吸收进而发挥生物活性。
176、在本技术中,“药学上可接受的载体”包括但不限于任何被相关的政府管理部门许可为可接受供人类或家畜使用的佐剂、载体、赋形剂、助流剂、增甜剂、稀释剂、防腐剂、染料/着色剂、矫味剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。
177、术语“溶剂化物”指本发明化合物或其盐包括以分子间非共价力结合的化学计量或非化学计量的溶剂,当溶剂为水时,则为水合物。
178、术语“前药”是指可以在生理条件下或者通过溶剂解转化为具有生物活性的本发明化合物。本发明的前药通过修饰在该化合物中的功能基团来制备,该修饰可以按常规的操作或者在体内被除去,而得到母体化合物。前药包括本发明化合物中的一个羟基或者氨基连接到任何基团上所形成的化合物,当本发明化合物的前药被施予哺乳动物个体时,前药被割裂而分别形成游离的羟基、游离的氨基。
179、本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氘(2h),氚(3h),碘-125(125i)或c-14(14c)。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。
180、术语“辅料”是指可药用惰性成分。术语“赋形剂”的种类实例非限制性地包括粘合剂、崩解剂、润滑剂、助流剂、稳定剂、填充剂和稀释剂等。赋形剂能增强药物制剂的操作特性,即通过增加流动性和/或粘着性使制剂更适于直接压缩。
181、本文所用的术语“治疗”和其它类似的同义词包括以下含义:
182、(i)预防疾病或病症在哺乳动物中出现,特别是当这类哺乳动物易患有该疾病或病症,但尚未被诊断为已患有该疾病或病症时;
183、(ii)抑制疾病或病症,即遏制其发展;
184、(iii)缓解疾病或病症,即,使该疾病或病症的状态消退;或者
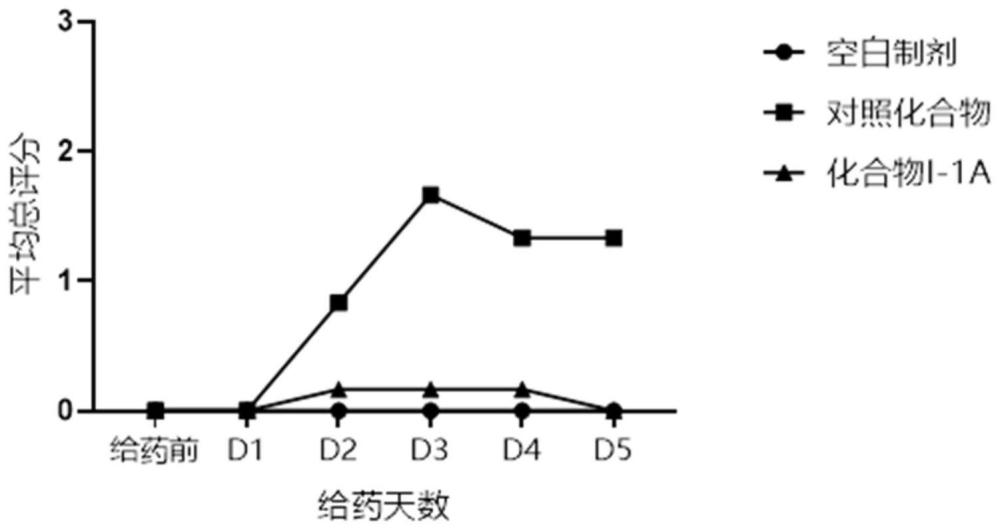
185、(iv)减轻该疾病或病症所造成的症状。
186、术语“预防”是指获得或发生疾病或障碍的风险降低。
187、术语“患者”是指根据本发明的实施例,即将或已经接受了该化合物或组合物给药的任何动物,哺乳动物为优。术语“哺乳动物”包括任何哺乳动物。哺乳动物的实例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、家兔、豚鼠、猴、人等,以人类为优。
188、术语“治疗有效量”是指在给予患者时,足以有效治疗本文所述的疾病或病症的化合物的量。“治疗有效量”将根据化合物、病症及其严重度、以及欲治疗患者的年龄而变化,可由本领域技术人员根据需要进行调整。
189、各步骤的反应,反应温度可因溶剂、起始原料、试剂等适宜选择,反应时间也可因反应温度、溶剂、起始原料、试剂等适宜选择。各步骤反应结束后,目标化合物可按常用方法自反应体系中进行分离、提纯等步骤,如过滤、萃取、重结晶、洗涤、硅胶柱层析等方法。在不影响下一步反应的情况下,目标化合物也可不经过分离、纯化直接进入下一步反应。
190、在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
191、本发明所用试剂和原料均市售可得。
192、本发明的积极进步效果在于:本发明人经过广泛而深入地研究,意外地开发了一种全新结构的化合物或其药学上可接受的盐及制备方法和用途;
193、通过细胞增殖抑制试验,本发明化合物能明显抑制人皮肤鳞状细胞增殖;进一步地经过小鼠药代动力学和皮肤刺激性试验,本发明化合物表现出符合皮肤局部给药的药代动力学性质,体内代谢快,皮肤刺激性反应低,潜在毒性小,成药性良好;
194、本发明的i所示化合物、其互变异构体、其立体异构体、其水合物、其溶剂化物、其药学上可接受的盐或其前药的方法操作简单、收率高、纯度高,可用于医药工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!