一种梅片树叶片愈伤组织诱导及悬浮细胞培养方法
本发明属于植物细胞悬浮培养,具体涉及一种梅片树叶片愈伤组织诱导及悬浮细胞培养方法。
背景技术:
1、梅片树是樟科(lauraceae)樟属(cinnamomum)植物,是阴香的一个化学型,多生长于温暖湿润疏松肥沃的环境下,主要分布于东南亚地区,国内广东、福建、广西、云南等省均有种植。梅片树叶互生或近对生,离基三出脉,果实呈卵形,11~12月成熟,可作为绿化树,同时也是一种药用植物。梅片树枝叶中含有冰片,其学名为“天然右旋龙脑”,是一种高级香料,也是一种名贵珍稀药材,广泛应用于医药、化妆品、香料等行业,获得市场的一致好评。梅州市平远县有一个梅片树种植基地,如今研发的梅片加工产品涵盖医药、护肤、美妆、日化等多个领域,梅片树种植及加工产业已成为推动当地经济发展的重要抓手。梅片树的活性成分能有效预防免疫系统衰退、心血管疾病等多种退变性疾病的发生,因此被广泛地应用于临床。梅片树枝的根、树皮和枝叶可入药,新鲜枝叶可提取精油用于日化美容护肤之中。梅片树的枝叶挥发油成份中主要有右旋龙脑、乙酸龙脑脂、斯巴醇、桉叶油素等,开发利用前景巨大。梅片树药用部分有两种,一种是树干缝隙中干燥后的树脂,另一种是蒸馏被切碎枝叶所提取的龙脑香树脂。这些药用成分可用于配制安宫牛黄解毒丸、双料喉风散、六神丸等60多种中成药。现代药理研究证实梅片树叶挥发油具有广泛的药理特性,包括抗菌、通窍、散郁火、消肿止痛等功效。从梅片树干可采集干燥树脂,由叶片可提取得到天然右旋龙脑。
2、龙脑(borned),俗称“冰片”,是一种单菇醇,分子式为c10h18o(154.25g/mol)。龙脑按来源分为天然龙脑和合成龙脑,天然龙脑按旋光不同又分为左旋龙脑(艾片)和右旋龙脑(天然冰片、梅片)。药理学研究发现,右旋龙脑具有良好开窍醒神、消肿止痛、抑菌、抗炎的作用,广泛应用于医药化工领域。此外右旋龙脑还能保护心脑血管、镇痛抗炎、dna保护及修复、调节中枢神经、开放生理性屏障、促进药物透过血脑屏障等药理作用。因此,梅片树药用价值非常高,市场需求也日益增加。
3、目前,生产中梅片树造林苗木主要以扦插苗为主,嫁接繁殖受到缺乏熟练工人及成活率较低的制约,种子繁育因遗传变异使得子代右旋龙脑的含量不稳定,因而不能在生产中使用。鉴于梅片树产业化发展的需要,梅州市林业科学研究所从2011年起开展梅片树遗传育种和培育技术等方面的研究,历经多年努力,成功从广东地区早期种植梅片树中筛选出右旋龙脑含量高的梅片树单株,并以此作为母树营建采穗圃开展梅片树的扦插繁育试验。此外,马笑宇等人已通过外植体上诱导腋芽途径建立了梅片树的快繁体系。
4、植物细胞悬浮培养是一种将游离的植物细胞或小的细胞团置于液体培养基中进行培养和生长的新技术,能够快速获得成熟植物细胞及其代谢产物。通过培养悬浮细胞,可以大量生产目标药效成分。目前已运用悬浮细胞技术成功获得包括人参、甘草、厚朴等大宗药材的次生代谢产物。植物悬浮细胞不仅可用于生产药用活性物质,还能为研究植物细胞的生理、生化、遗传、分化等提供实验材料用于遗传多样性分析等,以及为探究代谢产物生物合成路径提供技术基础。目前中国、日本、德国已成功进行人参、紫草等植物的大规模生产,能够满足人参、皂苷等植物次生代谢产物的市场需求。
5、植物细胞悬浮培养是植物细胞生长的微生物化。因其分散性好,细胞团大小及细胞形状大致相同,且重复性好、生长迅速、易于控制等有利因素被广泛用于生理学、细胞学、生物化学、发育生物学及遗传学、分子生物学的研究中。通过诱导出疏松湿润的愈伤进行细胞悬浮培养,还可诱导出胚状体,制成人工种子。
6、总而言之,悬浮细胞培养技术在药用植物生产研究中的应用,不仅可缓解目前药材资源紧张的情况,也为药用植物的代谢途径研究提供了技术基础,利用悬浮细胞技术进行组织培养还有利于作物优选和资源保护。
技术实现思路
1、本发明的目的是针对现有技术的上述不足,提供一种梅片树叶片愈伤组织诱导及悬浮细胞培养方法,以及悬浮细胞的冻存及复苏方法。
2、本发明的第一个目的是提供一种梅片树叶片愈伤组织诱导及悬浮细胞培养方法,其包括以下步骤:
3、s1、摘取梅片树嫩叶,经消毒后将叶片切割成小块;
4、s2、将切割好的叶片接入愈伤诱导培养基培养,诱导形成愈伤;
5、所述的愈伤诱导培养基为如下(1)-(2)中的任意一种:
6、(1)1/2ms培养基+3.0mg/l ba+1mg/l naa+6~12μmol/l mt+8g/l琼脂+30g/l蔗糖,ph 5.8~6.0;
7、(2)1/2ms培养基+3.0mg/l ba+1mg/l naa+5mg/l gln+8g/l琼脂+30g/l蔗糖,ph5.8~6.0;
8、s3、取疏松愈伤,压碎后,将愈伤接种至悬浮培养基内进行悬浮细胞培养;培养2-3周后,获得悬浮细胞。
9、优选,所述的步骤s1的消毒,包括以下步骤:将嫩叶先用流水冲洗,再放入纯水浸泡15分钟,然后用灭菌过的纯水洗涤3次,每次15秒;再用体积分数75%乙醇水溶液洗涤3次,每次15秒;最后用质量分数5% naclo水溶液洗涤5分钟;然后于超净台用无菌纯水漂洗3次,每次15秒;叶片用滤纸上吸干表面水分。
10、优选,所述的步骤s1中的将叶片切割成小块为将叶片切割成5mm×5mm大小的小块。
11、优选,所述的愈伤诱导培养基为1/2ms培养基+3.0mg/l ba+1mg/l naa+12μmol/lmt+8g/l琼脂+30g/l蔗糖,ph 5.8~6.0。
12、优选,所述的悬浮培养基为1/2ms培养基+3.0mg/l ba+1mg/l naa+30g/l蔗糖,ph5.8~6.0。
13、优选,所述的步骤s3,在获得悬浮细胞后进行继代培养,所述的继代培养是将悬浮细胞接种至新的悬浮培养基进行悬浮细胞培养。
14、优选,所述的步骤s2中的培养,其培养条件为:光照12h,黑暗12h,光照强度为2000~2500lx,相对湿度80%,温度为22℃;所述的步骤s3中的培养,其培养条件为:于25℃、110r·min-1恒温振荡器进行暗培养。
15、本发明的第二个目的是提供一种梅片树悬浮细胞的冻存及复苏方法,其包括以下步骤:
16、s1、预处理:取利用所述的梅片树叶片愈伤组织诱导及悬浮细胞培养方法获得的培养2-3周的悬浮细胞,离心,去除上层液后加入灭菌的0.2mol/l蔗糖溶液混匀,置于25℃、110r·min-1恒温振荡器暗培养24小时;
17、s2、冻存:取经步骤s1处理的细胞,离心,去除上层液,用冷冻保护剂浸泡细胞,混匀后分装于冻存管内,冻存管装入梯度降温盒内,于-80℃超低温保存柜保存,隔天去盒存放;所述的冷冻保护剂为1/2ms培养基+10%蔗糖+10% dmso;
18、s3、复苏:从-80℃超低温保存柜取出冻存管,放于39℃水浴锅解冻2-3分钟,使管内无冰块;解冻后立刻转移至离心管离心,用移液枪吸出上清,加灭菌的0.2mol/l蔗糖溶液洗涤2-3次,然后将细胞接入悬浮培养基内进行悬浮细胞培养。
19、优选,所述的悬浮培养基为1/2ms培养基+3.0mg/l ba+1mg/l naa+30g/l蔗糖,ph5.8~6.0。
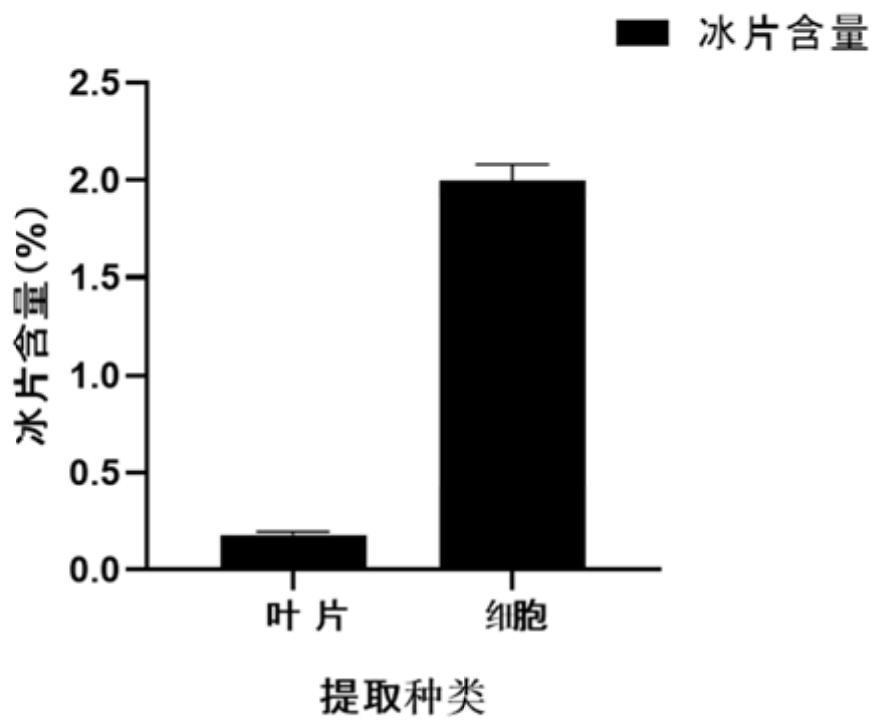
20、本发明在筛选出适合梅片树愈伤诱导条件的基础上,选取优良胚性梅片树愈伤组织,以细胞生长量为指标建立稳定的梅片树悬浮细胞培养体系,可以通过细胞系培养获取提取天然冰片的原材料,为广泛开发利用梅片树植物资源提供理论依据及技术支持。
21、本发明弥补了梅片树悬浮体系建立的空白,为梅片树天然冰片的提取提供更快更多更简便的途径。本发明的冻存及复苏方法的建立为未来梅片树内有效物质的储藏与应用提供了新的思路和方法。
- 还没有人留言评论。精彩留言会获得点赞!