一类含苯并呋喃结构的桥连联苯单膦配体及其制备方法和应用
本发明属于化学催化,特别涉及一类含苯并呋喃结构的桥连联苯单膦配体及其制备方法和应用。
背景技术:
1、手性膦配体是不对称催化反应中应用最广泛的配体之一,其在不对称催化过程中有着极其关键的作用,它的结构对反应类型、底物适应范围、反应活性以及对映选择性都有显著的影响。因此,新型手性配体的开发一直都是不对称催化领域研究的重点之一(noyori,r;ohkuma,t.angew.chem.int.ed.2002,41,2008.)。自1991年hayashi报道了单齿膦配体mop的合成并将其应用于不对称硅氢化反应后(uozumi,y;hayash,t.j.am.chem.soc.1991,113,9887),这类配体的发展得到了广泛关注,先后被应用于不对称加成反应(hayash,t.;taguchi t.angew.chem.int.ed.1999,38,2395)、不对称烯丙基烷基化反应(hayash,t.;hagiwara,h.org.lett.2011,13,932)等反应中并取得了优秀的结果。但是,相比较其他类配体,这类配体在数量、种类、骨架等方面还明显不够丰富。基于这些因素,自2002年以来,邱立勤等开发了一类使用手性醇的磺酸酯为手性源,通过中心手性向轴向传递手性的膦配体,并应用于不对称氢化反应中,取得很好的效果(org.lett.2002,4,4599;pnas,2004,101,5815;j.am.chem.soc.2006.128.5955);之后相继开发出o,p-手性联苯单膦配体、n,p-手性联苯单膦配体等,并成功应用于不对称suzuki偶联反应中(org.lett.2012,14,1966;adv.synth.catal.2012.354.239;acs catal.2014,4,1390;adv.synth.catal.2017,359,1656;cn102516300a;cn102532196a;zl201410113570.1),表现出高效的催化能力、较好的底物适用范围和良好的手性控制能力。但是,目前有关金与手性膦配体协同催化的不对称反应仍少有报道,其原因在于,由于在不对称金催化中,金为直线型单配位模式,从而使配体的手性中心远离了要产生的手性中心位置,导致反应中手性诱导非常困难。因此,开发新型的手性膦配体以实现金的不对称催化成为一个热点与难点。综上,丰富和发展膦配体制备方法,设计合成新型手性膦配体并应用于不同催化体系非常必要。
技术实现思路
1、为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一类适用于不对称催化的含苯并呋喃结构的桥连联苯单膦配体。
2、本发明另一目的在于提供一种上述含苯并呋喃结构的桥连联苯单膦配体的制备方法。
3、本发明再一目的在于提供上述含苯并呋喃结构的桥连联苯单膦配体的应用,特别是在不对称催化中的应用。
4、本发明的目的通过下述方案实现:
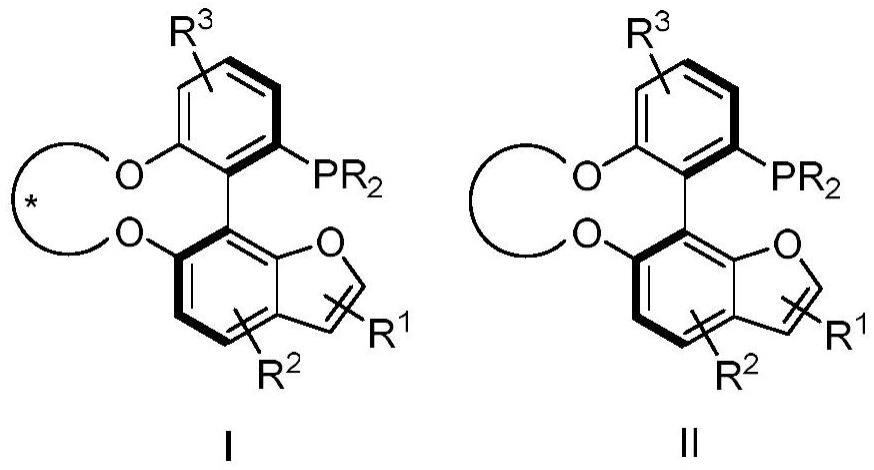
5、一类含苯并呋喃结构的桥连联苯单膦配体,具有如下式ⅰ-式ⅱ所示结构之一:
6、
7、包括其消旋体或对映体,其中,
8、r为取代或未取代的c6-20芳基、取代或未取代的呋喃基、取代或未取代的c1-20直链或支链烷基、取代或未取代的c3-20环烷基中的任意一种;
9、r1为环上一个或以上的取代基团,可为氢、卤素原子、羟基、羧基、氰基、硝基、氨基、巯基、取代或未取代的c1-c20的直链或支链烷基、取代或未取代的c3-c20的环烷基、c1-c20的氟代烷基、取代或未取代的c1-c20的烷基烃氧基、取代或未取代的c7-c20的芳基烃氧基、取代或未取代的c1-c20的烃硫基、取代或未取代的c1-c20的烃砜基、取代或未取代的苄基、取代或未取代的苄氧基、取代或未取代的c1-c20的n-烃基取代胺基、取代或未取代的c1-c20的n,n-二烃基取代胺基、取代或未取代的c1-c20的酰基、取代或未取代的c1-c20的酰胺基、c1-c20的烃氧羰基、磺酸基、磺酰胺基、取代或未取代的c1-c20的磺酰基、取代或未取代的c3-c20的含n、o和s中的一种或一种以上的杂环基、取代或未取代的c1-c9的烷基硅基、取代或未取代的苯基硅基、取代或未取代的c6-20芳基中的任意一种;
10、r2、r3分别为环上一个或以上的取代基团,可相同或不同分别为氢、卤素原子、羟基、羧基、氰基、硝基、取代或未取代的c1-c20的直链或支链烷基、取代或未取代的c3-c20的环烷基、c1-c20的氟代烷基、取代或未取代的c1-c20的烷基烃氧基、取代或未取代的c6-c20的芳基烃氧基、c1-c20的烃氧羰基、磺酸基、磺酰胺基、取代或未取代的c1-c9的烷基硅基、取代或未取代的c1-c20的n-烃基取代胺基、取代或未取代的c1-c20的n,n-二烃基取代胺基、取代或未取代的c6-20芳基中的任意一种。
11、进一步的,所述的取代指基团中的一个或一个以上氢原子可被卤素原子、氧原子、烯基、炔基、羟基、羰基、羧基、酯基、氰基、取代的氨基、硝基、c1-20的烷基、c1-20的烃氧基、三氟甲基、苯基、苄基或其他芳基取代。
12、进一步的,所述含苯并呋喃结构的桥连联苯单膦配体,具有式ⅰ-式ⅱ所示结构之一,包括其消旋体或对映体,其中,r为取代或未取代的苯基、取代或未取代的苄基、取代或未取代的苄氧基、取代或未取代的呋喃基、取代或未取代的c7-20芳基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、取代或未取代的c5-c20的直链或支链烷基、取代或未取代的环丙基、取代或未取代的环丁基、取代或未取代的c5-c20的环烷基中的任意一种。
13、进一步的,所述含苯并呋喃结构的桥连联苯单膦配体,具有式ⅰ-式ⅱ所示结构之一,包括其消旋体或对映体,其中,r1为环上一个或以上的取代基团,可为氢、氟、氯、溴、碘、羟基、羧基、氰基、硝基、氨基、巯基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、取代或未取代的c5-c20的直链或支链烷基、取代或未取代的环丙基、取代或未取代的环丁基、取代或未取代的c5-c20的环烷基、三氟甲基、c2-c20的氟代烷基、甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、取代或未取代的c5-c20的烃氧基、取代或未取代的苄氧基、取代或未取代的c8-c20的芳基烃氧基、甲硫基、取代或未取代的c2-c20的烃硫基、甲砜基、取代或未取代的c2-c20的烃砜基、取代或未取代的c1-c20的n-烃基取代胺基、取代或未取代的c1-c20的n,n-二烃基取代胺基、取代或未取代的c1-c20的酰基、取代或未取代的c1-c20的酰胺基、c1-c20的烃氧羰基、磺酸基、磺酰胺基、取代或未取代的c1-c20的磺酰基、取代或未取代的c3-c20的含n、o和s中的一种或一种以上的杂环基、三甲基硅基、三乙基硅基、取代或未取代的c7-c9的烷基硅基、取代或未取代的三苯基硅基、取代或未取代的苯基、取代或未取代的苄基、取代或未取代的c8-20芳基中的任意一种。
14、进一步的,所述含苯并呋喃结构的桥连联苯单膦配体,具有式ⅰ-式ⅱ所示结构之一,包括其消旋体或对映体,其中,r2、r3分别为环上一个或以上的取代基团,可相同或不同分别为氢、氟、氯、溴、碘、羟基、羧基、氰基、硝基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、取代或未取代的c5-c20的直链或支链烷基、取代或未取代的环丙基、取代或未取代的环丁基、取代或未取代的c5-c20的环烷基、三氟甲基、c2-c20的氟代烷基、甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、取代或未取代的c5-c20的烃氧基、取代或未取代的苄氧基、取代或未取代的c8-c20的芳基烃氧基、取代或未取代的c1-c20的n-烃基取代胺基、取代或未取代的c1-c20的n,n-二烃基取代胺基、c1-c20的烃氧羰基、磺酸基、磺酰胺基、三甲基硅基、三乙基硅基、取代或未取代的c7-c9的烷基硅基、取代或未取代的三苯基硅基、取代或未取代的苯基、取代或未取代的苄基、取代或未取代的c8-20芳基中的任意一种。
15、进一步的,所述的取代指基团中的一个或一个以上氢原子可被卤素原子、氧原子、烯基、炔基、羟基、羰基、羧基、酯基、氰基、取代的氨基、硝基、c1-20的烷基、c1-20的烃氧基、三氟甲基、苯基、苄基或其他芳基取代。
16、更进一步的,r、r1、r2、r3中的一个或一个以上氢原子可被氟原子、氯原子、溴原子、碘原子、氧原子、硫原子、烯基、炔基、芳基、羟基、氨基、羰基、羧基、酯基、氰基、甲基、乙基、甲氧基、甲硫基、硝基、取代或未取代的c3-c20的含n、o和s中的一种或一种以上的杂环基亚甲基取代。
17、进一步的,所述由脱去离去基团lg后得到,所述lg相同或不同的分别为羟基、羧基、酰氯、卤素、甲基磺酸酯、对甲苯磺酸酯或三氟甲基磺酸酯。
18、所述由脱去离去基团lg后得到,所述lg相同或不同的分别为羟基、羧基、酰氯、卤素、甲基磺酸酯、对甲苯磺酸酯或三氟甲基磺酸酯。
19、所述和的碳原子个数相同或不同的分别为1-20。
20、作为一种优选方案,所述为(2s,3s)-2,3-丁二醇、(2r,3r)-2,3-丁二醇、(2s,4s)-2,4-戊二醇、(2r,4r)-2,4-戊二醇、(2s,5s)-2,5-己二醇、(2r,5r)-2,5-己二醇、(3s,4s)-3,4-己二醇、(3r,4r)-3,4-己二醇、(1s,2s)-1,2-二苯乙二醇、(1r,2r)-1,2-二苯乙二醇、(2s,3s)-1,4-二苄氧基丁二醇、(2r,3r)-1,4-二苄氧基丁二醇、(2s,9s)-2,9-癸二醇、(2r,9r)-2,9-癸二醇、(3s,8s)-3,8-癸二醇、(3r,8r)-3,8-癸二醇、(4s,7s)-4,7-癸二醇、(4r,7r)-4,7-癸二醇、(5s,6s)-5,6-癸二醇、(5r,6r)-5,6-癸二醇、(2s,6s)-2,6-庚二醇、(2r,6r)-2,6-庚二醇、(3s,5s)-3,5-庚二醇、(3r,5r)-3,5-庚二醇、(2s,7s)-2,7-辛二醇、(2r,7r)-2,7-辛二醇、(3s,6s)-3,6-辛二醇、(3r,6r)-3,6-辛二醇、(2s,8s)-2,8-壬二醇、(2r,8r)-2,8-壬二醇、(3s,7s)-3,7-壬二醇、(3r,7r)-3,7-壬二醇、(4s,6s)-4,6-壬二醇、(4r,6r)-4,6-壬二醇、(2s,3s)-2,3-二溴丁二酸、(2r,3r)-2,3-二溴丁二酸、或上述手性二醇的甲磺酸酯、对甲基苯磺酸酯、三氟甲基磺酸酯;
21、作为一种优选方案,所述为1,1-二溴甲烷、1,2-二溴乙烷、1,3-二溴丙烷、1,4-二溴丁烷、1,5-二溴戊烷、1,6-二溴己烷、1,7-二溴庚烷、1,8-二溴辛烷、1,9-二溴壬烷、1,10-二溴癸烷、乙二醇缩合后端基的卤代化合物或其对甲苯磺酸酯、1,3-二溴苯、1,4-二溴苯、α,α-二溴邻二甲苯、α,α-二溴间二甲苯、α,α-二溴对二甲苯。
22、本发明还提供一种上述含苯并呋喃结构的桥连联苯单膦配体的制备方法,具体的:
23、当r2、r3为氢时,式ⅰ包括以下步骤方法制备得到,反应方程式如下:
24、
25、
26、(1)以2,2’,6,6’-四羟基联苯(化合物1)为起始原料,与发生亲核取代反应成环,得到具有中心手性和轴手性的桥连联苯二酚化合物(化合物2)或其对映体(化合物2');
27、进一步的,所述反应的温度可为50-90℃;所述反应的时间可为6-36h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
28、(2)桥连联苯二酚化合物(化合物2)或其对映体(化合物2')与氯甲基甲醚反应,得到烷基化的桥连联苯化合物(化合物3)或其对映体(化合物3');
29、进一步的,所述反应的温度可为0-40℃;所述反应的时间可为5-12h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
30、(3)烷基化的桥连联苯化合物(化合物3)或其对映体(化合物3')与卤代1,1-二甲氧基乙烷反应得到双烷基化的桥连联苯化合物(化合物4)或其对映体(化合物4');
31、进一步的,所述反应的温度可为0-120℃;所述反应的时间可为5-24h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
32、(4)双烷基化的桥连联苯化合物(化合物4)或其对映体(化合物4')在多聚磷酸(ppa)的存在下,一侧脱去mom的中间体化合物,一侧脱去甲氧基分子内成环,得到含苯并呋喃结构的桥连联苯化合物(化合物5)或其对映体(化合物5');
33、进一步的,所述反应的温度可为两段式加热,一阶段温度可为25-80℃,二阶段温度可为80-120℃;一阶段反应的时间可为0.5-5h,二阶段反应的时间可为4-24h;所述反应的环境为有机溶剂环境。一阶段反应,形成脱去mom的中间体化合物;二阶段升温反应,分子内脱去甲氧基成环。
34、(5)含苯并呋喃结构的桥连联苯化合物(化合物5)或其对映体(化合物5')和三氟甲磺酸酐反应,得到三氟甲磺酸酯化合物(化合物6)或其对映体(化合物6');
35、进一步的,所述反应的温度可为0-30℃;所述反应的时间可为6-24h;所述反应在有机碱(如n,n-二异丙基乙胺、三乙胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
36、(6)三氟甲磺酸酯化合物(化合物6)或其对映体(化合物6')与含取代基膦氧化合物反应,得到含苯并呋喃结构的桥连联苯膦氧化合物(化合物7)或其对映体(化合物7');
37、进一步的,所述反应的温度可为60-120℃;所述反应时间可为12-36h;所述反应在钯催化剂、配体和有机碱(如n,n-二异丙基乙胺、三乙胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
38、(7)含苯并呋喃结构的桥连联苯膦氧化合物(化合物7)或其对映体(化合物7')与卤化试剂反应,所获得的含卤化合物再通过常规偶联反应,得到含取代基的苯并呋喃结构的桥连联苯膦氧化合物(化合物8)或其对映体(化合物8');
39、进一步的,所述反应分为两步,第一步反应温度可为0-80℃,反应的时间可为2-24h,反应在有机碱(如n,n-二甲基甲酰胺、n,n-二异丙基乙胺、三乙胺中、三正丁胺中的任意一种)存在下进行;第二步反应温度可为60-120℃,反应时间可为6-36h,反应在钯催化剂、配体和无机碱(如磷酸钾、碳酸钾中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
40、(8)含取代基的苯并呋喃结构的桥连联苯膦氧化合物(化合物8)或其对映体(化合物8')经三氯硅烷还原得到本发明r2、r3为氢的含苯并呋喃结构的桥连联苯单膦配体(化合物9)或其对映体(化合物9');
41、进一步的,所述反应的温度可为80-160℃;所述反应的时间可为4-24h;所述反应在有机碱(如n,n-二异丙基乙胺、三乙胺中、三正丁胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
42、当r2、r3为氢时,式ⅱ化合物可包括以下步骤方法制备得到;
43、
44、
45、(1)以手性桥连联苯二酚化合物(化合物2)或其对映体(化合物2')为起始原料,与发生亲核取代反应成环,得到具有手性的双桥连联苯化合物(化合物10)或其对映体(化合物10');
46、进一步的,所述反应的温度可为50-90℃;所述反应的时间可为6-36h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
47、(2)双桥连联苯化合物(化合物10)或其对映体(化合物10')与4,4'-二叔丁基联苯的锂盐反应,得到具有轴手性的桥连联苯二酚(化合物11)或其对映体(化合物11');
48、进一步的,所述反应的温度可为-78-0℃;所述反应的时间可为1-36h;所述反应的环境为有机溶剂环境。
49、(3)轴手性的桥连联苯二酚(化合物11)或其对映体(化合物11')与氯甲基甲醚反应,得到烷基化的桥连联苯化合物(化合物12)或其对映体(化合物12');
50、进一步的,所述反应的温度可为0-40℃;所述反应的时间可为5-12h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
51、(4)烷基化的桥连联苯化合物(化合物12)或其对映体(化合物12')与卤代1,1-二甲氧基乙烷反应得到双烷基化的桥连联苯化合物(化合物13)或其对映体(化合物13');
52、进一步的,所述反应的温度可为0-120℃;所述反应的时间可为5-24h;所述反应在无机碱存在下进行;所述反应的环境为有机溶剂环境。
53、(5)双烷基化的桥连联苯化合物(化合物13)或其对映体(化合物13')在多聚磷酸(ppa)的存在下,一侧脱去mom的中间体化合物,一侧脱去甲氧基分子内成环,得到含苯并呋喃结构的桥连联苯化合物(化合物14)或其对映体(化合物14');
54、进一步的,所述反应的温度可为两段式加热,一阶段温度可为25-80℃,二阶段温度可为80-120℃;一阶段反应的时间可为0.5-5h,二阶段反应的时间可为4-24h;所述反应的环境为有机溶剂环境。一阶段反应,形成脱去mom的中间体化合物;二阶段升温反应,分子内脱去甲氧基成环。
55、(6)含苯并呋喃结构的桥连联苯化合物(化合物14)或其对映体(化合物14')和三氟甲磺酸酐反应,得到三氟甲磺酸酯化合物(化合物15)或其对映体(化合物15');
56、进一步的,所述反应的温度可为0-30℃;所述反应的时间可为6-24h;所述反应在有机碱(如n,n-二异丙基乙胺、三乙胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
57、(7)三氟甲磺酸酯化合物(化合物15)或其对映体(化合物15')与含取代基膦氧化合物反应,得到含苯并呋喃结构的桥连联苯膦氧化合物(化合物16)或其对映体(化合物16');
58、进一步的,所述反应的温度可为60-120℃;所述反应时间可为12-36h;所述反应在钯催化剂、配体和有机碱(如n,n-二异丙基乙胺、三乙胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
59、(8)含苯并呋喃结构的桥连联苯膦氧化合物(化合物16)或其对映体(化合物16')与卤化试剂反应,所获得的含卤化合物再通过常规偶联反应,得到含取代基的苯并呋喃结构的桥连联苯膦氧化合物(化合物17)或其对映体(化合物17');
60、进一步的,所述反应分为两步,第一步反应温度可为0-80℃,反应的时间可为2-24h,反应在有机碱(如n,n-二甲基甲酰胺、n,n-二异丙基乙胺、三乙胺中、三正丁胺中的任意一种)存在下进行;第二步反应温度可为60-120℃,反应时间可为6-36h,反应在钯催化剂、配体和无机碱(如磷酸钾、碳酸钾中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
61、(9)含取代基的苯并呋喃结构的桥连联苯膦氧化合物(化合物17)或其对映体(化合物17')经三氯硅烷还原得到本发明r2、r3为氢的含苯并呋喃结构的桥连联苯单膦配体(化合物18)或其对映体(化合物18');
62、进一步的,所述反应的温度可为80-160℃;所述反应的时间可为4-24h;所述反应在有机碱(如n,n-二异丙基乙胺、三乙胺中、三正丁胺中的任意一种)存在下进行;所述反应的环境为有机溶剂环境。
63、当r2、r3为非氢时,制备方法区别在于,先在联苯二酚化合物(化合物2)或其对映体(化合物2')的r2、r3位上选择性引入卤素或通过常规的偶联反应,引入相应的取代基,再进行后续反应。
64、上述化合物的消旋体,采用非手性或消旋的原料基于上述反应类似的方法和公知的原理,即可制备得到。
65、上述反应过程中,所述引入卤素,可通过卤化试剂如丁基锂、nbs(n-溴代丁二酰亚胺)或nis(n-碘代丁二酰亚胺)、碘等引入卤素。
66、上述反应过程中,使用的无机碱相同或不同的分别可为碳酸钠、碳酸钾、碳酸铯、氢氧化钠、氢氧化钾、氢氧化锂、氢化钠、氨基钠、叔丁醇钠、叔丁醇钾、磷酸钾和氟化铯等中的至少一种。
67、上述反应过程中,使用的有机溶剂相同或不同的分别可为乙醚、乙腈、苯、甲苯、二甲苯、二甲亚砜(dmso)、四氢呋喃、甲基四氢呋喃、甲基叔丁基醚、乙二醇二甲醚、二氯甲烷、二氯乙烷、氯仿、二硫化碳、四氯化碳、1,4-二氧六环、甲醇、乙醇、异丙醇、叔丁醇、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺、吡咯烷酮、n-甲基吡咯烷酮(nmp)等中的至少一种。
68、上述反应过程中使用的钯催化剂可为pd(oac)2、pdcl2、pd2dba3、pd(dba)2、[(cinnamyl)pdcl]2中的任意一种;所述的配体可为dppb、dppe、dppp、pph3、pcy3、ptbu3、s-phos、x-phos中的任意一种。其中,
69、
70、本发明的含苯并呋喃结构的桥连联苯单膦配体,以联苯为骨架,结构中引入呋喃环及其衍生物,改变了芳香环电子云密度及空间位阻,并通过手性二醇诱导产生手性,桥连的链有效调节配体的二面角,从而使得该手性膦配体具有反应活性高、对映选择性好、底物适应范围广等优点,特别适用于不对称金催化的[3+3]环化反应,如以2-(1-炔基-2-烯-1-酮为底物,与硝酮化合物或者肟醛混合物进行分子间[3+3]环化反应,显示出优异的催化活性及立体选择性,也可用于suzuki-miyaura偶联反应,如以n-(2-溴-3-甲氧基苯基)-3,5-二甲基苯甲酰胺为底物,与2-三氟甲基苯硼酸进行分子间偶联反应,取得优异的反应催化活性及立体选择性。
71、本发明相对于现有技术,具有如下的优点及有益效果:
72、本发明轴手性桥连联苯单膦配体合成方法简单,通过引入呋喃环,增大了芳环的电子云密度,并改变了空间位阻,通过引入桥连的链有效调节配体的二面角,使得配体、金属和底物在催化过程中形成最合适的配位环境,从而表现出优异的催化活性和对映选择性控制能力。
- 还没有人留言评论。精彩留言会获得点赞!