一种快速鉴别iPSC与EPSC的方法与流程
本发明属于生物医药,具体地,本发明涉及一种快速鉴别ipsc与epsc的方法。
背景技术:
1、诱导多能干细胞(induced pluripotent stem cell,ipsc)最初是日本科学家山中伸弥(shinya yamanaka)于2006年利用病毒载体将四个转录因子(oct4、sox2、klf4和c-myc)的组合转入成人的体细胞中,使其重编程而得到的在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等方面都与胚胎干细胞类似的一种多能干细胞。ipsc因其可由体细胞重编程获得,且不存在伦理和免疫排斥限制而成为了一类备受关注的种子细胞,ipsc在疾病模型构建、药物筛选和细胞治疗方面具有广阔的应用前景,但是目前仍存在ipsc细胞异质性高、分化效率不稳定、基于ipsc分化得到的体细胞成熟度低等问题。
2、扩展多潜能干细胞(expanded potential stem cell,epsc)最初是中国科学家邓宏魁于2017年利用在ipsc培养基中加入蛋白因子lif和三种化合物:chir99021、(s)-(+)-dimethindene maleate和minocyline hydrochlorid诱导形成的可以发育为胚胎外组织的一类新型多功能干细胞,其因单细胞克隆率高、高效的嵌合能力和胚外组织发育能力而受到广泛的关注。ipsc只能发育分化形成外、中、内三胚层组织和细胞,而epsc可以分化形成胚胎外组织,比ipsc具有更强的分化潜能。此外,与ipsc相比,epsc分化形成的功能细胞更接近体细胞、体外进行基因编辑的效率更高,传代过程中基因组更稳定,成为多能干细胞研发的重要细胞平台。
3、epsc在分化为大多数体细胞过程中首先要转化为ipsc,传统的epsc转化为ipsc的方法是使用ipsc培养基(如:e8培养基)培养大约48小时后即默认全部epsc细胞转化为了ipsc,但是这种分化方式适合小规模培养,仅限于实验室范围内使用,且无法判断epsc是否分化完全(即分化形成的ipsc细胞中是否还存在epsc的残留),若分化不完全则会导致分化形成的ipsc细胞中残留epsc,进而减弱ipsc后续的分化效率。目前的大规模培养过程中使用的转化方式对于epsc是否完全转化为ipsc也没有明确的鉴定标准。
4、目前,尚未见将丝裂霉素应用于epsc和ipsc鉴别中的相关研究或报道,本发明首次创造性地将丝裂霉素应用于epsc来源的ipsc中epsc残留检测中,并取得了较好的检测效果。
技术实现思路
1、有鉴于此,为了弥补本领域尚缺乏epsc来源的ipsc中是否存在epsc残留的检测方法这一技术空白,本发明的目的在于为本领域提供一种鉴别epsc是否完全转化为ipsc的检测方法,本发明首次采用丝裂霉素鉴别epsc是否完全转化为ipsc,所述方法检测效率高、成本低、准确性高、操作简单。
2、本发明的上述目的通过以下技术方案得以实现:
3、本发明的第一方面提供了细胞g1期阻滞剂在鉴别epsc和ipsc中的应用;
4、优选地,所述细胞g1期阻滞剂包括丝裂霉素、新福菌素、表阿霉素、阿霉素、衣霉素、长春新碱、丙戊酸钠、尼妥珠单抗、5-氟尿嘧啶、顺铂、氟西汀、索拉非尼、吲哚美辛、瑞博西尼、阿贝西利、哌柏西利、紫杉醇、表没食子儿茶素没食子酸酯、过氧化氢、奥曲肽、x射线辐照中的任意一种或多种;
5、更优选地,所述细胞g1期阻滞剂为丝裂霉素。
6、进一步,所述丝裂霉素对处于g1期的epsc的生长起阻滞作用。
7、进一步,所述丝裂霉素对处于s期和g2期的epsc细起毒害作用。
8、进一步,所述丝裂霉素对ipsc起毒害作用。
9、进一步,所述丝裂霉素的使用浓度为0.1-1.0μg/ml;
10、优选地,所述丝裂霉素的使用浓度为0.3-0.6μg/ml;
11、更优选地,所述丝裂霉素的使用浓度为0.3μg/ml或0.6μg/ml;
12、最优选地,所述丝裂霉素的使用浓度为0.3μg/ml。
13、进一步,所述丝裂霉素的处理时间为24-120h;
14、优选地,所述丝裂霉素的处理时间为24-72h;
15、更优选地,所述丝裂霉素的处理时间为24h或72h;
16、最优选地,所述丝裂霉素的处理时间为24h。
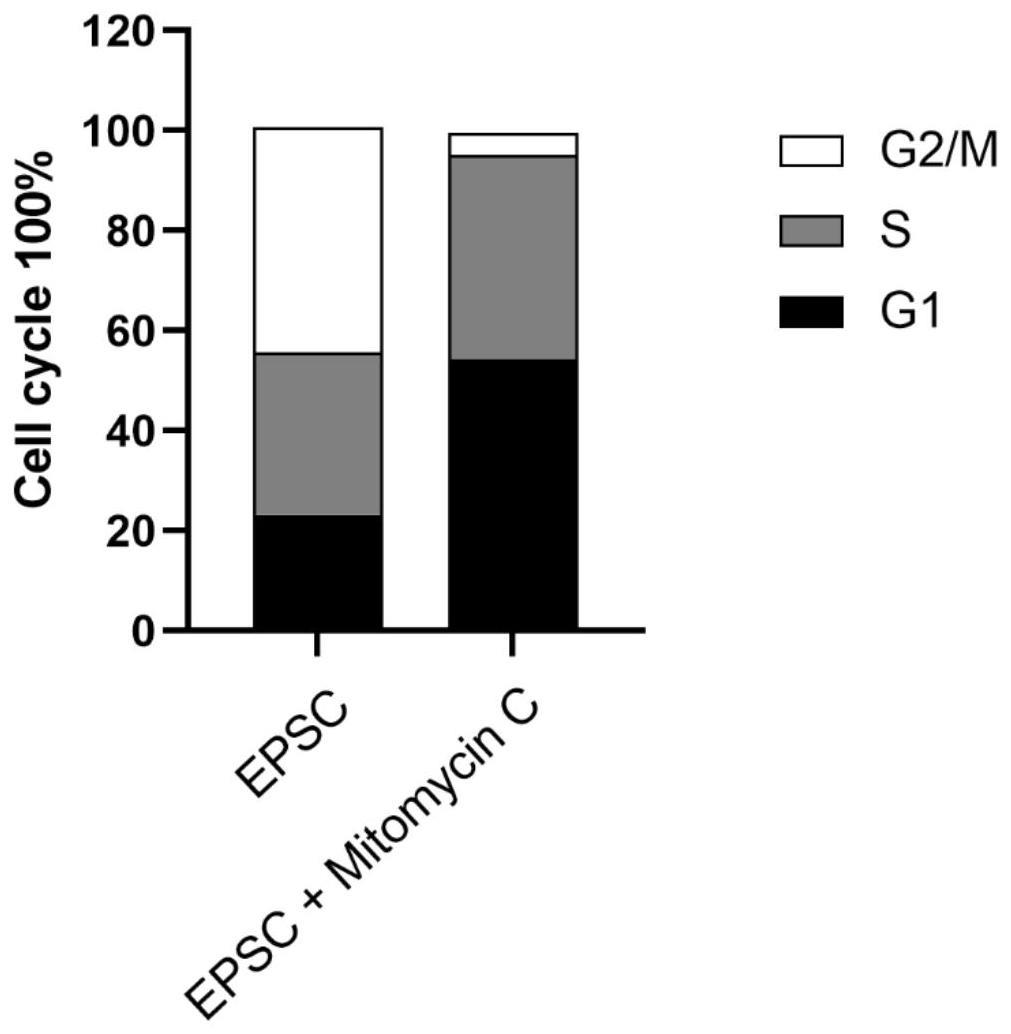
17、本技术的发明人在前期实验研究中意外地发现epsc和ipsc在细胞周期上有明显差异,其中,epsc具有g1期checkpoint,而ipsc对应的内细胞团不具有g1期checkpoint,基于epsc和ipsc在细胞周期调控上的这一差异,本技术提供了细胞g1期阻滞剂在鉴别epsc和ipsc中的应用。
18、在一些实施方案中,所述细胞g1期阻滞剂并不局限于本发明如前所述的试剂,只要是对处于g1期的epsc的生长起阻滞作用、对处于s期和g2期的epsc起毒害作用、对ipsc起毒害作用的试剂均在本发明的保护范围内。在本发明的具体实施方案中,所述细胞g1期阻滞剂优选为丝裂霉素。
19、在一些实施方案中,利用丝裂霉素干扰epsc分化产物,丝裂霉素可作用于epsc的g1期checkpoint,影响细胞周期,将细胞阻滞在g1期,对于处于其它时期的epsc,丝裂霉素具有毒害作用,因此随着丝裂霉素的作用时间延长,部分处于g1期的epsc会出现生长停止的现象,且g1期细胞占比也会逐渐增加。而丝裂霉素处理的ipsc因不具有g1期checkpoint而全部进入凋亡,根据ipsc、epsc在丝裂霉素作用下的不同表现,将两者进行鉴别区分。
20、若经丝裂霉素处理后,分化产物中检测到全部细胞为死细胞,则说明epsc已完全分化为ipsc,即分化产物中只有ipsc;若经丝裂霉素处理后,分化产物中检测到活细胞,则说明分化产物中存在epsc残留,即分化产物中同时存在ipsc和epsc,其中,检测到的细胞活率越高说明epsc分化效率越低,检测到的细胞活率越低说明epsc分化效率越高。
21、在本发明中,细胞周期又称细胞增殖期,是细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,主要是遗传物质dna的复制合成,然后进入分裂期完成增殖,就完成了一个细胞周期。根据细胞增殖周期不同生化特点,又将其分为四个连续时期。即g1期(dna合成前期),s期(dna合成期),g2(dna合成后期),m期(有丝分裂期)。
22、g1期:为下一步dna的合成做准备的阶段,包括rna及核蛋白的合成,脱氧核苷酸,胸腺激酶等的形成。上一次细胞增殖完成以后,细胞是否进入g1期还要取决于很多因素,比如是否受到外源生长或者其他与增殖相关的因子的影响。研究表明:细胞在进入g1期以后如果缺乏生长因子或者营养物质,可能发生阻滞,延长g1期,此时的g1期又被成为g0期。不同的细胞g1期的长短各异,4-5小时到数日不等,增殖旺盛的细胞g1短,衰退的细胞g1期时间长。
23、s期:g1期顺利完成以后,细胞进入到s期完成dna以及组蛋白的合成。在s期的结束时期,dna含量加倍。这个时期也是dna极易受损的时期,因为在dna合成的时候,双链分离为单链,结构不稳定,容易突变。不同细胞的s期时间差别不大,平均约为6-8小时。
24、g2期:其为dna合成后期,是有丝分裂的准备期。在这一时期,dna合成终止,而大量合成rna及蛋白质,包括微管蛋白和促成熟因子等。本期时间较短且恒定,约2-5个小时。
25、m期:又称为有丝分裂期,是细胞周期的终结,此时细胞将从一个细胞成功分离为两个子细胞。其需经前、中、后、末期,是一个连续变化过程,一般需1-2小时。
26、本发明的第二方面提供了一种鉴别epsc是否完全转化为ipsc的检测方法。
27、进一步,所述方法包括如下步骤:采用细胞g1期阻滞剂处理epsc转化为ipsc时得到的细胞分化产物,对细胞分化产物中细胞的存活状态进行检测;
28、优选地,若所述细胞分化产物中没有细胞存活,则表明epsc全部转化为ipsc;
29、优选地,若所述细胞分化产物中还有细胞存活,则表明尚存在epsc细胞的残留,epsc未完全转化为ipsc;
30、优选地,所述细胞g1期阻滞剂包括丝裂霉素、新福菌素、表阿霉素、阿霉素、衣霉素、长春新碱、丙戊酸钠、尼妥珠单抗、5-氟尿嘧啶、顺铂、氟西汀、索拉非尼、吲哚美辛、瑞博西尼、阿贝西利、哌柏西利、紫杉醇、表没食子儿茶素没食子酸酯、过氧化氢、奥曲肽、x射线辐照中的任意一种或多种;
31、更优选地,所述细胞g1期阻滞剂为丝裂霉素。
32、进一步,所述丝裂霉素的使用浓度为0.1-1.0μg/ml;
33、优选地,所述丝裂霉素的使用浓度为0.3-0.6μg/ml;
34、更优选地,所述丝裂霉素的使用浓度为0.3μg/ml或0.6μg/ml;
35、最优选地,所述丝裂霉素的使用浓度为0.3μg/ml。
36、进一步,所述丝裂霉素的处理时间为24-120h;
37、优选地,所述丝裂霉素的处理时间为24-72h;
38、更优选地,所述丝裂霉素的处理时间为24h或72h;
39、最优选地,所述丝裂霉素的处理时间为24h。
40、进一步,所述细胞分化产物以1×104-5×104个细胞/平方厘米接种于ipsc培养基中;
41、优选地,所述细胞分化产物以1.2×104-3.4×104个细胞/平方厘米接种细胞;
42、优选地,所述ipsc培养基为stem cell tesrtm-e8tm。
43、在一些实施方案中,所述细胞分化产物是指epsc分化为ipsc得到的细胞分化产物,基于epsc和ipsc在细胞周期调控上的差异对epsc是否完全转化为ipsc进行检测,根据经丝裂霉素处理后的细胞分化产物中细胞的存活状态进行鉴别。若经丝裂霉素处理后的细胞分化产物中没有细胞存活,则表明epsc全部转化为ipsc;若所述细胞分化产物中还有细胞存活,则表明尚存在epsc的残留,epsc未完全转化为ipsc,还需要延长转化时间,防止epsc的残留减弱ipsc后续的分化效率。
44、在一些实施方案中,所述细胞g1期阻滞剂并不局限于本发明如前所述的试剂,只要是对处于g1期的epsc的生长起阻滞作用、对处于s期和g2期的epsc起毒害作用、对ipsc起毒害作用的试剂均在本发明的保护范围内。在本发明的具体实施方案中,所述细胞g1期阻滞剂优选为丝裂霉素。
45、在一些实施方案中,所述对细胞分化产物中细胞的存活状态进行检测的方法包括电镜观察(通过电子显微镜观察细胞形态及内部结构,以判断细胞是否死亡)、染色观察(用染色剂染色后观察细胞,以判断细胞是否死亡)、体外细胞培养(将细胞置于体外环境中培养,以判断细胞是否死亡)、电生理分析(通过测量细胞膜电位,以判断细胞是否死亡)、生物化学分析(利用生物化学方法,检测细胞中特定细胞标志物,以判断细胞是否死亡)、荧光检测(使用荧光标记物检测细胞内的活性物质,以判断细胞是否死亡)。
46、在一些实施方案中,所述对细胞分化产物中细胞的存活状态进行检测的方法并不局限于本发明中所列举出的方法,任何能够鉴别细胞分化产物中细胞的存活状态的方法均在本发明的保护范围内。
47、本发明的第三方面提供了细胞g1期阻滞剂在epsc来源的ipsc中epsc残留检测中的应用;
48、优选地,所述细胞g1期阻滞剂包括丝裂霉素、新福菌素、表阿霉素、阿霉素、衣霉素、长春新碱、丙戊酸钠、尼妥珠单抗、5-氟尿嘧啶、顺铂、氟西汀、索拉非尼、吲哚美辛、瑞博西尼、阿贝西利、哌柏西利、紫杉醇、表没食子儿茶素没食子酸酯、过氧化氢、奥曲肽、x射线辐照中的任意一种或多种;
49、更优选地,所述细胞g1期阻滞剂为丝裂霉素;
50、最优选地,采用权本发明第二方面所述的方法进行检测;
51、最优选地,若所述细胞分化产物中没有细胞存活,则表明没有epsc的残留;
52、最优选地,若所述细胞分化产物中还有细胞存活,则表明存在epsc的残留。
53、在一些实施方案中,基于epsc和ipsc在细胞周期调控上的差异对epsc来源的ipsc中epsc残留进行检测,根据经丝裂霉素处理后的细胞分化产物中细胞的存活状态进行鉴别。若经丝裂霉素处理后的细胞分化产物中没有细胞存活,则表明没有epsc的残留;若所述细胞分化产物中还有细胞存活,则表明存在epsc残留,epsc未完全转化为ipsc,还需要延长转化时间,防止epsc的残留减弱ipsc细胞后续的分化效率。
54、在一些实施方案中,所述细胞g1期阻滞剂并不局限于本发明如前所述的试剂,只要是对处于g1期的epsc的生长起阻滞作用、对处于s期和g2期的epsc起毒害作用、对ipsc起毒害作用的试剂均在本发明的保护范围内。在本发明的具体实施方案中,所述细胞g1期阻滞剂优选为丝裂霉素。
55、本发明的第四方面提供了一种用于检测epsc来源的ipsc中epsc残留的试剂盒。
56、进一步,所述试剂盒包括细胞g1期阻滞剂;
57、优选地,所述细胞g1期阻滞剂包括丝裂霉素、新福菌素、表阿霉素、阿霉素、衣霉素、长春新碱、丙戊酸钠、尼妥珠单抗、5-氟尿嘧啶、顺铂、氟西汀、索拉非尼、吲哚美辛、瑞博西尼、阿贝西利、哌柏西利、紫杉醇、表没食子儿茶素没食子酸酯、过氧化氢、奥曲肽、x射线辐照中的任意一种或多种;
58、更优选地,所述细胞g1期阻滞剂为丝裂霉素;
59、优选地,所述试剂盒中还包括ipsc培养基;
60、更优选地,所述ipsc培养基为stem cell tesrtm-e8tm。
61、进一步,所述试剂盒还包括基底,这样的基底适合用于培养epsc分化为ipsc时得到的细胞分化产物,优选地,基底是塑料培养器皿(如培养皿)、多孔板或烧瓶。
62、进一步,所述试剂盒还包括使用该试剂盒的说明书,所述说明书中记载如何使用该试剂盒对epsc来源的ipsc中是否存在epsc残留进行检测。
63、相对于现有技术,本发明具有的优点和有益效果:
64、本发明首次将丝裂霉素用于epsc和ipsc的鉴别中,并首次提供了一种基于丝裂霉素鉴别epsc是否完全转化为ipsc的检测方法,所述方法检测效率高、成本低、准确性高、操作简单、通用性强、适用范围广,为本领域关于epsc来源的ipsc中epsc残留检测提供了新思路。所述方法可适用于由epsc分化得到ipsc产品的质量监控,为临床提供可靠的细胞产品,并可大大缩短epsc残留检测的时间,加速细胞产品的制备进程,具有良好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!