一种非小细胞肺癌免疫治疗预后相关基因、预后评分模型及其应用的制作方法
本发明涉及生物医药,具体涉及一种非小细胞肺癌免疫治疗预后相关基因、预后评分模型及其应用。
背景技术:
1、肺癌是全球癌症相关死亡的关键原因之一,2015版世界卫生组织肺部肿瘤的组织病理学分类依据形态和结构基础将肺癌分为鳞癌和腺癌两大类,其中,80%-85%的肺癌为非小细胞肺癌(non-small cell lung cancer,nsclc)。据统计,每年大约有160万肺癌患者死亡,肺癌已经成为严重威胁人们生命健康的社会问题。影响肺癌患者的预后因素有许多,具有相同临床分期和组织形态学分型的肺癌患者接受相同治疗方案,也可能具有不同的临床获益。2016年,keynote-024研究中,免疫检查点抑制剂(immune checkpoint blocades,icbs)的治疗方案运用于晚期非小细胞肺癌患者,患者总生存期(overall survival,os)显著延长,改变了非小细胞肺癌靶向治疗或联合化疗为主的总体治疗格局,为患者提供了更多的选择。随着以免疫检查点抑制剂为主的免疫治疗快速发展,越来越多的肺癌患者从免疫治疗中获益。尽管如此,大部分患者仍无法从免疫治疗中获益,甚至有患者出现疾病进展的不良预后。寻找能够精确预测免疫治疗疗效的生物标志物,发现免疫治疗的耐药人群,制定更加个体化的治疗方案,是临床迫切需要解决的问题。作为癌症免疫疗法的关键组成部分,免疫检查点阻断疗法(如pd-1/pd-l1单抗)在多种肿瘤患者中都获得了持久的响应。不过,目前只有少部分肿瘤患者能够从中获益,因此,如何精确筛选出能从免疫检查点抑制剂中获益的患者群体,是肺癌免疫治疗面临的最大挑战。
2、目前,用于预测非小细胞肺癌免疫检查点抑制剂疗效的生物标志物主要分为两类,一类是与肿瘤新抗原表位负荷相关的生物标志物,如肿瘤突变负荷(tumor mutationalburden,tmb)和微卫星不稳定(microsatellite instability,msi);另一类是提示t细胞炎症的肿瘤微环境的标志物,如程序性死亡配体-1(pd-l1)。临床上,通过免疫组化技术检测肿瘤细胞或肿瘤浸润免疫细胞上pd-l1的表达水平是目前应用最广泛的指标。早期icbs相关的临床试验数据表明,pd-l1高表达的肿瘤患者与pd-l1低表达/不表达患者相比,使用icbs有更好的临床获益。keynote-024研究中,对于pd-l1高表达(≥50%)的晚期nsclc患者,帕博利珠单抗较含铂化疗显著改善中位os(30月vs 14.2月)。oak研究中,pd-l1表达≥1%的人群使用阿特珠单抗,其中位os较化疗患者显著延长(15.7月vs 10.3月)。然而,pd-l1表达水平作为预测免疫治疗疗效的生物标志物存在局限性:①pd-l1表达在肿瘤中存在时间和空间异质性,即不同瘤种及肿瘤中的不同部位,肿瘤原发病灶和转移灶,新鲜标本和存储标本之间都存在pd-l1表达的差异;②抗体和免疫组化染色缺乏标准化。目前临床研究中,多种不同的抗pd-l1抗体用于免疫组化染色,如22c3、28-8抗体等,而染色情况也受制于评估者的主观判断;③pd-l1有效性的界定标准模糊,组织中pd-l1表达在多少百分比判定为“阳性”存在争议。在多项临床研究中证实了pd-l1表达水平(肿瘤细胞>50%/肿瘤浸润免疫细胞>10%)与icb临床获益之间的相关性。pd-l1 28-8pharm dx(dako)ihc检测在晚期nsclc接受纳武利尤单抗的患者中被批准,其评分系统定义为:pd-l1表达<1%为阴性,低表达为1%-5%,中间表达为5%-10%,高表达为>10%。④部分通过免疫组织化学检测为pd-l1表达<1%甚至不表达的患者仍然可以通过抗pd-1/pd-l1疗法获得临床益处。肿瘤突变负荷(tmb),定义为肿瘤基因组中每个编码区域的体细胞突变总数,衡量肿瘤外显子组中非同义编码突变的数量。高度突变的肿瘤可以产生许多新抗原,增加t细胞的反应性,因此高肿瘤突变负荷(tmb-h)被认为与肿瘤免疫治疗的良好预后有关。基于keynote-158研究结果,fda批准帕博利珠单抗用于不可切除或转移性tmb-h(≥10mut/mb)的实体瘤患者。在oak和poplar研究中,血液tmb(btmb)≥16mut/mb的晚期nsclc患者接受阿特珠单抗单药治疗可获得较好的临床预后。但是,不同的tmb计算方法和不同的阈值的定义标准,使得tmb是否可作为可靠的生物标志物有待进一步评估。此外,tmb并不总是与icb治疗的疗效和更长的生存期相关。在keynote-021和keynote-189中,组织tmb(ttmb)与帕博利珠单抗联合化疗的疗效无显著相关性,并且在不同肿瘤突变负荷的患者组中观察到相近的生存获益。微卫星是短dna序列的串联重复序列,在真核生物的基因组中广泛存在。人类错配修复基因(mmr基因)经转录翻译后可表达相应的错配修复蛋白,错配修复缺陷(dmmr)的细胞更容易受到微卫星突变的影响,随着突变的积累,导致微卫星不稳定(msi)的发生。dmmr肿瘤细胞可以在其膜上表达pd-l1,故微卫星高度不稳定(msi-h)/dmmr被认为是预测肺癌icb疗效的潜在生物标志物。2017年,美国fda批准pd-1抑制剂帕博利珠单抗治疗msi-h/dmmr的实体瘤患者,瘤种覆盖非小细胞肺癌在内的15个不同部位的恶性肿瘤。以上研究结果表明msi-h是一种泛癌免疫治疗预测因子,但其预测价值仅适用于<1%的nsclc患者,表明msi-h不适用于大范围筛选nsclc的免疫治疗应答者。综上,pd-l1表达水平,tmb和msi-h等现有生物标志物的临床应用均面临挑战,肿瘤细胞所处微环境对复杂的抗肿瘤免疫反应过程的影响,使得任何单一的生物标志物可能都不足以有效和可重复地预测icb对nsclc患者的疗效,提示仍需要开发更精确全面的生物标志物以预测nsclc免疫治疗的疗效,而开发新的更稳健的生物标志物及探索联合生物标志物检测的策略可能是克服这一困难的关键。而且,目前多种生物标志物在预测pd-1/pd-l1单抗疗效都集中于肿瘤细胞特征,而忽略了对肿瘤微环境状况的评估,稳定性欠佳,存在一定局限性,在肿瘤、肿瘤免疫微环境和宿主免疫之间存在复杂的癌症-免疫相互作用,这也部分解释了多项生物标志物的临床试验中肺癌对icb反应率不高的原因;因此,亟需更精准的生物标志物以预测免疫检查点抑制剂pd-1/pd-l1单抗的疗效。
3、目前,国际上已有学者从肿瘤免疫微环境角度预测免疫治疗疗效(包括geps,ips,tide,pan-f-tbrs,impers等评分)。其中geps(t细胞炎症基因评分)是目前研究较为可靠的预测免疫治疗疗效的生物标志物,该评分基于黑色素瘤基因表达谱数据建立,其预测价值在胃癌和头颈部鳞癌(hnscc)中得到验证,开创了高通量转录组数据建立标签基因构建评分进行免疫治疗疗效预测的先河,但该评分在晚期肺癌免疫治疗中的没有得到证实,过往有报道显示,nsclc中geps虽与肿瘤中淋巴细胞数量相关,但与免疫治疗疗效没有显著相关性。因此,亟待在现有研究和技术的基础上,设计研发一项肺癌的免疫治疗预后评分系统。
技术实现思路
1、本发明的目的在于克服现有技术的不足,提供一种非小细胞肺癌免疫治疗预后相关基因、预后评分模型及其应用。
2、为实现上述目的,本发明采取的技术方案为:一种非小细胞肺癌免疫治疗预后相关基因,所述基因包括ypel3、al355075.4、smoc1、dcaf8、fat1、akr7a3、ints3、setdb1、rnf44、norad、fah、agap1、pip5k1a、mafk、trap1、lrrc66、kiaa0907、ntf4、rhpn2、rrnad1、prelid1p1、slc25a6、ptrhd1、igsf8、traf4、ido1、clec6a、cd96、hcls1、cst7、ighv3-74、ncf1b、fam162a、il2rg、sh2d1a、cd247、cd3g、gsto1、nupr1、tbxas1、clec12a、cd37、prkcsh、yeats2、ccl5、sept14p12、ppm1g、tfrc、ndufa6和rab30。
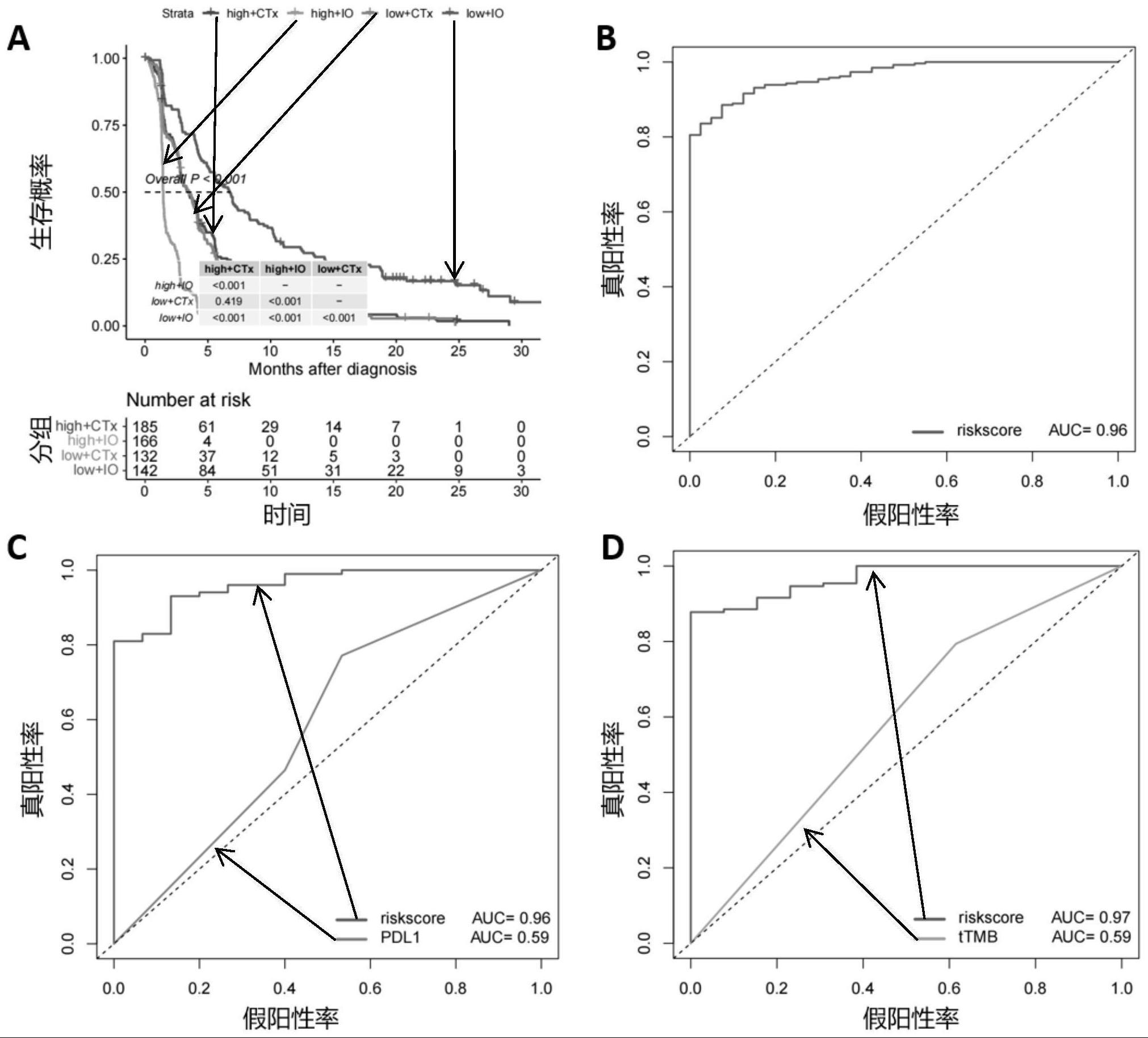
3、目前非小细胞肺癌治疗中预测免疫治疗疗效的生物标志物主要包括pd-l1表达水平以及肿瘤突变负荷,但这两个指标主要依赖肿瘤细胞的特征,忽略了肿瘤微环境对难以辨识出肿瘤免疫治疗耐药的人群。本发明通过解析接受免疫治疗和化疗的非小细胞肺癌患者的转录组谱筛选出相关的50个非小细胞肺癌免疫治疗预后相关基因,并运用机器学习算法建立一种基于非小细胞肺癌患者预后的评分模型(lira模型)。
4、本发明还提供所述非小细胞肺癌免疫治疗预后相关基因在构建非小细胞肺癌免疫治疗预后评分模型中的应用。
5、本发明还提供一种非小细胞肺癌免疫治疗预后评分模型的构建方法,包括以下步骤:
6、(1)收集肺癌患者的测序数据,并分成训练组和内部验证组;
7、(2)通过r包“iobr”的batch_sur()函数筛选与无进展生存期和总生存期相关且有统计学差异的基因;
8、(3)将步骤(2)获得的基因根据表达量平均值分成高低分组,通过r包“publish”的subgroupanalysis()函数,筛选与高分组治疗反应交互作用显著且有统计学差异的基因;
9、(4)选择训练组中接受阿特珠单抗治疗的队列,基于步骤(3)中得到的基因的表达量,通过r包“randomforestsrc”的rfsrc()函数,构建随机生存森林模型。
10、作为本发明所述构建方法的优选实施方式,所述步骤(3)获得的基因包括ypel3、al355075.4、smoc1、dcaf8、fat1、akr7a3、ints3、setdb1、rnf44、norad、fah、agap1、pip5k1a、mafk、trap1、lrrc66、kiaa0907、ntf4、rhpn2、rrnad1、prelid1p1、slc25a6、ptrhd1、igsf8、traf4、ido1、clec6a、cd96、hcls1、cst7、ighv3-74、ncf1b、fam162a、il2rg、sh2d1a、cd247、cd3g、gsto1、nupr1、tbxas1、clec12a、cd37、prkcsh、yeats2、ccl5、sept14p12、ppm1g、tfrc、ndufa6和rab30。
11、作为本发明所述构建方法的优选实施方式,还包括对所述模型的效能进行评估。
12、作为本发明所述构建方法的优选实施方式,所述模型在r语言程序中的评分公式为:lirascore<-lira_model(eset=eset,id_pdata="id")。
13、作为本发明所述构建方法的优选实施方式,以所述风险评分的平均值为临界值,其中大于或等于临界值为非小细胞肺癌免疫治疗预后差。
14、本发明还提供一种非小细胞肺癌免疫治疗预后评分模型,采用所述非小细胞肺癌免疫治疗预后评分模型的构建方法构建得到。
15、本发明还提供检测所述非小细胞肺癌免疫治疗预后相关基因的试剂在制备用于非小细胞肺癌免疫治疗预后的产品中的应用。优选地,所述产品包括试剂盒、诊断试剂、检测试剂、试纸、基因芯片或蛋白质芯片。所述试剂包括采用测序技术、核酸杂交技术或核酸扩增技术检测基因表达水平的试剂。
16、本发明还提供一种非小细胞肺癌免疫治疗预后试剂盒,所述试剂盒包括用于检测所述非小细胞肺癌免疫治疗预后相关基因的试剂。优选地,所述试剂包括引物、抗体或探针。
17、本发明的有益效果:本发明提供一种非小细胞肺癌免疫治疗预后相关基因、预后评分模型,本发明的lira模型根据与非小细胞肺癌患者的免疫治疗和化疗的预后相关的特征基因构建,能够一定程度上反映该患者免疫治疗的获益情况;同时,该模型能够筛选出一部分免疫治疗耐药或无法从免疫治疗中获益的潜在人群,从而为非小细胞肺癌患者提供更加个体化的治疗方案;与目前已有的分子标志物相比,该模型不仅是非小细胞肺癌患者接受免疫治疗后进展与死亡风险的预后独立预测因素,也是一个有效的预测患者免疫治疗应答的工具,为非小细胞肺癌患者提供更个体化的免疫效益评估,具有临床转化意义。
- 还没有人留言评论。精彩留言会获得点赞!