一种重组蛋白MMLV-RT的纯化方法与流程
本发明属于蛋白纯化领域,特别涉及一种重组蛋白mmlv-rt的纯化方法。
背景技术:
1、鼠白血病病毒的逆转录酶(mmlv-rt)是生物学研究常用的一种工具酶。逆转录酶是一类存在于部分rna病毒中具有逆转录活性、能以单链rna为模板合成dna的酶。由逆转录酶催化逆转录合成的dna称为互补dna(cdna)。通常情况下,细胞内的转录是以dna为模板合成rna的,所得rna为信使rna(mrna),为蛋白质合成提供模板。而在部分rna病毒中,要实现自身的扩增,必须具有dna,因此先由rna逆转录合成cdna,再以cdna为模板合成dna。
2、逆转录酶从rna模板中制造出单股dna。在缺乏dna-dependent rna聚合酶的病毒中,双股dna的制造可以经由宿主编码dna聚合酶δ完成,过程中可能会将病毒的dna-rna引子误认并且借由和引子去除类似的机制合成出双股dna,而在新的合成的dna即取代了旧有的rna模板。
3、作为比较常用的生物学产品,逆转录酶(mmlv-rt)市场需求很大,但是天然的逆转录酶提取复杂,产率很低。纯度也满足不了现有市场的要求。有鉴于此,本发明的目的在于获得一种快速简便地提纯目标蛋白mmlv-rt的方法。
技术实现思路
1、本发明提供一种重组蛋白mmlv-rt的纯化方法,其目的是要解决现有逆转录酶(mmlv-rt)的提纯方法纯化得率低、纯化后蛋白无活性或活性低的问题。
2、为达到上述目的,本发明采用的技术方案是:一种重组蛋白mmlv-rt的纯化方法,包括以下步骤:
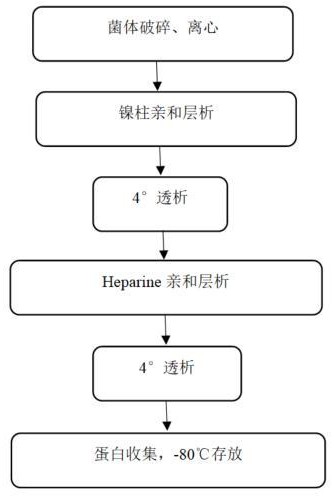
3、步骤一,取重组蛋白mmlv-rt菌体,加入缓冲液a进行菌液破碎,离心取上层清液得到重组蛋白预处理液;
4、步骤二,将步骤一获得的重组蛋白预处理液进行两次亲和层析纯化(柱层析),第一次亲和层析的介质为预装有ni2+的6%琼脂糖凝胶,先使用缓冲液a进行平衡,再依次使用缓冲液b、缓冲液c、缓冲液e过柱除杂,得到初步除杂的重组蛋白液,第二次亲和层析的介质为肝素琼脂糖凝胶,先使用缓冲液f进行平衡,再使用缓冲液g过柱除杂洗脱,得到二次除杂的重组蛋白液;
5、步骤三,将二次除杂的重组蛋白液收集,得到纯化的重组蛋白mmlv-rt,-80℃存放;
6、所述缓冲液a含有0.1-0.3 mm edta ph 8.0,0.5 -2 mm dtt,120-160 mm nacl,20-30 mm tris-hcl ph 7.5,1-3% triton x-100,15-25 mm咪唑,余量为水;
7、所述缓冲液b含有0.1-0.3 mm edta ph 8.0,0.5 -2 mm dtt,120-160 mm nacl,20-30 mm tris-hcl ph 7.5,1-3% triton x-100,35-45 mm咪唑,余量为水;
8、所述缓冲液c含有0.1-0.3 mm edta ph 8.0,0.5 -2 mm dtt,120-160 mm nacl,20-30 mm tris-hcl ph 7.5,1-3% triton x-100,90-110 mm咪唑,余量为水;
9、所述缓冲液e含有0.1-0.3 mm edta ph 8.0,0.5 -2 mm dtt,120-160 mm nacl,20-30 mm tris-hcl ph 7.5,1-3% triton x-100,250-350 mm咪唑,余量为水;
10、所述缓冲液f含有0.1-0.5m edta ph8.0,1-2 mm dtt,120-200 mm nacl, 100-150 mm kcl,15-20 mm tris-hcl ph7.5,0.01-0.05% triton x-100,余量为水;
11、所述缓冲液g含有0.1-0.5m edta ph8.0,1-2 mm dtt ,1-2m nacl, 100-150 mmkcl,15-20 mm tris-hcl ph7.5,0.01-0.05% triton x-100,余量为水。
12、以下为上述技术方案的相关解释:
13、1. 所述重组蛋白mmlv-rt通过将目的基因mmlv-rt构建原核表达体系,转化大肠杆菌诱导表达得到。
14、2. 表达载体为pet-28a,表达菌株为e.coli bl21(de3)。
15、3.步骤一中的上层清液以及步骤二中的两次亲和层析纯化后得到的重组蛋白液,均经sds-page分析确定目的蛋白的存在。
16、4.所述步骤二中,两次亲和层析纯化后,分别经透析袋4℃低温过夜透析。
17、5.步骤一和步骤二的总用时(菌液破碎、亲和层析挂柱、洗杂、洗脱、透析等)小于或8小时,以防时间过长蛋白沉淀或变性。
18、6.在第二次层析纯化过程中,最初的流动相是缓冲液f,洗脱的时候使用缓冲液g,这样一来缓冲液f的比例逐渐减少, 缓冲液g的比例逐渐增加。这一步骤是通过梯度提高盐离子浓度进行洗脱和除杂。
19、7. 所用试剂纯度等级可以仅为分析纯,不影响蛋白纯化流程及下游活性实验等。
20、8.第一次亲和层析纯化为镍柱亲和层析,填料为预装有ni2+的高度交联的6%琼脂糖凝胶(即固定相)。
21、9.第二次亲和层析纯化为heparine(肝素)亲和层析,填料为肝素琼脂糖凝胶(固定相)。
22、10.本技术方案中的亲和层析纯化,可使用人工过柱纯化,也可使用机器自动过柱。
23、11. 亲和层析纯化步骤中的“平衡”是指使用相应的流动相(缓冲液)对装有填料的层析柱进行冲洗,此为本领域技术人员知晓的公知常识。
24、以下为本技术方案的优点:
25、本发明属于生物技术领域,提供一种重组蛋白的纯化方法及其应用。具体地说,本发明涉及一种源于鼠白血病病毒的逆转录酶(mmlv-rt),一种依赖rna的dna聚合酶,这种酶无3,-5,核酸外切酶活性,具有rnase活性。逆转录酶是生物学研究常用的一种工具酶。对原核表达形成的重组蛋白质快速、简便的纯化方法,所获纯蛋白mmlv-rt纯度高。
26、本发明提供了一种重组蛋白的纯化方法。使用特定的溶解菌体的缓冲液来进行洗脱、除杂,并结合透析方法去除无机盐、咪唑、核酸等无法过柱去除的杂质,最后获得的目的蛋白纯度在95%及以上。
27、本发明对鼠白血病病毒的逆转录酶(mmlv-rt)进行原核表达,并对表达出的重组蛋白进行了纯化步骤的探索,确定了一种快速、简便、有效地获得目标蛋白mmlv-rt的方法,有效地获得具生物学活性的目标蛋白,降低了纯化成本,为相关蛋白开展酶学、遗传学、蛋白质组学等研究提供了技术支持与借鉴。
28、本发明蛋白纯化全程所用试剂为常规试剂,价格低且易获取;经本发明方法纯化所得纯蛋白具较高蛋白酶活性,解决了重组蛋白纯化得率低、纯化后蛋白无活性或活性低等常见技术问题,值得推广与应用;全程所用时间较短,纯化更快速、简便,适于工业化生产。
29、与现有技术相比,整体纯化流程简单,只需2步纯化就能得到纯度较高的蛋白,减少纯化时间、节约纯化成本的同时也利于工业生产放大。第二步纯化采用肝素柱,能有效去除核酸,大大降低了mmlv-rt酶在后续检测应用中的局限性(纯化后的酶中自带核酸对于检测结果的影响)。无需酶切去除组氨酸标签,因为组氨酸标签比较小且在目的片段的n端或c端,不影响蛋白的正确折叠,对于后续应用中酶的效果并无影响。本发明方法快速、简便、有效地获得具生物学活性的目标蛋白,减少纯化时间,降低纯化成本。
- 还没有人留言评论。精彩留言会获得点赞!