表达双特异性T细胞衔接器的溶瘤腺病毒、构建方法及用途
本发明属于生物医药,具体涉及表达双特异性t细胞衔接器的溶瘤腺病毒、构建方法及用途。
背景技术:
1、溶瘤病毒(ovs)是一类天然的或基因修饰的能够特异性杀伤肿瘤细胞的病毒,其能够在肿瘤细胞中优先复制,最终导致肿瘤细胞裂解,并激活抗肿瘤免疫反应。该种病毒在机体中发挥抗肿瘤作用通常被认为通过两种机制:一是溶瘤病毒在肿瘤细胞中进行特异性的复制导致肿瘤细胞直接裂解,肿瘤细胞裂解后释放出新的病毒感染和破坏其他肿瘤细胞;二是溶瘤病毒裂解肿瘤细胞后释放大量的肿瘤抗原,通过抗原呈递,激活免疫细胞,产生抗肿瘤反应。溶瘤病毒肿瘤治疗技术是肿瘤免疫治疗的前沿方向,在临床试验中表现出好的安全性和颠覆性疗效。目前溶瘤病毒已有代表性产品获批上市,具有极大的潜力与应用前景。常见的溶瘤病毒有单纯疱疹病毒、腺病毒、水泡性口炎病毒、痘病毒、麻疹病毒等。目前开展临床试验最多的溶瘤病毒类型是溶瘤腺病毒。截至2022上半年,全球已有至少四款溶瘤病毒疗法获批上市,分别为rigvir(echo-7病毒)、安柯瑞(重组人5型腺病毒)、t-vec(单纯疱疹病毒),delytact(单纯疱疹病毒)。溶瘤病毒通过特异性杀死肿瘤细胞,并传递肿瘤抗原而发挥抗肿瘤作用。然而肿瘤组织中除了含有大量的肿瘤细胞以外,还有大量间质细胞,包括肿瘤血管内皮细胞、成纤维细胞、抑制性免疫细胞等,这些细胞组成肿瘤微环境,调控肿瘤细胞的增殖。因此,溶瘤病毒单药治疗的效果有限。
2、b7-h3,也称cd276,最初研究表明b7-h3能够在人dc细胞上诱导表达,并具有刺激t细胞的增生、增强细胞毒性t淋巴细胞的诱导和γ干扰素分泌的功能。但是,随后也有研究报道人b7-h3是一个t细胞共抑制分子,能够显著抑制t细胞激活过程中ifn-γ,il-2,il-10和il-13的分泌。b7-h3敲除或阻断型抗体拮抗则能够促进t细胞增殖,抑制肿瘤的生长。b7-h3在肺癌、黑色素瘤、胰腺癌、肠癌、前列腺癌、卵巢癌、肾癌、胶质瘤、头颈部肿瘤等多种实体瘤和血液系统肿瘤中高表达。作为一个泛肿瘤抗原和潜在的免疫抑制性调节分子,近年来,针对b7-h3开展靶向治疗研究是抗肿瘤研究领域的热点之一。
3、目前,进入临床的b7-h3靶向生物药主要包括fc工程化抗体,抗体偶联药,抗体偶联核素,car-t等类型。其中进展较快的是y-mabs therapeutics公司的放射性核素标记的b7-h3单抗8h9(omburtamab),用于治疗儿童中枢神经系统/软脑膜转移的神经母细胞瘤,由于其出色的临床治疗效果,目前已经向欧洲药物管理局提交了上市申请,同时也在与fda沟通补充上市申请资料。同时,b7-h3靶向adc药物也取得了令人鼓舞的疗效,如日本daiichisankyo公司开发的b7-h3 adc药物ds-7300,偶联的毒素为dna topoisomerase i抑制剂dxd,临床i/ii期数据表明,对转移性去势抵抗性前列腺癌具有良好的安全性,并取得了明确的鼓舞人心的疗效;macrogenics公司也在2021年asco和esmo大会上,报道了他们的b7-h3 adc药mgc018的早期临床数据,mgc018偶联的毒素为dna合成抑制剂duocarmycin,结果显示mgc018具有可控制的安全性,对转移性黑色素瘤观察到了转移灶的缩小。macrogenics公司同时也开发了靶向b7-h3的fc工程化抗体enoblituzumab,目前也正在开展临床ii期试验,评价单药及联合pd-1等抗体对多种实体瘤的治疗效果。
4、1960年nisonoff首次提出双特异性抗体(bsab)的概念,随着基因工程抗体、免疫学等相关领域的快速进展,bsab的构建理念、技术平台以及产品研发也在不断发展创新。所谓双特异性抗体是含有两种特异性抗原结合位点的人工抗体,能在靶细胞和功能分子(细胞)之间架起桥梁应,激发具有导向性的免疫反应,是基因工程抗体的一种,现已成为抗体工程领域的热点,在肿瘤的免疫治疗中具有广阔的应用前景。双特异性t细胞衔接器(bispecific t cell engagers,bite)是一种双特异型抗体,它由两类抗体的scfv段融合而成,分别可以结合t细胞表面的cd3分子或者其它激活因子以及肿瘤细胞表面抗原分子,从而诱导t细胞对肿瘤细胞的杀伤,此过程不受mhc限制。目前这一疗法在血液系统恶性肿瘤中效果较好,其中一种cd3×cd19的bite,blinatumomab,已经被fda批准用于b细胞恶性肿瘤的治疗。但是bite在血清中的半衰期通常较短,并且可能存在严重的脱靶毒性。此外,由于实体瘤存在的物理屏障以及免疫抑制微环境,都限制了bite的运用。
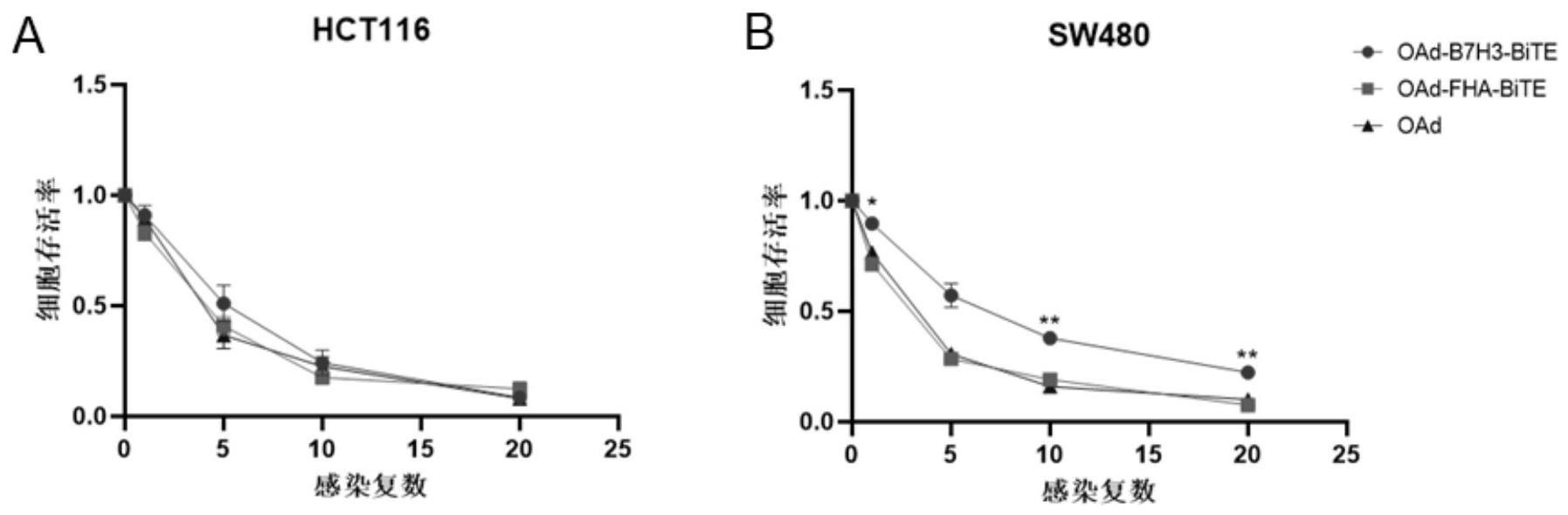
5、溶瘤病毒可以作为基因工程的平台,表达外源性治疗基因。开发特异性表达bite的溶瘤病毒(ovs-bite),利用ovs的自我复制以及细胞杀伤能力,可以持续表达并分泌bite,而经过特定基因修饰与改造,ovs又能够特异性靶向肿瘤细胞,使更多的bite能够渗透到肿瘤组织部位,从而降低其脱靶毒性,该治疗方法提高了ovs抗肿瘤治疗的能力,可以有效解决溶瘤病毒和bite的局限性。目前没有表达b7h3×cd3 bite的溶瘤腺病毒的报道。
技术实现思路
1、本发明旨在至少解决现有技术中存在的技术问题之一。本发明目的在于提供表达双特异性t细胞衔接器的溶瘤腺病毒,包括溶瘤腺病毒e1a和e1b基因表达盒、b7h3×cd3bite外源基因表达盒。
2、进一步地,所述溶瘤腺病毒e1a由人端粒酶启动子htertp控制。
3、更进一步地,e1a通过内部核糖体进入位点ires连接并启动e1b表达,形成htertp-e1a-ires-e1b结构的溶瘤腺病毒。
4、进一步地,所述溶瘤腺病毒e1a和e1b基因表达盒,包括以下可操作性相连的元件:人端粒酶启动子htertp、e1a基因、ires序列、e1b基因、终止子。
5、进一步地,所述的人端粒酶启动子htertp核苷酸序列如seq id no:1所示。
6、所述的溶瘤腺病毒e1a基因的核苷酸序列如seq id no:2所示。
7、所述的溶瘤腺病毒e1a基因的氨基酸序列如seq id no:3所示。
8、所述的ires核苷酸序列如seq id no:4所示。
9、所述的溶瘤腺病毒e1b基因的核苷酸序列如seq id no:5所示。
10、所述的溶瘤腺病毒e1b基因编码的e1b19k和e1b55k的氨基酸序列如seq id no:6和seq id no:7所示。
11、所述的溶瘤腺病毒e1a和e1b基因表达盒的终止子为sv40 polya,其核苷酸序列如seq id no:8所示。
12、进一步地,所述的b7h3×cd3 bite外源基因包括b7h3 scfv和cd3 scfv的融合基因。
13、其中,所述b7h3 scfv包括b7h3 scfv轻链可变区编码序列和b7h3 scfv重链可变区编码序列。
14、其中,所述cd3 scfv包括cd3 scfv重链可变区编码序列、cd3 scfv轻链可变区编码序列。
15、更进一步地,所述的b7h3×cd3 bite外源基因表达盒包括以下可操作性相连的元件:b7h3 scfv轻链可变区编码序列、b7h3 scfv重链可变区编码序列、cd3 scfv重链可变区编码序列、cd3 scfv轻链可变区编码序列。
16、优选地,所述的b7h3×cd3 bite外源基因表达盒包括以下可操作性相连的元件:启动子、信号肽编码序列、b7h3 scfv轻链可变区编码序列、连接序列1、b7h3 scfv重链可变区编码序列、连接序列2、cd3 scfv重链可变区编码序列、连接序列3、cd3 scfv轻链可变区编码序列、终止子。
17、进一步地,所述的b7h3×cd3 bite外源基因表达盒前还包括kozak序列,所述启动子包括真核启动子。优选地,所述真核启动子为cmv、mcmv、cag。
18、进一步地,所述信号肽为igκ信号肽,其核苷酸序列如seq id no:9所示。
19、进一步地,所述信号肽为igκ信号肽,其氨基酸序列如seq id no:10所示;
20、进一步地,所述的b7h3 scfv轻链可变区核苷酸序列如seq id no:11或seq idno:12所示。
21、进一步地,所述的b7h3 scfv轻链可变区氨基酸序列如seq id no:13或seq idno:14所示。
22、进一步地,所述的b7h3 scfv重链可变区核苷酸序列如seq id no:15或seq idno:16所示;
23、进一步地,所述的b7h3 scfv重链可变区氨基酸序列如seq id no:17或seq idno:18所示。
24、进一步地,所述的b7h3 scfv轻链可变区和重链可变区之间的连接肽是(g4s)3,其核苷酸序列如seq id no:19所示。
25、进一步地,所述连接肽(g4s)3,其氨基酸序列如seq id no:20所示。
26、进一步地,所述的cd3 scfv的核苷酸序列如seq id no:21所示。
27、进一步地,所述的cd3 scfv的氨基酸序列如seq id no:22所示。
28、进一步地,所述的b7h3 scfv和cd3 scfv之间的连接肽的核苷酸序列如seq idno:23所示。
29、进一步地,所述的b7h3 scfv和cd3 scfv之间的连接肽的氨基酸序列如seq idno:24所示。
30、本发明还提供一种重组溶瘤腺病毒载体,其可操作地插入或者含上述b7h3×cd3bite外源基因表达盒。
31、本发明还提供上述表达双特异性t细胞衔接器的溶瘤腺病毒的构建方法,包括以下步骤:将合成的e1a-e1b基因表达盒克隆入穿梭载体上,构建含有e1a-e1b基因表达的质粒,再将合成的b7h3×cd3 bite基因克隆入含有e1a-e1b基因表达的质粒中,然后进行重组腺病毒的包装,即得表达b7h3×cd3 bite的重组溶瘤腺病毒。
32、优选地,本发明还提供上述表达双特异性t细胞衔接器的溶瘤腺病毒的构建方法,包括以下步骤:合成e1a-e1b基因表达盒,并利用gibson克隆的方法将e1a-e1b基因表达盒克隆入穿梭载体上,构建含有e1a-e1b基因表达的质粒,再将b7h3×cd3 bite基因克隆入pdc316或pdc516穿梭质粒中,将携带b7h3×cd3 bite基因的pdc316或pdc516穿梭质粒与admax腺病毒包装系统的骨架质粒共转染hek293细胞进行重组腺病毒的包装,即得表达b7h3×cd3 bite的重组溶瘤腺病毒。
33、更优选地,所述骨架质粒包括pbhglox_e1,3cre或pbhgfrt_e1,3flp。
34、本发明还提供上述表达双特异性t细胞衔接器的溶瘤腺病毒或重组溶瘤腺病毒载体在制备治疗和/或预防和/或辅助治疗癌症或者肿瘤的药物中的用途。
35、所述用途中,所述的药物是以溶瘤腺病毒或重组溶瘤腺病毒载体作为抗癌活性成分,加入药学上可接受的辅料或辅助性成分制备而成的制剂。
36、其中,所述的制剂包括但不限于注射制剂、冻干制剂。
37、优选地,所述制剂为注射制剂。
38、所述癌症或者肿瘤为b7h3高表达的肿瘤,包括实体瘤、儿童易发肿瘤或血液系统肿瘤中至少一种。
39、所述实体瘤包括黑色素瘤,胰腺癌,肠癌,前列腺癌,卵巢癌,肾癌,胶质瘤或头颈部肿瘤中至少一种。
40、所述儿童易发肿瘤包括神经母细胞瘤,髓母细胞瘤或骨肉瘤中至少一种。
41、有益效果:在5型腺病毒基因组的基础上进行改造,本发明通过筛选、构建了一种表达双特异性t细胞衔接器的溶瘤腺病毒,包括溶瘤腺病毒e1a和e1b基因表达盒、b7h3×cd3bite外源基因表达盒。溶瘤腺病毒e1a由人端粒酶启动子(htertp)控制,并且e1a通过内部核糖体进入位点(ires)连接并启动e1b表达,而且所述的溶瘤病毒插入了包含针对b7h3的双特异性t细胞衔接器bite的表达框架,能持续表达b7h3×cd3 bite双功能抗体,封闭肿瘤细胞表面b7h3分子,并刺激t淋巴细胞活化从而靶向杀伤b7h3阳性的肿瘤细胞。通过体外和动物实验表明,本发明将双特异性t细胞衔接器与溶瘤病毒结合,相对于单纯的基因治疗或者溶瘤病毒治疗,本发明的溶瘤病毒显著增强对恶性肿瘤的抑制能力。
- 还没有人留言评论。精彩留言会获得点赞!