亲本介导的CRISPR-Cas9白背飞虱下一代的基因敲除方法
本发明属于基因工程,尤其涉及一种亲本介导的crispr-cas9白背飞虱下一代的高效基因敲除方法。
背景技术:
1、白背飞虱(white-backed planthopper,wbph,sogatellafurcifera)是危害水稻的主要农业害虫,传播病毒,例如南方水稻黑条矮缩病同时以口针刺破植株组织吸取汁液刺吸为害,消耗植株营养,同时刺吸取食时分泌凝固性唾液形成的口针鞘,有阻碍植株体内水分和养分输导的作用,严重时造成虱烧、黄塘和稻穗变色等症状;产卵为害是雌虫产卵时用剑状的产卵器划破寄主组织造成的伤痕,可促使植株体内水分散失,同时破坏输导组织,阻碍营养物质的输送,减弱同化作用,从而加重了植株的为害。同时刺吸和产卵造成的伤口也有利于病原菌的侵染,并造成腐生菌滋生;取食时分泌的蜜露,因富含各种糖类、氨基酸,覆盖在稻株上,极易招致烟煤病的滋生,影响植株光合作用。在现在化学农药滥用下,稻飞虱对农药的抗性在逐渐增加急需一种新的对环境绿色友好的新型农药对稻飞虱进行防治。
2、crispr/cas9系统是近年来兴起的一种新型基因编辑技术。它是一种原核生物免疫系统,被用来抵抗噬菌体病毒和外源质粒等外来遗传物质的入仗。它能够识别并切断外源dna,正是由于如此精确的靶向功能,使得外源基因的表达被沉默。迄今为止,cas9泛用于在各种物种和细胞类型(包括人类细胞系、细菌、动物、植物和昆虫)中实现有效的基因组编辑。此外,基于单细胞层面的crispr/cas9系统在模式和非模式昆虫中已初步建立和发展。例如在果蝇、家蚕等模式昆虫和蝴蝶、蚊子、甲虫等非模式昆虫中成功进行了高效的敲除和敲入实验。本发明采用sgrna(single guide rna)最为识别标靶基因的引导物质,2022年shirai等人首次将cas9/sgrna复合物注射到未受精的德国小蠊和赤拟谷盗雌虫卵巢中,并成功在发育中的卵母细胞中引发了遗传突变,产生稳定的遗传子代和突出的明显表型特征。这表明crispr/cas9技术的应用在遗传水平上为害虫生物防治提供了一种新的遗传控制策略,为向基因控制机制过渡提供了新思路,增加了在基于生物安全的病虫害治理中的应用潜力。高效和特异性的crispr/cas9介导的敲入程序通过促进复杂的基因组修饰,其运行成本低、操作简单等优点,为防治农业害虫提供了一种绿色、潜在的友好靶点,极大地扩展了crispr的应用。
3、目前引导昆虫产生定向的基因突变主要采用两种技术:crispr技术和remot(receptor mediated ovary transduction ofcargo)技术。首先crispr技术是一种常见的基因编辑技术,通过将特定基因编辑工具(如cas9蛋白和sgrna)注入昆虫卵细胞中,实现对基因组的修改。这种方法可以在较早的发育阶段进行基因编辑,以确保编辑效果被遗传到后代。crispr/cas9可以实现高效的基因突变,它已经在许多昆虫物种中成功应用,包括蚊子和果蝇等。remot技术中则是一种通过介导受体介导的输送方式,将目标基因表达载体传递到昆虫卵巢中。这种技术利用病毒载体或纳米颗粒,在昆虫体内递送基因材料。remot技术相对于rna干扰技术而言,具有更广泛的适用性,不受昆虫发育阶段的限制。
4、然而,这些技术在应用过程中也存在一些问题和缺陷:
5、1.技术复杂性:无论是crispr/cas9还是remot技术,都需要专业的实验室设备和技能来执行,对昆虫针对昆虫卵细胞层面的操作复杂且需要高度精确的操作,对于非专业人员而言可能有一定难度。
6、2.有效性和准确性:基因突变引导技术的有效性和准确性是关键问题。在实际应用中,存在着编辑效率低、不稳定等问题,如xue等人敲除褐飞虱(nilaparvata lugens)的一个眼睛色素沉着基因nl-cn,发现48.8%(n=164)的突变g1代bph,但在g0成虫中未发现明显的表型。此外,陈等使用crispr-cas9基因编辑技术敲除褐飞虱体内半胱氨酸亚磺酸脱羧酶(csad),仅诱导9.5%(2/21)的位点特异性诱变效率,无法实现可观的基因突变效果。
7、3.安全性:基因突变技术涉及到昆虫基因组的改变,这可能会引发一系列未知的影响,包括不良的遗传变异、生态系统紊乱等。因此,在使用这些技术时,必须进行全面的风险评估和监测。
8、4.遗传传递:昆虫基因突变的目的是通过遗传方式将所需特征传递给下一代,这仍然需要进一步的研究和验证。然而,rna干扰技术引导的基因突变具有可逆性,无法在群体中得到广泛传递,并具有持久的遗传效应。
9、综上所述,尽管crispr/cas9和remot技术为昆虫基因突变提供了有效的手段,但在应用过程中仍然存在一些问题和缺陷。随着稻飞虱对农药的抗性的逐渐增加,现有技术缺少一种环境绿色友好的新型农药对稻飞虱进行防治,这需要科学家们在实践中不断完善和改进,确保技术的安全性和有效性。同时,对于引导昆虫产生定向基因突变的应用,也需要进行严格的伦理和环境风险评估,以确保其合理性和可持续性。因此,研究人员开发了一种“直接亲本”crispr(dipa-crispr)的基因编辑方法。即将cas9和sgrna核糖核蛋白(rnps)注射到雌性成虫中,有效地在发育中的卵细胞中引入了遗传突变。dipa-crispr的简单性和可及性,它将极大地扩展基因编辑技术在各种模式和非模式昆虫中的应用,包括基因组未被任何方式操纵的全球农业和医疗害虫。此外,与dipa-crispr和remot技术相比,crispr/cas9系统显着提高了敲除效率。
技术实现思路
1、针对现有技术存在的问题,本发明提供了一种亲本介导的dipa-crispr白背飞虱下一代的高效基因敲除方法。
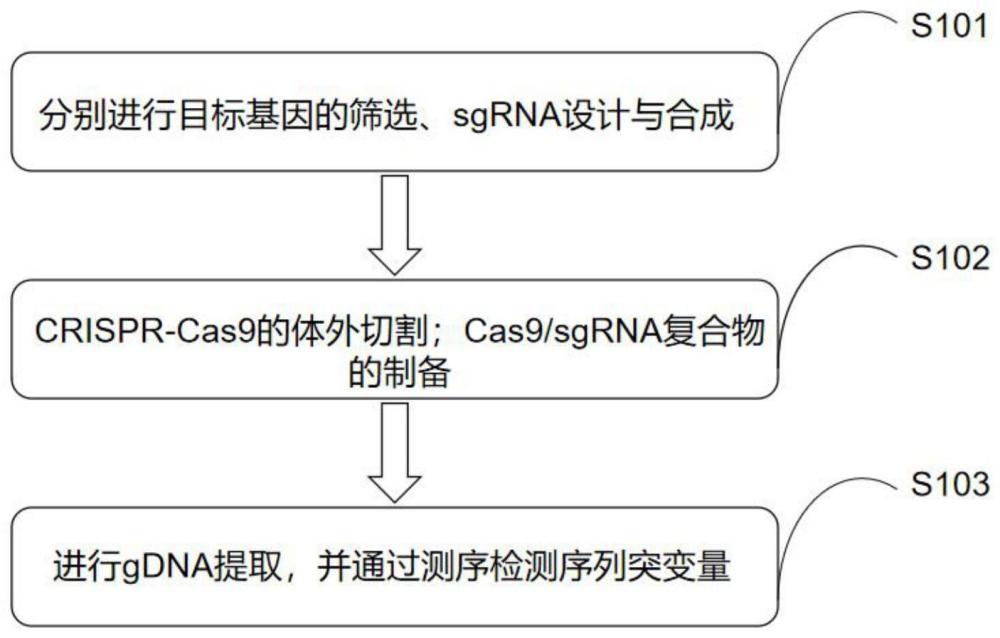
2、本发明是这样实现的,一种亲本介导的dipa-crispr白背飞虱下一代的高效基因敲除方法包括以下步骤:
3、s101,分别进行目标基因的筛选、sgrna设计与合成;
4、s102,cas9/sgrna复合物的制备;
5、s103,dipa-crispr的体外切割;
6、s104,gdna提取,并通过测序检测序列突变量。
7、进一步,s101中的目标基因的筛选、sgrna设计与合成方法为:
8、为了鉴定出目标基因,使用blastp在wbph基因组基因组中搜索草地贪夜蛾的tdo序列的同源物,并鉴定出一个sf-tdo序列(基因号:sfur00632-pa)。此外,sf-tdo与其他半翅目同源动物具有较高的蛋白同源性,其中两个最接近的是褐飞虱(89.87%,genbank基因号:alq52682.1)和紫莞叶蝉(63.90%,基因号:xp054262119.1)。通过crispor在线程序(http://crispor.tefor.net/),以sf-tdo第4和第5外显子的5'-gg-(n)18-ngg-3'为位点,设计了4个符合cas9可识别的原间隔邻近序列(pam)标准,表达的蛋白相同,带有相同bsmbi粘性末端,且具有高特异性和预测切割效率的sgrna。最后,设计后由genscript公司合成。
9、进一步,所述s102中的cas9/sgrna复合物的制备包括:
10、10μl混合物包括3.3μl 10μg/μl的cas9蛋白;4.16μl sgrna(浓度为1.3μg/μl,四条sgrna分别1.04μl);cas9:sgrna=33:13;和2.54μl无酶水。
11、1)取4.16μl sgrna(四条sgrna,每条各1.04μl)、2.54μl无酶水,轻微用移液枪吸打
12、2)加入3.3μl cas9(终浓度1.3μg/μl)轻微涡旋15s,短暂离心15s后,在室温孵育20min,放冰上备用。
13、进一步,所述s103中的dipa-crispr的体外切割包括:
14、将昆虫组织磨碎,再根据试剂盒说明书,使用microelute genomic dna kit提取野生型白背飞虱基因组;以基因组为模板,通过2×phantaflash mastermix以sf-tdo f/r为引物扩增dna;pcr产物通过qiaquick gel extraction kit纯化;使用t7high yield rna synthesis kit进行体外切割sgrna,反应体积为10μl,加入6×reactionbuffer 1μl,600ngcas9,再加入200ng sf-tdo sgrna(终浓度为3.125ng/μl)和3.06μl无酶水,涡旋15s,离心15s,再在室温下孵育15min,接着加入80ng模板,涡旋15s,离心15s,在37℃下孵育20min;
15、反应结束后,向反应液中加入等体积的6×dna loading buffer,轻轻混匀;将反应样品加载到2%琼脂糖凝胶上进行电泳;电泳后,在universal hood ii系统上对含有标记目标的凝胶进行可视化和成像。
16、进一步,所述s104中的gdna提取和测序检测包括:
17、第一步:样品收集:收集注射后有明显突变表型的wbph成虫;第二步:组织破碎:将昆虫样品在冰中快速冷冻,并使用一次性研磨棒将其组织彻底破碎。细胞裂解:加入裂解缓冲液(tris-hcl,edta,nacl,无酶水),将破碎的昆虫样品中的细胞膜溶解,并释放出细胞内的dna。第三步:蛋白质消化:加入蛋白酶k,将细胞中的蛋白质消化掉,以保证提取到的dna纯度较高。基因组提取:37度孵化30分钟后,收集注射后有明显突变表型的wbph成虫,接着在95度热激2分钟,从而灭活蛋白酶k,收集上清液以备后续的分子生物学操作。然后,以基因组为模板,通过2×phantaflashmastermix以sf-tdo f/r为引物扩增dna;pcr产物通过qiaquick gel extraction kit纯化。以dna回收产物为模板,利用t7核酸内切酶i确定打靶效率,如图2所示。接着用topo-blunt克隆试剂盒(喏维赞,中国,南京)克隆产物。取50μl大肠杆菌dh5α(c502-03,喏维赞,中国,南京)感受态细胞与5μl连接产物混匀,42c水浴45s,再冰浴3min。然后加500μl luria-bertani培养基,37℃振荡培养1.5h,吸取150μl培养液均匀涂到l.b平板(含ampicillin+抗生素)上,在37℃培养过夜。最后,挑取菌落在含有氨苄抗生素的l.b培养基中培养大肠杆菌,用通用引物进行菌液pcr鉴定,上、下游引物序列如表1所示。pcr程序为:95℃,2min;95℃,30s;62℃,20s;72℃,1min;40个循环;72℃,10min。然后用1.8%琼脂糖凝胶来检测目的pcr产物,正确的目的片段为1300bp左右。接着挑选几个阳性菌液,进行测序验证。最后数据分析:对测序得到的原始数据进行质量控制、拼接、序列比对、基因表达定量分析等一系列的生物信息学分析,得到转录组的相关信息。
18、结合上述的技术方案和解决的技术问题,本发明所要保护的技术方案所具备的优点及积极效果为:
19、第一、remot(reproductive cutting and mating technique)技术是一种在昆虫卵细胞中注入特定基因材料或生物标记物的技术,用于昆虫性状的调控和研究。以实现精确控制昆虫遗传的目的。然而,这种技术也面临着一些技术问题和挑战。
20、1.技术问题:注射准确性和卵细胞保护。昆虫卵细胞通常是相对较小且柔软的细胞,注射精确度要求很高。在注射过程中,很难将注射针准确地插入卵细胞,导致注射效率低下。此外,注射后的孵化率也可能受到影响,使得注射的细胞很难生存和发育。其次,remot技术对卵细胞的损伤也是一个挑战。由于需要将注射针插入到卵细胞内部,并注入外源基因或其他物质,注射过程中很容易对卵细胞造成机械损伤。这种损伤可能导致卵细胞的发育异常、畸形或死亡,从而影响实验结果的准确性。
21、在昆虫直接亲本显微注射过程中,需要准确地将注射针插入到昆虫卵母细胞内,同时确保细胞的完整性和稳定性。
22、2.解决难度:昆虫卵细胞非常微小且易受损,注射针的尺寸更小且需要高精度控制。技术复杂度高增加了技术操作的难度和失败的可能性。因此,解决准确性和保护问题需要精密的显微注射技术、专业的操作技巧以及对昆虫生殖解剖学的深入了解。研究人员需要经过长时间的培训和实践才能掌握这项技术。
23、本发明实施例,采用sgrna(guide rna)作为识别标靶基因的引导物质,dipa-crispr技术起源于ii型crispr/cas系统,该系统为细菌提供对病毒和质粒的适应性免疫。cas9是一种核酸内切酶,它利用rna双链tracrrna:crrna中的一个引导序列与dna靶序列形成碱基对,使cas9蛋白能够在dna中形成特异性双链断裂。为了解决注射准确性问题,研究人员通常使用先进的显微注射设备,如显微操作台和高分辨率显微镜,以便观察和控制注射的准确位置和深度。
24、3.创造性的技术效果:首先,与现有技术相比,本发明采用dipa-crispr技术首次应用于活体白背飞虱中,而remot技术和以往的crispr-cas9基因编辑技术大部分的都是在昆虫卵的单细胞层面进行对基因干扰和编辑。dipa-crispr技术在活体白背飞虱中有较高的突变率,且在不同程度上敲除了目标基因的表达水平。通过在亲本体内进行注射,可以更好地控制注射位置和深度,并减少注射中的误差。此外,研究人员通过亲本显微注射效技术在德国小蠊中基因编辑概率为21.8%,且在赤拟谷盗中最高达到50%以上,我们通过对白背飞虱最佳注射日龄进行筛选,发现注射组的g0成虫突变率最高可达到了54.4%,经基因组序列检测,其与野生型相比,完全敲除了目标基因的序列片段。更有力的证明了亲本体内注射可以利用亲本自身的生理状态和分子通道,提高基因编辑效率。其次,昆虫直接亲本显微注射技术方案可以减少对卵细胞的损伤。相比于直接注射卵细胞,通过在亲本体内进行注射可以更好地保护卵细胞免受机械性损伤。此外,亲本体内注射可以在生理环境下进行,提高了细胞的生存和发育能力。
25、最后,昆虫直接亲本显微注射技术方案简化了操作流程,降低了技术复杂度。相比于在卵细胞中进行注射,亲本体内注射不需要对卵细胞进行解剖,操作相对简单。这降低了技术操作的难度,使更多的研究人员可以进行这项技术。
26、第二,通过dipa-crispr基因编辑技术可以实现对昆虫基因组的定向编辑,通过crispr/cas9基因编辑工具,使得特定基因发生变异或失活,从而实现定向的基因突变。dipa-crispr基因敲除技术有如下优点:
27、1.高效性:亲本介导的基因敲除技术具有较高的基因编辑效率。通过直接对昆虫虫体中进行显微注射,可以确保基因编辑材料传递到后代,达到持久的遗传效应。这种高效性有助于加速昆虫基因研究和昆虫种群管理等领域的进展。
28、2.广泛适用性:昆虫亲本注射技术适用于各种昆虫物种,包括害虫和益虫等。不同昆虫物种之间可能存在差异,但通过调整和改进技术方案,可以实现在多种昆虫上进行定向基因突变。
29、3.灵活性:昆虫亲本注射技术具有一定的灵活性。可以根据需要选择不同的基因编辑工具、基因组目标和编辑区域等,以实现特定的基因突变效果。这种灵活性使得该技术方案能够应对不同的研究或应用需求。
30、4.基因资源丰富:昆虫亲本注射技术为昆虫基因资源的研究和利用提供了重要手段。通过定向基因突变,可以深入了解昆虫基因功能和调控机制,有助于揭示昆虫生物学中的关键问题,并为昆虫种群管理和害虫控制等领域提供新的思路和方法。
31、综上所述,在dipa-crispr基因编辑技术中,其技术方案具有定向性、高效性、广泛适用性、灵活性和丰富的基因资源等优点,可为昆虫基因研究和相关应用领域带来重要的技术进展和创新。
32、第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
33、(1)本发明的技术方案转化后的预期收益和商业价值为:
34、1.提高效率:dipa-crispr基因编辑技术能够大幅提高基因编辑的效率和准确性,这种直接注射的方式可能能够提高基因编辑的效率和准确性,从而加速目标基因突变的产生。在农业领域,白背飞虱是重要的害虫,通过dipa-crispr技术可以针对害虫的基因进行精确编辑,更快的实验周期和更高的成功率,实现对害虫的生物防治,提高作物产量和质量。
35、2.拓展应用领域:不同昆虫物种之间存在基因组差异,但通过调整显微注射方案和工具,可以实现对多种昆虫亲本的基因编辑。除了农业领域,dipa-crispr昆虫显微注射技术还可以应用于疾病传播媒介昆虫的基因编辑。比如,通过编辑蚊子的基因,可以减少蚊子传播疟疾等疾病的能力。这种广泛适应性在农业害虫控制、病媒生物管理等领域发挥重要作用。
36、3.商业应用价值:在农业领域,白背飞虱作为害虫对作物造成巨大损失,通过基因编辑技术实现昆虫种群的调控和管理是一种可行的方式。该技术方案可以用于开发更具有耐虫性的农作物品种,减少对化学农药的依赖,从而提高农作物产量和质量。此外,白背飞虱等模式昆虫具有快速繁殖、相对简单的基因组等特点,可作为药物研发的有效模型。通过基因编辑技术对昆虫进行精确的基因突变,可以揭示药物作用机制、筛选潜在药物靶点,并加速新药开发过程,具有广阔的商业发展前景。
37、4.知识产权优势:dipa-crispr昆虫显微注射技术属于前沿的生物技术,该技术领域的知识产权有望带来丰厚的经济回报。对该技术的专利保护和商业化推广,可以为科研机构和企业带来专利收入、技术转让和合作开发等多种商业利益。
38、综上所述,dipa-crispr基因编辑技术的预期收益和商业价值体现在基因突变效率提高、拓展应用领域、商业应用价值和知识产权优势等方面,该技术有望在农业遗传改良、害虫防治和其他领域产生重要的经济和社会效益。
39、(2)本发明的技术方案填补了国内外业内技术空白:
40、第一:提高注射效率:该技术方案通过显微注射的方式,直接将cas9与sgrna混合物注射到活体白背飞虱中,避免了传统转基因技术中常见的基因转导难题。传统的转基因技术在白背飞虱中应用效率低下,主要受到以下因素的限制:
41、a)白背飞虱虫体较小,通过卵注射实现crispr基因编辑的效率较低。这可能导致较长时间的繁育工作和低成功率。
42、b)飞虱卵的体外培养和胚胎发育过程受到许多不确定因素的干扰,难以获得稳定的转基因个体。
43、第二:提高转基因稳定性:直接亲本显微注射技术方案可以将cas9与sgrna混合物直接注射到白背飞虱的生殖细胞中,确保外源基因的稳定遗传。相比之下,传统的转基因技术往往通过基因载体介导的方式将外源基因导入昆虫卵细胞中,容易受到外源基因的随机插入和稳定性的影响。因此,该技术填补了传统转基因技术中外源基因稳定性不足的技术空白。
44、第三:转基因种质资源的丰富性:dipa-crispr显微注射技术方案允许在白背飞虱中引入多种外源基因,进一步丰富和拓展转基因种质资源。传统的转基因技术往往只允许引入单一外源基因,限制了转基因品种的多样性和功能丰富性。通过dipa-crispr显微注射,可以引入多个目标基因,实现多基因转基因,为研究和应用提供更多选择。
45、总的来说,白背飞虱的dipa-crispr显微注射技术方案填补了传统转基因技术中效率低下、稳定性不足和转基因种质资源有限等技术空白,为该领域的研究和应用提供了更高效、稳定和多样化的转基因技术手段和解决方案。
46、(3)本发明的技术方案是否克服了技术偏见:
47、1.提高编辑效率:昆虫dipa-crispr显微注射技术可以在成虫阶段对昆虫进行基因编辑。相较于remot技术,这种方法通常具有更高的编辑效率,因为成虫组织和细胞数量较少,而且可以通过显微镜进行精确操作。
48、2.更大的目标选择范围:昆虫直接亲本显微注射技术可以应用于多个昆虫物种,包括那些不易通过remot技术实现基因编辑的物种。这使得研究人员能够更广泛地应用基因编辑技术来探索各种昆虫的生物学特性。
49、第四,以下是每条权利要求带来的显著的技术进步:
50、1.**权利要求1**:
51、-**技术进步**:这一权利要求为白背飞虱的基因敲除提供了一种结构化的步骤流程。通过有序的操作,研究者可以高效地进行基因敲除实验。
52、2.**权利要求2**:
53、-**技术进步**:详细描述了目标基因的筛选、sgrna设计与合成的过程。使用blastp在特定的生物种中寻找特定目标基因,然后使用crispor在线工具进行sgrna的设计。这为研究者提供了一个系统化和精确的sgrna设计方案。
54、3.**权利要求3**:
55、-**技术进步**:为cas9/sgrna复合物的制备提供了详细的操作步骤。该权利要求确保了复合物的正确制备,从而保证crispr系统在白背飞虱中的功能。
56、4.**权利要求4**:
57、-**技术进步**:详述了dipa-crispr的体外切割过程,包括昆虫组织的处理、dna提取、sgrna的体外切割等。这确保了在对白背飞虱进行基因敲除实验之前,所有材料都经过了恰当的处理和验证。
58、5.**权利要求5**:
59、-**技术进步**:详细描述了从具有突变表型的昆虫中提取gdna并进行测序检测的方法。这个过程包括样品的收集、组织的破碎、dna的提取和纯化,以及pcr和测序的步骤。这为后续的基因敲除验证和分析提供了完整的方案。
60、上述的权利要求为白背飞虱的基因敲除提供了一套完整的技术流程,从目标基因的筛选、sgrna的设计和合成,到dna的提取和测序验证。这种系统化和详细的方法使得实验过程更为精确和可靠,从而增强了crispr技术在白背飞虱基因编辑中的应用潜力。
- 还没有人留言评论。精彩留言会获得点赞!