一种草铵膦的制备方法与流程
本技术涉及农药除草剂领域,具体地,涉及一种草铵膦的制备方法。
背景技术:
1、草铵膦具有杀草谱广、活性高、毒性低、在土壤中易降解、对作物安全、漂移小、环境相容性好和杀草较迅速等特点,能防除和快速杀灭马唐和黑麦草等100多种一年生和多年生阔叶杂草和禾本科杂草。
2、普通草铵膦是两种对映异构体的混合物,但只有l-异构体具有活性,而其在土壤中容易分解,对人类和动物毒性较小,可大幅降低环境压力,而且活性和对抗性杂草的防效也优于普通草铵膦。尽管目前市场上销售的草铵膦商品绝大多仍是其外消旋体,但随着技术创新与进步,l-异构体进入主流市场势不可挡。
3、现有合成手性纯l-草铵膦的方法主要有化学法和生物法。其中化学法包括化学拆分法和化学合成法。
4、化学拆分法是通过手性拆分试剂拆分化学法合成的消旋d,l-草铵膦或其衍生物,从而制得光学纯的l-草铵膦。公开号为wo1995023805a1的专利说明书公开了一种通过用手性碱如奎宁和辛可宁沉淀非对映异构体盐中的一种,由d,l-高丙氨酸-4-基-(甲基)膦酸的外消旋拆分获得[l]-或[d]-高丙氨酸-4-基-(甲基)膦酸和其盐的方法。该方法需要使用昂贵的手性拆分试剂,且收率较低,并无明显的产业化优势。
5、化学合成法以天然手性氨基酸或者不对称法合成l-草铵膦。
6、公开号为us5442088a的专利说明书公开了一种l-高丝氨酸内酯衍生物为原料经过开环氯代、酯化,与甲基亚磷酸二酯进行arbuzov反应,最后水解、精制得到l-草铵膦盐酸盐的方法。
7、
8、该多步反应工艺单元操作便捷,但arbuzov反应原料氯代底物的活性有限,通常需要在较高的温度下才能进行(130-140度或更高),同时由于高温下氯代烷烃副产进一步与甲基亚磷酸二酯产生副反应,使得其单耗大大增加,另外在该温度下反应由于部分原料或产品的消旋导致l型对映体过量值出现下降。
9、公开号为cn113490671b的专利说明书公开:以氨基保护或不保护的卤代高丝氨酸酯为原料,与甲基亚膦酸单氯酯缩合得到中间体,再经过水解得到l-草铵膦。
10、
11、该方法原料以高丝氨酸为原料,经过环合、氯代、酯化、保护基保护等多步反应合成,反应步骤较长。另外,arbuzov反应不可避免产生卤代烷烃,小分子卤代烃为3类致癌物且对大气层中的臭氧有破坏作用。
12、近年来,随着草铵膦需求量的不断增长,因此开发一种反应条件温和、收率更高、成本更低,且操作简单的草铵膦合成方法对除草剂使用减量增效具有极其重要的意义。
技术实现思路
1、为了简明起见,后文所述“式(n)化合物(如式(iii)化合物)”也可以涵盖式(n)化合物的任意光学异构体、几何异构体、互变异构体或异构体混合物、或农业上可接受的盐。
2、术语“光学异构体”意指,当化合物具有一个或更多个手性中心时,每个手性中心可以存在r构型或s构型,由此构成的各种异构体为光学异构体。光学异构体包括所有的非对映异构体、对映异构体、内消旋体、外消旋体或其混合物形式。例如,通过手性色谱柱或通过手性合成可以分离光学异构体。
3、术语“几何异构体”意指,当化合物中存在双键时,该化合物可以存在顺式异构体、反式异构体、e型异构体和z型异构体。几何异构体包括顺式异构体、反式异构体、e型异构体、z型异构体或其混合物形式。
4、术语“互变异构体”指因分子中某一原子在两个位置迅速移动而产生的异构体。本领域技术人员可以理解:互变异构体之间可以互相转变,在某一状态下可能会达到一种平衡状态而共存。
5、除非另有指明,本文提到“式(n)化合物(如式(iii)化合物)”时也涵盖该化合物中任一个原子被其同位素原子代替而得到的同位素标记化合物。即,本发明包括式(n)化合物的所有农业上可接受的同位素标记化合物,其中,一个或者多个原子被具有与通常在自然界中所发现的原子相同原子序数但是不同原子质量或者质量数的原子所替换。
6、适用于包含在本发明的化合物中的同位素的实例包括氢的同位素,诸如2h(d)和3h(t),碳的同位素,诸如11c、13c和14c,氯的同位素,诸如37cl,氟的同位素,诸如18f,碘的同位素,诸如123i和125i,氮的同位素,诸如13n和15n,氧的同位素,诸如15o、17o和18o,以及硫的同位素,诸如35s。
7、式(n)的同位素标记化合物一般可以通过本领域技术人员已知的常规技术或者通过使用合适的同位素标记试剂代替先前使用的非标记试剂以类似于在本文所附的实例和制备中所描述的方法,来进行制备。
8、式(n)化合物可以农业上可接受的盐的形式存在,比如,式(n)化合物的酸加成盐和/或碱加成盐。除非另有指明,否则本文所用的“农业上可接受的盐”包括可出现于式(n)化合物内的酸加成盐或碱加成盐。
9、式(n)化合物的农业上可接受的盐类包括其酸加成盐和碱加成盐。适当的酸加成盐是由形成无毒性盐的酸所形成的。其实例包括但不限于:乙酸盐、己二酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、硼酸盐、樟脑磺酸盐、柠檬酸盐、环己胺磺酸盐、乙二磺酸盐、甲酸盐、反丁烯二酸盐、葡萄庚糖酸盐、葡萄糖酸盐、葡萄糖醛酸盐、六氟磷酸盐、2-(4-羟苄基)苯甲酸盐、氢氯化物/氯化物、氢溴化物/溴化物、氢碘化物/碘化物、2-羟乙磺酸盐、乳酸盐、苹果酸盐、顺丁烯二酸盐、丙二酸盐、甲磺酸盐、甲基硫酸盐、萘酸盐、2-萘磺酸盐、烟碱酸盐、硝酸盐、乳清酸盐、草酸盐、十六酸盐、磷酸盐/磷酸氢盐/磷酸二氢盐、焦谷氨酸盐、葡萄糖二酸盐、硬脂酸盐、水杨酸盐、单宁酸盐、酒石酸盐、甲苯磺酸盐和三氟乙酸盐。适当的碱加成盐是由形成无毒性盐的碱所形成的。其实例包括但不限于:铵盐、铝、精氨酸、钙、胆碱、二乙胺、二乙醇胺、甘氨酸、赖氨酸、镁、葡甲胺、乙醇胺、钾、钠、锂、氨丁三醇和锌盐。还可形成酸和碱的半盐,例如半硫酸盐和半钙盐。用于制备本文中所述的化合物的农业上可接受的盐的方法是本领域技术人员已知的。
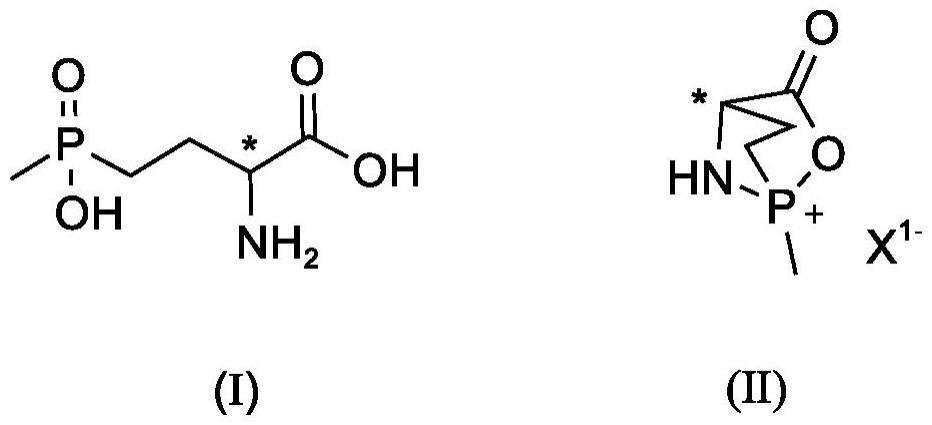
10、本发明的某些化合物可以以非溶剂化形式以及溶剂化形式(包括水合形式)存在。一般而言,式(n)化合物无论以溶剂化形式存在或以未溶剂化形式存在,其都包括在本发明的范围内。
11、本发明的某些化合物可以不同晶型或不定型形式存在,无论以何种形式存在,式(n)化合物都包括在本发明的范围内。
12、为了避免歧义,下面对本文中所使用的术语给出定义。除非另有说明,本文所用术语的含义如下。
13、在本文中使用时,术语“被取代”是指基团中的一个或多个(优选1至5个,更优选1至3个)氢原子独立地被相应数目的取代基所代替。
14、在本文中使用时,术语“独立地”是指当取代基的个数超过一个时,这些取代基可以相同也可以不同。
15、在本文中使用时,术语“任选”或“任选地”表示其所描述的事件可以发生或不发生。例如,一个基团“任选地被取代”表示:该基团可以是未被取代的,也可以是被取代的。
16、在本文中使用时,术语“杂原子”代表氧(o)、氮(n)、或s(o)m(其中m可以是0、1或2,即硫原子s、或亚砜基so、或磺酰基s(o)2)。
17、在本文中使用时,术语“烷基”是指饱和的脂族烃,包括直链及支链。在一些实施方式中,烷基基团具有例如1-6个或1-3个碳原子。例如,术语“c1-c6烷基”是指具有1-6个碳原子的直链或支链原子团。术语“c1-c6烷基”在其定义中包括术语“c1-6烷基”、“c1-c3烷基”和“c1-c4烷基”。烷基的实例包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、2-戊基、3-戊基、异戊基、新戊基、(r)-2-甲基丁基、(s)-2-甲基丁基、3-甲基丁基、2,3-二甲基丙基、2,3-二甲基丁基、己基等。
18、在本文中使用时,术语“c3-c6环烷基”是指具有3至6个形成环的碳原子的环烷基。例如,c3-c6环烷基包括环丙基、环丁基、环戊基或环己基。
19、在本文中使用时,术语“n元杂环烷基”是指具有m个形成环的碳原子和(n-m)个形成环的杂原子的环烷基,所述杂原子选自n、o和s中的至少一种。例如,三元至六元杂环烷基包括但不限于氧杂环丁烷、硫杂环丁烷、氮杂环丁烷、四氢呋喃、四氢噻吩、吡咯烷、四氢吡喃、四氢噻喃、哌啶、吗啉、哌嗪。
20、在本文中使用时,术语“c6-c10芳基”是指具有含6-10个碳原子的芳环的芳基,优选为苯基。
21、在本文中使用时,术语“n元杂芳基”是指具有m个形成芳环的碳原子和(n-m)个形成芳环的杂原子的杂芳基,所述杂原子选自n、o和s中的至少一种。例如,五元至十元杂芳基包括但不限于吡嗪、吡唑、吡咯、呋喃、噻吩、噻唑、吡啶。
22、在本文中使用时,术语“卤代烷基”是指具有一个或多个卤素取代基的烷基基团(至多全卤代烷基,即,烷基基团的每个氢原子均被卤素原子所取代)。例如,术语“c1-c6卤代烷基”是指具有一个或多个卤素取代基的c1-c6烷基基团(至多全卤代烷基,即,烷基基团的每个氢原子均被卤素原子所取代)。另举一例,术语“c1卤代烷基”是指具有1、2或3个卤素取代基的甲基基团。卤代烷基基团的例子包括:cf3、c2f5、chf2、ch2f、ch2cf3、ch2cl等。
23、本文中,与取代基个数、碳原子个数、环原子个数相关的数目范围表示该范围内所有整数的逐个列举,而范围仅是作为一种简化的表示法。例如:“1-4个取代基”表示1、2、3或4个取代基;“3-8个碳原子”表示3个、4个、5个、6个、7个或8个碳原子。因此,与取代基个数、碳原子个数、环原子个数相关的数目范围也涵盖其任意一个子范围,且每一个子范围也视为被本文公开。
24、在本技术人的公开号为cn116041387a的专利申请的基础上,经过发明人的进一步研究,发现当反应原料特别为卤代高丝氨酸(而不是卤代高丝氨酸酯)时,具有新的反应路线,并基于该发现完成了本发明。
25、在第一方面,本技术提供了一种制备式(i)表示的草铵膦或其盐、对映异构体或任意比例对映异构体的混合物的方法,其包括以下步骤:
26、
27、使式(ii)化合物水解以得到式(i)化合物,
28、
29、其中,
30、x1为卤素;并且
31、*用于标识手性碳原子。
32、根据本发明,式(i)化合物可以单一对映异构体的形式存在,例如,在本发明的一个实施方式中,式(i)化合物可以为纯的l-草铵膦或d-草铵膦。另外,式(i)化合物也可以对映异构体混合物的形式存在,并且所述对映异构体在对映异构体混合物中可各自以任意比例存在,例如,在本发明的一个实施方式中,式(i)化合物的任意比例对映异构体的混合物包含0.1:99.9至99.9:0.1的l-草铵膦和d-草铵膦。然而,由于只有l-草铵膦具有活性,因此本发明式(i)化合物的l-对映异构体在对映异构体混合物中也可优选地以更大比例存在,例如,在一个实施方式中,式(i)化合物的任意比例对映异构体的混合物包含50:50至99.9:0.1(例如60:40、70:30、80:20、90:10、95:5或99:1等)的l-草铵膦和d-草铵膦。
33、在本发明的第一方面的制备方法中,所述使式(ii)化合物水解可直接在中性条件下水解,即可直接在水的存在下进行该水解反应。另外,所述水解也可以优选地在酸或碱的存在下进行。更具体地,所述酸可以选自盐酸、硫酸、氢溴酸、氢碘酸、磷酸、硝酸、甲酸和醋酸中的至少一种,优选盐酸或硫酸;所述碱可以选自碱金属或碱土金属的氢氧化物、碳酸盐、碳酸氢盐或碱式碳酸盐、氨水、有机碱、有机胺,优选氢氧化钠或三乙胺。另外,在本发明的一个实施方式中,所述水解可以在例如30-140℃(例如40℃、50℃、60℃、70℃、80℃、90℃、100℃、110℃、120℃或130℃等)、优选70-110℃的温度下进行。
34、进一步地,本发明的第一方面的制备方法还可以包括制备式(iii)化合物的步骤。
35、在本发明的一个实施方式中,所述式(ii)化合物可以通过使式(iv)化合物或其盐
36、
37、与以下中的任一种反应来制备:式(v)化合物;式(vi)化合物;式(v)化合物和式(vi)化合物;式(v)化合物和式(vii)化合物;式(vi)化合物和式(vii)化合物;或式(v)化合物、式(vi)化合物和式(vii)化合物,
38、
39、其中,
40、x2为卤素;并且
41、r1、r2、r3和r4各自独立地选自氢、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基,或者r1和r2与其所连接的n原子一起形成三元至六元杂环烷基,其中所述c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基任选地被卤素、羧基、羟基、氰基、氨基、硝基、c1-c3烷基、c1-c3卤代烷基、c1-c3烷氧基、c3-c6环烷基或c6-c10芳基取代。
42、作为式(v-vii)化合物的优选方案,r1、r2、r3和r4可以各自独立地选自氢、c1-c6烷基或c3-c6环烷基,优选氢、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基、环丙基、环丁基、环戊基或环己基。另外,在一个优选的实施方式中,当在本文中使用时,卤素可以选自氟、氯或溴;c1-c6烷基可以选自甲基、乙基、丙基或异丙基;c2-c6烯基可以选自乙烯基、丙烯基、1-丁烯基、2-丁烯基或异丁烯基;c2-c6炔基可以选自乙炔基、丙炔基、1-丁炔基或2-丁炔基;c3-c6环烷基可以选自环丙基、环丁基、环戊基或环己基;三元至六元杂环烷基可以选自包含n、o和s中的至少一个杂原子的环丙基、环丁基、环戊基或环己基;c6-c10芳基可以选自苯基或萘基;和/或五元至十元杂芳基可以选自吡嗪基、吡唑基、吡咯基、呋喃基、噻吩基、噻唑基或吡啶基。
43、作为式(v-vii)化合物的替代方案,r1、r2、r3和r4也可以各自独立选自-si(r8)(r9)(r10),其中r8、r9和r10各自独立地选自氢、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基,其中所述c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基任选地被卤素、羧基、羟基、氰基、氨基、硝基、c1-c3烷基、c1-c3卤代烷基、c1-c3烷氧基、c3-c6环烷基或c6-c10芳基取代。
44、在如上所述的制备式(ii)化合物的步骤中,所使用的式(v)化合物、式(vi)化合物和/或式(vii)化合物可以作为初始反应物添加到反应体系中,也可以由其他化合物原位反应得到。例如,式(v)化合物可由式(vii)化合物与式(viii)化合物nhr1r2原位反应得到,或由式(vi)化合物与式(vii)化合物原位反应得到;以及式(vi)化合物(此处r3和r4可分别对应于r1和r2)可由式(vii)化合物与式(viii)化合物原位反应得到。作为制备式(ii)化合物的替代方案,式(ii)化合物也可以通过使式(iv)化合物或其盐与式(vii)化合物和式(viii)化合物反应得到。进一步地,在上述的各种制备式(ii)化合物的步骤中,对于各原料的投料顺序没有任何限制,即可以以任意顺序将各原料投入反应体系中。
45、根据本发明,如上所述的制备式(ii)化合物的步骤可以优选地在缚酸剂的存在下进行。具体地,所述缚酸剂可以选自nr5r6r7,其中r5、r6和r7各自独立地选自氢、c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基,或者r5、r6和r7中的任意两个与其所连接的n原子一起形成三元至六元杂环烷基,其中所述c1-c6烷基、c2-c6烯基、c2-c6炔基、c3-c6环烷基、三元至六元杂环烷基、c6-c10芳基或五元至十元杂芳基任选地被卤素、羧基、羟基、氰基、氨基、硝基、c1-c3烷基、c1-c3卤代烷基、c1-c3烷氧基、c3-c6环烷基或c6-c10芳基取代。
46、另外,由于式(viii)化合物nhr1r2符合上述缚酸剂的通式,即也符合作为缚酸剂的要求,因此可以选择加入过量的式(viii)化合物以作为反应中优选存在的缚酸剂。在本发明的一个优选实施方式中,所述缚酸剂可以选自过量的式(viii)化合物、氨、三乙胺、吗啉和哌啶中的至少一种。
47、进一步地,如上所述的制备式(ii)化合物的步骤可以在无溶剂或有机溶剂的存在下进行。在本发明的一个实施方式中,所述有机溶剂选自芳烃类溶剂(例如苯、二甲苯、三甲苯、乙基苯、二乙苯、异丙基苯、二异丙基苯、卤代苯或二卤代苯)、烷烃类溶剂(例如正己烷、环己烷、正庚烷、甲基环己烷、乙基环己烷)、卤代烃类溶剂(例如二氯甲烷、二氯乙烷、氯仿或四氯化碳)、醚类溶剂(例如四氢呋喃、甲基四氢呋喃、甲基叔丁基醚、二异丙基醚、甲基环戊基醚、乙二醇二甲醚、二氧六环或二乙二醇二甲醚)、酯类溶剂(例如乙酸乙酯、乙酸异丙酯或乙酸丁酯)、酰胺类溶剂(例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、六甲基磷酰三胺、n-甲基吡咯烷酮或1,3-二甲基-2-咪唑啉酮)或含硫溶剂(例如二甲基亚砜或环丁砜),优选地,所述有机溶剂选自甲苯和氯苯中的至少一种。
48、对于如上所述的制备式(ii)化合物的步骤中各反应物的用量以及反应条件,可以根据实际需要和本领域技术人员的知识进行调整。在本发明的一个实施方式中,式(iv)化合物或其盐、式(v)化合物+式(vi)化合物+式(vii)化合物的用量之和、以及缚酸剂的摩尔比可以为1:0.9-5:0.9-5,优选1:1.05-1.5:1.05-1.5。在本发明的另一个实施方式中,所述反应可以在-20-20℃(例如-10℃、-5℃、0℃、5℃、10℃或15℃等)的温度下进行1-15小时(例如2h、4h、6h或12h等),然后在20-120℃(例如30℃、45℃、60℃、75℃、90℃或105℃等)的温度下进行0.5-24小时(例如1h、2h、4h、6h、12h或18h等)。
49、作为制备式(ii)化合物的替代方案,所述式(ii)化合物还可以通过包括以下步骤的方法来制备:
50、1)使式(iv)化合物或其盐
51、
52、与以下中的任一种反应:式(v)化合物;式(vi)化合物;式(v)化合物和式(vi)化合物;式(v)化合物和式(vii)化合物;式(vi)化合物和式(vii)化合物;或式(v)化合物、式(vi)化合物和式(vii)化合物,
53、
54、以得到式(iii)化合物,
55、
56、2)由式(iii)化合物反应制备式(ii)化合物,
57、其中,x1、x2、r1、r2、r3、r4和*如前所定义。
58、在该替代方案中,反应原料与前述方案基本上相同,区别在于明确了得到式(iii)化合物作为中间体以进行后续反应。因此,该替代方案中的反应原料选择、反应体系、反应条件等均可参照前述制备式(ii)化合物的方案,在此不再赘述,以避免不必要的冗余。以反应条件为例进行说明,步骤1)的反应可以在-20-20℃的温度下进行1-15小时;步骤2)的反应在20-120℃的温度下进行0.5-24小时。
59、在第二方面,本技术提供了一种式(ii)化合物或其盐、对映异构体或任意比例对映异构体的混合物,
60、
61、其中,x1和*如前所定义。
62、优选地,所述式(ii)化合物可以参照本发明的第一方面来制备。
63、在第三方面,本技术提供了一种制备式(ii)化合物或其盐、对映异构体或任意比例对映异构体的混合物的方法,其包括以下步骤:
64、
65、使式(iv)化合物或其盐
66、
67、与以下中的任一种反应:式(v)化合物;式(vi)化合物;式(v)化合物和式(vi)化合物;式(v)化合物和式(vii)化合物;式(vi)化合物和式(vii)化合物;或式(v)化合物、式(vi)化合物和式(vii)化合物,
68、
69、其中,x1、x2、r1、r2、r3、r4和*如前所定义。
70、在第四方面,本技术提供了一种制备式(ii)化合物或其盐、对映异构体或任意比例对映异构体的混合物的方法,其包括:
71、
72、由式(iii)化合物反应制备得到式(ii)化合物,
73、
74、其中,x1和*如前所定义。
75、在第五方面,本技术提供了一种式(iii)化合物或其盐、对映异构体或任意比例对映异构体的混合物,
76、
77、其中,x1和*如前所定义。
78、优选地,所述式(iii)化合物可以参照本发明的第一方面来制备。
79、在第六方面,本技术提供了一种制备式(iii)化合物或其盐、对映异构体或任意比例对映异构体的混合物的方法,其包括:
80、
81、使式(iv)化合物或其盐
82、
83、与以下中的任一种反应:式(v)化合物;式(vi)化合物;式(v)化合物和式(vi)化合物;式(v)化合物和式(vii)化合物;式(vi)化合物和式(vii)化合物;或式(v)化合物、式(vi)化合物和式(vii)化合物,
84、
85、其中,x1、x2、r1、r2、r3、r4和*如前所定义。
86、在第七方面,本技术提供了一种制备式(iii)化合物或其盐、对映异构体或任意比例对映异构体的混合物的方法,其包括:
87、
88、使式(iv)化合物或其盐
89、
90、与式(vii)化合物和式(viii)化合物反应,
91、
92、其中,x1、x2、r1、r2和*如前所定义。
93、本领域技术人员能够理解,在本技术的一个方面中描述的定义和优选项同样适用于其他方面。本领域技术人员能够明了本技术各个方面的实施方式可以以各种方式组合,而不偏离本技术的主题和思想,这些组合也包括在本技术的范围内。
94、经过研究发现,本发明与现有技术相比,至少包括以下有益效果:
95、1、利用卤代高丝氨酸为原料,制备得到五元环中间体,进一步得到季鏻盐中间体,最后水解得到目标产物。该工艺由于反应机理的不同,可以避免michaelis-arbuzov反应中的卤代烃副产,该卤代烃副产常为氯乙烷、氯甲烷,均为3类致癌物且对大气层中的臭氧有破坏作用,相应地,省去了上述副产的分离、纯化和收集等设备和工程投入,也规避上述副产所带来的潜在环境和安全风险;
96、2、省去了卤代高丝氨酸的酯化步骤,利用羧酸成环的策略既同时保护了氨基和羧基,也可用于后续c-p键的构建;以及
97、3、简化了原料来源,直接以甲基二氯化膦为原料,不需要使用甲基亚磷酸二酯作为中间体,缩减了原材料成本。
- 还没有人留言评论。精彩留言会获得点赞!