P2X3和/或P2X2/3受体拮抗剂、包含其的药物组合物及其用途的制作方法
发明领域本发明涉及p2x3和/或p2x2/3受体拮抗剂、包含其的药物组合物及其用于预防或治疗p2x3和/或p2x2/3受体拮抗剂调节的疾病的用途。
背景技术:
0、发明背景
1、嘌呤类化合物通过细胞表面嘌呤能受体发挥作用,其发挥着广泛的生理学和病理学作用。atp(在更小的程度上腺苷)可以刺激感觉神经末梢产生强烈的疼痛以及显著增加的感觉神经放电。根据分子结构、转导机制和药理学特征,atp受体被分为两个主要家族,p2y-和p2x-嘌呤能受体。p2y-嘌呤能受体为g-蛋白偶联受体,而p2x-嘌呤能受体为atp-门控阳离子通道家族。已知嘌呤能受体(特别是p2x受体)能够形成同源多聚体或异源多聚体。迄今为止,多种p2x受体亚型的cdna已经被克隆,包括:六种同源性受体:p2x1、p2x2、p2x3、p2x4、p2x5和p2x7;三种异源性受体:p2x2/3、p2x4/6、p2x1/5。小鼠基因组p2x3受体亚基的结构和基因图谱也有报道。
2、研究表明p2x3和/或p2x2/3受体拮抗剂可用于治疗疼痛等疾病。本发明提供作为p2x受体调节剂(特别是p2x3和/或p2x2/3受体拮抗剂)的化合物。
技术实现思路
0、发明概述
1、本发明提供用作p2x受体调节剂(特别是p2x3和/或p2x2/3受体拮抗剂)的化合物,其有效拮抗p2x受体(特别是p2x3和/或p2x2/3受体),具有更好的物理化学性质(例如溶解度、物理和/或化学稳定性)、改善的药物代谢动力学性质(例如改善的生物利用度、合适的半衰期和作用持续时间)、改善的安全性(较低的毒性和/或较少的副作用,较宽的治疗窗)等更优异的性质。
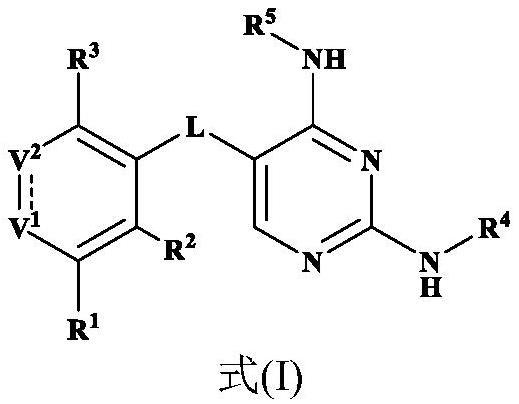
2、本发明的一个方面提供化合物或其药学上可接受的盐、酯、立体异构体、多晶型物、溶剂合物、n-氧化物、同位素标记的化合物、代谢物或前药,其中所述化合物具有式(i)的结构:
3、
4、其中:
5、l选自c(=o)、crr’、nr、o、s、s=o和s(=o)2;
6、v1选自n、和nr;
7、v2选自cr6和c(=o);
8、表示单键或双键,条件是当为单键时,v1为nr并且v2为c(=o);
9、r和r’各自独立地选自h、卤素、c1-6烷基、c2-6烯基、c2-6炔基、饱和或部分不饱和的c3-10环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基和c6-12芳烷基,所述环烃基和杂环基中至多2个环成员为c(=o);
10、r1、r2、r3和r6各自独立地选自h、卤素、-cn、-nh2、-oh、-sh、-se-r、-si(r)3、c1-6烷基、c2-6烯基、c2-6炔基、饱和或部分不饱和的c3-10环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基、c6-12芳烷基、卤代c1-6烷基、-c(=o)ra、-oc(=o)ra、-c(=o)ora、-ora、-sra、-s(=o)ra、-s(=o)2ra、-s(=o)2nrarb、-s(=o)(=nr)ra、-nrarb、-c(=o)nrarb、-c(=s)nrarb、-c(=nr)nrarb、-nra-c(=o)rb、-nra-c(=o)orb、-nra-s(=o)2-rb、-nra-c(=o)-nrarb、-c1-6亚烷基-nrarb、-c1-6亚烷基-ora、-c1-6亚烷基-c(=o)r、-c1-6亚烯基-ora、-o-c1-6亚烷基-nrarb和-p(=o)rarb;
11、r4和r5各自独立地选自h、-c(=o)ora、-nrarb、-nra-c(=o)rb、-nra-c(=o)orb、-c1-6亚烷基-nrarb、-c1-6亚烷基-ora、-c1-6亚烷基-o-c1-6亚烷基-ora、c1-6烷基、卤代c1-6烷基、c2-6烯基、c2-6炔基、饱和或部分不饱和的c3-10环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基和c6-12芳烷基;
12、或者r1与r4共同构成-nh-(c1-6亚烷基)-l-(c1-6亚烷基)-,优选为-nhch2ch2-o-ch2ch2-;
13、上述烷基、亚烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基和芳烷基在每次出现时各自任选地被一个或多个独立地选自下列的取代基取代:卤素、羟基、氧代、氨基、氰基、硝基、-si(r)3、c1-6烷基、饱和或部分不饱和的c3-6环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基、c6-12芳烷基、-c(=o)ra、-oc(=o)ra、-c(=o)ora、-ora、-sra、-s(=o)ra、-s(=o)2ra、-s(=o)2nrarb、-nrarb、-c(=o)nrarb、-nra-c(=o)rb、-nra-c(=o)orb、-nra-s(=o)2-rb、-nra-c(=o)-nrarb、-c1-6亚烷基-nrarb、-c1-6亚烷基-ora、-c1-6亚烯基-ora和-o-c1-6亚烷基-nrarb,所述烷基、环烃基、杂环基、芳基、杂芳基和芳烷基进一步任选地被一个或多个独立地选自下列的取代基取代:卤素、羟基、氧代、氨基、氰基、硝基、-nrarb、c1-6烷基、-o-c1-6烷基、饱和或部分不饱和的c3-6环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基和c6-12芳烷基;并且
14、ra和rb在每次出现时各自独立地选自h、-oh、c1-6烷基、c2-6烯基、c2-6炔基、饱和或部分不饱和的c3-10环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基和c6-12芳烷基;或者ra和rb连同其所连接的原子共同构成3-12元杂环或杂芳环,上述基团进一步任选地被一个或多个独立地选自下列的取代基取代:卤素、羟基、氧代、氨基、氰基、硝基、c1-6烷基、-o-c1-6烷基、饱和或部分不饱和的c3-6环烃基、饱和或部分不饱和的3-10元杂环基、c6-10芳基、5-14元杂芳基和c6-12芳烷基。
15、本发明的另一方面提供药物组合物,其包含预防或治疗有效量的本发明的化合物或其药学上可接受的盐、酯、立体异构体、多晶型物、溶剂合物、n-氧化物、同位素标记的化合物、代谢物或前药以及一种或多种药学上可接受的载体,所述药物组合物优选为固体制剂、半固体制剂、液体制剂或气态制剂。
16、本发明的另一方面提供本发明的化合物或其药学上可接受的盐、酯、立体异构体、多晶型物、溶剂合物、n-氧化物、同位素标记的化合物、代谢物或前药或者本发明的药物组合物在制备用于治疗p2x3和/或p2x2/3受体拮抗剂调节的疾病的药物中的用途。
17、本发明的另一方面提供本发明的化合物或其药学上可接受的盐、酯、立体异构体、多晶型物、溶剂合物、n-氧化物、同位素标记的化合物、代谢物或前药或者本发明的药物组合物,其用于治疗p2x3和/或p2x2/3受体拮抗剂调节的疾病。
18、本发明的另一方面提供预防或治疗p2x3和/或p2x2/3受体拮抗剂调节的疾病的方法,所述方法包括向需要其的个体给药有效量的本发明的化合物或其药学上可接受的盐、酯、立体异构体、多晶型物、溶剂合物、n-氧化物、同位素标记的化合物、代谢物或前药或者本发明的药物组合物。
19、发明详细描述
20、定义
21、除非在下文中另有定义,本文中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。提及本文中使用的技术意图指在本领域中通常所理解的技术,包括那些对本领域技术人员显而易见的技术的变化或等效技术的替换。虽然相信以下术语对于本领域技术人员很好理解,但仍然阐述以下定义以更好地解释本发明。
22、术语“包括”、“包含”、“具有”、“含有”或“涉及”及其在本文中的其它变体形式为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。
23、如本文中所使用,术语“亚烷基”表示饱和二价烃基,优选表示具有1、2、3、4、5或6个碳原子的饱和二价烃基,例如亚甲基、亚乙基、亚丙基或亚丁基。
24、如本文中所使用,术语“烷基”定义为线性或支化饱和脂肪族烃。在一些实施方案中,烷基具有1至12个,例如1至6个碳原子。例如,如本文中所使用,术语“c1-6烷基”指1至6个碳原子的线性或支化的基团(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基或正己基),其任选地被1或多个(诸如1至3个)适合的取代基如卤素取代(此时该基团被称作“卤代烷基”)(例如ch2f、chf2、cf3、ccl3、c2f5、c2cl5、ch2cf3、ch2cl或-ch2ch2cf3等)。术语“c1-4烷基”指1至4个碳原子的线性或支化的脂肪族烃链(即甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
25、如本文中所使用,术语“烯基”意指线性的或支化的单价烃基,其包含一个双键,且具有2-6个碳原子(“c2-6烯基”)。所述烯基为例如乙烯基、1-丙烯基、2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基和4-甲基-3-戊烯基。当本发明的化合物含有亚烯基时,所述化合物可以纯e(异侧(entgegen))形式、纯z(同侧(zusammen))形式或其任意混合物形式存在。
26、如本文中所使用,术语“炔基”表示包含一个或多个三键的单价烃基,其优选具有2、3、4、5或6个碳原子,例如乙炔基或丙炔基。
27、如本文中所使用,术语“环烷基”指饱和的单环或多环(诸如双环)烃环(例如单环,诸如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基,或双环,包括螺环、稠合或桥连系统(诸如双环[1.1.1]戊基、双环[2.2.1]庚基、双环[3.2.1]辛基或双环[5.2.0]壬基、十氢化萘基等)),其任选地被1或多个(诸如1至3个)适合的取代基取代。所述环烷基具有3至15个碳原子。例如,术语“c3-6环烷基”指3至6个成环碳原子的饱和的单环或多环(诸如双环)烃环(例如环丙基、环丁基、环戊基或环己基),其任选地被1或多个(诸如1至3个)适合的取代基取代,例如甲基取代的环丙基。
28、如本文中所使用,术语“亚环烃基”、“环烃基”和“烃环”是指具有例如3-10个(适合地具有3-8个,更适合地具有3-6个)环碳原子的饱和(即,“亚环烷基”和“环烷基”)或不饱和的(即在环内具有一个或多个双键和/或三键)单环或多环烃环,其包括但不限于(亚)环丙基(环)、(亚)环丁基(环)、(亚)环戊基(环)、(亚)环己基(环)、(亚)环庚基(环)、(亚)环辛基(环)、(亚)环壬基(环)、(亚)环己烯基(环)等。
29、如本文中所使用,术语“杂环基”、“亚杂环基”和“杂环”是指具有例如3-10个(适合地具有3-8个,更适合地具有3-6个)环原子、其中至少一个环原子是选自n、o和s的杂原子且其余环原子是c的饱和(即,杂环烷基)或部分不饱和的(即在环内具有一个或多个双键和/或三键)环状基团。例如,“3-10元(亚)杂环(基)”是具有2-9个(如2、3、4、5、6、7、8或9个)环碳原子和独立地选自n、o和s的一个或多个(例如1个、2个、3个或4个)杂原子的饱和或部分不饱和(亚)杂环(基)。亚杂环基和杂环(基)的实例包括但不限于:(亚)环氧乙烷基、(亚)氮丙啶基、(亚)氮杂环丁基(azetidinyl)、(亚)氧杂环丁基(oxetanyl)、(亚)四氢呋喃基、(亚)二氧杂环戊烯基(dioxolinyl)、(亚)吡咯烷基、(亚)吡咯烷酮基、(亚)咪唑烷基、(亚)吡唑烷基、(亚)吡咯啉基、(亚)四氢吡喃基、(亚)哌啶基、(亚)吗啉基、(亚)二噻烷基(dithianyl)、(亚)硫吗啉基、(亚)哌嗪基或(亚)三噻烷基(trithianyl)。所述基团也涵盖双环系统,包括螺环、稠合或桥连系统(诸如8-氮杂螺[4.5]癸烷、3,9-二氮杂螺[5.5]十一烷、2-氮杂双环[2.2.2]辛烷等)。亚杂环基和杂环(基)可任选地被一个或多个(例如1个、2个、3个或4个)适合的取代基取代。
30、如本文中所使用,术语“(亚)芳基”和“芳环”指具有共轭π电子系统的全碳单环或稠合环多环芳族基团。例如,如本文中所使用,术语“c6-10(亚)芳基”和“c6-10芳环”意指含有6至10个碳原子的芳族基团,诸如(亚)苯基(苯环)或(亚)萘基(萘环)。(亚)芳基和芳环任选地被1或多个(诸如1至3个)适合的取代基(例如卤素、-oh、-cn、-no2、c1-6烷基等)取代。
31、如本文中所使用,术语“(亚)杂芳基”和“杂芳环”指单环、双环或三环芳族环系,其具有5、6、8、9、10、11、12、13或14个环原子,特别是1或2或3或4或5或6或9或10个碳原子,且其包含至少一个可以相同或不同的杂原子(所述杂原子是例如氧、氮或硫),并且,另外在每一种情况下可为苯并稠合的。特别地,“(亚)杂芳基”或“杂芳环”选自(亚)噻吩基、(亚)呋喃基、(亚)吡咯基、(亚)噁唑基、(亚)噻唑基、(亚)咪唑基、(亚)吡唑基、(亚)异噁唑基、(亚)异噻唑基、(亚)噁二唑基、(亚)三唑基、(亚)噻二唑基等,以及它们的苯并衍生物;或(亚)吡啶基、(亚)哒嗪基、(亚)嘧啶基、(亚)吡嗪基、(亚)三嗪基等,以及它们的苯并衍生物。
32、如本文中所使用,术语“芳烷基”优选表示芳基或杂芳基取代的烷基,其中所述芳基、杂芳基和烷基如本文中所定义。通常,所述芳基可具有6-14个碳原子,所述杂芳基可具有5-14个环原子,并且所述烷基可具有1-6个碳原子。示例性芳烷基包括但不限于苄基、苯基乙基、苯基丙基、苯基丁基。
33、如本文中所使用,术语“卤代”或“卤素”基团定义为包括f、cl、br或i。
34、如本文中所使用,术语“含氮杂环”指饱和或不饱和的单环或双环基团,其在环中具有2、3、4、5、6、7、8、9、10、11、12或13个碳原子和至少一个氮原子,其还可任选地包含一个或多个(例如一个、两个、三个或四个)选自n、o、c=o、s、s=o和s(=o)2的环成员,其通过所述含氮杂环中的氮原子以及任一其余环原子与分子的其余部分连接,所述含氮杂环任选地为苯并稠合的,并且优选通过所述含氮杂环中的氮原子以及所稠合的苯环中的任一碳原子与分子的其余部分连接。
35、术语“取代”指所指定的原子上的一个或多个(例如一个、两个、三个或四个)氢被从所指出的基团的选择代替,条件是未超过所指定的原子在当前情况下的正常原子价并且所述取代形成稳定的化合物。取代基和/或变量的组合仅仅当这种组合形成稳定的化合物时才是允许的。
36、如果取代基被描述为“任选地被取代”,则取代基可(1)未被取代或(2)被取代。如果取代基的碳被描述为任选地被取代基列表中的一个或多个取代,则碳上的一个或多个氢(至存在的任何氢的程度)可单独和/或一起被独立地选择的任选的取代基替代。如果取代基的氮被描述为任选地被取代基列表中的一个或多个取代,则氮上的一个或多个氢(至存在的任何氢的程度)可各自被独立地选择的任选的取代基替代。
37、如果取代基被描述为“独立地选自”一组,则各取代基独立于另一者被选择。因此,各取代基可与另一(其他)取代基相同或不同。
38、如本文中所使用,术语“一个或多个”意指在合理条件下的1个或超过1个,例如2个、3个、4个、5个或10个。
39、除非指明,否则如本文中所使用,取代基的连接点可来自取代基的任意适宜位置。
40、当取代基的键显示为穿过环中连接两个原子的键时,则这样的取代基可键连至该可取代的环中的任一成环原子。
41、本发明还包括所有药学上可接受的同位素标记的化合物,其与本发明的化合物相同,除了一个或多个原子被具有相同原子序数但原子质量或质量数不同于在自然界中占优势的原子质量或质量数的原子替代。适合包含入本发明的化合物中的同位素的实例包括(但不限于)氢的同位素(例如氘(2h)、氚(3h));碳的同位素(例如11c、13c及14c);氯的同位素(例如36cl);氟的同位素(例如18f);碘的同位素(例如123i及125i);氮的同位素(例如13n及15n);氧的同位素(例如15o、17o及18o);磷的同位素(例如32p);及硫的同位素(例如35s)。某些同位素标记的本发明的化合物(例如掺入放射性同位素的那些)可用于药物和/或底物组织分布研究(例如分析)中。放射性同位素氚(即3h)及碳-14(即14c)因易于掺入且容易检测而特别可用于该目的。用正电子发射同位素(例如11c、18f、15o及13n)进行取代可在正电子发射断层显像术(pet)研究中用于检验底物受体占据情况。被同位素标记的本发明的化合物可通过与描述于随附路线和/或实施例及制备中的那些类似的方法通过使用适当的被同位素标记的试剂代替之前采用的非标记的试剂来制备。本发明的药学上可接受的溶剂合物包括其中结晶溶剂可被同位素取代的那些,例如,d2o、丙酮-d6或dmso-d6。
42、术语“立体异构体”表示由于至少一个不对称中心形成的异构体。在具有一个或多个(例如一个、两个、三个或四个)不对称中心的化合物中,其可产生外消旋混合物、单一对映异构体、非对映异构体混合物和单独的非对映异构体。特定个别分子也可以几何异构体(顺式/反式)存在。类似地,本发明的化合物可以两种或更多种处于快速平衡的结构不同的形式的混合物(通常称作互变异构体)存在。互变异构体的代表性实例包括酮-烯醇互变异构体、苯酚-酮互变异构体、亚硝基-肟互变异构体、亚胺-烯胺互变异构体等。要理解,本技术的范围涵盖所有这样的以任意比例(例如60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%)的异构体或其混合物。
43、本文中可使用实线实楔形或虚楔形描绘本发明的化合物的化学键。使用实线以描绘键连至不对称碳原子的键欲表明,包括该碳原子处的所有可能的立体异构体(例如,特定的对映异构体、外消旋混合物等)。使用实或虚楔形以描绘键连至不对称碳原子的键欲表明,存在所示的立体异构体。当存在于外消旋混合物中时,使用实及虚楔形以定义相对立体化学,而非绝对立体化学。除非另外指明,否则本发明的化合物意欲可以立体异构体(其包括顺式及反式异构体、光学异构体(例如r及s对映异构体)、非对映异构体、几何异构体、旋转异构体、构象异构体、阻转异构体及其混合物)的形式存在。本发明的化合物可表现一种以上类型的异构现象,且由其混合物(例如外消旋混合物及非对映异构体对)组成。
44、本发明涵盖本发明的化合物的所有可能的结晶形式或多晶型物,其可为单一多晶型物或多于一种多晶型物的任意比例的混合物。
45、还应当理解,本发明的某些化合物可以游离形式存在用于治疗,或适当时,以其药学上可接受的衍生物形式存在。在本发明中,药学上可接受的衍生物包括但不限于,药学上可接受的盐、酯、溶剂合物、n-氧化物、代谢物或前药,在将它们向需要其的患者给药后,能够直接或间接提供本发明的化合物或其代谢物或残余物。因此,当在本文中提及“本发明的化合物”时,也意在涵盖化合物的上述各种衍生物形式。
46、本发明的化合物的药学上可接受的盐包括其酸加成盐及碱加成盐。
47、适合的酸加成盐由形成药学可接受盐的酸来形成。实例包括乙酸盐、己二酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、硼酸盐、樟脑磺酸盐、柠檬酸盐、环己氨磺酸盐、乙二磺酸盐、乙磺酸盐、甲酸盐、延胡索酸盐、葡庚糖酸盐、葡糖酸盐、葡糖醛酸盐、六氟磷酸盐、海苯酸盐、盐酸盐/氯化物、氢溴酸盐/溴化物、氢碘酸盐/碘化物、羟乙基磺酸盐、乳酸盐、苹果酸盐、顺丁烯二酸盐、丙二酸盐、甲磺酸盐、甲基硫酸盐、萘甲酸盐(naphthylate)、2-萘磺酸盐、烟酸盐、硝酸盐、乳清酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、磷酸盐/磷酸氢盐/磷酸二氢盐、焦谷氨酸盐、糖二酸盐、硬脂酸盐、丁二酸盐、单宁酸盐、酒石酸盐、甲苯磺酸盐、三氟乙酸盐及昔萘酸盐(xinofoate)。
48、适合的碱加成盐由形成药学可接受盐的碱来形成。实例包括铝盐、精氨酸盐、苄星青霉素盐、钙盐、胆碱盐、二乙胺盐、二乙醇胺盐、甘氨酸盐、赖氨酸盐、镁盐、葡甲胺盐、乙醇胺盐、钾盐、钠盐、氨丁三醇盐及锌盐。
49、适合的盐的综述参见stahl及wermuth的“handbook of pharmaceutical salts:properties,selection,and use”(wiley-vch,2002)。用于制备本发明的化合物的药学上可接受的盐的方法为本领域技术人员已知的。
50、如本文中所使用,术语“酯”意指衍生自本技术中各个通式化合物的酯,其包括生理上可水解的酯(可在生理条件下水解以释放游离酸或醇形式的本发明的化合物)。本发明的化合物本身也可以是酯。
51、本发明的化合物可以溶剂合物(优选水合物)的形式存在,其中本发明的化合物包含作为所述化合物晶格的结构要素的极性溶剂,特别是例如水、甲醇或乙醇。极性溶剂特别是水的量可以化学计量比或非化学计量比存在。
52、本领域技术人员会理解,由于氮需要可用的孤对电子来氧化成氧化物,因此并非所有的含氮杂环都能够形成n-氧化物;本领域技术人员会识别能够形成n-氧化物的含氮杂环。本领域技术人员还会认识到叔胺能够形成n-氧化物。用于制备杂环和叔胺的n-氧化物的合成方法是本领域技术人员熟知的,包括用过氧酸如过氧乙酸和间氯过氧苯甲酸(mcpba)、过氧化氢、烷基过氧化氢如叔丁基过氧化氢、过硼酸钠和双环氧乙烷(dioxirane)如二甲基双环氧乙烷来氧化杂环和叔胺。这些用于制备n-氧化物的方法已在文献中得到广泛描述和综述,参见例如:t.l.gilchrist,comprehensive organic synthesis,vol.7,pp748-750;a.r.katritzky和a.j.boulton,eds.,academic press;以及g.w.h.cheeseman和e.s.g.werstiuk,advances in heterocyclic chemistry,vol.22,pp 390-392,a.r.katritzky和a.j.boulton,eds.,academic press。
53、在本发明的范围内还包括本发明的化合物的代谢物,即在给药本发明的化合物时体内形成的物质。这样的产物可由例如被给药的化合物的氧化、还原、水解、酰胺化、脱酰胺化、酯化、酶解等产生。因此,本发明包括本发明的化合物的代谢物,包括通过使本发明的化合物与哺乳动物接触足以产生其代谢产物的时间的方法制得的化合物。
54、本发明在其范围内进一步包括本发明的化合物的前药,其为自身可具有较小药理学活性或无药理学活性的本发明的化合物的某些衍生物当被给药至身体中或其上时可通过例如水解裂解转化成具有期望活性的本发明的化合物。通常这样的前药会是所述化合物的官能团衍生物,其易于在体内转化成期望的治疗活性化合物。关于前药的使用的其他信息可参见“pro-drugs as novel delivery systems”,第14卷,acs symposium series(t.higuchi及v.stella)。本发明的前药可例如通过用本领域技术人员已知作为“前-部分(pro-moiety)(例如“design of prodrugs”,h.bundgaard(elsevier,1985)中所述)”的某些部分替代本发明的化合物中存在的适当官能团来制备。
55、本发明还涵盖含有保护基的本发明的化合物。在制备本发明的化合物的任何过程中,保护在任何有关分子上的敏感基团或反应基团可能是必需的和/或期望的,由此形成本发明的化合物的化学保护的形式。这可以通过常规的保护基实现,例如,在t.w.greene&p.g.m.wuts,protective groups in organic synthesis,john wiley&sons,1991中所述的那些保护基,这些参考文献通过援引加入本文。使用本领域已知的方法,在适当的后续阶段可以移除保护基。
56、术语“约”是指在所述数值的±10%范围内,优选±5%范围内,更优选±2%范围内。
- 还没有人留言评论。精彩留言会获得点赞!