生产3-脱氢莽草酸的重组微生物、其构建方法及应用
本公开涉及生物,具体涉及生产3-脱氢莽草酸的重组微生物、其构建方法及应用,以及更具体地,涉及前述重组微生物在制备3-脱氢莽草酸中的应用。
背景技术:
1、3-脱氢莽草酸(3-dehydroshikimate,dhs)是微生物及植物体内芳香族氨基酸生物合成代谢途径中的一种重要中间产物,对维系生物正常发育、完成代谢过程具有重要作用。dhs可被进一步催化形成莽草酸(shikimate)及其芳香族氨基酸和衍生物,以及原儿茶酸(protocatechuate)、香草醛(vanillin)、儿茶酚(catechol)、没食子酸(gallate)、已二酸(adipate)、水杨酸(salicylic acid)等一系列重要化工产品。利用3-脱氢莽草酸合成这些化工产品可以避免有毒的苯和甲苯等原料的使用,减少对人体和环境影响。与此同时,3-脱氢莽草酸还是一种十分有效的抗氧化剂,其活性甚至优于没食子酸、没食子酸丙酯(propyl gallate)、对苯二酚(bhq)、丁羟甲苯(bht)、生育酚(α-tocopherol)等一些商品化的抗氧化剂,具有重要的应用价值。此外,dhs作为一种小分子手性化合物,还可以作为药物合成中非常有潜力的合成中间体。因此,研究dhs的生产具有重要的应用前景。
2、目前,利用微生物生产dhs最主要报道的文献有以下3篇现有技术文献。
3、现有技术文献1以质粒表达系统调控6个基因的过表达,5l发酵罐放大发酵dhs产量达到69g/l。具体的,在突变aroe的e.coli ab2834中利用质粒表达系统过表达tkta/glf/glk/arof/arob,。前述发酵过程中的发酵培养基中包含如下组分:磷酸氢二钾7.5g/l,柠檬酸铁铵0.3g/l,一水柠檬酸2.1g/l,芳香族氨基酸和维生素,微量元素以及葡萄糖。其通过过表达tkta增加dhs前体e4p供给,通过pts系统替换为glf/glk增加dhs另一个前体pep供给,通过突变aroe阻断dhs降解(通过添加复杂培养基成分维持生长)以及通过过表达aroffbr/arob强化dhs合成途径。
4、但是,现有技术文献1的技术方案存在如下缺陷:(1)发酵培养基成分复杂(需要添加多种芳香族氨基酸以及维生素等必须成分):由于在大肠杆菌中突变aroe(相当于敲除aroe)时,细胞因为无法合成生长必需的芳香族氨基酸导致细胞无法正常生长,需要额外添加复杂的营养物质维持细胞生长;(2)发酵过程繁琐:由于需要额外添加芳香族氨基酸以及维生素,因此需要进行过滤除菌操作;(3)遗传不稳定性以及增加细胞代谢负担:质粒系统过表达相关基因时,会导致细胞除了维持正常生长还需要承担质粒系统带来的代谢负担;(4)dhs产量与转化率不高:因为细胞内代谢网络的复杂性以及刚性,利用质粒系统过表达相关基因并不会充分扰动代谢网络偏向dhs的生物合成,进而导致碳源-葡萄糖等仅有一部分流向dhs合成途径;(5)生产成本较高:需要添加大量的芳香族氨基酸以及微量元素、dhs产量与转化率低;(6)进一步提升dhs生产性能困难:由于质粒系统调控了dhs合成相关的6个关键基因,进一步可调控的有效基因不明确,菌株代谢瓶颈不清晰。
5、现有技术文献2以基因组系统调控10个基因表达,在7l发酵罐中发酵120小时产量达到目前文献报道的最高水平117g/l。具体的,在敲除aroe的e.coli ab2834中先后敲除tyrr/ptsg/pyka,基因组水平上过表达arob/arod/ppsa/galp/arog/arof,前述发酵过程中的发酵培养基包含如下组分:葡萄糖30g/l,甘油10g/l,酵母抽提物15.75g/l,胰蛋白胨21.375g/l,磷酸氢二钾5.25g/l,七水硫酸镁1g/l,柠檬酸0.8g/l,1ml/l微量元素以及200μg/l盐酸硫胺素。前述发酵过程中的发酵培养基包含如下组分:600g/l葡萄糖,100g/l酵母抽提物,20g/l七水硫酸镁,以及微量元素,转化率为0.39g/g葡萄糖。其通过pts系统替换为glf/glk、过表达ppsa、敲除pyka增加dhs前体pep供给,通过敲除aroe阻断dhs降解(通过添加复杂培养基成分维持生长)以及通过过表达arof/arog/arob/arod强化dhs合成途径。
6、但是,现有技术文献2的技术方案同样存在如下缺陷:(1)发酵培养基成分复杂(需要添加大量的酵母抽提物等复杂培养基成分):由于在大肠杆菌中敲除aroe,细胞因为无法合成生长必需的芳香族氨基酸导致细胞无法正常生长,需要额外添加复杂的营养物质维持细胞生长;(2)发酵所需的流加培养基成分复杂:敲除aroe导致的维持细胞生长所需;(3)发酵周期过长:发酵120小时,可能是由于流加培养基每次流加时酵母抽提物含量低;(4)dhs转化率不高:在发酵过程中,除了葡萄糖以外,还存在甘油、胰蛋白胨以及酵母抽提物等可作为碳源的的营养物质,而现有技术文献2中仅报道了dhs对葡萄糖的转化率(0.39g/g);(5)生产成本高:发酵培养基中大量的复杂培养基成分(酵母抽提物、胰蛋白胨)、发酵周期长、dhs转化率低;(6)进一步提升dhs生产性能困难:由于质粒系统调控了dhs合成相关的6个关键基因,进一步可调控的有效基因不明确,菌株代谢瓶颈不清晰。
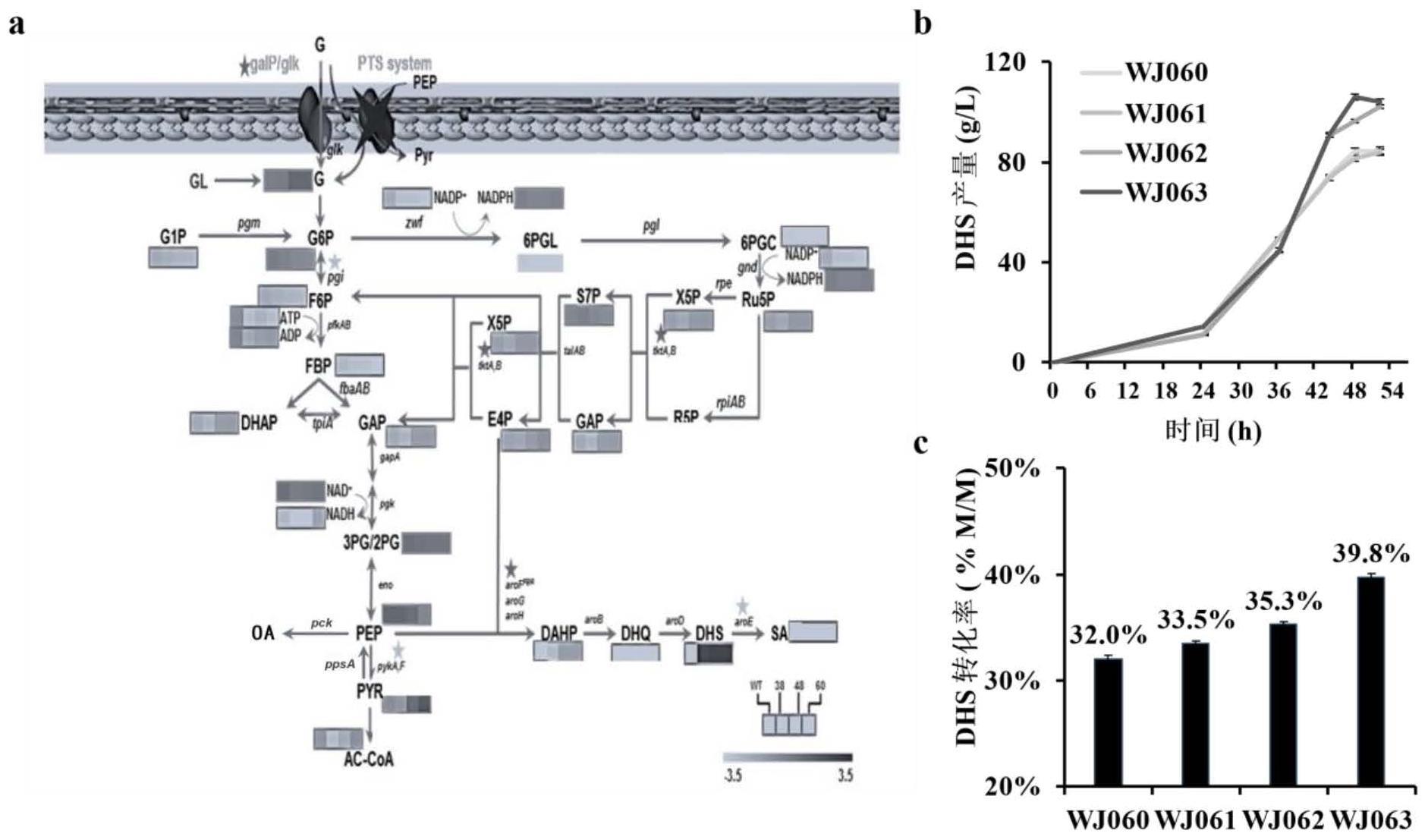
7、现有技术文献3以基因组系统调控10个基因表达,在简单无机盐发酵培养基中发酵52小时产量达到94.4g/l,转化率为32.65%m/m。具体的,包括在e.coli atcc8739中利用杂合启动子元件(p1)表达aroe(而非敲除,避免发酵培养基中添加复杂培养基成分),敲除tyrr/ptsi,调控aroffbr表达(p2)过表达tkta(p3),组合调控大肠本底基因glk/galp表达、弱化pykf/pyka/pgi表达(p1)。其通过pts系统替换为glf/glk、同时弱化pyka/pykf增加dhs前体pep供给,通过基因组过表达tkta增加dhs前体e4p供给,通过弱化aroe积累dhs的同时维持细胞生长,调控aroffbr表达强化dhs合成途径。
8、但是,现有技术文献3同样存在转化率低、生产成本高、进一步提升dhs生产性能困难等问题。
9、总之,上述现有技术文献中所公开的技术方案以质粒系统或是基因组系统迭代调控多位点基因表达实现了dhs高效合成,但由于代谢瓶颈不清晰导致的进一步工程改造困难、dhs生产成本较高、dhs的转化率较低等问题限制了大肠杆菌工程菌进一步提升dhs生产性能的可能。
10、现有技术文献
11、1.altered glucose transport and shikimate pathway product yields ine.coli,jian yi et.al.,biotechnology progress,(2003)
12、2.cell factory design and culture process optimization fordehydroshikimate biosynthesis in escherichia coli,si-sun choi et.al.,front.bioeng.biotechnol.,(2019)
13、3.cn 107619817 a
技术实现思路
1、发明要解决的问题
2、鉴于现有技术中存在的问题,本公开提供了新的能够生产3-脱氢莽草酸菌株及其构建方法与应用。本公开记载的技术方案通过基于代谢组学数据分析与挖掘,验证了出发菌中存在的2个关键代谢瓶颈,即限制碳源(葡萄糖为例)以更优、更大的通量流向目标产物dhs的过程。进而利用途径工程和前体工程系统的精细调控2个关键靶点所涉及途径的相关基因,构建的新一代dhs细胞生产菌株的生产性能显著提升。
3、用于解决问题的方案
4、[1].一种生产3-脱氢莽草酸的重组微生物,其中,所述重组微生物与野生型菌株或出发菌株相比,具有如下(a)~(c)所示的至少一种特性:
5、(a)增强的脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平;
6、(b)降低或消失的丙酮酸激酶的酶活性和/或其编码基因的表达水平;
7、(c)增强的脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平,和降低或消除的丙酮酸激酶的酶活性和/或其编码基因的表达水平。
8、[2].根据[1]所述的重组微生物,其中,在野生型菌株或出发菌株中,
9、在起始脱氢奎尼酸合成酶翻译的起始密码子的上游插入调控元件p2或p3,以增强脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平;或
10、敲除野生型微生物或出发菌株中编码丙酮酸激酶的基因,以降低或消失丙酮酸激酶的酶活性和/或其编码基因的表达水平;
11、其中,调控元件p2的序列如seq id no:4所示,调控元件p3的序列如seq id no:2所示;
12、任选的,所述的脱氢奎尼酸合成酶的编码基因的序列如将gene id:947927所示的核苷酸序列前45个碱基替换为seq id no:1所示。
13、[3].根据[1]或[2]所述的重组微生物,其中,与野生型微生物或出发菌株相比,还具有如下(d)所示的特性:
14、(d)增强的3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶的酶活性和/或其编码基因的表达水平;
15、可选的,在起始3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶翻译的起始密码子的上游插入调控元件p1、p2或p3,以增强3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶的酶活性和/或其编码基因的表达水平;
16、优选的,所述调控元件p1的序列如seq id no:3所示,调控元件p2的序列如seq idno:4所示,调控元件p3的序列如seq id no:2所示;任选的,所述的3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶的编码基因的序列如将gene id:947084所示的核苷酸序列第443位的碱基c突变为t后所示。
17、[4].根据[3]所述的重组微生物,其中,所述重组微生物与野生型微生物或出发菌株相比,还具有如下(e)所示的特性:
18、(e)增强的脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平;
19、可选的,在起始脱氢奎尼酸脱水酶翻译的起始密码子的上游插入调控元件p1、p2或p3,以增强脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平;
20、优选的,在起始脱氢奎尼酸脱水酶翻译的起始密码子的上游插入调控元件p2或p3,以增强脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平。
21、[5].根据[4]所述的重组微生物,其中,所述重组菌株与野生型菌株或出发菌株相比,具有如下(f)~(i)所示的特性:
22、(f)增强的磷酸烯醇丙酮酸合酶的酶活性和/或其编码基因的表达水平;
23、(g)增强的磷酸烯醇丙酮酸羧激酶的酶活性和/或其编码基因的表达水平;
24、(h)增强的烯醇酶的酶活性和/或其编码基因的表达水平;
25、(i)降低或消失的转醛酶的酶活性和/或其编码基因的表达水平;
26、可选的,
27、对于(f),在起始磷酸烯醇丙酮酸合酶翻译的起始密码子的上游插入调控元件p3,以增强磷酸烯醇丙酮酸合酶的酶活性和/或其编码基因的表达水平;
28、对于(g),在起始磷酸烯醇丙酮酸羧激酶翻译的起始密码子的上游插入调控元件p3,以增强磷酸烯醇丙酮酸羧激酶的酶活性和/或其编码基因的表达水平;
29、对于(g),在起始烯醇酶翻译的起始密码子的上游插入调控元件p3,以增强烯醇酶的酶活性和/或其编码基因的表达水平;
30、对于(i),敲除野生型微生物或出发菌株中编码转醛酶的基因,以降低或消除转醛酶的酶活性和/或其编码基因的表达水平。
31、[6].根据[1]~[5]任一项所述的重组微生物,其中,所述出发菌株包括大肠杆菌wj060。
32、[7].一种用于3-脱氢莽草酸生产的重组微生物的制备方法,其中,所述方法包含如下步骤:
33、(a1)相较于野生型微生物或出发菌株,增强脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平的步骤;
34、(b1)相较于野生型微生物或出发菌株,降低或消除丙酮酸激酶的酶活性和/或其编码基因的表达水平的步骤;
35、(c1)相较于野生型微生物或出发菌株,增强脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平的步骤,和降低或消除丙酮酸激酶的酶活性和/或其编码基因的表达水平的步骤。
36、[8].根据[7]所述的制备方法,其中,在野生型微生物或出发菌株中,
37、在起始脱氢奎尼酸合成酶翻译的起始密码子的上游插入调控元件p2或p3,以增强脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平;或
38、敲除野生型微生物或出发菌株中编码丙酮酸激酶的基因,以降低或消失丙酮酸激酶的酶活性和/或其编码基因的表达水平;或
39、在起始脱氢奎尼酸合成酶翻译的起始密码子的上游插入调控元件p3,以增强脱氢奎尼酸合成酶的酶活性和/或其编码基因的表达水平,并敲除编码丙酮酸激酶的基因,以降低或消除丙酮酸激酶的酶活性和/或其编码基因的表达水平;
40、其中,调控元件p2的序列如seq id no:4所示,调控元件p3的序列如seq id no:2所示;
41、任选的,所述的脱氢奎尼酸合成酶的编码基因的序列如将gene id:947927所示的核苷酸序列前45个碱基替换为seq id no:1所示。
42、[9].根据[7]或[8]所述的制备方法,其中,所述方法包含如下步骤:
43、(d1)增强3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶的酶活性和/或其编码基因的表达水平的步骤;
44、可选的,在起始3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶翻译的起始密码子的上游插入调控元件p1、p2或p3,以增强3-脱氧-d-阿拉伯庚酮糖-7-磷酸合成酶的酶活性和/或其编码基因的表达水平;
45、优选的,所述调控元件p1的序列如seq id no:3,调控元件p2的序列如seq id no:4,调控元件p3的序列如seq id no:2所示。
46、[10].根据[7]~[9]任一项所述的制备方法,其中,所述方法还包含如下步骤:
47、(e1)增强的脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平的步骤;
48、可选的,在起始脱氢奎尼酸脱水酶翻译的起始密码子的上游插入调控元件p1、p2或p3,以增强脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平;
49、优选的,在起始脱氢奎尼酸脱水酶翻译的起始密码子的上游插入调控元件p2或p3,以增强脱氢奎尼酸脱水酶的酶活性和/或其编码基因的表达水平;
50、更优选的,所述调控元件p1的序列如seq id no:3所示,调控元件p2的序列如seqid no:4所示,调控元件p3的序列如seq id no:2所示。
51、[11].根据[7]~[10]任一项所述的制备方法,其中,所述方法还包含如下步骤:
52、(f1)增强磷酸烯醇丙酮酸合酶的酶活性和/或其编码基因的表达水平的步骤;
53、(g1)增强磷酸烯醇丙酮酸羧激酶的酶活性和/或其编码基因的表达水平的步骤;
54、(h1)增强烯醇酶的酶活性和/或其编码基因的表达水平的步骤;
55、(i1)降低或消除的转醛酶的酶活性和/或其编码基因的表达水平的步骤;
56、可选的,
57、对于(f1),在起始磷酸烯醇丙酮酸合酶翻译的起始密码子的上游插入调控元件p3,以增强磷酸烯醇丙酮酸合酶的酶活性和/或其编码基因的表达水平;
58、对于(g1),在起始磷酸烯醇丙酮酸羧激酶翻译的起始密码子的上游插入调控元件p3,以增强pck酶的酶活性和/或其编码基因的表达水平;
59、对于(h1),在起始烯醇酶翻译的起始密码子的上游插入调控元件p3,以增强烯醇酶的酶活性和/或其编码基因的表达水平;
60、对于(i1),敲除野生型微生物或出发菌株中编码转醛酶的基因,以降低或消除转醛酶的酶活性和/或其编码基因的表达水平。
61、[12].根据[7]~[11]任一项所述的制备方法,其中,所述出发菌株包括大肠杆菌wj060。
62、[13].[1]~[6]任一项所述的重组微生物,或[7]~[12]任一项所述的制备方法制备得到的重组微生物在生产3-脱氢莽草酸中的应用。
63、[14].一种生产3-脱氢莽草酸的方法,其中,所述方法包括:以葡萄糖为底物,利用[1]~[6]任一项所述的重组微生物,或根据[7]~[12]任一项所述的制备方法制备得到的重组微生物进行发酵反应的步骤。
64、发明的效果
65、在一个具体的实施方式中,本公开基于大肠杆菌基因组进行改造,无需借助外源质粒表达基因,可在不受外源质粒的影响下,实现基因在大肠杆菌中的稳定表达。
66、在一个具体的实施方式中,本公开基于代谢组学数据分析与发掘,通过优化大肠杆菌基因组中arob的基因的表达方式和/或阻断基因pyk的表达,进而减少3-脱氧-d-阿拉伯庚酮糖-7-磷酸和pyr积累,制备得到的菌株有效地提高了dhs的产量与转化率。
67、在一个具体的实施方式中,通过优化大肠杆菌基因组中arof基因的表达方式,制备得到的菌株有效地提高了dhs的产量与转化率。
68、在一个具体的实施方式中,通过组合优化大肠杆菌基因组中基因arof和arob的表达方式,利用不同强度的启动子启动arof和arob的表达,制备得到的菌株有效地提高了dhs的产量与转化率。
69、在一个具体的实施方式中,通过组合优化大肠杆菌基因组中基因arof、arob和arod的表达方式,利用不同强度的启动子启动arof、arob和arod的表达,制备得到的菌株有效地提高了dhs的产量与转化率。
70、在一个具体的实施方式中,通过敲除大肠杆菌基因组中的基因pykf或利用杂合组成型启动子元件p3调控ppsa、pcka或eno的表达,制备得到的菌株有效地提高了dhs的产量与转化率。
71、在一个具体的实施方式中,本公开所提供的重组大肠杆菌可以简单的葡萄糖为底物,发酵生产dhs,发酵成本低廉、发酵条件简单,便于实际生产应用。
- 还没有人留言评论。精彩留言会获得点赞!