一种小鼠原代肾小球系膜细胞的提取和纯化方法
本发明属于肾小球系膜细胞,具体涉及一种小鼠原代肾小球系膜细胞的提取和纯化方法。
背景技术:
1、慢性肾脏病(ckd)的重要病理生理学改变是肾功能的持续下降和尿蛋白的进行性产生,这些都与肾小球的滤过膜系统密切相关。肾小球滤过膜系统结构较为复杂,包括基底膜、肾小球系膜细胞和外围带有足突的足细胞。因此,提取高纯度原代肾小球系膜细胞和足细胞在解释和研究ckd的发生发展以及进行临床药物筛选的基础研究等方面具有重要应用前景。
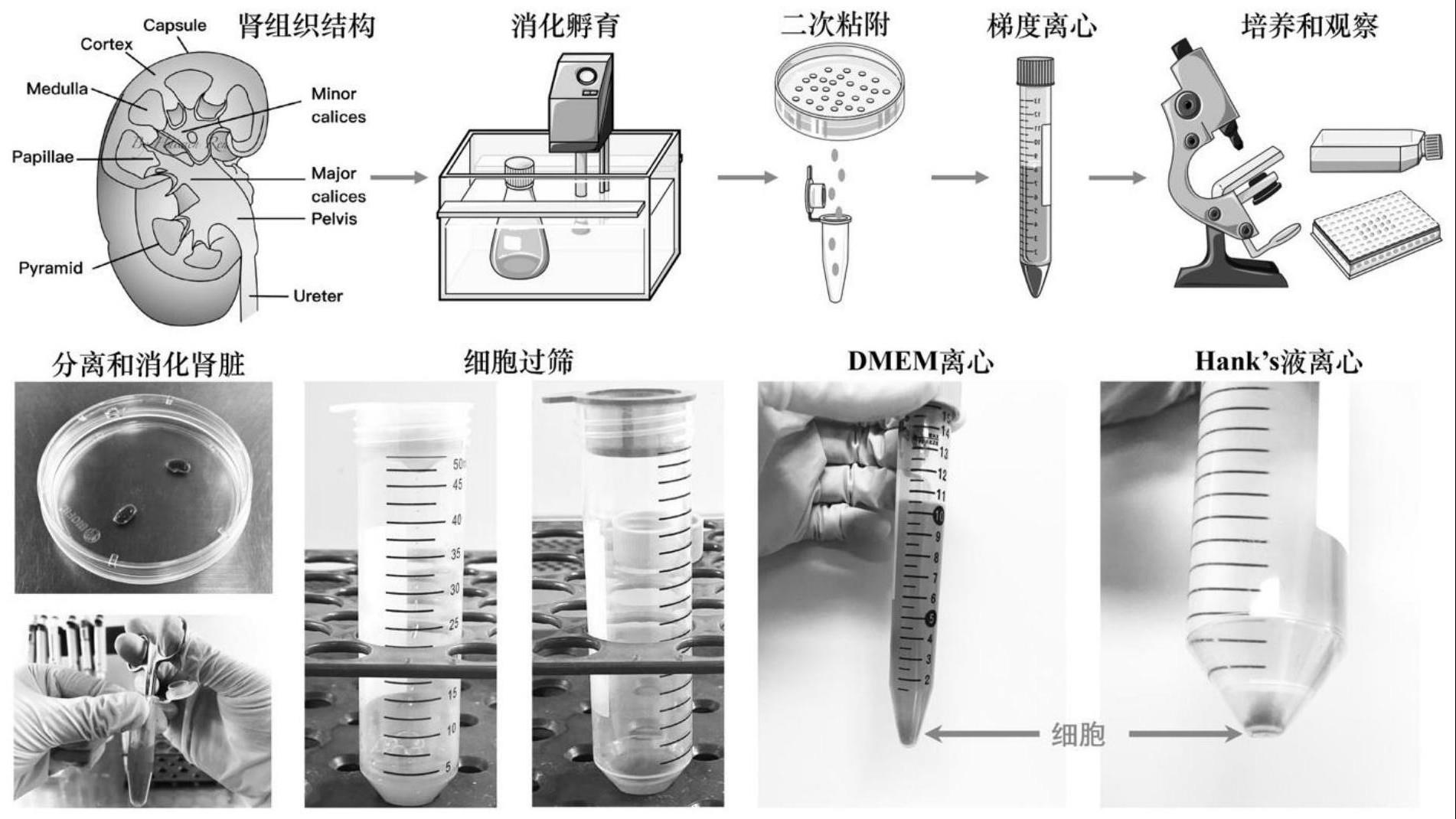
2、肾脏是人体分化程度最高的器官之一,肾包膜(capsule)包裹的肾脏实质分为肾皮质(cortex)和肾髓质(medulla,分为外髓和内髓),髓质由肾锥体(pyramid)和肾柱构成,几个肾锥体合成一个肾乳头(papillae),再汇聚成肾小盏(minor calices),合成肾大盏(major calices),最后经由肾盂(pelvis)出肾门移行为输尿管(ureter)。肾脏的功能单位被称为肾单位,包括包曼氏囊、肾小球、近端小管、髓袢(分为降支、升支细段和升支粗段)、远端小管和集合管。肾小球的结构较为复杂,主要有滤过膜系统构成,包括基底膜、内皮细胞、肾小球系膜细胞和外围带有足突的足细胞。这些细胞按一定位置排列在包曼氏囊上,行成功能结构都独一无二的高度特化的肾小球滤过膜系统,参与肾脏大分子蛋白的滤过过程,因此它们的解剖结构决定了提取较为困难。
3、肾小球疾病是终末期肾病的主要原因。肾小球损伤可由全身性疾病(如糖尿病肾脏疾病)或原发性肾小球损伤(如iga肾病)所导致。在大多数人类肾小球病中,系膜细胞的激活和增殖以及足细胞的损伤和丢失其中起着关键作用。为了研究人类肾小球疾病背后的分子机制,小鼠被广泛用于模拟人类肾小球病。然而,基于此的转化研究一直具有挑战性。
4、肾小球系膜细胞被认为是内皮来源的间充质基质细胞,没有特异性表达的细胞标志物。尽管诸如血小板衍生生长因子受体α、血小板衍生生长因子受体β、结蛋白和α8整合素等基因在系膜细胞中强烈表达,但这些基因在其他基质细胞中也高表达,不具有特异性,因此识别和鉴定较为困难。
技术实现思路
1、本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种小鼠原代肾小球系膜细胞的提取和纯化方法,该方法能提取和纯化出鉴定效果更佳、纯度更高的小鼠原代肾小球系膜细胞。
2、为解决上述技术问题,本发明采用的技术方案是:一种小鼠原代肾小球系膜细胞的提取和纯化方法,该方法如图1所示,具体为:
3、s1、肾小球的提取:
4、s101、分离和消化:取6-8周龄雄性小鼠未去除肾包膜的肾脏,置于含有质量分数为1%的青链霉素的预冷hank’s平衡盐溶液中,肾包膜(capsule)包裹的肾脏实质分为肾皮质(cortex)和肾髓质(medulla,分为外髓和内髓),髓质由肾锥体(pyramid)和肾柱构成,几个肾锥体合成一个肾乳头(papillae),再汇聚成肾小盏(minor calices),合成肾大盏(major calices),最后经由肾盂(pelvis)出肾门移行为输尿管(ureter),分离肾脏皮质和外髓部分,放入至含有浓度为0.75mg/ml胶原蛋白酶iv和浓度为0.75mg/ml胰蛋白酶抑制剂的hank’s平衡盐溶液中,剪碎成块状组织,然后置于温度为37℃的水浴预热的消化液中摇动后,向消化后的物质中加入等体积的预冷培养基,得到消化混合物;
5、s102、梯度过滤:将70μm细胞筛置于50ml离心管a上,使用吸管将s101中得到的消化混合物经由所述70μm细胞筛打入所述50ml离心管a中,边用灭菌的5ml注射器的注射塞研磨,边用hank’s平衡盐溶液冲洗,收集滤过液;将40μm细胞筛置于50ml离心管b上,使用吸管将所述滤过液经由所述40μm细胞筛打入所述50ml离心管b中,保留所述40μm细胞筛网上方的物质,翻转所述40μm细胞筛网并放置到10cm培养皿a中,用hank’s平衡盐溶液将所述40μm细胞筛网上方的物质冲洗至所述10cm培养皿a中;
6、s103、晃动悬浮:摇动s102中所述10cm培养皿a,收集悬浮液体a至50ml离心管c中;
7、s104、二次粘附:将40μm细胞筛置于50ml离心管d上,使用吸管将s103中得到的悬浮液体a经由所述40μm细胞筛打入所述50ml离心管e中,保留所述40μm细胞筛网上方的物质,翻转所述40μm细胞筛网并放置到10cm培养皿b中,用hank’s平衡盐溶液将所述40μm细胞筛网上方的物质冲洗至所述10cm培养皿b中;摇动所述10cm培养皿b,收集悬浮液体b至50ml离心管f中,离心后,弃上清液,用无血清ham's f-12培养基重悬,得到重悬混合液;
8、s105、聚乙烯吡咯烷酮梯度离心:质量分数为50%聚乙烯吡咯烷酮分层液装在15ml离心管内,从侧壁滴加s104中得到的重悬混合液至所述50%聚乙烯吡咯烷酮分层液的液面上方,离心后,弃上清液,保留最底层沉淀物,即为肾小球沉淀物;
9、s2、肾小球系膜细胞培养:用系膜细胞培养基重悬s105中得到的肾小球沉淀物并接种培养,3~5日爬出细胞,每日换液,隔日传代,取第3~5代细胞,即为肾小球系膜细胞;
10、所述系膜细胞培养基由以下质量分数的原料制成:dmem培养液70.6%、ham's f-12培养液23.4%、胎牛血清5%和青链霉素1%;
11、s3、肾小球鉴定:用足细胞标志物肾病蛋白(nephrin)对s105中得到的肾小球沉淀物进行鉴定,呈阳性即为肾小球;
12、s4、肾小球系膜细胞的鉴定:采用系膜细胞阳性标志物α-平滑肌肌动蛋白(α-sma)阳性、上皮细胞即足细胞标志物肾病蛋白(nephrin)阴性和内皮细胞标志物紧密连接蛋白-1(zo-1)阴性共同检测。
13、优选地,s101中所述消化液为含有浓度为0.75mg/ml胶原蛋白酶iv和浓度为0.75mg/ml胰蛋白酶抑制剂的dmem培养液。
14、优选地,s101中所述的预冷培养基为质量分数为10%胎牛血清的dmem培养液。
15、优选地,s101中摇动的摇速为120rpm/分。
16、优选地,s104中离心的条件为:4℃、转速为500rpm/分的条件下离心3分。
17、优选地,s105中离心的条件为:4℃、转速为12000rpm/分的条件下离心60分。
18、本发明与现有技术相比具有以下优点:
19、本发明提取和纯化的小鼠原代肾小球系膜细胞,由于进行了多次梯度纯化,最终得到原代细胞的纯度佳、活力高、杂质少,仅需要少量小鼠肾脏,一次提取就可获得足够多的原代肾小球系膜细胞进行培养和鉴定。分离过程中全程无菌操作,污染率小。在通过组织提取细胞的过程中,混合液经过充分消化、梯度细胞过筛、二次粘附和梯度离心等一系列提取纯化过程,有效减少了肾小球损失以及肾脏其他组织和杂质残留,进一步提高了肾小球的提纯度,最后通过肾组织不同部位的免疫荧光鉴定标志物进行多细胞标志物综合检测,得到鉴定效果更佳、纯度更高的小鼠原代肾小球系膜细胞。
20、下面结合附图和实施例对本发明作进一步详细说明。
- 还没有人留言评论。精彩留言会获得点赞!