一种利用生物质产酶、糖化及制氢气的反应系统和方法与流程
本发明涉及生物制氢,尤其是涉及一种利用生物质产酶、糖化及制氢气的反应系统和方法。
背景技术:
1、氢能是一种绿色、高效、应用广泛的二次能源,对节能、提高能效,乃至能源结构转型有积极作用。氢能不仅是能源,还是重要载体,能够将传统化石能源和可再生能源连接起来,实现二者平稳过渡。国人对氢能的认识也在不断进步。从最初对氢能的制备技术、成本、安全等问题存在诸多争议,到工业制备技术成熟,氢成为能源重要的补充能源;到前不久《氢能产业发展中长期规划(2021-2035年)》发布,将氢能作为中国能源的重要组成部分。
2、目前,制氢方法主要有化学重整法、水电解法和生物法等。当前制氢主要来源于化石能源重整,相较于储量有限且不可再生的化石能源,生物质能源在自然生态循环中利用太阳能可实现碳循环再生和碳中和,其来源包含动植物、微生物以及由这些生命体排泄和代谢的所有有机物质,以秸秆、柴薪、禽畜粪便、林业废弃物、城市生活垃圾、废弃油脂等形式广泛存在,但大部分生物质被当作燃料直接燃烧处理,从而造成环境污染和资源浪费,因此,利用生物质重整制氢是能源清洁转型发展的重要方向之一。
3、相比传统制氢技术的高能耗,大量温室气体的排放,微生物转化制取氢气的技术利用了微生物自身的新陈代谢释放氢的特点,其不仅可以达到成本低廉的目的,还可以提高转化率。由生物质转化的氢能属于“绿氢”,加工转换排碳量微小,生物质直接发酵制取氢气,减少了风能、光能、电解水制氢需要先储能的环节,节省了成本和能源转换损耗。生物质氢气的热值(140.4mj/kg)是同质量焦炭、汽油等化石燃料热值的3-4倍,通过燃料电池可实现综合转化效率90%以上。cn 107012089a中对光合微生物同步糖化制氢进行了研究,实现酶解和产氢同时进行,解除碳水化合物对纤维素酶的抑制作用,降低了反应成本。
4、总体来说,生物质糖平台制氢过程仍然存在底物利用率低,产氢率不高等制约因素。
技术实现思路
1、本发明的目的就是为了解决现有技术存在的问题而提供一种利用生物质产酶、糖化及制氢气的反应系统和方法。本发明实现了生物质糖平台制氢全过程耦合,使得纤维素酶制备、生物质酶解糖化和产氢同时进行,并将生物质制氢各环节工艺更加优化,使得制氢成本进一步降低,而且实现了过程的连续化,提高了设备利用率,并进一步降低人力成本,整个过程的经济性进一步提高,为后续工业化应用奠定了基础。
2、本发明的目的可以通过以下技术方案来实现:
3、一种利用生物质产酶、糖化及制氢气的反应方法,具体步骤如下:
4、s1、制备纤维素酶液:将霉菌接种于以生物质为主要原料的发酵培养基中,发酵培养后得到纤维素酶液和菌体的混合液;
5、s2、步骤s1中得到的纤维素酶液和菌体的混合液经微滤膜过滤后得到过滤后的纤维素酶液和浓缩的菌液,过滤后的纤维素酶液进行酶解糖化,浓缩的菌液回流继续进行发酵产酶;
6、s3、制备可发酵糖液:步骤s2中得到的纤维素酶液与预处理生物质混合,通过预处理生物质的酶解糖化作用制备可发酵糖液;
7、s4、制备氢气:步骤s3中得到的可发酵糖液与产气肠杆菌混合,厌氧发酵制备氢气。
8、进一步地,步骤s1中,所述霉菌为里氏木霉(trichoderma reesei,cgmcc3.3711);
9、所述发酵培养基配方如下:葡萄糖0.5~10g/l,预处理生物质30~60g/l,(nh4)2so4 0.5~5g/l,kh2po4 0.5~4g/l,mgso4·7h2o 0.5~2g/l,cacl2 0.5~5g/l,微量元素溶液0.05~0.5%,用自来水配制,初始ph4.0~5.5,122~124℃灭菌40~60min,备用;
10、所述生物质,选自玉米秸秆、麦秆、高粱秸秆或木屑等农林作物废弃物中的任意一种或几种的组合;
11、所述生物质预处理方法如下:将待处理的生物质材料进行粉碎处理,粉碎后粒径控制在1~5mm,按料水比1:1~4:1加入自来水混合均匀,加入t-80 1~20g/l,将混合后的物料置于高温高压反应釜中,温度控制100~250℃,反应时间3~50min;
12、所述生物质预处理反应装置的搅拌组件为框式搅拌桨。
13、进一步地,步骤s1中,所述霉菌经过种液培养基进行扩培后,再接种于以生物质为主要原料的发酵培养基中,通过连续或间歇发酵过程,获得纤维素酶和菌体的混合液。
14、上述更进一步地,所述种液培养基配方如下:葡萄糖0.1~10.0g/l,蛋白胨0.3~2.0g/l,玉米浆0.3~2.0g/l,微量元素溶液0.05~0.5%,用自来水配制,初始ph4.0~5.5,经115~122℃灭菌15~30min,备用;
15、所述扩培条件如下:用无菌接种铲挑取霉菌的斜面菌种置于种液培养基中,25~32℃,140~220r/min培养24~40h,得到霉菌种液;
16、霉菌种液以3~20%(v/v)的接种量接种于发酵培养基中。
17、上述更进一步地,所述种液培养基和发酵培养基中的微量元素溶液配方如下:feso4·7h2o 2~30g,znso4·7h2o 0.5~30g,mnso4·h2o 0.1~10g,柠檬酸3~50g,用蒸馏水定容至200ml,置于棕色试剂瓶冷藏备用。
18、进一步地,步骤s1中,所述发酵培养采用好氧发酵罐进行,搅拌转速范围为100~300r/min,通气量范围为0.3~2vvm,温度范围为25~37℃,罐压范围为0.04~0.07mpa。
19、进一步地,步骤s1中,所述发酵培养采用补料-分批发酵工艺制备纤维素酶,所述补料-分批发酵工艺的补料策略为:
20、a.0~18h,不补料;
21、b.从第18h开始至发酵结束,以15~100ml/min流速补加葡萄糖溶液,葡萄糖溶液浓度为10~600g/l;
22、c.从第80h开始至发酵结束,以20~80ml/min流速补加预处理生物质溶液,生物质溶液浓度为0.5~2.5%(w/v),预处理方法同上,该生物质溶液补料前经122~130℃灭菌处理30~80min。
23、上述更进一步地,所述补料-分批发酵工艺的溶氧(do)为15~50%,ph为3.0~6.5(采用20%氢氧化钠控制),发酵周期为120~220h。
24、上述更进一步地,所述补料-分批发酵工艺采用与膜分离的耦合发酵工艺,具体步骤如下:在发酵过程中,纤维素酶液和菌体的混合液通过微滤膜过滤,操作压力0.08~0.8mpa,透过液即为纤维素酶液,进入酶解糖化,截留液为浓缩的菌液,回流重新进行发酵产酶,从发酵启动第80h开始,产酶发酵过程便与微滤膜分离进行耦合发酵,直至发酵结束;
25、耦合发酵工艺能够解除纤维素酶发酵过程中的产物抑制作用,使得纤维酶产率得到提升。
26、上述更进一步地,所述微滤膜的膜孔径为0.22~0.45μm,进行微滤膜分离前需要对微滤膜进行高温灭菌处理,灭菌温度为115~123℃,灭菌时间为15~20min。
27、进一步地,步骤s3中,将步骤s2中得到的纤维素酶液20u/g生物质的酶加量加入酶解体系中,ph为4.0~6.5(通过20%naoh溶液控制),酶解温度为45~60℃,酶解时间48h。
28、所述酶解体系,是指以20~35%(w/v)底物浓度的预处理生物质,以20u/g的纤维素酶液加量进行酶解糖化过程,其产物为后续生物制氢的主要原料,其主要成分为葡萄糖、木糖和未反应的生物质。
29、进一步地,步骤s4中,所述产气肠杆菌为enterobacter aerogenes,保藏编号为cgmcc1.4535。
30、进一步地,步骤s4中,所述厌氧发酵温度为34~40℃;
31、发酵转速为30~100r/min,保证物料混合均匀;
32、发酵周期10~60h。
33、进一步地,步骤s4中,所述产气肠杆菌在第二种液培养基中进行扩培活化后,再接种于产氢气发酵培养基中,厌氧发酵罐后制备氢气。
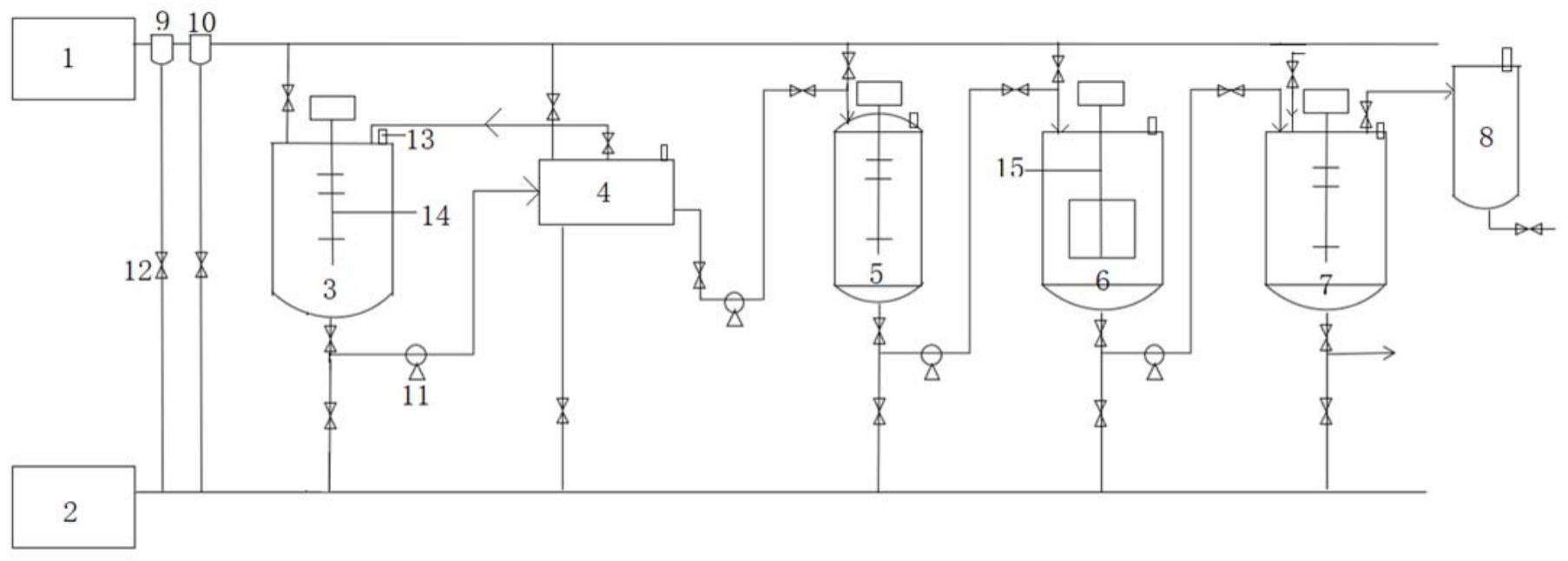
34、上述更进一步地,所述第二种液培养基配方如下:葡萄糖20g/l,玉米浆5g/l,酵母粉0.5g/l,mgso4·7h2o 0.3g/l,nacl 3g/l,kh2po4 1.8g/l,feso4·7h2o 0.1g/l,l-cysteine 0.5g/l,溶液a1ml/l,溶液b1ml/l,用自来水配制,初始ph6.5~7.5,110℃灭菌20min,备用;
35、所述溶液a配方如下:mnso4·7h2o 0.07g/l,znso4·7h2o 0.4g/l,h3bo3 0.1g/l,cacl·2h2o 0.1g/l,na2moo4 0.09g/l,cocl2·6h2o 0.3g/l;
36、所述溶液b配方如下:l-ascorbic acid 0.35g/l,citic acid 0.2g/l,pyridoxine hydrochloride 0.5g/l,para-aminobenzoic acid 0.02g/l,d-biotin 0.3g/l,vitamin b10.2g/l,riboflavin 0.2g/l。
37、上述更进一步地,所述扩培条件如下:培养温度为34~40℃,培养转速为30~100r/min,培养时间为8~16h。
38、上述更进一步地,所述产氢气发酵培养基配方以可发酵糖液为底料,再加入玉米浆5g/l(终浓度),酵母粉0.2g/l,mgso4·7h2o 0.3g/l,nacl 3g/l,kh2po4 1.8g/l,feso4·7h2o 0.1g/l,l-cysteine 0.5g/l,溶液a 1ml/l,溶液b1ml/l,初始ph4.0~4.5,110℃灭菌20min备用;
39、所述溶液a和溶液b与种液配方中的成分相同。
40、进一步地,步骤s4中,所述厌氧发酵采用厌氧发酵罐中进行,将产氢气发酵培养基灭菌后加入至厌氧发酵罐中,通入氮气30s~180s,用于除去厌氧发酵罐中的氧气,采用严格厌氧发酵。
41、此外,本发明还提供一种利用生物质产酶、糖化及制氢气的反应系统,包括通过管道依次相连的好氧发酵罐、微滤膜单元、酶解缓冲罐、酶解糖化罐和厌氧发酵罐,
42、所述好氧发酵罐用于制备纤维素酶液,
43、所述微滤膜单元用于过滤制备的纤维素酶液,得到过滤后的纤维素酶液和浓缩的菌液,
44、所述酶解缓冲罐用于暂时储存过滤的纤维素酶液,
45、所述酶解糖化罐用于制备可发酵糖液,可发酵糖液作为产气肠杆菌制氢气的原料,所述酶解糖化罐利用预处理生物质的酶解糖化作用,制备可发酵糖液,
46、所述厌氧发酵罐用于产气肠杆菌制氢气。
47、进一步地,所述反应系统还包括空气压缩机,所述空气压缩机的空气出口通过管道依次并列连接预过滤器、精过滤器、好氧发酵罐、微滤膜单元、酶解缓冲罐和酶解糖化罐的空气进口,所述空气压缩机用于保证压缩空气使用过程中的无菌度满足工艺要求,
48、空气压缩机的空气出口与好氧发酵罐、微滤膜单元、酶解缓冲罐和酶解糖化罐并列相连的管道上均设有阀门。
49、进一步地,所述反应系统还包括蒸汽发生器,所述蒸汽发生器的蒸汽出口通过管道依次并列连接预过滤器、精过滤器、好氧发酵罐、微滤膜单元、酶解缓冲罐、酶解糖化罐和厌氧发酵罐的蒸汽进口,多个并列相连的管道上均设有阀门。
50、进一步地,所述好氧发酵罐的出口通过管道与微滤膜单元的进料口连接。
51、进一步地,所述微滤膜单元的一个出料口通过管道与酶解缓冲罐的进料口连接,相连的管道上依次设有阀门和泵,所述微滤膜单元的另一个出料口通过管道与好氧发酵罐的回流口连接,相连的管道上设有阀门,过滤后的纤维素酶液通过微滤膜单元的一个出料口通过管道输送至酶解缓冲罐中,浓缩的菌液回流入好氧发酵罐继续进行发酵产酶。
52、进一步地,所述微滤膜单元还包括微滤膜,所述微滤膜孔径为0.22~0.45μm。
53、进一步地,所述酶解缓冲罐的出料口通过管道与酶解糖化罐的酶液进口连接,相连的管道上依次设有阀门、泵和阀门。
54、进一步地,所述酶解糖化罐的出料口通过管道与厌氧发酵罐的进料口连接,相连的管道上依次设有阀门、泵和阀门,
55、所述可发酵糖液的主要成分为葡萄糖和木糖。
56、进一步地,所述厌氧发酵罐的罐底设有出料口,所述厌氧发酵罐的罐顶设有氢气出口,氢气出口通过管道与氢气收集罐相连,相连的管道上设有阀门。
57、进一步地,所述厌氧发酵罐的罐顶还设有氮气入口,氮气入口通过管道引入氮气,相连的管道上设有阀门。
58、进一步地,所述氢气收集罐的罐底设有放料口,所述放料口用于排水和其他料液。
59、进一步地,所述好氧发酵罐、微滤膜单元、酶解缓冲罐、酶解糖化罐、厌氧发酵罐和氢气收集罐的罐顶均设有排气口。
60、进一步地,所述好氧发酵罐、酶解缓冲罐和厌氧发酵罐的罐内设有桨叶式搅拌桨,所述桨叶式搅拌桨用于保证物料和菌体混合均匀;
61、所述酶解糖化罐的罐内设有框式搅拌桨,所述框式搅拌桨用于保证预处理生物质与纤维素酶液混合均匀,同时强化酶解体系的传质、传热性能。
62、与现有技术相比,本发明的有益效果如下所示:
63、1、本发明首次将生物质产酶、糖化、制氢气三个过程耦合,在纤维素酶发酵过程中,将生物发酵与膜分离技术进行耦合,既解除了纤维素酶发酵过程中的产物抑制效应,又与后续糖化、制氢过程提供了原料,使整个过程得以连续,提高了生物制氢气效率;
64、2、发酵-膜分离耦合技术在小分子物质生产过程中有所应用,比如丁醇、乳酸等,在酶制剂大分子物质中的应用报道相对较少,本发明将纤维素酶的发酵与膜分离进行耦合,并与后续酶解糖化-发酵产氢进行集合,解决了纤维素酶发酵过程中产物抑制效应,并为后续的酶解糖化及发酵产氢提供了帮助。
65、2、本发明中生物质预处理工艺条件相对温和,不需要额外添加酸、碱等物质,预处理过程不产生对后续发酵菌种具有抑制作用的有毒物质,预处理后原料利用率高;
66、3、本发明纤维素酶产酶培养基中所用预处理生物质与后续酶解糖化所用预处理生物质为相同预处理方法,通过发酵驯化过程,发酵产酶所得纤维素酶系更适合对酶解糖化的预处理物料,使得酶解得率得到有效提高,发酵所得酶系更合理;
67、4、本发明操作简单,方式灵活,既可进行连续生产制氢气,也可以进行间歇操作,可广泛应用于生物质糖平台制氢气各个领域。
- 还没有人留言评论。精彩留言会获得点赞!