小鼠前列腺类器官制备方法及原发原位前列腺癌动物模型
本发明属于生物,具体涉及一种小鼠前列腺类器官制备方法及原发原位前列腺癌动物模型。
背景技术:
1、前列腺癌是我国男性癌症发病率升高的6种癌症之一,位居男性恶性肿瘤的第6位,发病率增长速度为每年8%-10%,严重影响我国男性。小鼠前列腺类器官培养以及肿瘤模型的建立,为研究前列腺癌发生发展以及探索各种治疗手段提供了可能的技术平台。
2、现有的前列腺癌动物模型主要有皮下移植模型、病人来源异种种植模型(pdx)、原位移植模型、基因鼠模型和致癌物质诱导模型。皮下移植模型具有成本低、肿瘤细胞系易于获得等优点,但需要在免疫缺陷鼠皮下移植较大数量的肿瘤细胞系,细胞系本身很难表征病人肿瘤特征,皮下肿瘤更是无法反映前列腺肿瘤细胞与基质互相作用的组织生态。病人来源异种种植模型(pdx)具有接近病人个体,反应个体疾病特征,保留肿瘤的异质性等优点,但pdx模型需要移植在皮下,而且由于病人本身的差异,标本取材的差异,导致该模型的成功率很大程度上取决于标本本身,且重度免疫缺陷鼠的饲养成本太高,难度很大。原位移植模型虽然可以模拟人体疾病的发生发展过程,但由于小鼠前列腺组织体积较小,手术难度非常大,且监测肿瘤形成需要特殊设备。基因鼠模型的背景非常清晰,成瘤的位置也可发生在前列腺组织原位,但是该模型的成本较高,基因鼠制备繁殖周期过长。致癌物质诱导模型很大程度上取决于小鼠的基因背景、诱发形成的小鼠前列腺癌模型的肿瘤个体间差异很大,成瘤率也较低,且该模型很难模拟病人的肿瘤形成情况。
技术实现思路
1、为了解决上述问题,本发明提供一种小鼠前列腺类器官制备方法及原发原位前列腺癌动物模型。本发明构建的原位原发的小鼠前列腺肿瘤模型,可模拟在人体内由于遗传改变导致正常细胞向肿瘤细胞转化的过程,能动态地表征了肿瘤发生发展的过程,在基因层面、肿瘤微环境、肿瘤发展及病理生理等方面与肿瘤发生发展真实情况更加贴近。
2、本发明的技术方案为:
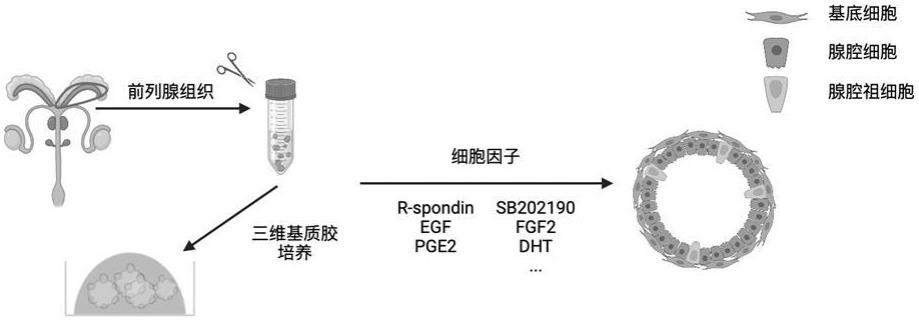
3、一种小鼠的前列腺细胞类器官的培养方法,包括以下步骤:
4、(1)取小鼠的前列腺细胞进行原代培养;
5、(2)将培养得到的原代细胞培养成类器官;
6、其中,获取小鼠前列腺细胞的操作步骤具体为:
7、(s1)安乐死小鼠,用75%乙醇反复喷淋小鼠尸体;
8、(s2)充分暴露小鼠腹腔脏器,之后将小鼠的膀胱、睾丸和精囊腺进行充分分离;
9、(s3)将膀胱、睾丸和精囊腺在预冷的pbs中反复漂洗,之后去除精囊腺、尿道和膀胱,仅留下前列腺的前、中、后和两侧叶组织;
10、(s4)将步骤(s3)所得前列腺组织剪成组织块;
11、(s5)将所得组织块进行消化处理,得到组织悬液;
12、(s6)将所述组织悬液依次进行过滤、离心,去除上清液,即得小鼠前列腺原代细胞。
13、步骤(s5)中,加入胶原酶混合物进行消化处理,所述胶原酶混合物为胶原酶ⅰ和胶原酶ⅳ按照体积比2:1组成的混合物;
14、所述消化处理的具体操作为:
15、用15-20ml的胶原酶混合物在50ml离心管中重悬所述组织块,于37℃摇床、220rpm条件下消化30-40min,期间每10分钟取出上下颠倒和/或用枪头吹打30-50次;
16、用等体积的dmem和10%fbs混合物中和所述胶原酶混合物,终止消化过程。
17、本技术发明人在长期研究中发现,通过使用胶原酶i+iv联合trypsin消化,具有以下优点:一、胶原酶(collagenase)通过水解细胞间质的脯氨酸,从而使细胞离散。胶原酶对胶原的消化作用很强,它仅对细胞间质有消化作用而对细胞损害不大,因此适于消化分离纤维性组织和较硬的癌组织。钙镁离子和血清不会对胶原酶的活性及消化作用产生影响。前列腺组织内主要包含上皮细胞和基质细胞等,使用胶原酶i+iv能够有效分离上皮组织与细胞间质,且胶原酶对细胞伤害性较小,在震荡和吹打所提供的机械力的帮助下能够实现高效分离上皮组织的目标。二、胰蛋白酶(trypsin)通过作用于与赖氨酸或精氨酸相连接的肽腱,除去细胞间粘蛋白及糖蛋白,影响细胞骨架,从而使细胞分离。当经过胶原酶处理过后的组织团块,基本已被消化为上皮组织团块,继续使用胰蛋白酶适当地进行消化,可使组织内部细胞变得松散,更大程度上将其消化为单个细胞,在此过程中吹打提供的机械力同样重要。
18、步骤(2)中,将所述原代细胞进行培养为类器官的具体操作为:
19、(a)将获得原代细胞加入基质胶于冰上进行重悬后,种于细胞培养板;
20、(b)将所述细胞培养板转移至孵箱中凝固;
21、(c)向细胞培养板的孔中加入类器官培养基,进行培养,即得所述类器官。
22、步骤(a)中,先对获得的原代细胞加入ack于冰上进行重悬,静置后,离心,去除上清液,再加入基质胶于冰上进行重悬;所述原代细胞与蛋白浓度为8-12mg/ml的基质胶混合;
23、步骤(c)中,加入类器官培养基后,还在相邻孔中加入pbs,防止培养基蒸发。
24、所述类器官培养基为基于dmem/f12,添加以下细胞因子配制得到:
25、白细胞抗原hla-b27 50倍稀释、表皮细胞生长因子(egf)50-100ng/ml、人重组r-spondin-1 250-1000ng/ml、a83-01 200-500nm、二盐酸盐(y-27632 )10-50μm、l-丙氨酰-l-谷氨酰胺(glutamax) 100倍稀释、二氢睾酮(dht) 1000倍稀释、n-乙酰半胱氨酸(n-acetylcysteine) 1-2mm、gmp级重组人noggin 100-1000ng/ml、角质细胞因子(fgf10)500ng/ml。
26、关于培养基成分的选择时,由于前列腺作为激素依赖性组织,其生长发育需要依赖雄激素及其代谢产物,因此在基础类器官培养基的基础上添加了dht(双氢睾酮),支持体外前列腺类器官的生长,更好的模拟体内前列腺细胞的生长分化等过程。此外,本发明所使用的体外培养前列腺类器官的培养基没有添加n2、wnt3a、gastrin等细胞因子,降低成本,配制简单。
27、基于所述的小鼠的前列腺细胞类器官构建原位原发前列腺癌动物模型的方法,包括如下步骤:
28、(a)将所述类器官进行基因编辑;
29、(b)将基因编辑后的类器官注射到动物前列腺组织内,即得所述原位原发前列腺癌动物模型。
30、上述动物前列腺组织可以为人或小鼠的前列腺组织,也可以为其他动物的前列腺组织。
31、在对类器官进行基因编辑之前,还对培养得到的类器官进行传代培养,具体为:
32、(a1)将培养获得的类器官中的培养基除去,之后加入重组消化酶;
33、(b1)转移至离心管中,在37℃水浴条件下进行温育;
34、(c1)对类器官进行反复吹打后,离心;
35、(d1)去除上清液,对获得的细胞加入基质胶于冰上进行重悬,之后种于细胞培养板;
36、(e1)将所述细胞培养板转移至培养箱中凝固;
37、(f1)向细胞培养板的孔中加入类器官培养基,进行类器官的传代培养。
38、对所述类器官进行基因编辑的操作具体为:
39、(a2)将培养获得的类器官中的培养基除去,之后加入重组消化酶;
40、(b2)转移至离心管中,在37℃水浴条件下进行温育;
41、(c2)对类器官进行反复吹打后,离心;
42、(d2)去除上清液,对获得的细胞加入virus进行重悬,之后种于细胞培养板;
43、(e2)2000rpm、32℃条件下进行离心处理1小时后,在37℃条件下进行孵育;
44、(f2)将类器官转移至离心管中,1500rpm离心10min;
45、(g2)去除上清液,加入基质胶进行重悬,之后种于细胞培养板;
46、(h2)所述细胞培养板转移至培养箱中凝固;
47、(f2)向细胞培养板的孔中加入类器官培养基,进行类器官的基因编辑。
48、所述基因编辑具体为突变trp53和pten基因,高表达cmyc基因。本发明通过使用crispr-cas9技术,通过慢病毒感染将trp53、pten基因敲除同时通过逆转录病毒感染的方法将myc基因过表达,基因背景较为清晰明确,成瘤成功率高,时间周期短。
49、优选地,本发明所述基因编辑还包括对类器官转入荧光标记基因。
50、所述方法构建得到的原位原发前列腺动物模型在药物筛选、药物毒性试验或作为内分泌治疗试验动物模型中的应用。
51、本发明的有益效果为:
52、本发明提供一种小鼠前列腺类器官制备方法及原发原位前列腺癌动物模型,通过体外分离、消化并培养小鼠前列腺细胞类器官,同时将类器官以不同临床热点突变基因为背景进行基因编辑组合,再注射至小鼠的前列腺原位组织,使其发生发展为肿瘤;本发明构建的原位原发的小鼠前列腺肿瘤模型,可模拟在人体内由于遗传改变导致正常细胞向肿瘤细胞转化的过程,能动态地表征了肿瘤发生发展的过程,在基因层面、肿瘤微环境、肿瘤发展及病理生理等方面与肿瘤发生发展真实情况更加贴近。本发明方法可高效率地制备得到更接近前列腺癌特征、符合临床研究需求的前列腺癌模型,该模型可以在探究前列腺癌及耐药特性发生发展机制、寻找和优化新的前列腺癌可能的治疗方式等研究领域提供有利工具。本发明方法相比于基因工程肿瘤动物模型耗时短,且不会导致动物成瘤前死亡,成瘤率高;相比移植瘤动物模型,具有肿瘤发生驱动因素明确,器官微环境更加真实等特点。
- 还没有人留言评论。精彩留言会获得点赞!