抗人αvβ8的单克隆兔抗体及其应用的制作方法
本发明涉及抗体药物,尤其涉及抗人αvβ8的单克隆兔抗体及其应用。
背景技术:
1、转化生长因子-β(tgf-β)信号通路在成熟有机体和发育中的胚胎中都参与了许多细胞过程,这些过程包括细胞生长,细胞分化,细胞凋亡,细胞动态平衡等其它细胞功能。tgf-β的三种亚型中,tgf-β1在肿瘤中普遍存在,它损害效应t淋巴细胞的许多功能,并促进cd4pos foxp3pos调节性t细胞(tregs)的发育和稳定。随后,在t淋巴细胞中选择性靶向tgf-β信号,通过效应t淋巴细胞7抑制其细胞毒功能,从而有效地消除癌细胞。因此,中和tgf-β的免疫调节作用被认为是一种有前景的抗癌治疗方法。
2、tgf-β是少数以非活性形式分泌的细胞因子之一。这个小的潜伏期复合物由成熟的细胞因子组成,周围环绕着非共价结合的潜伏期相关肽(lap)。只要lap与成熟细胞因子保持密切接触,分泌的潜伏tgf-β就可以储存在tme中,附着于细胞外基质,没有任何免疫调节功能。因此,激活分泌的tgf-β潜伏复合物,涉及暴露成熟细胞因子的受体结合域,是tgf-β介导的肿瘤免疫调节功能不可缺少的。在体内,tgf-β1的激活在很大程度上依赖于整合素,包括αvβ8整合素,其表达受β8亚基(itgβ8)的调控。
3、研究表明,整合素αvβ8在treg中的表达对于有效激活肿瘤细胞产生的tgf-β和促进肿瘤免疫逃逸至关重要。因此,对整合素的抑制成为治疗肿瘤的重要机制之一。目前,已经有几种整合素的抑制剂上市,还有许多其他药物正在进行临床前研究。自2015年以来,至少有130项整合素靶向治疗的临床试验。总共有6种整合素抑制剂药物,针对四种整合素,包括αiibβ3(也称为糖蛋白iib/iiia)、α4β7、α4β1和αlβ2。
4、可见,目前已经上市的整合素的抗体中针对αvβ8较为罕见,并且市面上的抗体多数在小鼠体内构建获得,而这些抗体对阻断受体αvβ8与配体l-tgfβ的结合的作用是非常有限的。
技术实现思路
1、有鉴于此,本发明要解决的技术问题在于提供抗人αvβ8的单克隆兔抗体并提供其在阻断αvβ8与l-tgfβ的结合中的应用。
2、本发明提供的抗人αvβ8单克隆兔抗体,
3、其重链cdr1具有如seq id no:1~17任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列;
4、其重链cdr2具有如seq id no:18~38任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列;
5、其重链cdr3具有如seq id no:39~53任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列;
6、其轻链cdr1具有如seq id no:54~72任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列;
7、其轻链cdr2具有如seq id no:73~85任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列;
8、其轻链cdr3具有如seq id no:86~105任一项所示的氨基酸序列,或者与其具有至少80%序列同源性的序列。
9、本发明中,所述与具有至少80%序列同源性的序列为在原序列的基础上,经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列中,所述多个为2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个或15个。
10、本发明所述抗人αvβ8单克隆兔抗体中:
11、其重链cdr1的氨基酸序列如seq id no:1~17任一项所示;
12、其重链cdr2的氨基酸序列如seq id no:18~38任一项所示;
13、其重链cdr3的氨基酸序列如seq id no:39~53任一项所示;
14、其轻链cdr1的氨基酸序列如seq id no:54~75任一项所示;
15、其轻链cdr2的氨基酸序列如seq id no:73~85任一项所示;
16、其轻链cdr3的氨基酸序列如seq id no:86~105任一项所示。
17、进一步的,本发明所述的抗人αvβ8单克隆兔抗体中:
18、其重链可变区具有如seq id no:106~128任一项所示的氨基酸序列;
19、其轻链可变区具有如seq id no:129~151任一项所示的氨基酸序列。
20、更进一步的,本发明所述的抗人αvβ8单克隆兔抗体中:
21、其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:129任一项所示。
22、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:130任一项所示。
23、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:131任一项所示。
24、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:132任一项所示。
25、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:133任一项所示。
26、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:134任一项所示。
27、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:135任一项所示。
28、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:136任一项所示。
29、或其重链可变区的氨基酸序列如seq id no106~128任一项所示,轻链可变区的氨基酸序列如seq id no:137任一项所示。
30、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:138任一项所示。
31、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:139任一项所示。
32、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:140任一项所示。
33、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:141任一项所示。
34、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:142任一项所示。
35、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:143任一项所示。
36、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:144任一项所示。
37、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:145任一项所示。
38、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:146任一项所示。
39、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:147任一项所示。
40、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:148任一项所示。
41、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:149任一项所示。
42、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:150任一项所示。
43、或其重链可变区的氨基酸序列如seq id no:106~128任一项所示,轻链可变区的氨基酸序列如seq id no:151任一项所示。
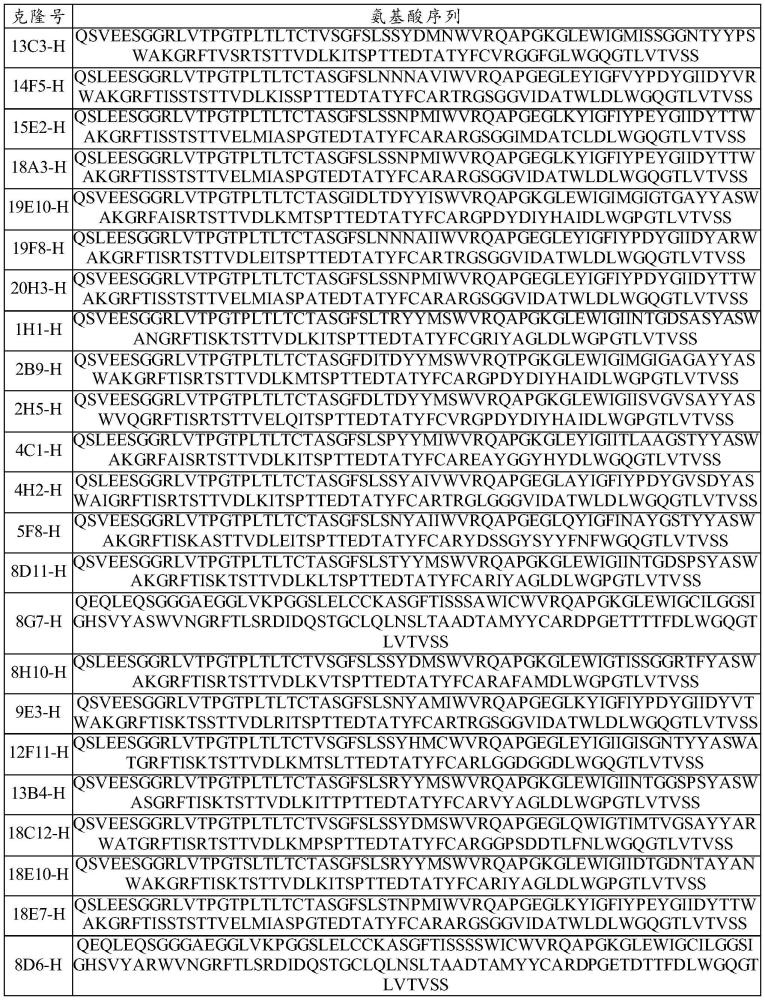
44、本发明通过αvβ8胞外段二聚体蛋白免疫2只兔子,利用单b细胞技术获得兔源抗体,通过单b细胞上清活性分析(elisa结合,elisa阻断试验)获得候选兔源抗体,将兔抗体轻重链基因可变区序列克隆至编码兔抗体轻重链恒定区序列的上游,进行哺乳动物细胞表达,proteina纯化,制备兔单克隆抗体。对兔抗体进行生化试验和细胞结合试验来分析抗体的亲和力、特异性和鼠,猴的交叉活性,并对候选抗体进行了功能检测(阻断试验),确定能够阻断αvβ8与tgfβ结合的抗体。
45、本发明所述的抗人αvβ8单克隆兔抗体其恒定区为兔igg(氨基酸序列如seq idno:152所示)。
46、本发明还提供了如下i)~vii)中的任意一项的生物材料:
47、i)、编码如前所述的抗体的核酸;
48、ii)、含有i)所述的核酸的表达单元;
49、iii)、含有i)所述的核酸或ii)所述表达单元的表达载体;
50、iv)、含有ii)所述表达载体的宿主;
51、v)、基因组中整合有i)所述的核酸或ii)所述表达单元的宿主;
52、vi)、如前所述抗体经化学标记或生物标记获得的标记抗体;
53、vii)、如前抗体或vi)所述标记抗体与固体介质或半固体介质偶联制得的偶联物。
54、本发明中所述的核酸是编码抗人αvβ8单克隆兔抗体轻链可变区的核酸,或者为编码其重链可变区的核酸,其可为单链的或是双链的,可以是dna、rna、cdna或pna。所述核酸可以包括具有不同功能的核苷酸序列,如编码区和非编码区如调控序列(例如启动子或转录终止子)。核酸在拓扑学上可以是线性或环状的。核酸可以是例如载体(如表达或克隆载体)的一部分,或一个片段或多个片段的组合。所述核酸可直接从天然来源获得,或者可由重组、酶法或化学技术辅助制备。所述rna形式为由基因转录获得的mrna等。
55、本发明中,所述的表达单元包括如前所述的核酸和启动子、终止子。为了调节表达的水平或蛋白的折叠,所述表达单元中还包括其他元件。
56、本发明中,所述的质粒载体用于核酸的扩增、保藏,或者用于抗体在宿主中的表达。本发明所述的质粒载体包括骨架和核酸。具体的,所述骨架来源于植物、动物、细菌、真菌、噬菌体或病毒,本发明对此不做限定,一些实施例中,所述质粒载体的骨架载体选自pmd19-t、pcdna3.1、abvec2.0-higg1、pcomb3xtt、pcomb3、pfuse-higg4-fc2、pcomb3xlambda、pee12.4、pee6.4、pcho1.0、pcomb3xss、pfuse-higg1e1-fc2、pcdna3.1-higg1-fc2、pfuse-higg1-fc2、pfuse-migg1-fc2。本发明实施例中,以pmd19-t载体作为核酸扩增和保藏的骨架,而以ptt5-rabbit-igg作为抗体重链的表达骨架,以ptt5-rabbit-kappa1作为轻链表达的骨架。所述质粒载体的构建包括:将ptt5空载体装载到兔igg恒定区,再把可变区序列构建到装了恒定区的载体上。
57、本发明所述的宿主用于本发明所述核酸的保存或扩增,也可用于所述抗体的构建与表达,本发明对此不做限定。一些实施例中,所述细胞为原核细胞或真核细胞,本发明中,所述原核生物包括但不限于大肠杆菌,所述的真核细胞包括真菌细胞、植物细胞、哺乳动物细胞或昆虫细胞。本发明实施例中以大肠杆菌dh5α为例制备如前所述的抗体。
58、本发明所述经化学标记或生物标记的所述抗体中,所述化学标记为同位素、免疫毒素和/或化学药物;所述生物标记为生物素、亲和素或酶标记。所述酶标记优选为辣根过氧化物酶或碱性磷酸酶。所述免疫毒素优选为黄曲霉毒素、白喉毒素、绿脓杆菌外毒素、蓖麻毒蛋白、相思子毒蛋白、槲寄生凝集素、蒴莲根毒素、pap、造草素、白树毒素或丝瓜毒素。
59、本发明所述抗体或其结合物与固体介质或半固体介质偶联制得的偶联物中,所述固体介质或非固体介质选自胶体金、聚苯乙烯平板或珠粒。
60、进一步的,本发明还提供了所述抗体的制备方法,包括:培养如前所述的宿主、诱导所述抗体的表达。
61、更进一步的,本发明还提供了如前所述抗体和/或所述的生物材料中的至少一种在制备治疗tgfβ信号通路相关疾病的药物中的应用。
62、本发明中,所述tgfβ信号通路相关疾病包括肿瘤;所述治疗包括阻断αvβ8与l-tgfβ结合。
63、本发明中,所述肿瘤为tgfβ信号通路相关的癌症,例如,所述肿瘤为肺腺癌、卵巢癌、膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌和/或甲状腺癌。
64、更进一步的,本发明还提供了治疗tgfβ信号通路相关疾病的药物,其原料包括如前所述的抗体和/或如前所述的生物材料。一些情况下,所述药物中还可以包括肿瘤的其它治疗剂。
65、本发明所述的药物中,还包括药学上可接受的辅料。
66、本发明所述的药物为口服制剂或注射剂。所述注射剂为注射用粉针剂或注射液剂。
67、更进一步的,本发明还提供了治疗tgfβ信号通路相关疾病的方法,其包括给予本发明所述的药物。本发明所述方法中,给予的方式包括注射或口服。
68、更进一步的,本发明还提供了所述的抗体和/或所述的生物材料在制备αvβ8检测试剂中的应用。
69、更进一步的,本发明所述的αvβ8检测试剂,其包括如前所述的抗体和/或如前所述的生物材料。
70、一些实施例中,本发明所述的检测试剂是基于免疫学的检测试剂,所述免疫学检测的方法包括elisa、免疫组化、流式细胞术。
71、更进一步的,本发明还提供了检测αvβ8的方法,其包括以本发明所述的检测试剂对样品进行检测。
72、本发明通过αvβ8胞外段二聚体蛋白免疫2只兔子,然后通过筛选获得了具有良好特异性的兔抗体。经验证,这些抗体与αvβ8具有良好结合的能力,其中部分还能够阻断tgfβ与αvβ8的结合。实验表明,当配体biotinylated-latent-tgfβ工作浓度为0.25ug/ml时,抗体具有较好的阻断活性。
- 还没有人留言评论。精彩留言会获得点赞!