工程化改造的PSD蛋白、细胞外囊泡及其制备方法和应用与流程
本技术属于生物工程领域,具体涉及一种工程化改造的psd蛋白、工程化改造的细胞外囊泡及其制备方法和应用。
背景技术:
1、细胞外囊泡(extracellular vesicle, ev)是由细胞分泌的,直径大约为30~1000nm,能够被受体细胞摄取的膜性囊泡小体。ev作为蛋白质、rna、脂质等生物大分子在细胞间转运的载体,是细胞与细胞间通讯的重要媒介,因此也被认为是一种天然驯化的药物载体。
2、细胞外囊泡的药代动力学是开发细胞外囊泡药物递送系统的重要问题之一。据报道,静脉注射的细胞外囊泡药物半衰期小于10分钟,主要被肝脏中的巨噬细胞清除(imai等, 2015; morishita等, 2015)。而巨噬细胞主要通过识别磷脂酰丝氨酸(ps),磷脂酰丝氨酸导致的细胞外囊泡表面负电荷被巨噬细胞识别,并与静脉注射后被巨噬细胞清除相关(matsumoto等, 2017)。
3、目前有文章通过tim4(一个特异性与磷脂酰丝氨酸结合的蛋白)胶珠来捕获ps(+)-ev,进而反向筛选出ps(-)-ev,其在天然细胞外囊泡中只占10%。ps(-)-ev经静脉注射后能够大大延长细胞外囊泡的半衰期(matsumoto et al., 2021)。因此如何获取ps(-)-ev是一项改善细胞外囊泡循环时间的关键技术。
4、目前文献中常用的方法有:(1)通过tim4偶联磁珠捕获ps(+)-ev,反向筛选出ps(-)-ev;(2)直接提取血浆中的细胞外囊泡,因为血浆中的细胞外囊泡已经经过巨噬细胞吞噬后残留的ps(-)-ev(matsumoto等, 2021);(3)通过原核表达纯化磷脂酰丝氨酸脱羧酶(psd),体外添加psd与ev共孵育催化,获取ps(-)-ev(kobayashi 等, 2022)。
5、然而,通过tim4偶联胶珠反向筛选的方法,由于天然细胞外囊泡中ps(-)-ev仅占10%左右,细胞外囊泡的产量非常低。从血浆中提取ps(-)-ev的方法,成本高,产量低。体外psd催化的方法由于需要表达纯化psd蛋白,psd蛋白可溶性较低,导致蛋白产量较低。表达后蛋白孵育容易引入其它污染。体外孵育反应速度慢,孵育时间过长容易对细胞外囊泡造成影响。体外孵育后需要进行再纯化,增加细胞外囊泡生产工序,存在细胞外囊泡产量的损失。
技术实现思路
1、针对现有技术中的上述问题,本技术提供了一种工程化改造的psd蛋白和一种工程化改造的细胞外囊泡,通过工程化改造的psd蛋白对细胞外囊泡表面的磷脂酰丝氨酸进行催化,减少巨噬细胞的吞噬,进而减少体内清除,延长细胞外囊泡的循环时间。
2、本技术的具体技术方案如下:
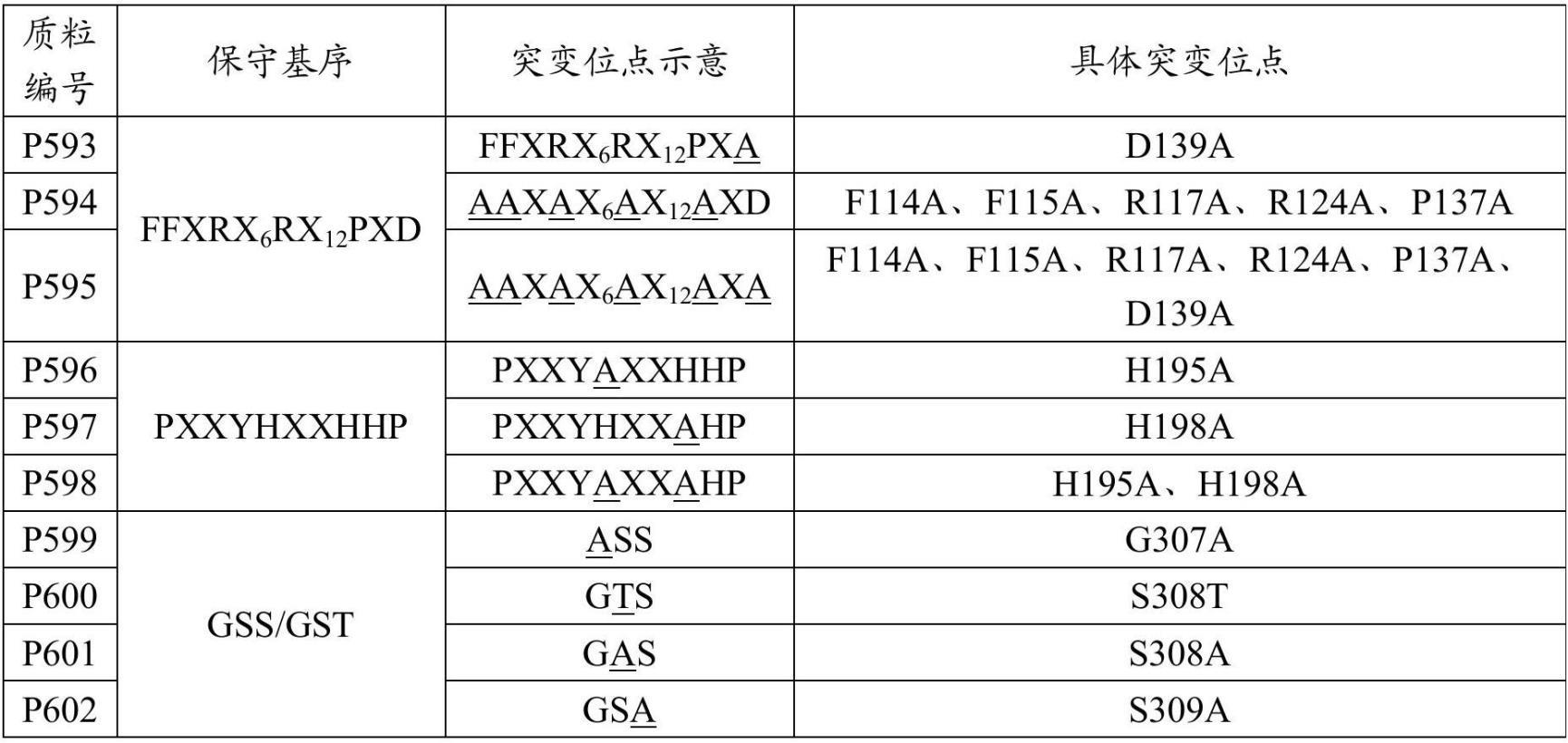
3、1. 一种工程化改造的磷脂酰丝氨酸脱羧酶(psd蛋白),其包含如下三个功能域:参照如seq id no: 1所示的野生型psd蛋白的第114~139位的x1x2x3x4(x5)mx6(x7)nx8x9x10、第191~120位的x11x12x13x14x15x16x17x18x19x20和第307~309位的x21x22x23;
4、其中,x1、x2各自独立地为phe、trp、leu、val、ile或tyr;
5、x4、x6各自独立地为arg、lys、gln或asn;
6、x8、x11、x20为pro;
7、x10为asp、glu或asn;
8、x14为tyr、trp、phe、thr或ser;
9、x15、x18、x19各自独立地为his、asn、gln、lys或arg;
10、x21为gly;
11、x22为ser;
12、x23为ser、thr或val;
13、x3、x5、x7、x9、x12、x13、x16、x17各自独立地为任意氨基酸,m、n分别表示m、n个重复的氨基酸,m=1-6、2-5、3-4,或该数值范围内的任意正整数,n=1-12、2-11、3-10、4-9、5-8、6-7,或该数值范围内的任意正整数;
14、优选地,所述psd蛋白包含如下三个功能域:参照如seq id no: 1所示的野生型psd蛋白的第114~139位的ffxrx6rx12pxd、第191~120位的pxxyhxxhxp和第307~309位的gss/gst,其中x各自独立地为任意氨基酸。
15、2. 根据项1所述的工程化改造的psd蛋白,其为来源于诺氏疟原虫(plasmodiumknowlesi)的psd蛋白。
16、3. 根据项1或2所述的工程化改造的psd蛋白,其为n端缺失1至45位氨基酸的截短的psd蛋白,优选为n端缺失1至34位氨基酸的截短的psd蛋白。
17、4. 根据项1~3中任一项所述的工程化改造的psd蛋白,其包含在一个或两个位置的插入、缺失或替换突变,所述位置为相对于如seq id no: 1所示的野生型psd蛋白的第217位和第219位;
18、优选地,所述突变为替换突变;
19、优选地,所述替换突变为p217h和f219n;
20、优选地,所述工程化改造的psd蛋白包含如seq id no: 3~seq id no: 5和seq idno: 10~seq id no: 12中任一个所示的氨基酸序列,或与seq id no: 3~seq id no: 5和seq id no: 10~seq id no: 12中任一个所示的氨基酸序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相似性的氨基酸序列。
21、5. 一种融合蛋白,其包含根据项1~4中任一项所述的工程化改造的psd蛋白。
22、6. 根据项5所述的融合蛋白,其还包含促进psd蛋白可溶性的序列,优选为gst序列。
23、7. 根据项5或6所述的融合蛋白,其还包含一种或多种信号肽;
24、优选地,所述信号肽为分泌型蛋白的信号肽;
25、优选地,所述分泌型蛋白选自抗体、细胞因子、蛋白质类激素和消化酶中的一种或两种以上;
26、优选地,所述融合蛋白包含如seq id no:6~seq id no:8中任一个所示的氨基酸序列,或与seq id no:6~seq id no:8中任一个所示的氨基酸序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相似性的氨基酸序列。
27、8. 一种编码项1~4中任一项所述的工程化改造的psd蛋白或者项5~7中任一项所述的融合蛋白的核酸分子;
28、优选地,所述核酸分子的序列如seq id no: 9所示,或为具有与seq id no: 9至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相似性的核苷酸序列。
29、9. 一种表达载体,其包含项8所述的核酸分子。
30、10. 一种工程化改造的细胞,其包含项8所述的核酸分子和编码货物蛋白的核酸分子;
31、优选地,所述货物蛋白选自治疗性肽、dna结合蛋白、rna结合蛋白、荧光蛋白、酶和连接治疗化合物的接头中的一种或多种;
32、优选地,所述治疗性肽是抗体和/或细胞因子,例如所述细胞因子选自如下的一种或多种:人白细胞介素家族成员、肿瘤坏死因子家族成员、干扰素和t细胞衔接器;
33、优选地,所述rna结合蛋白选自如下的一种或多种:l7ae、hnrnpa2b1、hnrnpc1、hnrnpg、hnrnpk、hnrnpq、ybx1、hur、ago2、igf2bp1、mex3c、anxa2、alix、ncl、fus和mvp。
34、11. 一种制备工程化改造的细胞外囊泡的方法,其包括以下步骤:
35、培养项10所述的工程化改造的细胞,并从培养基中分离所述工程化改造的细胞分泌的细胞外囊泡。
36、12. 一种工程化改造的细胞外囊泡,其包含项5~7中任一项所述的融合蛋白和货物蛋白;
37、优选地,所述融合蛋白位于所述细胞外囊泡膜上;
38、优选地,所述货物蛋白选自治疗性肽、dna结合蛋白、rna结合蛋白、荧光蛋白、酶和连接治疗化合物的接头中的一种或多种;
39、优选地,所述治疗性肽是抗体和/或细胞因子,例如所述细胞因子选自如下的一种或多种:人白细胞介素家族成员、肿瘤坏死因子家族成员、干扰素和t细胞衔接器;
40、优选地,所述rna结合蛋白选自如下的一种或多种:l7ae、hnrnpa2b1、hnrnpc1、hnrnpg、hnrnpk、hnrnpq、ybx1、hur、ago2、igf2bp1、mex3c、anxa2、alix、ncl、fus和mvp。
41、13. 一种药物组合物,其包含项12所述的工程化改造的细胞外囊泡或项11所述的方法制备的工程化改造的细胞外囊泡,以及药学上可接受的载体。
42、14. 项5~7的融合蛋白、项12所述的工程化改造的细胞外囊泡或项11所述的方法制备的工程化改造的细胞外囊泡在制备诊断、治疗和/或预防疾病的药物中的用途。
43、15. 一种诊断、治疗和/或预防疾病的方法,包括给予有需要的受试者有效量的项12所述的工程化改造的细胞外囊泡或项11所述的方法制备的工程化改造的细胞外囊泡。
44、发明的效果
45、与现有技术大部分真核生物中的psd蛋白可溶性较低不同,本技术的工程化改造的psd蛋白天然存在部分可分泌形式,可溶性较高,蛋白产量高。本技术通过构建能够表达工程化改造的psd蛋白或通过构建能够表达包含工程化改造的psd蛋白的融合蛋白的工程化细胞,使工程化改造的psd蛋白或融合蛋白分泌至细胞培养上清,在细胞分泌细胞外囊泡过程中就能够同时完成psd催化磷脂酰丝氨酸羧基裂解,在工程化改造的细胞外囊泡提取后即可获得表面ps含量极低的细胞外囊泡,能够显著减少巨噬细胞吞噬,增加细胞外囊泡在体内的循环时间。本技术的制备工程化改造的细胞外囊泡的方法简便、耗时短、成本低,同时还能够避免再纯化过程中细胞外囊泡的损失。
- 还没有人留言评论。精彩留言会获得点赞!