一种低噪音双元荧光素酶载体构建方法与应用与流程
本发明涉及分子生物学,具体为一种低噪音双元荧光素酶载体构建方法与应用。
背景技术:
1、基因是指携带有遗传信息的dna序列,是控制生物体性状的基本遗传单位。基因通过指导各类rna和蛋白质的合成来表达自己所携带的遗传信息,从而控制生物个体的性状表现和生理功能。
2、基因启动子是基因的组成部分,它通常位于基因转录起始位点上游,长度从数百碱基对到数千碱基对不等。启动子不会被翻译,但它控制着基因表达的起始时间和表达的程度,像开关一样决定着基因的活动。基因启动子通过与转录因子结合来控制基因的表达,其核心序列是基因非编码区上游的rna聚合酶结合位点,该位点指挥rna聚合酶的结合,指导rna复制合成,启动基因转录;除此之外,启动子内还有增强子、沉默子、边界元件、绝缘子等元件,各元件协同作用,调控基因的转录。因此,研究基因的启动子结构以及启动子与转录因子的互作机制,是研究基因功能的重要组成部分。
3、双荧光素酶报告基因检测系统由萤火虫荧光素酶和海肾荧光素酶组成,在这个系统中,通常以目的基因的启动子驱动萤火虫荧光素酶基因表达,以海肾荧光素酶作为转染的内参,减少各检测样本因细胞数量和转染效率差异而产生的实验误差。双荧光素酶报告基因检测系统是检测启动子活性以及转录因子与目的基因启动子区dna相互作用的有效且广泛使用的检测方法,目前用于该检测系统的报告基因载体通常只表达1个荧光素酶基因,检测过程中需要共转染分别表达萤火虫荧光素酶和海肾荧光素酶的两个报告基因载体,导致各检测样品中两个报告基因载体的转染效率差异较大,进而导致两者的表达水平在不同检测组中存在很大偏差,从而导致大的实验误差。
4、除此之外,部分报告基因载体受自身组成元件的影响,在没有启动子驱动萤火虫荧光素酶基因表达的情况在,在转染样品中也会检测到较强的荧光信号,形成系统噪音,影响待测启动子活性的检测。因此,解决双荧光素酶报告基因检测系统中萤火虫荧光素酶和海肾荧光素酶转染效率的稳定性和均一性,并有效降低萤火虫荧光素酶报告基因的系统噪音,对双荧光素酶报告基因检测系统的准确性至关重要。
技术实现思路
1、针对以上现有技术中的不足,本发明提供了一种低噪音双元荧光素酶载体构建方法与应用。通过克隆目标基因的启动子序列连入该载体的多克隆位点区域,构建重组双元荧光素酶报告基因表达载体,转染真核细胞株后使用双荧光素酶报告基因检测试剂盒检测转染细胞中的内参基因海肾荧光素酶和启动子报告基因萤火虫荧光素酶的活性;本发明构建的双元荧光素酶报告基因载体转染后荧光素酶报告基因和内参海肾荧光素酶基因的转染效率具有一致性,能更有效的校正实验误差,且背景载噪音低。
2、本发明的一个目的在于提供一种。
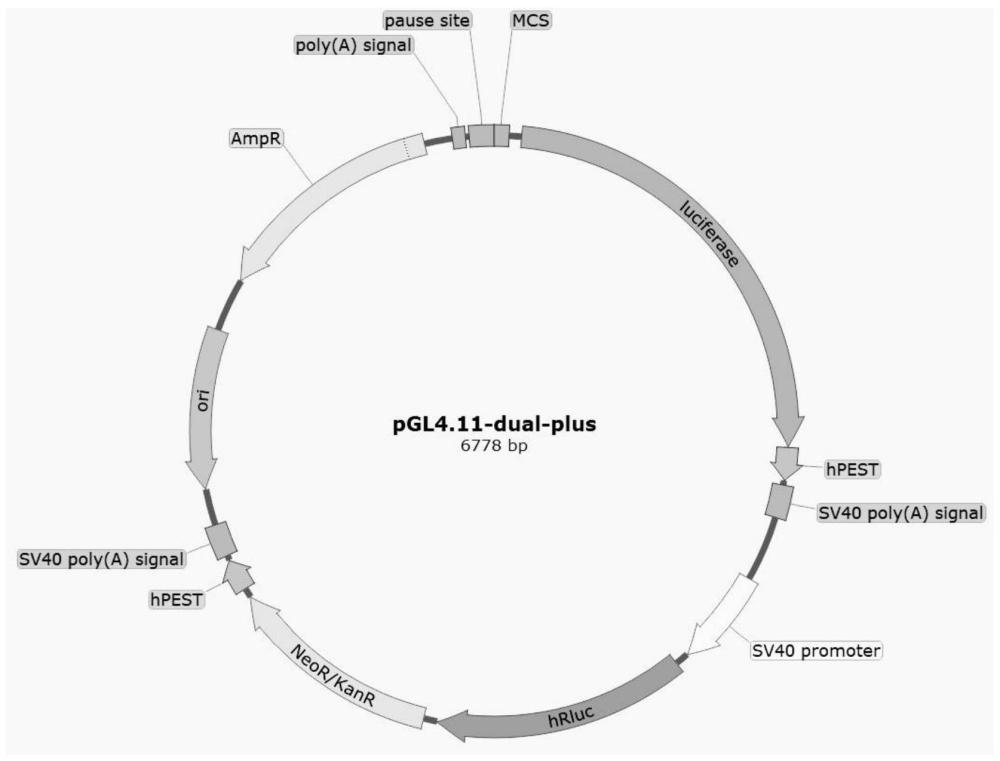
3、一种双元荧光素酶载体,所述双元荧光素酶载体是由载体ppgl4.11改造而成,所述pgl4.11-dual-plus载体包含多克隆位点、报告基因荧光素酶编码基因、sv40终止信号和内参基因海肾荧光素酶hrluc/真核筛选标记neor融合表达框,所述多克隆位点用于插入目标基因的启动子片段。
4、优选的,所述多克隆位点位于所述报告基因荧光素酶编码基因之前。
5、优选的,所述内参基因海肾荧光素酶hrluc/真核筛选标记neor融合表达框位于报告基因荧光素酶编码基因的sv40终止信号之后,由sv40 promoter启动子、内参基因海肾荧光素酶报告基因hrluc、真核筛选标记neor基因和sv40终止信号组成。
6、优选的,所述sv40 promoter启动子序列如seq所示;内参基因海肾荧光素酶基因hrluc序列如seq所示;真核筛选标记neor序列如真核筛选标记neor所示;sv40终止信号如seq所示。
7、本发明的另外一个目的在于提供一种双元荧光素酶载体的构建方法。
8、上述任一项所述的双元荧光素酶载体的构建方法,包括如下步骤:
9、s1:人工合成包含sv40 poly(a)signal、sv40启动子、hrluc/neor融合基因及poly(a)signal的dna片段,xbai/bamhi双酶切;
10、s2:xbai/bamhi双酶切pgl4.11质粒,回收大片段后,使用t4 dna连接酶与步骤s1中双酶切的片段进行链接,获得pgl4.11-dual-plus重组载体;
11、s3:将步骤s1中得到的pgl4.11-dual-plus重组载体转化至大肠杆菌dh5α感受态细菌,培养后提取重组质粒,得到双元荧光素酶载体,即为pgl4.11-dual-plus载体。
12、优选的,基于双元荧光素酶载体构建方法的s1中:
13、人工合成的包含sv40 poly(a)signal、sv40启动子、hrluc/neor融合基因及poly(a)signal的dna片段,其序列如seq id no:5所示。
14、优选的,基于双元荧光素酶载体构建方法的s2中:
15、将得到的pgl4.11-dual-plus重组载体通过热激法转化至大肠杆菌dh5α感受态细菌,并通过氨苄青霉素抗性筛选获得阳性重组质粒。
16、优选的,所述抗性筛选的具体方法如下:
17、挑取单菌落接种于含氨苄青霉素的lb液体培养基中,在37℃、200rpm的条件下培养过夜,使用商品化质粒小提试剂盒提取重组pgl4.11-dual-plus载体质粒dna。
18、本发明的最后一个目的在于提供一种双元荧光素酶载体的应用。
19、上述任一项所述的双元荧光素酶载体在体外真核生物基因的启动子活性检测、启动子snp分析、转录因子对启动子的调控研究中的应用。
20、优选的,包括如下步骤:
21、s101:将启动子dna片段插入pgl4.11-dual-plus载体的多克隆位点区域,构建特定基因启动子的重组双元荧光素酶报告基因表达载体;
22、s102:将步骤s101中构建的重组双元荧光素酶报告基因表达载体转染真核细胞,转染24小时后收集细胞;如检测其他调控因子对启动子的调控机制,则共转染其他调控因子;
23、s103:使用商品化的双荧光素酶报告基因检测试剂盒中的报告基因细胞裂解液裂解细胞;
24、s104:将步骤s103中获得的裂解细胞放入加入酶标板中,按照双荧光素酶报告基因检测试剂盒操作步骤,加入海肾荧光素酶底物,检测海肾荧光素酶报告基因的荧光值;
25、s105:在步骤s104的基础上,按照双荧光素酶报告基因检测试剂盒操作步骤,在酶标板检测孔中加入萤火虫荧光素酶底物,检测萤火虫荧光素酶报告基因的荧光值;
26、s106:以报告基因裂解液为空白对照,计算突变型启动子相对于野生型启动子的启动子活性。
27、与现有技术相比,本发明的有益效果是:
28、1、本发明的pgl4.11-dual-plus载体系统只需通过更换插入的启动子dna片段即可实现对不同基因的检测,使用范围广,操作简便;
29、2、本发明构建的pgl4.11-dual-plus载体同时包含荧光素酶报告基因表达框和内参基因海肾荧光素酶的表达框,只需转染1个质粒,即可同时转染报告基因和内参基因,实验操作更为高效快速;
30、3、本发明的pgl4.11-dual-plus载体的能确保报告基因和内参基因转染效率一致,更有效的校正实验误差;
31、4、本发明的pgl4.11-dual-plus载体在多克隆位点区域不插入启动子的情况下,转染真核细胞后的荧光素酶信号极低,具有低噪音的特点。
32、5、本发明提供了一套完整可行的基于pgl4.11-dual-plus载体的真核生物启动子活性检测、启动子snp分析、转录因子对启动子的调控研究中的检测方法。
- 还没有人留言评论。精彩留言会获得点赞!