一种用于检测小鼠DR5蛋白的抗体及其相关检测产品
本发明属于生物医学,具体地,本发明涉及一种用于检测小鼠dr5蛋白的抗体及其相关检测产品,更具体地,本发明涉及一种用于检测小鼠dr5蛋白的抗体6a11及其相关检测产品和用途。
背景技术:
1、近年来,随着生物医学不断地发展,抗体的应用也越来越广泛,不仅在临床和生物实验的检测工作中大显身手,还在疾病的治疗研究中崭露头角。基于单克隆抗体的几种衍生物:双特异性抗体、抗体-药物偶联物研发也正在蓬勃发展。检测方面,在基于抗原-抗体结合机制的常用免疫分析技术(免疫印迹法、酶联免疫吸附测定、免疫荧光、免疫组化、免疫沉淀等)中,抗体选择的合适与否直接影响了结果。治疗方面,相对于多克隆抗体,单克隆抗体表现出更强的特异性及更高的纯度。基于单克隆抗体的高特异性和单克隆抗体人源化技术的进步,越来越多的单克隆抗体在疾病的靶向治疗中发挥了重要的作用。
2、肿瘤坏死因子相关凋亡诱导配体(trail)作为肿瘤坏死因子超家族中的一员,其可在对正常细胞相对安全的情况下,选择性的诱导肿瘤细胞凋亡。人的trail受体共有5种,其中trail-r1(dr4)、trail-r2(dr5)胞内段均含有死亡结构域,通常被称为死亡受体。在众多trail受体中,dr5是最值得关注的,其高表达于肿瘤细胞,健康细胞表达较低甚至几乎不表达,且大多数临床中使用的化疗药物均可诱导dr5高表达,因此,dr5在trail诱导的肿瘤细胞凋亡中发挥主要作用。随着trail/dr5研究的不断深入,越来越多的研究表明trail/dr5通路与缺血/缺氧性疾病的诊断和治疗密切相关。
3、小鼠和人的trail-trail-r系统不尽相同,小鼠仅表达单一的mtrail-r,也称为mk,其胞内段也含有死亡结构域,与人类的dr4胞内死亡结构域有43%的同源性,与dr5胞内死亡结构域有49%的同源性。目前市面上抗体公司所制备的dr5单克隆抗体大多数以死亡结构域中的一段序列所制备的多肽作为免疫原,因物种之间trail-r死亡结构域的高度同源性,许多dr5抗体可同时用在人、大鼠、小鼠的免疫分析检测。以dr5胞外段作为免疫原制备单克隆抗体的例子有一些,但针对小鼠dr5胞外段抗体的应用场景较为局限,这一现象导致了缺乏特异性针对小鼠dr5胞外段的抗体来应用于western blot等免疫分析实验。
技术实现思路
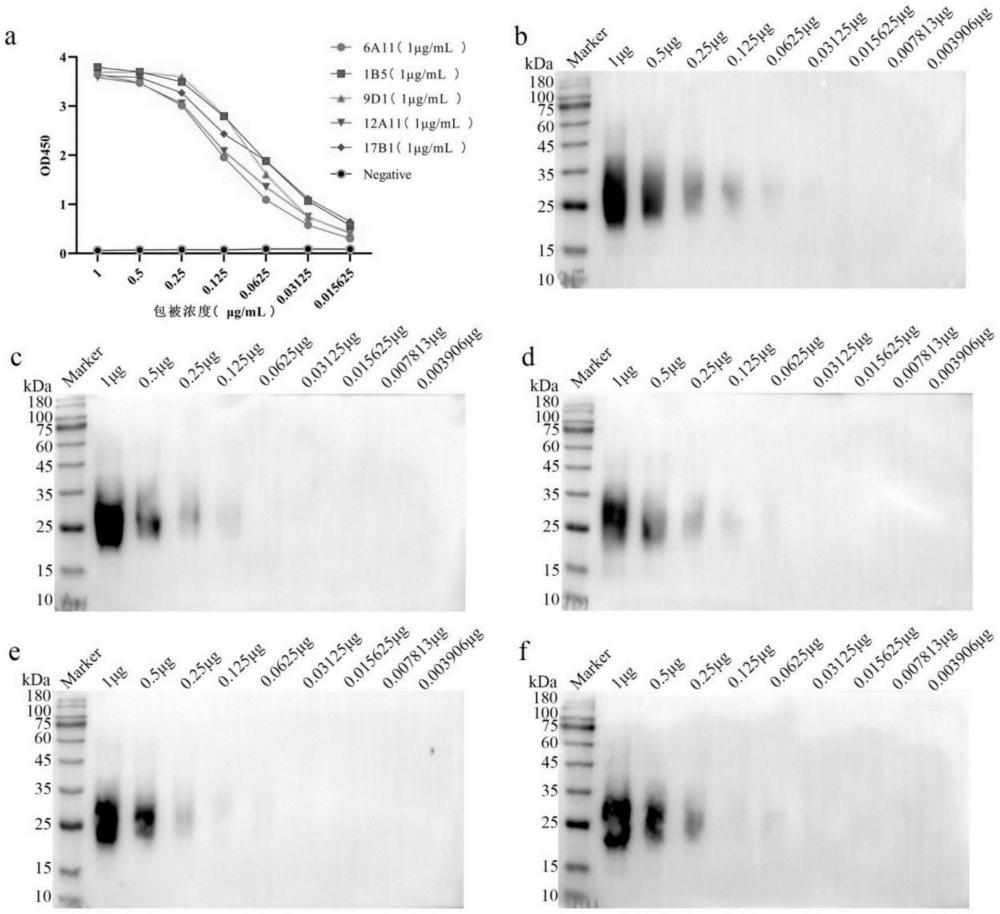
1、为了弥补本领域关于小鼠dr5胞外段相关抗体的技术空白,本发明通过分子克隆技术获得小鼠dr5胞外段基因,进一步通过蛋白表达与纯化获得了纯度较高的小鼠dr5胞外段蛋白(mdr5-his),以mdr5-his原核表达蛋白作为免疫抗原,通过与弗氏佐剂等比混合免疫wistar大鼠制备单克隆抗体。三次免疫后用mdr5-his真核表达蛋白及gst-mdr5原核表达蛋白进行效价检测及初步筛选,继而冲击免疫。冲击免疫后取大鼠脾脏分离脾细胞与小鼠sp2/0骨髓瘤细胞进行融合,经过筛选、亚克隆获得稳定分泌抗小鼠dr5单克隆抗体的杂交瘤细胞株。通过序列比对的方式初步鉴定单克隆抗体的类型。杂交瘤细胞扩大培养后收集上清,根据亚类结果选择合适的纯化方式从而对抗小鼠dr5单克隆抗体进行纯化。其中,抗小鼠dr5单克隆抗体6a11具有较强的特异性和亲和力,亲和力为nm级,此外,还具有较高的灵敏度,可应用于western blot、elisa、免疫荧光检测中。
2、本发明具体的技术方案如下:
3、首先,本发明提供了一种抗dr5的抗体。
4、进一步,所述抗体包含如seq id no:7所示的重链可变区中3个互补决定区hcdr1-3和如seq id no:15所示的轻链可变区中的3个互补决定区lcdr1-3。
5、进一步,当按照imgt编号方案对所述抗体cdrs进行定义时,所述抗体包含如下cdrs序列:
6、(i)重链可变区中3个互补决定区hcdr1-3分别如seq id no:1、seq id no:2、seqid no:3所示;
7、(ii)轻链可变区中的3个互补决定区lcdr1-3分别如seq id no:9、seq id no:10、seq id no:11所示。
8、进一步,当按照kabat编号方案对所述抗体cdrs进行定义时,所述抗体包含如下cdrs序列:
9、(i)重链可变区中3个互补决定区hcdr1-3分别如seq id no:4、seq id no:5、seqid no:6所示;
10、(ii)轻链可变区中的3个互补决定区lcdr1-3分别如seq id no:12、seq id no:13、seq id no:14所示。
11、进一步,所述抗体包含的重链可变区和轻链可变区的序列如下:
12、(a)所述重链可变区如seq id no:7所示,或与seq id no:7具有至少70%序列同一性;
13、(b)所述轻链可变区如seq id no:15所示,或与seq id no:15具有至少70%序列同一性。
14、在本发明中,对所述抗体的重链可变区和轻链可变区中的cdrs进行定义的编号方案并不局限于imgt编号方案、kabat编号方案,所述编号方案包括现有的编号方案和将来可能产生的新的编号方案。在一些实施方式中,所述编号方案包括但不限于:imgt编号方案、kabat编号方案、chothia编号方案、martin(增强型chothia)编号方案、abm编号方案、aho编号方案、contact编号方案中的任意一种或任意多种(两种或两种以上)组合,经上述编号方案或编号方案组合对本发明提供的抗体的重链可变区和轻链可变区中的cdrs进行定义得到的hcdr1-3、lcdr1-3序列均包含在本发明的保护范围内。
15、其次,本发明提供了一种编码如前所述抗体的多核苷酸;
16、优选地,编码所述抗体的重链可变区的多核苷酸序列如seq id no:8所示;
17、优选地,编码所述抗体的轻链可变区的多核苷酸序列如seq id no:16所示。
18、再次,本发明提供了一种包含如前所述多核苷酸的载体;
19、优选地,所述载体包括质粒、人工染色体、噬菌体、动物病毒;
20、更优选地,所述载体含有以下任意一种或多种控制表达的元件:启动子序列、转录起始序列、增强子序列、选择元件、报告基因、复制起始位点。
21、再次,本发明提供了一种包含如前所述载体的宿主细胞;
22、优选地,所述宿主细胞包括原核细胞、酵母细胞、昆虫细胞、哺乳动物细胞;
23、更优选地,所述宿主细胞为哺乳动物细胞;
24、最优选地,所述哺乳动物细胞包括hek293细胞、cho细胞、ns0细胞、sp2/0细胞、hela细胞、a549细胞、293t细胞、cos细胞、bhk细胞。
25、再次,本发明提供了一种检测dr5的试剂盒或药物组合物。
26、进一步,所述试剂盒包含如前所述的抗体;
27、优选地,所述抗体为标记抗体;
28、更优选地,所述标记抗体的标记物包括生物素、荧光染料、催化底物显色的酶、放射性同位素、化学发光试剂、纳米颗粒类标记物;
29、最优选地,所述荧光染料包括荧光素类染料及其衍生物、罗丹明类染料及其衍生物、cy系列染料及其衍生物、alexa系列染料及其衍生物、attotm系列染料、tye系列染料、量子点、蛋白类染料及其衍生物;
30、最优选地,所述催化底物显色的酶包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶、碳酸酐酶、乙酰胆碱酯酶、6-磷酸葡萄糖脱氧酶;
31、最优选地,所述放射性同位素包括212bi、131i、111in、90y、186re、211at、125i、188re、153sm、213bi、32p、94mtc、99mtc、203pb、67ga、68ga、43sc、47sc、110min、97ru、62cu、64cu、67cu、68cu、86y、88y、121sn、161tb、166ho、105rh、177lu、172lu、18f;
32、最优选地,所述化学发光试剂包括鲁米诺及其衍生物、光泽精、甲壳动物荧光素及其衍生物、联吡啶钌及其衍生物、吖啶酯及其衍生物、二氧环乙烷及其衍生物、洛粉碱及其衍生物、过氧草酸盐及其衍生物;
33、最优选地,所述纳米颗粒类标记物包括纳米颗粒、胶体、有机纳米颗粒、磁性纳米颗粒、量子点纳米颗粒、稀土络合物纳米颗粒;
34、最优选地,所述胶体包括胶体金属、分散型染料、染料标记的微球、染料标记的乳胶;
35、最优选地,所述胶体金属包括胶体金、胶体银、胶体硒;
36、优选地,所述药物组合物包含如前所述的抗体。
37、再次,本发明提供了如前所述的抗体、如前所述的多核苷酸、如前所述的载体和/或如前所述的宿主细胞在非诊断目的地检测dr5蛋白中的应用、在制备用于检测dr5蛋白的产品中的应用或在制备用于治疗dr5相关疾病的药物中的应用。
38、最后,本发明提供了如下任一种方法:
39、一种体外检测dr5蛋白的方法,所述方法包括如下步骤:将如前所述的抗体或如前所述的试剂盒与待测样品接触,检测dr5蛋白与所述抗体免疫复合物的形成。
40、一种诊断dr5相关疾病的方法,所述方法包括如下步骤:将受试者来源的待测样品与如前所述的抗体或如前所述的试剂盒接触,检测待测样品中dr5蛋白的存在或含量。
41、进一步,所述待测样品可以是来源于任何生物体的任何固体或流体样品,包括但不限于单细胞生物,例如细菌、酵母、原生动物和变形虫等,多细胞生物(例如植物或动物,所述动物包括人或者非人的其他动物)。更具体地,所述动物样品包括可以是从例如血液、血浆、血清、尿液、粪便、痰液、粘液、淋巴液、滑液、胆汁、腹水、胸腔积液、血清肿、唾液、脑脊液、水性或玻璃体液、或任何身体分泌物、渗出液或皮肤或粘膜表面的拭子。
42、一种治疗dr5相关疾病的方法,所述方法包括如下步骤:给有需要的受试者施用治疗有效量的本发明如前所述的药物组合物。
43、一种制备如前所述的宿主细胞的方法,所述方法包括如下步骤:将如前所述的载体导入到宿主细胞中得到如前所述的宿主细胞。
44、进一步,所述将载体导入到宿主细胞的操作可采用本领域技术人员已知的方法实现,例如电穿孔、lipofectine转染、lipofectamin转染等方法。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
- 还没有人留言评论。精彩留言会获得点赞!