作为PI3K-γ抑制剂的由叔羟基取代的缩合咪唑衍生物的制作方法
本发明提供调节磷酸肌醇3-激酶-γ(pi3kγ)的活性并适用于治疗与pi3kγ的活性相关的疾病的叔醇化合物,所述疾病包括例如自身免疫疾病、癌症、心血管疾病和神经退行性疾病。
背景技术:
1、磷酸肌醇3-激酶(pi3k)属于在肌醇环的d3位置上使磷酸肌醇磷酸化的脂质信号传导激酶大家族(cantley,science,2002,296(5573):1655-7)。pi3k根据其结构、调控和底物特异性分成三类(i、ii和iii类)。i类pi3k包括pi3kα、pi3kβ、pi3kγ和pi3kδ,都是双重特异性脂质和蛋白激酶的家族,其催化磷脂酰肌醇-4,5-二磷酸酯(pip2)的磷酸化,从而产生磷脂酰肌醇-3,4,5-三磷酸酯(pip3)。pip3充当控制许多细胞过程(包括生长、存活、黏附和迁移)的第二信使。所有四种i类pi3k同种型均以由催化亚单位(p110)和控制其表达、活化和亚细胞定位的紧密缔合的调控亚单位构成的异二聚体形式存在。pi3kα、pi3kβ和pi3kδ与被称为p85的调控亚单位缔合并且通过生长因子和细胞因子经由酪氨酸激酶依赖机制来活化(jimenez,等人,j biol chem.,2002,277(44):41556-62),而pi3kγ与两种调控亚单位(p101和p84)缔合并且其活化通过g蛋白偶合受体的活化来驱动(brock,等人,j cellbiol.,2003,160(1):89-99)。pi3kα和pi3kβ广泛表达。相反,pi3kγ和pi3kδ主要于白血球中表达(vanhaesebroeck等人,trends biochem sci.,2005,30(4):194-204)。
2、pi3kγ的表达主要局限于造血系统,但是其也可以较低水平在内皮、心脏和脑中检测到。小鼠中的pi3kγ基因敲除或激酶死亡敲除为正常且丰富的并且不表示任何明显的不良表型。在细胞水平上的分析指示,pi3kγ为嗜中性粒细胞中gpcr配体诱导的ptdins(3,4,5)p3产生、趋化性和呼吸爆发所需要的。pi3kγ缺失巨噬细胞和树突状细胞展现降低的朝向多种化学引诱剂的迁移。pi3kγ缺乏的t细胞显示受损的响应于抗cd3或con a刺激的细胞因子产生。在腺苷a3a受体下游起作用的pi3kγ对于通过fcεri与ige交联所诱导的肥大细胞的持续脱颗粒至关重要。pi3kγ也为嗜曙红细胞的存活所必需的(ruckle等人,nat.rev.drug discovery,2006,5,903-918)
3、已知其独特表达模式和细胞功能,pi3kγ在多种自身免疫和炎症疾病模型中的潜在作用已用遗传和药理学工具进行研究。在哮喘和过敏模型中,pi3kγ-/-小鼠或用pi3kγ抑制剂治疗的小鼠显示产生接触性超敏和延迟型超敏反应的能力欠缺。在这些模型中,pi3kγ显示对于将嗜中性粒细胞和嗜酸性粒细胞募集至呼吸道以及肥大细胞脱颗粒是重要的(参见例如laffargue等人,immunity,2002,16,441-451;prete等人,the embojournal,2004,23,3505-3515;pinho等人,l.leukocyte biology,2005,77,800-810;thomas等人,eur.j.immunol.2005,35,1283-1291;doukas等人,j.pharmacol.expther.2009,328,758-765)。
4、在两种不同的急性胰腺炎模型中,pi3kγ的遗传切除显著地降低腺细胞损伤/坏死和嗜中性粒细胞浸润的程度而不会对分离的胰腺泡的分泌功能产生任何影响(lupia等人,am.j.pathology,2004,165,2003-2011)。pi3kγ-/-小鼠主要在类风湿性关节炎的四种不同模型(cia、α-cii-ia、k/bxn血清转移和tnf转殖基因)中受到保护并且pi3kγ抑制作用抑制了cia和α-cii-ia模型中关节炎症和损坏的进展(参见例如camps等人,nat.medicine,2005,11,939-943;randis等人,eur.j.immunol,2008,38,1215-1224;hayer等人,fasb j.,2009,4288-4298)。在人类全身性红斑狼疮的mrl-lpr小鼠模型中,pi3kγ抑制作用减少了肾小球肾炎并且延长了寿命(barber等人,nat.medicine,2005,9,933-935)。
5、有证据表明,归因于骨髓源性细胞浸润的慢性炎症为神经退化疾病诸如阿尔茨海默氏病(alzheimer's disease,ad)的进展中的关键组分(giri等人,am.j.physiol.cellphysiol.,2005,289,c264-c276;el khoury等人,nat.med.,2007,13,432-438)。与此建议相符,在ad小鼠模型中,pi3kγ抑制作用显示减弱海马中活化的星形细胞和小神经胶质细胞的aβ(1-40)诱导的聚集并且预防肽诱导的认知缺陷和突触功能障碍(passos等人,brainbehav.immun.2010,24,493-501)。pi3kγ缺乏或抑制作用也显示延迟小鼠(人类多发性硬化症的小鼠模型,所述疾病为神经退化疾病的另一形式)中实验性自身免疫脑脊髓炎的发作并且缓解症状(参见例如rodrigues等人,j.neuroimmunol.2010,222,90-94;berod等人,euro.j.immunol.2011,41,833-844;comerford等人,plos one,2012,7,e45095;li等人,neuroscience,2013,253,89-99)。
6、慢性炎症已正式地被承认为多种不同类型的癌症的标志之一。因此,选择性抗炎药物表示一类新颖抗癌疗法(hanahan和weinberg,cell,2011,144,646-674)。由于据报告pi3kγ介导多种炎症过程,也已研究其作为免疫肿瘤学靶标的作用。最新研究报告了pi3kγ缺乏会抑制肺癌、胰腺癌和黑色素瘤的同基因模型中的肿瘤生长(llc、pan02和b16)。pi3kγ缺乏或抑制作用也抑制自发性乳腺癌模型中的肿瘤生长(schmid等人,cancercell,2011,19,715-727)。进一步研究报告了pi3kγ缺乏可能改善患有结肠炎相关结肠癌的小鼠中的炎症和肿瘤生长(gonzalez-garcia等人,gastroenterology,2010,138,1373-1384)。详细机制分析指示了cd11b+骨髓细胞的肿瘤浸润可在肿瘤位点处引起原致癌性炎症并且骨髓细胞中的pi3kγ在介导多种化学引诱剂将细胞运送至肿瘤的信号传导方面至关重要(schmid等人,cancer cell,2011,19,715-727)。其他研究表明pi3kγ也为原生骨髓细胞在肿瘤位点处分化为m2巨噬细胞所需要的。m2巨噬细胞通过分泌免疫抑制因子如精氨酸酶1来促进肿瘤生长和进展,所述精氨酸酶1消耗肿瘤微环境的精氨酸,从而促进t细胞死亡和nk细胞抑制(schmidt等人,cancer res.2012,72(suppl 1:abstract,411;kaneda等人,cancer res.,74(suppl 19:abstact 3650))。
7、除了其促进原致癌性微环境的潜在作用以外,pi3kγ也可在癌细胞中发挥直接作用。据报告pi3kγ在肉瘤的小鼠模型中为卡波西肉瘤(kaposi’s sarcoma)相关疱疹病毒编码的vgpcr致癌基因和肿瘤生长的信号传导所需要的(martin等人,cancer cell,2011,19,805-813)。也表明pi3kγ为t-all(subramanjam等人,cancer cell,2012,21,459-472)、pdac和hcc细胞(falasca and maffucci,frontiers in physiology,2014,5,1-10)的生长所需要的。此外,在胰腺癌中的驱动突变的调查中,发现pi3kγ基因含有在先前未被鉴别为胰腺癌中的驱动基因的基因集合中的第二高评分预测驱动突变(r839c)(carter等人,cancer biol.ther.2010,10,582-587)。
8、最后,也已报告pi3kγ缺乏对不同心血管疾病模型中的实验性动物提供保护。例如,pi3kγ缺乏将减少血管紧张素引发的平滑肌收缩并且因此保护小鼠免于血管紧张素诱发的高血压(vecchione等人,j.exp.med.2005,201,1217-1228)。在严格动物心肌梗塞模型中,pi3kγ抑制作用会提供有效心脏保护,从而减少梗塞发展并保留心肌功能(doukas等人,proc.natl.acad.sci.usa,2006,103,19866-19871)。
9、出于这些原因,需要开发可用于治疗诸如癌症、自身免疫病症以及炎症和心脏病的疾病的新型pi3kγ抑制剂。本技术涉及此需要和其他需要。
技术实现思路
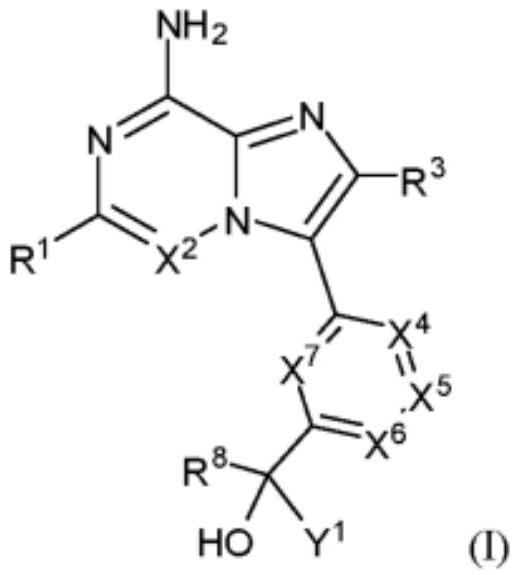
1、本发明尤其涉及式(i)化合物:
2、
3、或其药学上可接受的盐;其中本文定义组成成员。
4、本发明进一步提供包含式(i)化合物或其药学上可接受的盐和药学上可接受的载剂的药物组合物。
5、本发明进一步提供抑制pi3kγ激酶活性的方法,所述方法包括使所述激酶与式(i)化合物或其药学上可接受的盐接触。
6、本发明进一步提供治疗患者的与pi3kγ激酶表达或活性异常相关的疾病或病症的方法,所述方法通过向患者施用治疗有效量的式(i)化合物或其药学上可接受的盐来进行。
7、本发明进一步提供用于本文所述的任何方法中的式(i)化合物或其药学上可接受的盐。
8、本发明进一步提供式(i)化合物或其药学上可接受的盐用于制备用于本文所述的任何方法中的药剂的用途。
- 还没有人留言评论。精彩留言会获得点赞!