一种肠道样本预处理和两步法制备单细胞悬液的方法及其应用与流程
本发明属于细胞分子生物领域,涉及一种优化的肠道样本预处理和两步法解离制备单细胞悬液的方法及其应用。
背景技术:
1、肠道既是人体重要的消化器官,也是人体最大的免疫器官。肠壁分为黏膜层、黏膜下层、肌层和浆膜四层。黏膜层是最靠近管腔的一层,由上皮、固有层和黏膜肌层组成。肠道上皮细胞可分为6种分化的细胞谱系,包括肠细胞、m细胞、杯状细胞、潘氏细胞、tuft细胞和肠内分泌细胞,这些细胞各有不同的功能。肠道有人体最大的免疫细胞群体,与多种疾病息息相关。肠道主要免疫细胞是肠上皮内淋巴细胞和固有层淋巴细胞。肠上皮内淋巴细胞是机体内最大的淋巴细胞群,约90%是cd3+t细胞,其中一半为cd3+cd8+t细胞,可通过fas受体诱导细胞凋亡来清除入侵病原,并分泌细胞因子调节肠道上皮细胞和固有层淋巴细胞功能。另外,肠道上皮细胞还具有促进t细胞存活、巡逻和保护宿主的机制。固有层白细胞主要包括树突细胞、分泌iga的浆细胞、t细胞和固有淋巴样细胞(ilc)等。此外,粘膜肌层的平滑肌和分布在黏膜下层的肠壁神经丛也是一些研究者关注的组织类型。
2、与传统bulk测序相比,单细胞测序可以有效解决组织间异质性问题,并有助于发现新的稀有细胞类型。经过近几年的高速发展,单细胞测序逐渐成为医学和生物学研究中常用的研究手段,已广泛应用于人和小鼠的不同器官、不同组织的多种疾病研究中。高通量单细胞测序技术的实现有赖于高质量单细胞悬液的制备。肠道(尤其是结直肠)是人类炎症和癌症等疾病易发部位,也是免疫微环境等多因子研究的重要组织部位,是包括人、小鼠、大鼠、昆虫、鱼类等多物种在内的单细胞转录组测序、单细胞微生物组学中经常被关注和研究的样本类型。虽然目前已经有公开的肠道样本解离方法,也有多篇肠道样本相关的单细胞测序文章,但实际进行肠道样本解离时,仍存在多种因素限制了这类样本的解离成功率和数据质量。首先,肠道中有些细胞类型比较脆弱(如上皮细胞、中性粒细胞等),如果研究者关注这些细胞类型,一般要求将采集的新鲜肠道样本立刻进行解离,而有些样本,尤其是人的手术样本,受手术时间和实验场地限制,往往需要采集后先在组织保护液中保存数小时甚至更长时间才能进行解离,导致了较严重的解离偏好性,比如单细胞数据中免疫细胞占了很大比例,而上皮细胞和中性粒细胞几乎检测不到。其次,由于肠道内共生许多微生物菌群,代谢相对旺盛,在组织保护液中较长时间的保存(超过2h)往往导致一些细胞中线粒体基因表达过高,严重影响单细胞数据质量和后续数据分析的可靠性。第三,采用其他的组织保存方式,如用细胞冻存液梯度冻存或再复苏解离或者液氮速冻后抽提细胞核,结果往往也不理想。
3、将新鲜采集的样本立即进行组织固定使细胞内生物大分子维持采集时所处的状态,可以有效避免以上问题的发生。但常用的组织固定液如福尔马林或多聚甲醛会导致细胞中rna降解,无法采用基于polya捕获的单细胞转录组测序平台,如10x genomicschromium、bd rhapsody、mobinova等;醇类(如甲醇、乙醇)固定不会导致rna降解,但易导致样本问题(乙醇固定的样本偏硬易皱缩)或捕获上的偏好性(甲醇固定的样本中高gc含量的基因检出偏少)。dsp(thermo scientific,lot#22585)是一种同型双功能n-羟基琥珀酰亚胺酯(nhs酯)交联剂,具有硫醇可切割性和伯胺反应性,适用于多种应用,如免疫沉淀chip。dsp在8个碳原子间隔臂的每端有一个胺反应性nhs酯。nhs酯在ph值7–9的条件下与伯胺反应可形成稳定的酰胺键,并释放n-羟基琥珀酰亚胺。dsp可穿透细胞膜进行胞内的蛋白交联而不破坏rna。37℃条件下,用10-50mm dtt可以切割间隔臂中的二硫键而使蛋白解交联。dtt是一种还原剂,在单细胞测序反转录体系中被用于抑制rnase作用,防止rna降解。
技术实现思路
1、针对现有技术存在的不足,本发明提供了一种样本固定的肠道样本预处理方式和优化的解离结肠组织、获得高细胞活率和丰富细胞类型的用于单细胞测序的单细胞悬液制备方法及应用。
2、本发明中,将dsp用于肠道样本采集后立即固定以保持细胞内核酸和蛋白的分子状态,并利用单细胞测序的反转录体系中的dtt对dsp形成的二硫键进行切割从而解除蛋白分子之间的交联作用,mrna的反转录不受影响。另外,在已有的肠道样本两步法解离的基础上,对解离实验体系(酶的组合)和流程进行了优化,将解离时间控制在2.5h以内,并能够获得稳定且细胞类型丰富的解离结果。
3、本发明提出的样本固定的肠道样本预处理方式和两步法肠道组织单细胞悬液制备方法,首先将采集并清洗好的肠道组织用含二硫双(琥珀酰亚胺丙酸酯)(dsp)的pbs固定交联后保存于美天旎组织保护液(miltenyi,130-100-008)中,肠道组织细胞内核酸和蛋白的分子状态被固定,固定条件为室温固定20-40min;加入tris-hcl ph 7.5停止固定,清洗组织并转移,2-8℃保存并于48h内解离。组织解离采用两步法,先用含edta的消化液i消化,使上皮层与固有层分离开;将固有层组织剪碎并用含有弹性蛋白酶、胶原酶、dnase i的消化液ii消化;在固有层消化期间,用tryple处理上皮层细胞;然后将得到的上皮层细胞和固有层细胞分别进行红细胞裂解和细胞清洗后,进行镜检计数和特定细胞比例混合上机。
4、所述消化液i为含有edta(乙二胺四乙酸二钠)的消化液,其包括但不限于作为溶剂的hank's平衡盐溶液(hbss)、8-15mm edta、8-12mm hepes、1-10%(w/v)fbs。优选地,edta的浓度为10mm,hepes的浓度为10mm,fbs的浓度为2%(w/v)。
5、所述消化液ii为含有弹性蛋白酶、胶原酶、脱氧核糖核苷酸酶i(dnase i)的消化液,其包括但不限于dmem培养基、0.02%-0.2%弹性蛋白酶、0.1%-0.3%胶原酶ii和0.1%-0.3%胶原酶iv、20-50u/mldnase i。优选地,弹性蛋白酶的浓度为0.1%,胶原酶ii的浓度为0.2%,胶原酶iv的浓度为0.2%,dnase i的浓度为30u/ml。此处的百分比均表示质量体积比(w/v);所述消化液ii中的脱氧核糖核苷酸酶i的作用是降解死亡破裂细胞释放出来的dna,减少细胞结团,提供细胞悬液质量,是单细胞解离中的常用试剂。
6、具体地,消化液i的消化条件为37℃、22rpm,所述消化液i消化时间为15-30min。优选地,消化20min。
7、具体地,消化液ii的消化条件为37℃、22rpm,所述消化液ii消化时间为25-45min。优选地,消化30min。
8、优选地,用tryple(thermofisher,lot#12604013)对消化液i解离得到的上皮细胞层进一步消化10-15min;优选地,消化15min。
9、本发明提出的方法,通过用dsp进行样本固定预处理提高了肠道样本中脆弱细胞类型的稳定性并减少了胁迫诱导的线粒体基因过表达,并且通过优化消化体系和实验流程,实现了在约2.5小时内完成对肠道样本的两步法温和解离。dsp是一种硫醇可裂解、同型双功能和胺反应性交联剂,可以对细胞内的核酸与蛋白进行交联,使细胞维持在固定交联的状态,并且不会损伤rna。因此,肠道样本先用dsp固定可以减少脆弱细胞类型在组织保护液中保存期间的凋亡及相应线粒体基因过表达,从而提高样本的稳定性。在上皮层解离中,首先用edta消化将上皮细胞和隐窝从组织上剥离下来,再利用tryple进行10-15min处理,使未完全分散开的隐窝细胞团解离成单细胞。相较于以往方法,本发明方法可以在约2.5h内使用更温和的实验条件获得更丰富的细胞类型。在固有层解离中,采用弹性蛋白酶和胶原酶组合的酶解体系代替了以往报道中仅用胶原酶解离的方式。与常规仅有一种或两种胶原酶相比,弹性蛋白酶可以水解弹性蛋白从而破坏组织的紧密连接,更利于组织中血管、肌层等细胞的释放。分别解离的上皮层细胞和固有层细胞分别进行镜检计数,然后根据研究目的按照特定比例进行细胞混合上机。
10、本发明首次创新提出,将新鲜采集的肠道样本用dsp固定交联后再放入组织保护液中保存或运输,于48h内进行组织解离,并利用单细胞测序平台的反转录体系中都包含的dtt对dsp交联的蛋白进行解交联,无需额外特殊处理。并首次创新提出,上皮层与固有层分步解离时间的优化,固有层细胞解离方法,以及上皮层与固有层细胞可按特定比例混合上机。本发明所述“两步法”是指:一层含义是指上皮层与固有层分开为两个步骤分别进行解离;另一层含义是指上皮层解离分为edta处理和trple消化两个步骤。
11、具体地,本发明提出的样本预处理和两步法肠道组织单细胞悬液制备方法,包括但不限于以下步骤:样本采集、样本固定、样本放入组织保存液、上皮细胞解离、固有层细胞解离、上皮细胞继续消化、镜检计数、最终重悬和细胞混合上机等步骤。
12、所述方法中,用dsp(二硫双(琥珀酰亚胺丙酸酯))固定新鲜采集的肠道样本后再放入美天旎组织保护液保存。其中dsp的浓度范围为0.5-1.5mg/ml。优选地,为1mg/ml。
13、所述方法中,用dsp固定新鲜采集的肠道样本放入美天旎组织保护液中保存的时间范围为≤48h。保存的温度范围为2-8℃,优选地,为4℃。
14、所述方法中,用edta(乙二胺四乙酸)消化将上皮细胞和隐窝从组织上剥离下来,再利用tryple(一种温和的、非动物源性重组酶,gibco,lot#a1217702)进行10-15min处理,使未完全分散开的隐窝细胞团解离成单细胞;优选地,所述处理时间为15min。
15、所述方法中,在固有层解离中采用包含弹性蛋白酶与胶原酶组合的消化液ii;所述胶原酶包括胶原酶ii和胶原酶iv。其中,所述弹性蛋白酶、胶原酶ii、胶原酶iv的含量(w/v)范围为0.02%-0.2%、0.1%-0.3%、0.1%-0.3%。优选地,所述弹性蛋白酶、胶原酶ii、胶原酶iv的含量(w/v)分别为0.1%、0.2%、0.2%。
16、本发明中,所述“弹性蛋白酶”是从猪胰腺中提取制备的一种广泛特异性的丝氨酸蛋白酶,可切割小的疏水性氨基酸的羧基侧的蛋白质,可水解弹性蛋白并消化血红蛋白、酪蛋白和纤维蛋白。
17、本发明中所述“胶原酶ii”和“胶原酶iv”是从溶组织梭状细胞芽孢杆菌提取制备的胶原蛋白水解酶的两种同工酶形式,主要水解结缔组织中胶原蛋白成分。
18、本发明方法中,控制一个样本的解离在≤2.5h内完成。优选地,为2-2.5h。更优选地,为2h。具体实施方案中,本发明通过优化消化酶类型和实验流程,实现了在2.5小时内完成对肠道样本的两步法温和解离。
19、本发明中,在上皮层解离中,首先用edta消化将上皮细胞和隐窝从组织上剥离下来,再利用tryple进行短时间处理,使未完全分散开的隐窝细胞团解离成单细胞。相较于以往方法,本发明的处理方法可以在较短时间内使用更温和的实验条件获得更丰富的细胞类型。在固有层解离中,采用弹性蛋白酶与胶原酶组合代替了以往报道中仅用胶原酶解离的方式。与常规仅有一种或两种胶原酶相比,弹性蛋白酶与胶原酶组合更利于组织中各种细胞类型的释放,同时也有利于实验室建立针对不同物种的更稳定、更通用的单细胞悬液制备体系。
20、本发明所述方法获得的单细胞悬液的细胞活率>80%。优选地,为≥85%。更优选地,为≥90%。
21、本发明还提出了所述方法在包括但不限于单细胞测序、单细胞悬液制备、肠道原代细胞解离、单细胞流式分析或分选、肠道原代细胞培养等方面中的应用。
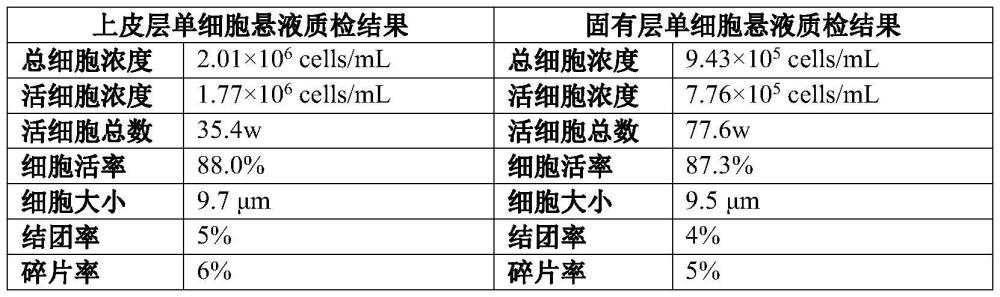
22、在一具体实施方案中,本发明优化的方法,包括如下具体步骤:
23、(1)样本采集:新鲜采集的肠道组织放入冰上预冷的培养皿中,清除肠道内容物并用剪刀纵向剖开,用冰上预冷的1×pbs彻底清洗3次,每次3ml。
24、(2)样本固定与保存:用剪刀将清洗干净的肠道样本剪成约1cm长、2mm宽的细条,放入500μl含有1mg/mldsp的1×pbs(gibco,lot#10010023)中,室温固定30min。加入10μl的1m tris-hcl ph 7.5(invitrogen,lot#15567027),停止固定。吸去上清,用1×pbs清洗一次后,将组织转移并浸没到装有组织保护液的离心管中,4℃保存或运输时间不超过48h。
25、(3)上皮细胞解离:将肠道组织取出至冰上预冷的小培养皿中,用3ml冰上预冷的1×pbs再清洗1次。将组织转移至15ml离心管,加入9ml消化液i。消化液i的配方为:hbss(gibco,lot#14025092)+10mm edta(invitrogen,lot#am9260g)+10mm hepes(4-羟乙基哌嗪乙磺酸,solarbio,lot#h8090)+2%fbs(胎牛血清,gibco,lot#a3160901),杂交炉内37℃、22rpm消化15min。手持离心管,上下用力振荡15次(可见上清混浊),立即冰上静置10min。取出离心管轻柔摇晃混匀,再冰上静置10s,将上清转移至新的15ml管。底部剩余组织用3ml hbss清洗并将上清转移至同一15ml管,放置冰上。
26、(4)固有层细胞解离:离心管底部剩余组织小心转移到新的5ml离心管中,用冰上预冷的1×pbs清洗一次,用无菌剪刀剪碎至乳糜状,转移到15ml离心管中。加入5ml消化液ii,杂交炉内37℃、22rpm消化30min。消化液ii配方为:dmem(gibco,lot#21068028),0.1%(w/v)弹性蛋白酶(sigma,lot#e7885),0.2%(w/v)胶原酶ii(gibco,lot#17101015),0.2%(w/v)胶原酶iv(gibco,lot#17104019)和30u/mldnase i(thermo scientific,lot#90083)。消化结束后过40μm细胞筛,4℃、400g离心10min。细胞沉淀加入2ml红细胞裂解液(美天旎,lot#130-094-183)重悬,冰上静置3min。4℃、500g离心5min。细胞沉淀用1mldmem+0.04%bsa(macs,lot#130-091-376)重悬,放置冰上。
27、(5)上皮细胞继续消化:固有层细胞酶解消化30min期间,将(3)获得的上皮细胞4℃、400g离心7min,用3ml 1x tryple(thermofisher,lot#12604013)重悬后,37℃孵育15min,然后用1ml枪头轻轻吸打混匀。加入hbss+2%fbs至总体积8ml,4℃、400g离心7min。细胞沉淀用2ml红细胞裂解液重悬,冰上静置3min。4℃、400g离心7min。细胞沉淀用1ml消化液i重悬,放置冰上。
28、(6)镜检计数:将(4)得到的固有层细胞和(5)得到的上皮细胞分别用吖啶橙ao/碘化丙啶pi染色后,用荧光细胞计数仪进行镜检计数和细胞活率等检测。
29、(7)最终重悬和细胞混合上机:将(4)得到的固有层细胞和(5)得到的上皮细胞分别4℃、400g离心7min。细胞沉淀分别用200μl dmem+0.04%bsa重悬,镜检计数并将浓度调整到10xgenomics单细胞上机所需的浓度(700-1200cells/μl)。然后,根据实验需要将上皮细胞与固有层细胞按照1:1或其他实验要求比例混合,用于10x单细胞上机。
30、与现有技术相比,本发明的优势及有益效果包括:
31、本发明将新鲜采集的样本先用dsp固定后再放入组织保护液中保存48h以内,dsp可穿透细胞膜进行胞内的蛋白交联而不破坏rna,可以使细胞内核酸和蛋白的分子保持在采集时的稳定状态,不会因保存或解离期间的胁迫诱导引起一些脆弱细胞的死亡和部分细胞内线粒体基因的高表达。同时利用单细胞测序反转录体系中的dtt对dsp形成的二硫键进行切割以解除交联作用,无需额外的复杂解交联处理,也不影响mrna的反转录。
32、本发明采用将结肠上皮层与固有层分别进行解离,并在时间上穿插安排,控制一个样本的解离可以在较短的时间内(≤2.5h)完成,既确保了所获得的单细胞悬液能保持较高的细胞活率(>80%),又可以根据实验需要,将上皮层细胞和固有层细胞按照特定的比例进行混合上机测序,弥补了以往单一酶解体系造成的特定细胞类型的细胞数过少或丢失的缺点。
33、本发明在上皮层解离中,首先用edta消化将上皮细胞和隐窝从组织上剥离下来,再利用tryple进行短时间处理,使未完全分散开的隐窝细胞团解离成单细胞。相较于以往仅用edta消化或用edta加胰酶消化,tryple是一种非动物源性重组酶,可以直接替代胰酶使用,并且因其纯度高于胰蛋白酶提取物,从而减少了对细胞可能造成的伤害。本发明的处理方法可以在较短时间内使用更温和的实验条件获得更丰富的细胞类型(如隐窝中的干细胞、祖细胞等)。
34、本发明在固有层解离中,采用弹性蛋白酶与胶原酶的组合代替了以往报道中仅用胶原酶解离的方式。相较于胶原酶仅作用于胶原蛋白的水解,弹性蛋白酶更利于组织中血管、肌层等细胞的释放,因此采用弹性蛋白酶与胶原酶组合更利于组织样本中各种类型细胞的释放,同时也有利于实验室建立适用于不同物种的更稳定、更通用的肠道样本单细胞悬液制备体系。
35、本发明提供的两步法肠道组织单细胞悬液制备方法,即一种优化的两步法肠道组织单细胞悬液制备方法,通过优化消化酶类型和实验流程,实现了在2.5小时内完成对肠道样本的两步法温和解离,分别获得高质量的单细胞悬液,然后可以根据研究目的将上皮层细胞和固有层细胞按照特定比例进行混合用于单细胞测序,弥补了以往单一消化酶解离造成的细胞类型偏好性或两步法实验流程过于复杂的缺点。本发明提供的方法可应用于包括但不限于单细胞测序、单细胞悬液制备、肠道原代细胞解离、单细胞流式分析或分选、肠道原代细胞培养等方面。
- 还没有人留言评论。精彩留言会获得点赞!