一种HIV-1衣壳抑制剂中间体及其合成方法与流程
本发明涉及一种hiv-1衣壳抑制剂中间体及其合成方法,属于药物中间体合成。
背景技术:
1、n-boc-3-哌嗪酮作为一种重要的化工或医药中间体被广泛应用,例如:苯丙氨酸衍生物新型hiv-1衣壳抑制剂。
2、由于衣壳对病毒是至关重要的,而编码它的rna相当稳定,破坏衣壳能够给艾滋病毒带来致命的打击。
3、2h-吡嗪酮[1,2-c]嘧啶作为hiv整合酶的抑制剂,通过干扰病毒生命周期的多个重要环节来抑制hiv-1复制,而且不会迅速出现耐药性风险,因此,能够用于治疗接受过多次治疗的多药耐药(mdr)hiv患者,即医疗需求未得到满足的患者人群。此外,目前还正在研究该类药物用于治疗hiv以及用于暴露前预防(prep),但是,目前该类药物的合成工艺存在以下缺陷:
4、两步合成工艺,处理繁琐,特别是在关完环后生成1,4-哌嗪-2酮乙醇溶液需要浓缩后加10倍体积水稀释,水相用20倍体积二氯甲烷萃取三次。由于1,4-哌嗪-2酮乙醇具有较好的水溶性,导致需要使用大量的萃取剂,而产品回收率偏低,一般小于等于70%。
5、因此,本技术提出一种hiv-1衣壳抑制剂中间体及其合成方法。
技术实现思路
1、本发明的目的在于克服现有技术中的不足,提供一种hiv-1衣壳抑制剂中间体及其合成方法,能够直接利用关环反应的产物进行boc保护反应,缩短了工艺周期,节约合成成本。
2、为达到上述目的,本发明是采用下述技术方案实现的:
3、一方面,本发明提供一种hiv-1衣壳抑制剂中间体的合成方法,包括:
4、采用串联法,以氯代乙酸乙酯和1,2-乙二胺为原料在碱性条件下进行关环反应生成哌嗪-2-酮溶液,并直接利用关环反应的产物哌嗪-2-酮溶液进行boc保护反应,获得hiv-1衣壳抑制剂中间体n-boc-3-哌嗪酮。
5、进一步的,所述关环反应包括:
6、将氯代乙酸乙酯加入机溶剂ⅰ中;
7、在氮气保护下,控制反应液温度体系内温为20~25℃,并将1,2-乙二胺加入反应液中,控制反应液温度体系内温为0~5℃,并在预设时间内将乙醇钠的乙醇溶液匀速滴加入反应液中,控制反应液温度体系内温为20~25℃,并搅拌反应,过滤,获得哌嗪-2-酮溶液。
8、进一步的,所述关环反应中:
9、所述预设时间为2h;
10、在一些优选的实施例中,所述有机溶剂ⅰ选自醇类;
11、在一些优选的实施例中,所述搅拌反应时间为16~20小时;
12、在一些优选的实施例中,所述氯代乙酸乙酯质量标准大于95~98%;
13、在一些优选的实施例中,所述氯代乙酸乙酯和机溶剂ⅰ的重量比为1:(5~10);
14、在一些优选的实施例中,所述1,2-乙二胺质量标准大于95~99%;
15、在一些优选的实施例中,所述氯代乙酸乙酯和1,2-乙二胺摩尔比为1:
16、(1~3);
17、在一些优选的实施例中,所述乙醇钠的乙醇溶液为10~20wt%的乙醇钠的乙醇溶液;
18、在一些优选的实施例中,所述氯代乙酸乙酯和乙醇钠的乙醇的摩尔比为1:(1~3)。
19、进一步的,所述关环反应中:
20、所述有机溶剂ⅰ选自甲醇、乙醇、异丙醇、丙醇中的一种或几种;
21、在一些优选的实施例中,所述有机溶剂ⅰ为乙醇;
22、在一些优选的实施例中,所述搅拌反应时间为16小时;
23、在一些优选的实施例中,所述氯代乙酸乙酯质量标准大于98%;
24、在一些优选的实施例中,所述氯代乙酸乙酯和机溶剂ⅰ的重量比为1:8;
25、在一些优选的实施例中,所述1,2-乙二胺质量标准大于98%;
26、在一些优选的实施例中,所述氯代乙酸乙酯和1,2-乙二胺摩尔比为1:1;
27、在一些优选的实施例中,所述乙醇钠的乙醇溶液为20wt%的乙醇钠的乙醇溶液;
28、在一些优选的实施例中,所述氯代乙酸乙酯和乙醇钠的乙醇的摩尔比为1:1。
29、进一步的,所述boc保护反应包括:
30、将二叔丁基二碳酸酯加入关环反应的产物哌嗪-2-酮溶液中后,将三乙胺和dmap滴加入反应液中;
31、控制反应液体系内温为20~25℃,搅拌反应,获得n-boc-3-哌嗪酮的乙醇溶液。
32、进一步的,所述boc保护反应中:
33、所述搅拌反应时间为16-20小时
34、在一些优选的实施例中,所述氯代乙酸乙酯和二叔丁基二碳酸酯的摩尔比为1:(1.5~2);
35、在一些优选的实施例中,所述氯代乙酸乙酯和三乙胺的摩尔比为1:
36、(1.5~3);
37、在一些优选的实施例中,所述氯代乙酸乙酯和dmap的摩尔比为1:
38、(0.1~0.2)。
39、进一步的,所述boc保护反应中:
40、所述搅拌反应时间为16小时;
41、在一些优选的实施例中,所述氯代乙酸乙酯和二叔丁基二碳酸酯的摩尔比为1:1.5;
42、在一些优选的实施例中,所述氯代乙酸乙酯和三乙胺的摩尔比为1:1.5;
43、在一些优选的实施例中,所述氯代乙酸乙酯和dmap的摩尔比为1:0.1。
44、进一步的,在boc保护反应后还包括后处理过程;
45、所述后处理过程包括:
46、浓缩除去boc保护反应的产物n-boc-3-哌嗪酮的乙醇溶液中大部分乙醇后,经去离子水稀释、乙酸乙酯萃取、稀盐酸洗涤、碳酸氢钠溶液洗涤、脱溶、乙酸乙酯和庚烷体系结晶处理,获得hiv-1衣壳抑制剂中间体n-boc-3-哌嗪酮。
47、进一步的,在后处理过程中:
48、除去n-boc-3-哌嗪酮的乙醇溶液中70~90%的乙醇;
49、在一些优选的实施例中,所述去离子水与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为(5~10):1;
50、在一些优选的实施例中,所述乙酸乙酯与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为(10~20):1;
51、在一些优选的实施例中,所述稀盐酸浓度为0.3~0.9mol/l;
52、在一些优选的实施例中,所述稀盐酸浓度与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为(5~10):1;
53、在一些优选的实施例中,所述碳酸氢钠溶液为3~5wt%的碳酸氢钠溶液;
54、在一些优选的实施例中,所述碳酸氢钠溶液与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为(5~10):1。
55、进一步的,在后处理过程中:
56、除去n-boc-3-哌嗪酮的乙醇溶液中70~90%的乙醇;
57、在一些优选的实施例中,所述去离子水与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为10:1;
58、在一些优选的实施例中,所述乙酸乙酯与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为(10~20):1;
59、在一些优选的实施例中,所述去离子水与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为10:1;
60、在一些优选的实施例中,所述稀盐酸浓度为0.3mol/l;
61、在一些优选的实施例中,所述稀盐酸浓度与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为5:1;
62、在一些优选的实施例中,所述碳酸氢钠溶液为5wt%的碳酸氢钠溶液;
63、在一些优选的实施例中,所述碳酸氢钠溶液与浓缩后的n-boc-3-哌嗪酮的乙醇溶液的体积比为5:1。
64、另一方面,本发明提供一种hiv-1衣壳抑制剂中间体,根据上述的hiv-1衣壳抑制剂中间体的合成方法合成;
65、所述hiv-1衣壳抑制剂中间体为n-boc-3-哌嗪酮。
66、与现有技术相比,本发明所达到的有益效果:
67、本发明的合成工艺的原料简单容易获得,没有需要申请备案的原料药,易于推广使用。
68、本发明的合成工艺制备成本低廉,不需要大型设备或者特定的定制设备。
69、本发明的合成工艺反应条件温和安全,不需要超高温和超低温的反应条件,过程相对安全,既没有有毒有害的副产品生成,也无高毒和高沸中间体产生。
70、本发明通过串联法将关环反应和boc保护反应串联,使得行boc保护反应能够直接将关环反应的产物作为反应原料,实现两步合成n-boc-3-哌嗪酮的工艺技术,既避免了水溶性物料1,4-哌嗪-2酮的萃取后处理工艺,又减少了中间纯化处理的过程,缩短了工艺周期,节约了合成成本。
71、本技术利用乙酸乙酯萃取n-boc-3-哌嗪酮的乙醇溶液,随后用乙酸乙酯-庚烷体系结晶,能够提高目标产物的纯度,松散性状,均一性,利于工业化生产。
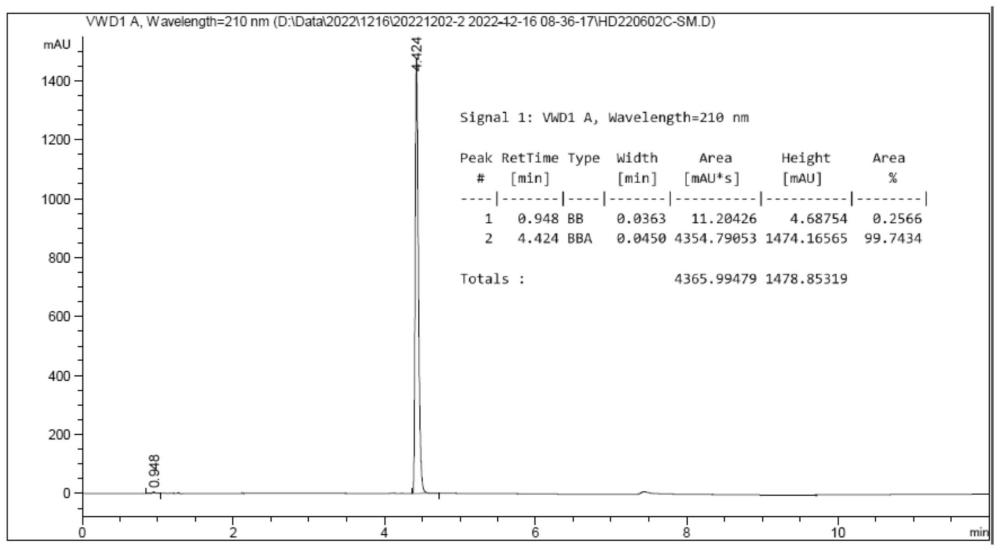
72、本技术合成方法获得的目标产物n-boc-3-哌嗪酮的化学纯度纯高达99%,收率高达90%。
- 还没有人留言评论。精彩留言会获得点赞!