配体化合物、有机铬化合物及包含其的催化剂组合物的制作方法
本发明涉及配体化合物、有机铬化合物、包含该有机铬化合物的催化剂组合物,以及使用其低聚乙烯的方法。
背景技术:
1、如1-己烯和1-辛烯的直链α-烯烃被用作清洁剂,润滑剂,增塑剂等,特别地,其主要在线性低密度聚乙烯(lldpe)的制备过程被用作用于调节聚合物密度的共聚单体。
2、在常规线性低密度聚乙烯(lldpe)的制备工艺中,为了通过在聚合物主链上形成支链来调节密度,将如1-己烯和1-辛烯的α-烯烃共聚单体与乙烯一起进行共聚。
3、因此,为了制备具有高共聚单体含量的lldpe,存在的缺陷在于,共聚单体的成本占了制造成本的很大一部分。为了解决这样的缺陷,已经进行了各种尝试。
4、这些直链α-烯烃主要通过壳牌高级烯烃工艺制备。然而,根据该方法,根据schultz-flory分布同时合成了不同长度的α-烯烃,并且需要单独的分离过程来获得特定的α-烯烃,这很不方便。
5、为了解决这个缺陷,提出了一种通过乙烯的三聚反应选择性合成1-己烯,或者通过乙烯的四聚反应选择性合成1-辛烯的方法。此外,已经对能够使乙烯选择性低聚的催化剂体系进行了更多研究。
6、[现有技术文件]
7、[专利文件]
8、(专利文件1)us 5064802b2
技术实现思路
1、技术问题
2、本发明要解决的课题是提供一种具有新型结构的配体化合物,其表现出高催化活性和对1-己烯和1-辛烯的高选择性,并且可以以优异的效率低聚乙烯,以及,提供一种有机铬化合物和包含该化合物的催化剂组合物。
3、技术方案
4、为了解决上述课题,本发明提供了一种配体化合物、一种有机铬化合物、一种催化剂组合物和一种低聚乙烯的方法。
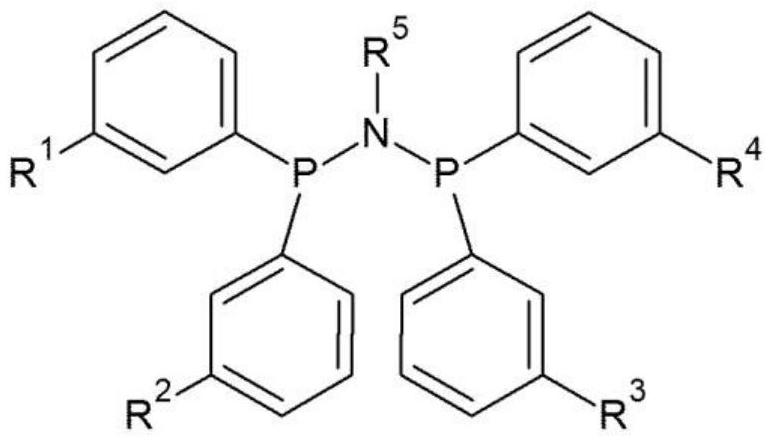
5、(1)本发明提供了一种由式1表示的配体化合物。
6、[式1]
7、
8、在式1中,r1至r4各自独立地为5至20个碳原子的烷基或三烷基甲硅烷基,其中三烷基甲硅烷基的烷基为1至4个碳原子的烷基,且r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
9、(2)本发明提供了根据(1)所述的配体化合物,其中,r1至r4各自独立地为8至12个碳原子的烷基、三丙基甲硅烷基或三丁基甲硅烷基。
10、(3)本发明提供了根据(1)或(2)所述的配体化合物,其中r1至r4各自独立地为正癸基、三丙基甲硅烷基或三丁基甲硅烷基。
11、(4)本发明提供了根据(1)至(3)中任一项所述的配体化合物,其中,r5为3至5个碳原子的烷基、被6至10个碳原子的芳基取代的1至5个碳原子的烷基、5至8个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至8个碳原子的环烷基。
12、(5)本发明提供了根据(1)所述的配体化合物,其中,由式1表示的配体化合物由式2表示。
13、[式2]
14、
15、在式2中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
16、(6)本发明提供了根据(5)所述的配体化合物,其中由式2表示的配体化合物是选自式2-1至式2-11中的一种。
17、[式2-1]
18、
19、[式2-2]
20、
21、[式2-3]
22、
23、[式2-4]
24、
25、[式2-5]
26、
27、[式2-6]
28、
29、[式2-7]
30、
31、[式2-8]
32、
33、[式2-9]
34、
35、[式2-10]
36、
37、[式2-11]
38、
39、(7)本发明提供了根据(1)所述的配体化合物,其中,由式1表示的配体化合物由式3表示。
40、[式3]
41、
42、在式3中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
43、(8)本发明提供了根据(7)所述的配体化合物,其中,由式3表示的配体化合物由式3-1表示。
44、[式3-1]
45、
46、(9)本发明提供了根据(1)所述的配体化合物,其中,由式1表示的配体化合物由式4表示。
47、[式4]
48、
49、在式4中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
50、(10)本发明提供了根据(9)所述的配体化合物,其中,由式4表示的配体化合物由式4-1或者式4-2表示。
51、[式4-1]
52、
53、[式4-2]
54、
55、(11)本发明提供了根据(1)所述的配体化合物,其中,由式1表示的配体化合物由式5表示。
56、[式5]
57、
58、在式5中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基,以及n为4至14。
59、(12)本发明提供了根据(11)所述的配体化合物,其中,由式5表示的配体化合物由式5-1表示。
60、[式5-1]
61、
62、(13)本发明提供了一种有机铬化合物,其包含根据(1)至(12)中任一项所述的配体化合物和与该配体化合物形成配位键的铬。
63、(14)本发明提供了根据(13)所述的有机铬化合物,其中,由式1表示的配体化合物中的n和两个p中的一个或多个的非共享电子对与铬形成配位键。
64、(15)本发明提供了一种催化剂组合物,其包含根据(1)至(12)中任一项所述的配体化合物、铬和助催化剂。
65、(16)本发明提供了根据(15)所述的催化剂组合物,其中,所述铬衍生自铬源,且所述铬源包括选自乙酰丙酮酸铬(iii)、四氢呋喃氯化铬(iii)、2-乙基己酸铬(iii)、乙酸铬(iii)、丁酸铬(iii)、戊酸铬(iii)、月桂酸铬(iii)、三(2,2,6,6-四甲基-3,5-庚二酸)铬(iii)和硬脂酸铬(iii)的一种或多种。
66、(17)本发明提供了根据(15)或(16)所述的催化剂组合物,其中所述助催化剂是选自由式6至式9表示的化合物中的一种或多种。
67、[式6]
68、-[al(r13)-o]a-
69、在式6中,r13各自独立地为卤素基团、1至20个碳原子的烃基,或者被卤素取代的1至20个碳原子的烃基,且a为2以上的整数。
70、[式7]
71、e(r14)3
72、在式7中,e是铝或硼,并且r14各自独立地是氢、卤素基团、1至20个碳原子的烃基、或被卤素基团取代的1至20个碳原子的烃基。
73、[式8]
74、[l-h]+[g(y)4]-
75、[式9]
76、[l]+[g(y)4]-
77、在式8和式9中,l是中性或阳离子路易斯酸,[l-h]+是布朗斯台德酸,g是第13族中的元素,并且y各自独立地是取代或未取代的1至20个碳原子的烷基或取代或未取代的6至20个碳原子的芳基,其中,如果烷基或芳基被取代,则取代基为卤素基团、1至20个碳原子的烃基、1至20个碳原子的烷氧基、或者6至20个碳原子的芳氧基。
78、(18)本发明提供了一种制备直链α-烯烃的方法,该方法包括在根据(15)至(17)中任一项所述的催化剂组合物的存在下使乙烯低聚的步骤(s10)。
79、(19)本发明提供了根据(18)所述的制备直链α-烯烃的方法,其中所述直链α-烯烃为1-己烯、1-辛烯或它们的混合物。
80、有益效果
81、如果使用本发明的包含所述配体化合物的有机铬化合物和催化剂组合物进行乙烯的低聚,则由于高催化剂活性和对1-己烯和1-辛烯的高选择性,可以以优异的产率生产直链α-烯烃。
82、具体实施方式
83、在下文中,将更加详细地描述本发明以帮助理解本发明。
84、将理解在本公开和权利要求中使用的字词或术语不应该解释成在通常使用的字典中所定义的含义。应进一步理解,基于发明人可以将所述字词或术语适当地定义以最好地解释本发明的原则,所述字词或术语应该解释为具有与相关技术的语境和本发明的技术创意一致的含义。
85、配体化合物
86、本发明提供了一种配体化合物,其适用于用作乙烯低聚反应的催化剂。如果将配体化合物应用于乙烯的低聚反应,特别是应用于用作形成直链α-烯烃的催化剂组合物,则可以表现出优异的催化剂活性,同时表现出对直链α-烯烃的高选择性。特别地,如果与常规的基于pnp的催化剂相比,在相同的反应条件下固体聚乙烯的产量小,并且可以更有效地制备直链α-烯烃。
87、根据本发明的实施方式,与配体化合物形成配位键的有机铬化合物可以用于使用乙烯制备直链α-烯烃,并且可以在乙烯条件下在反应中进行低聚反应以高选择性形成液体型α-烯烃,特别是液体型1-己烯或1-辛烯。这是由于乙烯低聚反应中通过形成金属杂环化合物的过渡态而提高了对特定长度的α-烯烃的选择性。
88、根据本发明的实施方式,所述配体化合物包括二膦基氨基部分,具有特定取代基的芳基与二膦基氨基部分的末端连接,因此,配体化合物本身可以具有可以发挥强的给电子基团作用的类型。由于这样的结构特征,配体化合物可以应用于用以低聚乙烯的催化剂体系以显示高活性,特别是对1-己烯、1-辛烯等的高选择性。这被认为是由于相邻铬活性位点之间的相互作用。特别地,如果被特定取代基取代的芳基与二膦基氨基的磷(p)原子连接,电子密度可能在二膦基氨基中包含的磷(p)原子和氮(n)原子处增加,并且整个配体化合物的电学和三维性质可能会发生变化。因此,配体和铬原子之间的键可能会变化,催化剂的结构可能会更加稳定,通过改变过渡态的能量(活化能),与传统的金属杂环庚烷或金属杂环壬烷类型相比可以以更高活性和选择性形成α-烯烃,且可以进一步减少副产物如具有大分子量的固体α-烯烃,如聚乙烯蜡(pe蜡)的量。
89、根据本发明的一个实施方式,所述配体化合物的特征在于,位于二膦基氨基残基末端的苯基在间位上具有特定碳数的烷基或被具有特定碳数的烷基作为取代基取代的甲硅烷基。在苯基的间位上取代的取代基通过两个分子的配体化合物与铬原子的结合防止了非活性物质的产生,并降低了氮-磷键的可旋转性以防止配体化合物在催化剂中的解离,从而生产具有高稳定性和优异的活性和选择性的铬催化剂。
90、根据本发明的实施方式,在配体化合物中,向与两个磷原子键合的氮原子上键合了大体积取代基如环烷基或苯基,并且与氮键合的大体积取代基阻止了氮和磷之间的键的旋转以进一步提高催化剂的稳定性和活性。在这种情况下,根据与氮原子键合的取代基的空间性质,催化剂的活性、稳定性、选择性等可能改变。如果与氮原子键合的取代基的空间应变过高,则存在的问题在于配体的合成和金属络合物的形成困难、并且所生成的络合物不稳定。另外,如果与氮原子键合的取代基的空间应变过高,则存在的问题在于如乙烯的原料的接近变得困难,且催化剂的活性劣化。另外,如果与氮原子键合的取代基的空间应变过低,则可能无法阻止氮原子与磷原子之间的键的旋转,并且可能无法保护金属中心原子,从而成为劣化催化剂活性和稳定性的因素。即,如果与氮原子键合的取代基的空间应变过高或过低,则存在的问题在于催化剂的活性降低,稳定性劣化,以及如聚乙烯蜡的副产物的量增加。因此,选择相对于与磷原子键合的取代基而言,具有合适的空间应变的与氮原子键合的取代基是非常重要的。根据本发明的配体化合物在与磷原子键合的苯基的间位引入取代基,并且p-n-p官能团周围的空间应变增加。因此,通过引入由式1的r5表示的取代基以便不过分地增加与氮原子键合的取代基的空间应变,可以在使用包含其的催化剂组合物进行乙烯低聚反应期间改善收率和选择性。特别地,如果引入具有仲烷基类型的取代基作为由式1的r5表示的取代基,则可以进一步提高效率。在具有伯烷基类型的取代基的情况下,为了补充低空间应变,可以在1位碳或2位碳处引入如苯基的芳基,以形成合适的空间应变以提高收率和选择性。
91、根据本发明的一个实施方式,所述配体化合物可以由式1表示。
92、[式1]
93、
94、在式1中,r1至r4各自独立地为5至20个碳原子的烷基或三烷基甲硅烷基,其中三烷基甲硅烷基的烷基为1至4个碳原子的烷基,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
95、在本发明中,“烷基”是指直链、环状或支链类型的烃残基,且根据限定的碳数,特别包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基和己基。
96、在本发明中,“三烷基甲硅烷基”是指由-sir3表示的取代基,其中每个r独立地为烷基,并且如果提及时,三烷基甲硅烷基的碳数可以是指r的所有碳数的总和。
97、在本发明中,除非另有说明,“芳基”是指任选取代的苯环,或通过稠合一个或多个任选取代基而形成的环体系。任选的取代基的实例包括取代的1至2个碳原子的烷基、取代的2至3个碳原子的烯基、取代的2至3个碳原子的炔基、杂芳基、杂环基、芳基、任选具有1至3个氟取代基的烷氧基、芳氧基、芳烷氧基、酰基、芳酰基、杂芳酰基、酰氧基、芳酰氧基、杂芳酰氧基、硫烷基、亚磺酰基、磺酰基、氨基磺酰基、磺酰基氨基、羧基酰胺基、氨基羰基、羧基、氧代、羟基、巯基、氨基、硝基、氰基、卤素或脲基。这样的环或环体系可以任选地稠合到具有任选一个或多个取代基的芳基环(例如苯环)、碳环或杂环。非限制性实例包括苯基、萘基、四氢萘基、联苯、茚满基、蒽基、菲基及其取代的衍生物。
98、根据本发明的一个实施方式,r1至r4各自独立地为8至12个碳原子的烷基、三丙基甲硅烷基或三丁基甲硅烷基。在一个特别的实施方式中,r1至r4可以各自独立地为三丙基甲硅烷基或三丁基甲硅烷基、或正癸基。也就是说,在配体化合物中,位于二膦基氨基残基末端的苯基可以在间位上具有10个碳原子的烷基或被3或4个碳原子的烷基取代的甲硅烷基作为取代基。
99、根据本发明的一个实施方式,r5可以为3至5个碳原子的烷基、被6至10个碳原子的芳基取代的1至5个碳原子的烷基、5至8个碳原子的环烷基、被6至10个碳原子的芳基取代的5至8个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至8个碳原子的环烷基。
100、根据本发明的一个实施方式,由式1表示的配体化合物可以由式2表示。
101、[式2]
102、
103、在式2中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
104、根据本发明的一个实施方式,由式2表示的配体化合物可以是选自由式2-1至式2-11表示的配体化合物的一种。
105、[式2-1]
106、
107、[式2-2]
108、
109、[式2-3]
110、
111、[式2-4]
112、
113、[式2-5]
114、
115、[式2-6]
116、
117、[式2-7]
118、
119、[式2-8]
120、
121、[式2-9]
122、
123、[式2-10]
124、
125、[式2-11]
126、
127、根据本发明的一个实施方式,由式1表示的配体化合物可以由式3表示。
128、[式3]
129、
130、在式3中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
131、根据本发明的一个实施方式,由式3表示的配体化合物可以由式3-1表示。
132、[式3-1]
133、
134、根据本发明的一个实施方式,由式1表示的配体化合物可以由式4表示。
135、[式4]
136、
137、在式4中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基。
138、根据本发明的一个实施方式,由式4表示的配体化合物可以由式4-1或式4-2表示。
139、[式4-1]
140、
141、[式4-2]
142、
143、根据本发明的一个实施方式,由式1表示的配体化合物可以由式5表示。
144、[式5]
145、
146、在式5中,r5为1至10个碳原子的烷基、被6至10个碳原子的芳基取代的1至10个碳原子的烷基、5至10个碳原子的环烷基、被6至10个碳原子的芳基取代的5至10个碳原子的环烷基、或者与6至10个碳原子的芳基稠合的5至10个碳原子的环烷基,以及n为4至14。
147、根据本发明的一个实施方式,由式5表示的配体化合物可以由式5-1表示。
148、[式5-1]
149、
150、根据本发明的一个实施方式,除了上述实施方式以外,所述配体化合物还可以通过在满足上述条件的范围内的各种组合来实现,且只要是由式1表示,任何化合物都可以适用作为本发明的配体化合物。
151、有机铬化合物和催化剂组合物
152、本发明提供了一种有机铬化合物,其包含由式1表示的配体化合物和与所述配体化合物形成配位键的铬(cr)。
153、根据本发明的一个实施方式,所述有机铬化合物是所述配体化合物的铬配合物,且可以是这样的类型:铬源的铬与由式1表示的配体化合物中的n和两个p中的一个或多个非共用电子对形成配位键。也就是说,在该结构中,二膦基氨基残基的磷原子或氮原子为铬原子提供非共用电子对,特别地,其中两个非共用电子对被共用的双齿状态可能是优选的。这样的有机铬化合物可以被应用于乙烯低聚反应的催化剂体系,以显示出优异的催化剂活性和对1-己烯和1-辛烯的高选择性。
154、在本发明中,“催化剂组合物”是指能够通过以任意顺序添加包含铬源、配体化合物和助催化剂这三种成分,或者过渡金属化合物和助催化剂这两种成分而获得具有活性的催化剂组合物的状态。这里,催化剂组合物可以称为催化剂体系,并且在本发明中,催化剂组合物和催化剂体系表示相同的含义。所述催化剂组合物的三种组分或两种组分可以在存在或不存在溶剂和单体的情况下添加,并且可以以负载或未负载的状态使用。
155、此外本发明提供了一种催化剂组合物,其包含所述配体化合物、铬和助催化剂。由式1表示的配体化合物和铬可以如上所述配位以形成有机铬化合物。即,催化剂体系可以是包括铬、由式1表示的配体化合物和助催化剂的三组分的催化剂体系,或者是包括有机铬化合物和助催化剂的双组分的催化剂体系。在一个特定的实施方式中,催化剂组合物可包含:包含所述配体化合物、与所述配体化合物形成配位键的铬的有机铬化合物,以及助催化剂。此外,催化剂组合物可以包含铬化合物,其中,助催化剂的部分组分与所述有机铬化合物结合。
156、根据本发明的一个实施方式,所述铬可以来源于铬源,且铬源可以是氧化态为0至6的有机或无机铬化合物。在一个特定的实施方式中,所述铬源可以是铬金属,或者其中任意有机或无机基团与铬键合的化合物。在此,有机基团可以是,每个基团具有1至20个碳原子的烷基、烷氧基、酯基、酮基、酰氨基、羧酸酯基等,且无机基团可以是卤素,硫酸根,氧等。
157、根据本发明的一个实施方式,所述铬源为对烯烃的低聚显示出高活性并且易于使用和获得的化合物,并且可以是选自乙酰丙酮酸铬(iii)、四氢呋喃氯化铬(iii)、2-乙基己酸铬(iii)、乙酸铬(iii)、丁酸铬(iii)、戊酸铬(iii)、月桂酸铬(iii)、三(2,2,6,6-四甲基-3,5-庚二酸)铬(iii)和硬脂酸铬(iii)的一种或多种化合物。
158、根据本发明的一个实施方式,所述助催化剂可以是选自由式6至式9表示的化合物的一种或多种。
159、[式6]
160、-[al(r13)-o]a-
161、在式6中,r13各自独立地为卤素基团、1至20个碳原子的烃基,或者被卤素取代的1至20个碳原子的烃基,且a为2以上的整数。
162、[式7]
163、e(r14)3
164、在式7中,e是铝或硼,并且r14各自独立地是氢、卤素基团、1至20个碳原子的烃基、或被卤素基团取代的1至20个碳原子的烃基。
165、[式8]
166、[l-h]+[g(y)4]-
167、[式9]
168、[l]+[g(y)4]-
169、在式8和式9中,l是中性或阳离子路易斯酸,[l-h]+是布朗斯台德酸,g是第13族中的元素,并且y各自独立地是取代或未取代的1至20个碳原子的烷基或取代或未取代的6至20个碳原子的芳基,其中,如果烷基或芳基被取代,则取代基为卤素基团、1至20个碳原子的烃基、1至20个碳原子的烷氧基、或者6至20个碳原子的芳氧基。
170、根据本发明的一个实施方式,所述催化剂组合物可以通过多种方法制备。在一个特定的实施方式中,第一,可以通过包括以下的步骤来制备催化剂组合物:使有机铬化合物与由式6或式7表示的化合物接触。第二,可以通过包括以下的步骤来制备催化剂组合物:使有机铬化合物与由式6或式7表示的化合物接触以获得混合物;以及向所述混合物添加由式8或式9表示的化合物。第三,可以通过包括以下的步骤来制备催化剂组合物:使有机铬化合物与由式8或式9表示的化合物接触。第四,可以通过包括以下的步骤来制备催化剂组合物:使有机铬化合物与由式8或式9表示的化合物接触以获得混合物;以及向所述混合物添加由式6或式7表示的化合物。第五,可以通过包括以下的步骤来制备催化剂组合物:使铬源与式8或式9表示的化合物接触以获得反应产物,以及使所述反应产物与所述配体化合物接触。
171、根据本发明的一个实施方式,在所述催化剂组合物的制备方法中的第一种方法或第三种方法中,由式6或式7表示的化合物与有机铬化合物的摩尔比可以为1:2至5,000,特别是1:100至3,000,更特别是1:300至1,500,在此范围内,有机铬化合物的烷基化可以完全进行,可以提高催化剂组合物的活性,可以防止由于剩余烷基化剂之间的副反应而导致的烷基化的有机铬化合物的活性劣化,同时可以提高经济可行性和所制备的直链α-烯烃的纯度。
172、根据本发明的一个实施方式,在所述催化剂组合物的制备方法中的第二种方法的情况下,由式8或式9表示的化合物与有机铬化合物的摩尔比可以为1:1至500,特别是1:1至50,更特别是1:1至1:25,在此范围内,活化剂的量是足够的,金属化合物的活化可以完全进行,并且可以提高催化剂组合物的活性,可以最小化残留的活化剂,并且可以提高所制备的直链α-烯烃的纯度。
173、根据本发明的一个实施方式,由式6表示的化合物可以是烷基铝氧烷,且特定实例可以包括甲基铝氧烷、乙基铝氧烷、异丁基铝氧烷、丁基铝氧烷等,更特别地为甲基铝氧烷。
174、根据本发明的一个实施方式,由式7表示的化合物可以是三烷基铝、二烷基卤化铝、烷基二卤化铝、二烷基氢化铝、烷基二氢化铝、三烷基硼等。在一个特定实施方式中,由式6表示的化合物可以是三烷基铝,如三甲基铝、三乙基铝、三异丁基铝、三丙基铝、三丁基铝、三异丙基铝、三仲丁基铝、三环戊基铝、三戊基铝、三异戊基铝、三己基铝、三辛基铝、乙基二甲基铝、甲基二乙基铝、三苯基铝和三对甲苯基铝;二烷基卤化铝,如二乙基氯化铝;二烷基氢化铝,如二乙基氢化铝、二正丙基氢化铝、二异丙基氢化铝、二正丁基氢化铝、二丁基氢化铝、二异丁基氢化铝(dibah)、二正辛基氢化铝、二苯基氢化铝、二对甲苯基氢化铝、二苄基氢化铝、苯基乙基氢化铝、苯基-正丙基氢化铝、苯基异丙基氢化铝、苯基正丁基氢化铝、苯基异丁基氢化铝、苯基正辛基氢化铝、对甲苯基乙基氢化铝、对甲苯基正丙基氢化铝、对甲苯基异丙基氢化铝、对甲苯基正丁基氢化铝、对甲苯基异丁基氢化铝、对甲苯基正辛基氢化铝、苄基乙基氢化铝、苄基正丙基氢化铝、苄基异丙基氢化铝、苄基正丁基氢化铝、苄基异丁基氢化铝和苄基正辛基氢化铝;烷基二氢化铝,如正丙基二氢化铝、异丙基二氢化铝、正丁基二氢化铝、异丁基二氢化铝和正辛基二氢化铝;以及三烷基硼,如三甲基硼、三乙基硼、三异丁基硼、三丙基硼和三丁基硼。
175、根据本发明的一个实施方式,由式8或式9表示的化合物可以是三甲基铵四苯基硼酸盐、三乙基铵四苯基硼酸盐、三丙基铵四苯基硼酸盐、三丁基铵四苯基硼酸盐、n,n-二甲基苯铵四苯基硼酸盐、n,n-二乙基苯铵四苯基硼酸盐、三甲基铵四(对甲苯基)硼酸盐、三乙基铵四(对甲苯基)硼酸盐、三丙基铵四(对甲苯基)硼酸盐、三丁基铵四(对甲苯基)硼酸盐、n,n-二甲基苯铵四(对甲苯基)硼酸盐、n,n-二乙基苯铵四(对甲苯基)硼酸盐、三甲基铵四(邻,对二甲基苯基)硼酸盐、三乙基铵四(邻,对二甲基苯基)硼酸盐、三丙基铵四(邻,对二甲基苯基)硼酸盐、三丁基铵四(邻,对二甲基苯基)硼酸盐、n,n-二甲基苯铵四(邻,对二甲基苯基)硼酸盐、n,n-二乙基苯铵四(邻,对二甲基苯基)硼酸盐、三甲基铵四(对三氟甲基苯基)硼酸盐、三乙基铵四(对三氟甲基苯基)硼酸盐、三丙基铵四(对三氟甲基苯基)硼酸盐、三丁基铵四(对三氟甲基苯基)硼酸盐、n,n-二甲基苯铵四(对三氟甲基苯基)硼酸盐、n,n-二乙基苯铵四(对三氟甲基苯基)硼酸盐、三甲基铵四(五氟苯基)硼酸盐、三乙基铵四(五氟苯基)硼酸盐、三丙基铵四(五氟苯基)硼酸盐、三丁基铵四(五氟苯基)硼酸盐、n,n-二甲基苯铵四(五氟苯基)硼酸盐、n,n-二乙基苯铵四(五氟苯基)硼酸盐、n,n-二(十八烷基)苯铵四(五氟苯基)硼酸盐、三甲基鏻四苯基硼酸盐、三乙基鏻四苯基硼酸盐、三丙基鏻四苯基硼酸盐、三丁基鏻四苯基硼酸盐、三甲基碳鎓四苯基硼酸盐、三乙基碳鎓四苯基硼酸盐、三丙基碳鎓四苯基硼酸盐、三丁基碳鎓四苯基硼酸盐、三甲基铵四苯基铝酸盐、三乙基铵四苯基铝酸盐、三丙基铵四苯基铝酸盐、三丁基铵四苯基铝酸盐、三甲基铵四(对甲苯基)铝酸盐、三乙基铵四(对甲苯基)铝酸盐、三丙基铵四(对甲苯基)铝酸盐、三丁基铵四(对甲苯基)铝酸盐等。
176、根据本发明的一个实施方式,构成催化剂组合物的组分的含量比可以通过考虑催化剂活性和对直链α-烯烃的选择性来确定。根据一个特定的实施方式,如果所述催化剂组合物是三组分的催化剂组合物,配体化合物的二膦基氨基残基:铬源:助催化剂的摩尔比可以控制在约1:1:1至约10:1:10,000,或者约1:1:100至5:1:3,000。此外,如果所述催化剂组合物是双组分的催化剂组合物,有机铬化合物的二膦基氨基残基:助催化剂的摩尔比可以控制在1:1至1:10,000,或1:1至1:5,000,或1:1至1:3,000。
177、根据本发明的一个实施方式,在制备催化剂组合物期间的反应溶剂可以使用基于烃的溶剂,例如戊烷、己烷和庚烷;以及芳香族溶剂,例如苯和甲苯。
178、根据本发明的一个实施方式,构成催化剂组合物的组分可以在存在或不存在合适的溶剂和单体的情况下同时或以任意顺序添加,从而可以充当具有活性的催化剂组合物。在此情况下,所述合适的溶剂可以包括庚烷、甲苯、环己烷、甲基环己烷、1-己烯、1-辛烯、二乙醚、四氢呋喃、乙腈、二氯甲烷、氯仿、氯苯、甲醇、丙酮等。
179、根据本发明的一个实施方式,所述有机铬化合物和助催化剂可以以在载体中负载的形式使用,并且在此情况下,载体可以是氧化硅或氧化铝。
180、根据本发明的一个实施方式,所述催化剂组合物可以进一步包括载体。在一个特定的实施方式中,由式1表示的配体化合物可以以载体中的负载形式应用于乙烯的低聚。所述载体可以是应用于负载型催化剂中的金属、金属盐或金属氧化物,并且在特定的实施方式中,所述载体可以是氧化硅、氧化硅-氧化铝、氧化硅-氧化镁等,并且可以包括金属的氧化物、碳酸盐、硫酸盐、硝酸盐成分,如na2o、k2co3、baso4、和mg(no3)2。
181、根据本发明的一个实施方式,所述催化剂组合物可被用于乙烯的三聚或四聚反应,并且可以通过上述描述以高选择性来生产1-己烯或1-辛烯。
182、乙烯低聚方法
183、本发明提供了一种制备直链α-烯烃的方法作为低聚乙烯的方法,包括在催化剂组合物的存在下使乙烯低聚的步骤(s10)。
184、在本发明中,“低聚”是指烯烃的低聚。根据聚合的烯烃的数量,低聚被称为三聚或四聚,并统称为多聚。特别地,在本公开中,低聚是指由乙烯选择性地制备作为lldpe的主要共聚单体的1-己烯和1-辛烯。
185、根据本发明的一个实施方式,乙烯的低聚反应可以是乙烯的三聚或四聚,并且可以形成1-己烯或1-辛烯作为所得反应产物,因此,直链α-烯烃可以是1-己烯、1-辛烯或其混合物。
186、根据本发明的一个实施方式,乙烯低聚方法可以通过使用乙烯作为原料并应用上述催化剂组合物、常用设备和接触技术来进行。在一个特定的实施方式中,乙烯的低聚反应可包括在惰性溶剂存在或不存在下的均相液相反应、催化剂组合物的一部分或全部不溶解的淤浆反应、其中α-烯烃产物作为主要介质的本体相反应、或气相反应。
187、根据本发明的一个实施方式,乙烯的低聚反应可以在惰性溶剂下进行。所述惰性溶剂的特定实例可包括苯、甲苯、二甲苯、异丙基苯、氯苯、二氯苯、庚烷、环己烷、甲基环己烷、甲基环戊烷、正己烷、1-己烯、1-辛烯、2,2,4-三甲基戊烷等。
188、根据本发明的一个实施方式,乙烯的低聚反应可以在0℃至200℃、或0℃至150℃、或30℃至100℃、或50℃至100℃的温度下进行。另外,所述反应可以在15psig至3000psig、或15psig至1500psig、或15psig至1000psig的压力下进行。
189、在下文中,将更详细地解释本发明的实施方式,使得本发明所属领域的技术人员可以容易地执行。然而,实施方式可以通过各种不同类型来实现,并不限于本文解释的实施方式。
190、合成实施例和对比合成实施例
191、合成实施例1:由式2-1表示的配体化合物的合成
192、[式2-1]
193、
194、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml二氯甲烷中的1mmol(1eq)的环戊胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-1表示的配体化合物。
195、<由式2-1表示的配体化合物>
196、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-环戊基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
197、1h nmr(500mhz,c6d6):δ8.23-7.17(m,16h),3.50(五重峰,1h),2.27-2.14(m,2h),1.77-1.63(m,2h),1.42-1.15(m,24h),1.00-0.86(m,36h),0.87-0.81(m,4h),0.79-0.67(m,24h)。
198、合成实施例2:由式2-2表示的配体化合物的合成
199、[式2-2]
200、
201、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的环己胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-2表示的配体化合物。
202、<由式2-2表示的配体化合物>
203、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-环戊基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
204、1h nmr(500mhz,c6d6):δ8.20-7.17(m,16h),3.52(五重峰,1h),2.29-2.15(m,2h),1.75-1.61(m,4h),1.40-1.15(m,24h),1.00-0.88(m,36h),0.86-0.80(m,4h),0.78-0.68(m,24h)。
205、合成实施例3:由式2-3表示的配体化合物的合成
206、[式2-3]
207、
208、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的环庚胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-3表示的配体化合物。
209、<由式2-3表示的配体化合物>
210、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-环庚基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
211、1h nmr(500mhz,c6d6):δ8.15-7.16(m,16h),3.65(五重峰,1h),2.35-2.22(m,2h),1.94-1.86(m,2h),1.60-1.45(m,4h),1.44-1.15(m,24h),1.00-0.86(m,36h),0.85-0.79(m,4h),0.78-0.68(m,24h)。
212、合成实施例4:由式2-4表示的配体化合物的合成
213、[式2-4]
214、
215、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的环辛胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-4表示的配体化合物。
216、<由式2-4表示的配体化合物>
217、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-环辛基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
218、1h nmr(500mhz,c6d6):δ8.10-7.15(m,16h),3.78(五重峰,1h),2.40-2.28(m,2h),1.94-1.86(m,2h),1.67-1.49(m,4h),1.48-1.15(m,24h),1.00-0.86(m,36h),0.85-0.79(m,6h),0.78-0.68(m,24h)。
219、合成实施例5:由式2-5表示的配体化合物的合成
220、[式2-5]
221、
222、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的2,3-二氢-1h-茚-2-基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-5表示的配体化合物。
223、<由式2-5表示的配体化合物>
224、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-(2,3-二氢-1h-茚-2-基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
225、1h nmr(500mhz,c6d6):δ7.80-7.15(m,16h),7.10-6.90(m,4h),4.65(五重峰,1h),3.73-3.61(m,2h),2.75-2.67(m,2h),1.43-1.29(m,24h),1.01-0.92(m,36h),0.80-0.71(m,24h)。
226、合成实施例6:由式2-6表示的配体化合物的合成
227、[式2-6]
228、
229、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的1,2,3,4-四氢萘-2-基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-6表示的配体化合物。
230、<由式2-6表示的配体化合物>
231、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-(1,2,3,4-四氢萘-2-基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
232、1h nmr(500mhz,c6d6):δ8.10-7.15(m,16h),7.08-6.89(m,4h),3.86(五重峰,1h),3.42-3.29(m,1h),3.01-2.87(m,3h),1.69-1.50(m,2h),1.44-1.16(m,24h),0.99-0.85(m,36h),0.83-0.65(m,24h)。
233、合成实施例7:由式2-7表示的配体化合物的合成
234、[式2-7]
235、
236、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的异丙基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-7表示的配体化合物。
237、<由式2-7表示的配体化合物>
238、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-异丙基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
239、1h nmr(500mhz,c6d6):δ8.20-7.15(m,16h),3.45(五重峰,1h),1.67(d,6h),1.39-1.15(m,24h),1.01-0.89(m,36h),0.80-0.67(m,24h)。
240、合成实施例8:由式2-8表示的配体化合物的合成
241、[式2-8]
242、
243、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的3-甲基丁烷-2-基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-8表示的配体化合物。
244、<由式2-8表示的配体化合物>
245、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-(3-甲基丁烷-2-基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
246、1h nmr(500mhz,c6d6):δ8.10-7.20(m,16h),3.65-3.52(m,1h),1.82-1.70(m,1h),1.41-1.16(m,24h),1.07(d,3h),0.99-0.87(m,36h),0.80-0.69(m,27h),0.56(d,3h)。
247、合成实施例9:由式2-9表示的配体化合物的合成
248、[式2-9]
249、
250、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的苄基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-9表示的配体化合物。
251、<由式2-9表示的配体化合物>
252、n-苄基-n-(双(3-(三丙基甲硅烷基)苯基)膦基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
253、1h nmr(500mhz,c6d6):δ7.94-7.15(m,16h),7.12-6.85(m,5h),4.74(s,2h),1.39-1.15(m,24h),0.99-0.88(m,36h),0.80-0.68(m,24h)。
254、合成实施例10:由式2-10表示的配体化合物的合成
255、[式2-10]
256、
257、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的苯乙基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-10表示的配体化合物。
258、<由式2-10表示的配体化合物>
259、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-苯乙基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
260、1h nmr(500mhz,c6d6):δ8.18-7.14(m,16h),7.12-6.84(m,5h),3.48(t,2h),2.33(t,2h),1.40-1.14(m,24h),1.02-0.90(m,36h),0.81-0.67(m,24h)。
261、合成实施例11:由式2-11表示的配体化合物的合成
262、[式2-11]
263、
264、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的4-苯基环己基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式2-11表示的配体化合物。
265、<由式2-11表示的配体化合物>
266、n-(双(3-(三丙基甲硅烷基)苯基)膦基)-n-(4-苯基环己基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺)
267、1h nmr(500mhz,c6d6):δ8.15-7.18(m,18h),7.13-7.00(m,3h),3.64(五重峰,1h),2.88-2.72(m,1h),2.49(d,1h),2.46-2.34(m,2h),2.16(d,1h),1.87-1.74(m,2h),1.71-1.60(m,1h),1.58-1.49(m,1h),1.39-1.28(m,24h),0.99-0.90(m,36h),0.78-0.70(m,24h)。
268、合成实施例12:由式3-1表示的配体化合物的合成
269、[式3-1]
270、
271、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丁基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的2,3-二氢-1h-茚-2-基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式3-1表示的配体化合物。
272、<由式3-1表示的配体化合物>
273、n-(双(3-(三丁基甲硅烷基)苯基)膦基)-n-(2,3-二氢-1h-茚-2-基)-1,1-双(3-(三丁基甲硅烷基)苯基)膦胺)
274、1h nmr(500mhz,c6d6):δ7.83-7.17(m,16h),7.11-6.92(m,4h),4.59(五重峰,1h),3.68-3.57(m,2h),2.71-2.65(m,2h),1.39-1.27(m,48h),0.94-0.84(m,36h),0.83-0.75(m,24h)。
275、合成实施例13:由式4-1表示的配体化合物的合成
276、[式4-1]
277、
278、在氮气气氛下向干燥烧瓶中注入11mmol(2.2eq)的环庚胺和10ml的二氯甲烷并进行搅拌。向烧瓶中缓慢注入在10ml的二氯甲烷中稀释的5mmol(1eq)的氯代双(3-(三丙基甲硅烷基)苯基)膦。将反应混合物搅拌4小时,并通过1h nmr确认转化。反应结束后,通过过滤除去析出的固体,减压除去溶剂,通过柱色谱得到5mmol的中间体化合物n-环庚基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺。
279、然后,在氮气气氛下向干燥的烧瓶中注入5mmol(1eq)的n-环庚基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺中间体化合物和13ml的甲基叔丁基醚,并冷却至-78℃,接着搅拌。向烧瓶中缓慢注入2.1ml(5.25mmol,1.05eq)的其中正丁基锂以2.5m溶解于己烷中的溶液,并搅拌1小时。然后,缓慢注入在10ml的甲基叔丁基醚中稀释的5mmol(1eq)的氯代双(3-(三丁基甲硅烷基)苯基)膦。将反应混合物搅拌4小时,并通过1h nmr确认转化。反应完成后,通过过滤器除去沉淀的固体,在减压下除去溶剂,并通过柱色谱得到4mmol(收率80%)的由式4-1表示的配体化合物。
280、<由式4-1表示的配体化合物>
281、n-(双(3-(三丁基甲硅烷基)苯基)膦基)-n-环庚基-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺
282、1h nmr(500mhz,c6d6):δ8.16-7.15(m,16h),3.64(五重峰,1h),2.34-2.21(m,2h),1.93-1.85(m,2h),1.59-1.45(m,4h),1.43-1.15(m,36h),1.00-0.85(m,36h),0.85-0.79(m,16h),0.78-0.68(m,12h)。
283、合成实施例14:由式4-2表示的配体化合物的合成
284、[式4-2]
285、
286、在氮气气氛下向干燥烧瓶中注入11mmol(2.2eq)的4-苯基环己基胺和10ml的二氯甲烷并进行搅拌。向烧瓶中缓慢注入在10ml的二氯甲烷中稀释的5mmol(1eq)的氯代双(3-(三丙基甲硅烷基)苯基)膦。将反应混合物搅拌4小时,并通过1h nmr确认转化。反应结束后,通过过滤除去析出的固体,减压除去溶剂,通过柱色谱得到5mmol的中间体化合物n-(4-苯基环己基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺。
287、然后,在氮气气氛下向干燥的烧瓶中注入5mmol(1eq)的n-(4-苯基环己基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺中间体化合物和13ml的甲基叔丁基醚,并冷却至-78℃,接着搅拌。向烧瓶中缓慢注入2.1ml(5.25mmol,1.05eq)的其中正丁基锂以2.5m溶解于己烷中的溶液,并搅拌1小时。然后,缓慢注入在10ml的甲基叔丁基醚中稀释的5mmol(1eq)的氯代双(3-(三丁基甲硅烷基)苯基)膦。将反应混合物搅拌4小时,并通过1h nmr确认转化。反应完成后,通过过滤器除去沉淀的固体,在减压下除去溶剂,并通过柱色谱得到4mmol(收率80%)的由式4-1表示的配体化合物。
288、<由式4-2表示的配体化合物>
289、n-(双(3-(三丁基甲硅烷基)苯基)膦基)-n-(4-苯基环己基)-1,1-双(3-(三丙基甲硅烷基)苯基)膦胺
290、1h nmr(500mhz,c6d6):δ8.14-7.17(m,18h),7.14-7.00(m,3h),3.61(五重峰,1h),2.87-2.72(m,1h),2.50(d,1h),2.47-2.33(m,2h),2.15(d,1h),1.88-1.75(m,2h),1.70-1.60(m,1h),1.59-1.49(m,1h),1.39-1.26(m,36h),0.99-0.87(m,36h),0.82-0.70(m,24h)。
291、合成实施例15:由式5-1表示的配体化合物的合成
292、[式5-1]
293、
294、参考org.chem.front,2015,2,536,在乙醚中溶解20mmol(1eq)的1,3-二溴苯,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(1eq)的正丁基锂,并搅拌1小时。然后,向其中添加22mmol(1.1eq)的1-溴癸烷,并将温度升至室温,接着额外搅拌4小时。然后,加入水以淬灭反应,并将生成物用乙醚萃取,用盐水洗涤并用硫酸镁(mgso4)干燥。真空除去溶剂。然后,使用己烷通过氧化硅柱分离3-(正癸基)苯基溴。
295、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(正癸基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的2,3-二氢-1h-茚-2-基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式5-1表示的配体化合物。
296、<由式5-1表示的配体化合物>
297、n-(双(3-癸基苯基)膦基)-1,1-双(3-癸基苯基)-n-(2,3-二氢-1h-茚-2-基)膦胺)
298、1h nmr(500mhz,c6d6):δ7.76-7.12(m,16h),7.07-6.89(m,4h),4.49(五重峰,1h),3.67-3.55(m,2h),2.69-2.60(m,2h),2.43-2.28(t,24h),1.43-1.19(m,192h),0.98-0.85(t,36h)。
299、对比合成实施例1:由式10表示的配体化合物的合成
300、[式10]
301、
302、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丁基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的6-十一烷基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式9表示的配体化合物。
303、对比合成实施例2:由式11表示的配体化合物的合成
304、[式11]
305、
306、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丁基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的0.5mmol(0.5eq)的4,4'-亚甲基双(环己烷-1-胺)缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式10表示的配体化合物。
307、对比合成实施例3:由式12表示的配体化合物的合成
308、[式12]
309、
310、参考chemcatchem 2019,11,4351,在20ml的四氢呋喃中溶解20mmol(2eq)的4-(三异丙基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的异丙基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式11表示的配体化合物。
311、对比合成实施例4:由式13表示的配体化合物的合成
312、[式13]
313、
314、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(二甲基辛基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的异丙基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式12表示的配体化合物。
315、对比合成实施例5:由式14表示的配体化合物的合成
316、[式14]
317、
318、在20ml的四氢呋喃中溶解20mmol(2eq)的1-溴-3,4-二甲基苯,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的2-异丙基环己基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式13表示的配体化合物。
319、对比合成实施例6:由式15表示的配体化合物的合成
320、[式15]
321、
322、在20ml的四氢呋喃中溶解20mmol(2eq)的3-(三丁基甲硅烷基)苯基溴,并冷却至-78℃。在保持该温度的同时,向其中滴加20mmol(2eq)的正丁基锂,接着搅拌3小时。然后,向其中滴加溶解在10ml四氢呋喃中的10mmol(1eq)的二氯(二乙基氨基)膦,并将温度升至室温,接着搅拌过夜。然后,使用真空除去溶剂,并且将获得的未经额外纯化的中间体溶解在30ml己烷中,并向其中添加hcl(在乙醚中,2eq)。将所得物搅拌15分钟并过滤。将通过真空干燥滤液获得的2.1mmol(2.1eq)的中间体溶解在3.8ml的二氯甲烷中,并向其中添加3mmol(3eq)的三乙胺。然后,将溶解在3.8ml的二氯甲烷中的1mmol(1eq)的环十二烷基胺缓慢加入到反应体系中,接着在室温下搅拌过夜。然后,使用真空除去溶剂,并将所得物溶解在7.6ml己烷中并负载到氧化硅顶部。使用含有1vol%的三乙胺的己烷进行氧化硅过滤,并将由此获得的溶液浓缩以获得由式14表示的配体化合物。
323、实施例和对比实施例
324、实施例1-1
325、在氩气气氛下,将17.5mg(0.05mmol)的乙酰丙酮酸铬(iii)(cr(acac)3)和0.5mmol的根据合成实施例1的由式2-1表示的配体化合物放入烧瓶中,注入100ml的甲基环己烷并搅拌以制备5mm(基于cr)的催化剂溶液。
326、准备容量为600ml的parr反应器,在120℃下施加真空2小时,内部用氩气置换,并将温度降低至80℃。然后,注入180ml的甲基环己烷和2ml的mmao(异庚烷溶液,al/cr=600),并向其中注入2ml(1.0μmol的cr)的催化剂溶液。以1,000rpm搅拌2分钟后,打开调整为30bar的乙烯管线的阀门,使反应器内填充乙烯,然后以1,000rpm进行搅拌60分钟。关闭乙烯管路阀,使用干冰/丙酮浴将反应器冷却至0℃,缓慢排出未反应的乙烯,并注入0.5ml的壬烷(gc内标)。在搅拌10秒后,取出2ml的反应器的液体部分,用水淬灭,使用ptfe注射过滤器过滤由此获得的有机部分以制造gc-fid样品。然后,通过gc(agilent公司,6890n,alltech at-5(30m x 0.32mm id x 0.25μm;序列号12446))分析液体产物的分布。向剩余溶液中添加400ml乙醇/hcl(10vol%的12m hcl水溶液),进行搅拌和过滤,并分析固体产物的量。将由此获得的聚合物在80℃的真空烘箱中干燥过夜。
327、实施例2-1至15-1,和对比实施例1-1至6-1
328、除了如下表1中改变催化剂的类型以外,进行与实施例1-1中相同的方法。
329、[表1]
330、 组 配体化合物 助催化剂 铬源 实施例1-1 合成实施例1(式2-1) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例2-1 合成实施例2(式2-2) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例3-1 合成实施例3(式2-3) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例4-1 合成实施例4(式2-4) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例5-1 合成实施例5(式2-5) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例6-1 合成实施例6(式2-6) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例7-1 合成实施例7(式2-7) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例8-1 合成实施例8(式2-8) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例9-1 合成实施例9(式2-9) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例10-1 合成实施例10(式2-10) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例11-1 合成实施例11(式2-11) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例12-1 合成实施例12(式3-1) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例13-1 合成实施例13(式4-1) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例14-1 合成实施例14(式4-2) mmao <![cdata[cr(acac)<sub>3</sub>]]> 实施例15-1 合成实施例15(式5-1) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例1-1 对比合成实施例1(式10) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例2-1 对比合成实施例2(式11) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例3-1 对比合成实施例3(式12) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例4-1 对比合成实施例4(式13) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例5-1 对比合成实施例5(式14) mmao <![cdata[cr(acac)<sub>3</sub>]]> 对比实施例6-1 对比合成实施例6(式15) mmao <![cdata[cr(acac)<sub>3</sub>]]>
331、实施例1-2
332、在氩气气氛下,将0.05mmol的四氢呋喃氯化铬(iii)(cr(thf)3cl3)、0.5mmol的根据合成实施例1的式2-1表示的配体化合物和0.5mmol的作为助催化剂的n,n-二甲基苯铵四(五氟苯基)硼酸盐(ab)放入烧瓶中,向其中注入30ml的二氯甲烷并搅拌1小时,并在真空中除去溶剂。然后,将所得物溶解在甲基环己烷中并过滤,并再次在真空中除去溶剂并溶解在甲基环己烷中以制备0.15mm(基于cr)的催化剂溶液。
333、准备容量为600ml的parr反应器,在120℃下施加真空2小时,内部用氩气置换,并将温度降低至70℃。然后,向其中注入180ml的甲基环己烷和2ml(725μmol)的二异丁基氢化铝作为活化剂,并向其中注入5ml(0.75μmol的cr)的催化剂溶液。以1,000rpm进行搅拌2分钟,并打开调节至40巴的乙烯管路的阀门以使反应器内部填充乙烯,然后以1,000rpm进行搅拌60分钟。关闭乙烯管路阀,使用干冰/丙酮浴将反应器冷却至0℃,缓慢排出未反应的乙烯,并向其中注入0.5ml的壬烷(gc内标)。在搅拌10秒后,取出2ml的反应器的液体部分,用水淬灭,使用ptfe注射过滤器过滤由此获得的有机部分以制造gc-fid样品。然后,通过gc(agilent公司,6890n,alltech at-5(30m x 0.32mm id x 0.25μm;序列号12446))分析液体产物的分布。向剩余溶液中添加400ml乙醇/hcl(10vol%的12m hcl水溶液),进行搅拌和过滤,并分析固体产物的量。将由此获得的聚合物在80℃的真空烘箱中干燥过夜。
334、实施例2-2至15-2,和对比实施例1-2至6-2
335、除了如下表2中改变催化剂的类型以外,进行与实施例1-2中相同的方法。
336、[表2]
337、
338、
- 还没有人留言评论。精彩留言会获得点赞!