LPA表达的治疗性抑制的制作方法
本发明关于lpa基因表达的治疗性抑制,且尤其关于sln360分子在预防或治疗与lp(a)水平升高相关的病状方面的治疗用途的有效剂量及剂量方案。此类病状包括中风、动脉粥样硬化、血栓形成及心血管疾病,诸如冠心病及主动脉狭窄。
背景技术:
1、脂蛋白(a)[lp(a)]长期以来视为动脉粥样化血栓形成性心血管疾病的基因决定的独立危险因素。1门德尔(mendelian)随机分组研究不断地证明lp(a)血浆浓度与心肌梗塞、中风、外周动脉疾病及心血管死亡的风险之间的因果关系。2lp(a)浓度在最高分数(大致350nmol/l)的患者终生有患心血管疾病的风险等效于家族性高胆固醇血症。3-4lp(a)水平升高亦与主动脉瓣钙化、主动脉狭窄的发展及更快速进展以及较高速率的主动脉瓣置换相关。5-6尽管一些疗法具有中等lp(a)降低作用,诸如施用烟碱酸或pcsk9抑制剂,但目前尚无针对lp(a)浓度升高的药物治疗获得监管批准。
2、lpa基因编码脂蛋白元(a)[apo(a)],其为一种lp(a)粒子的肝合成中的主要及限速组分。7多年来努力进行研发降低apo(a)的肝产生且由此降低lp(a)血浆浓度的rna靶向疗法。先前1期及2期研究已证实,反义寡核苷酸(aso)派拉卡森(pelacarsen)可随着每周一次施用降低lp(a)血浆浓度高达80%。8
3、sln360为靶向lpa信使rna的短干扰rna(sirna)。sln360为共价连接至三触角n-乙酰基-半乳糖胺(galnac)部分的19聚体sirna。galnac缀合物与几乎完全在肝细胞上表达的去唾液酸糖蛋白受体结合。此方法引起肝细胞中选择性摄取sln360及其中的浓度,使得该药物能够结合及降解wo 2020/099476中描述的编码apo(a)的信使rna。
技术实现思路
1、在第一方面中,本发明提供用于预防或治疗与lp(a)水平升高相关的病状的sln360,其中该sln360用于以100mg至600mg的个别剂量施用。
2、在另一方面中,本发明提供一种预防或治疗有需要的受试者的与lp(a)水平升高相关的病状的方法,其中该sln360以100mg至600mg的个别剂量施用。
3、在另一方面中,本发明提供一种sln360的用途,其用于制备用于预防或治疗与lp(a)水平升高相关的病状的药剂或医药组合物,其中该sln360用于以100mg至600mg的个别剂量施用。
4、因此,在所有方面中,个别剂量可提供例如以下量的sln360:
5、100-600mg、125-600mg、150-600mg、175-600mg、200-600mg、225-600mg、250-600mg、275-600mg、300-600mg、325-600mg、350-600mg、375-600mg、400-600mg、425-600mg、450-600mg、475-600mg、500-600mg、525-600mg、550-600mg或575-600mg;
6、100-575mg、125-575mg、150-575mg、175-575mg、200-575mg、225-575mg、250-575mg、275-575mg、300-575mg、325-575mg、350-575mg、375-575mg、400-575mg、425-575mg、450-575mg、475-575mg、500-575mg、525-575mg或550-575mg;
7、100-550mg、125-550mg、150-550mg、175-550mg、200-550mg、225-550mg、250-550mg、275-550mg、300-550mg、325-550mg、350-550mg、375-550mg、400-550mg、425-550mg、450-550mg、475-550mg、500-550mg或525-550mg;
8、100-525mg、125-525mg、150-525mg、175-525mg、200-525mg、225-525mg、250-525mg、275-525mg、300-525mg、325-525mg、350-525mg、375-525mg、400-525mg、425-525mg、450-525mg、475-525mg或500-525mg;
9、100-500mg、125-500mg、150-500mg、175-500mg、200-500mg、225-500mg、250-500mg、275-500mg、300-500mg、325-500mg、350-500mg、375-500mg、400-500mg、425-500mg、450-500mg或475-500mg;
10、100-475mg、125-475mg、150-475mg、175-475mg、200-475mg、225-475mg、250-475mg、275-475mg、300-475mg、325-475mg、350-475mg、375-475mg、400-475mg、425-475mg或450-475mg;
11、100-450mg、125-450mg、150-450mg、175-450mg、200-450mg、225-450mg、250-450mg、275-450mg、300-450mg、325-450mg、350-450mg、375-450mg、400-450mg或425-450mg;
12、100-425mg、125-425mg、150-425mg、175-425mg、200-425mg、225-425mg、250-425mg、275-425mg、300-425mg、325-425mg、350-425mg、375-425mg或400-425mg;
13、100-400mg、125-400mg、150-400mg、175-400mg、200-400mg、225-400mg、250-400mg、275-400mg、300-400mg、325-400mg、350-400mg或375-400mg;
14、100-375mg、125-375mg、150-375mg、175-375mg、200-375mg、225-375mg、250-375mg、275-375mg、300-375mg、325-375mg或350-375mg;
15、100-350mg、125-350mg、150-350mg、175-350mg、200-350mg、225-350mg、250-350mg、275-350mg、300-350mg或325-350mg;
16、100-325mg、125-325mg、150-325mg、175-325mg、200-325mg、225-325mg、250-325mg、275-325mg或300-325mg;
17、100-300mg、125-300mg、150-300mg、175-300mg、200-300mg、225-300mg、250-300mg或275-300mg;
18、100-275mg、125-275mg、150-275mg、175-275mg、200-275mg、225-275mg或250-275mg;
19、100-250mg、125-250mg、150-250mg、175-250mg、200-250mg或225-250mg;
20、100-225mg、125-225mg、150-225mg、175-225mg或200-225mg;
21、100-200mg、125-200mg、150-200mg或175-200mg;
22、100-175mg、125-175mg或150-175mg;
23、100-150mg或125-150mg;或
24、100-125mg。
25、可能需要个别剂量提供300mg至600mg的量的sln360,例如:
26、300-600mg、325-600mg、350-600mg、375-600mg、400-600mg、425-600mg、450-600mg、475-600mg、500-600mg、525-600mg、550-600mg或575-600mg;
27、300-575mg、325-575mg、350-575mg、375-575mg、400-575mg、425-575mg、450-575mg、475-575mg、500-575mg、525-575mg或550-575mg;
28、300-550mg、325-550mg、350-550mg、375-550mg、400-550mg、425-550mg、450-550mg、475-550mg、500-550mg或525-550mg;
29、300-525mg、325-525mg、350-525mg、375-525mg、400-525mg、425-525mg、450-525mg、475-525mg或500-525mg;
30、300-500mg、325-500mg、350-500mg、375-500mg、400-500mg、425-500mg、450-500mg或475-500mg;
31、300-475mg、325-475mg、350-475mg、375-475mg、400-475mg、425-475mg或450-475mg;
32、300-450mg、325-450mg、350-450mg、375-450mg、400-450mg或425-450mg;
33、300-425mg、325-425mg、350-425mg、375-425mg或400-425mg;
34、300-400mg、325-400mg、350-400mg或375-400mg;
35、300-375mg、325-375mg或350-375mg;
36、300-350mg或325-350mg;或
37、300-325mg。
38、举例而言,个别剂量提供以下量的sln360:约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg或约600mg。
39、关于数值的术语“约”应视为平均值+/-10%,例如+/-5%。
40、因此,个别剂量可提供以下量的sln360:100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg或600mg。
41、在某些实施例中,个别剂量优选提供300mg的量或450mg的量的sln360。
42、应理解,个别剂量中所施用的sln360量通常与接受受试者的体重无关。
43、可能需要经由包含多个剂量或一系列剂量的给药方案向受试者施用sln360。
44、通常,在给药方案下的施用将为每月一次或更不频繁,例如每2月一次(每2个月一次)、每3月一次(每3个月一次)、每4月一次(每4个月一次)、每5月一次(每5个月一次)、每6月一次(每6个月一次)、每7月一次(每7个月一次)、每8月一次(每8个月一次)、每9月一次(每9个月一次)、每10月一次(每10个月一次)、每11月一次(每11个月一次)或每12月一次(每12个月一次)施用。
45、在某些实施例中,在给药方案下的施用优选地为每4月一次或每6月一次。
46、在某些实施例中,个别剂量优选提供300mg的量的sln360,且在给药方案下的施用为每4月一次。
47、在某些实施例中,个别剂量优选提供300mg的量的sln360,且在给药方案下的施用为每6月一次。
48、在某些实施例中,个别剂量优选提供450mg的量的sln360,且在给药方案下的施用为每6月一次。
49、因此连续剂量之间的间隔将通常为一个或多个月。举例而言,剂量之间的间隔可为至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月或至少12个月。
50、在某些实施例中,间隔优选可为至少4个月或至少6个月。
51、在某些实施例中,个别剂量提供优选300mg的量的sln360,且连续剂量之间的间隔优选为至少4个月。
52、在某些实施例中,个别剂量优选提供300mg的量的sln360,且连续剂量之间的间隔优选为至少6个月。
53、在某些实施例中,个别剂量优选提供450mg的量的sln360,且连续剂量之间的间隔优选为至少6个月。
54、举例而言,间隔可为1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月。
55、在某些实施例中,间隔优选可为4个月或6个月。
56、在某些实施例中,个别剂量提供优选300mg的量的sln360,且连续剂量之间的间隔优选为4个月。
57、在某些实施例中,个别剂量优选提供300mg的量的sln360,且连续剂量之间的间隔优选为6个月。
58、在某些实施例中,个别剂量优选提供450mg的量的sln360,且连续剂量之间的间隔优选为6个月。
59、在本发明的上下文中,一个月可为一个日历月或28至31天的时段,例如30天的时段。然而,应理解,精确的每月给药对于任何个别受试者而言可能并不实际。因此,连续剂量可间隔相关数目个月±7天,例如±5天,例如±3天,例如±2天,例如±1天。
60、因此,在指示每月给药时,连续剂量可间隔1个日历月或30天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
61、在指示每2月一次给药时,连续剂量可间隔2个日历月或60天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
62、在指示每3月一次给药时,连续剂量可间隔3个日历月或90天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
63、在指示每4月一次给药时,连续剂量可间隔4个日历月或120天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
64、在指示每5月一次给药时,连续剂量可间隔5个日历月或150天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
65、在指示每6月一次给药时,连续剂量可间隔6个日历月或180天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
66、在指示每7月一次给药时,连续剂量可间隔7个日历月或210天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
67、在指示每8月一次给药时,连续剂量可间隔8个日历月或240天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
68、在指示每9月一次给药时,连续剂量可间隔9个日历月或270天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
69、在指示每10月一次给药时,连续剂量可间隔10个日历月或300天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
70、在指示每11月一次给药时,连续剂量可间隔11个日历月或330天±7天,例如±5天,例如±3天,例如±2天,例如±1天;
71、在指示每12月一次给药时,连续剂量可间隔365天或12个日历月±7天,例如±5天,例如±3天,例如±2天,例如±1天。
72、在某些实施例中,经由包含例如第一剂量、第二剂量、第三剂量及视情况一个或多个后续剂量的给药方案向受试者施用sln360。
73、前两个剂量之间的间隔可为4周,而第二与第三剂量之间及任何后续剂量之间的间隔可为5周。
74、前两个剂量之间的间隔可为4周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
75、前两个剂量之间的间隔可为3周,而第二与第三剂量之间及任何后续剂量之间的间隔可为4周。
76、前两个剂量之间的间隔可为3周,而第二与第三剂量之间及任何后续剂量之间的间隔可为5周。
77、前两个剂量之间的间隔可为3周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
78、前两个剂量之间的间隔可为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为3周。
79、前两个剂量之间的间隔可为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为4周。
80、前两个剂量之间的间隔可为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为5周。
81、前两个剂量之间的间隔可为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
82、前两个剂量之间的间隔可为1周,而第二与第三剂量之间及任何后续剂量之间的间隔可为3周。
83、前两个剂量之间的间隔可为1周,而第二与第三剂量之间及任何后续剂量之间的间隔可为4周。
84、前两个剂量之间的间隔可为1周,而第二与第三剂量之间及任何后续剂量之间的间隔可为5周。
85、前两个剂量之间的间隔可为1周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
86、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
87、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔可为4周。
88、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
89、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为4周。
90、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔可为6周。
91、第一剂量提供100mg-600mg的量的sln360,且第二、第三及任何后续剂量提供200mg-600mg的量的sln360。在某些实施例中,第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
92、在某些实施例中,第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
93、在某些实施例中,第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
94、在某些实施例中,第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
95、在某些实施例中,第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
96、在某些实施例中,第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
97、在某些实施例中,第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
98、在某些实施例中,第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
99、在某些实施例中,第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
100、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
101、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
102、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
103、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
104、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
105、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
106、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
107、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
108、在某些实施例中,前两个剂量之间的间隔为4周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
109、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
110、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
111、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
112、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
113、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
114、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
115、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
116、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
117、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
118、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
119、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
120、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
121、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
122、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
123、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
124、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
125、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
126、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为4周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
127、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
128、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
129、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
130、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
131、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
132、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
133、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
134、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
135、在某些实施例中,前两个剂量之间的间隔为2周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
136、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
137、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
138、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供200mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
139、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
140、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
141、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供300mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
142、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供200mg的量的sln360。
143、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供300mg的量的sln360。
144、在某些实施例中,前两个剂量之间的间隔为3周,而第二与第三剂量之间及任何后续剂量之间的间隔为6周,其中第一剂量提供450mg的量的sln360,且第二、第三及任何后续剂量提供450mg的量的sln360。
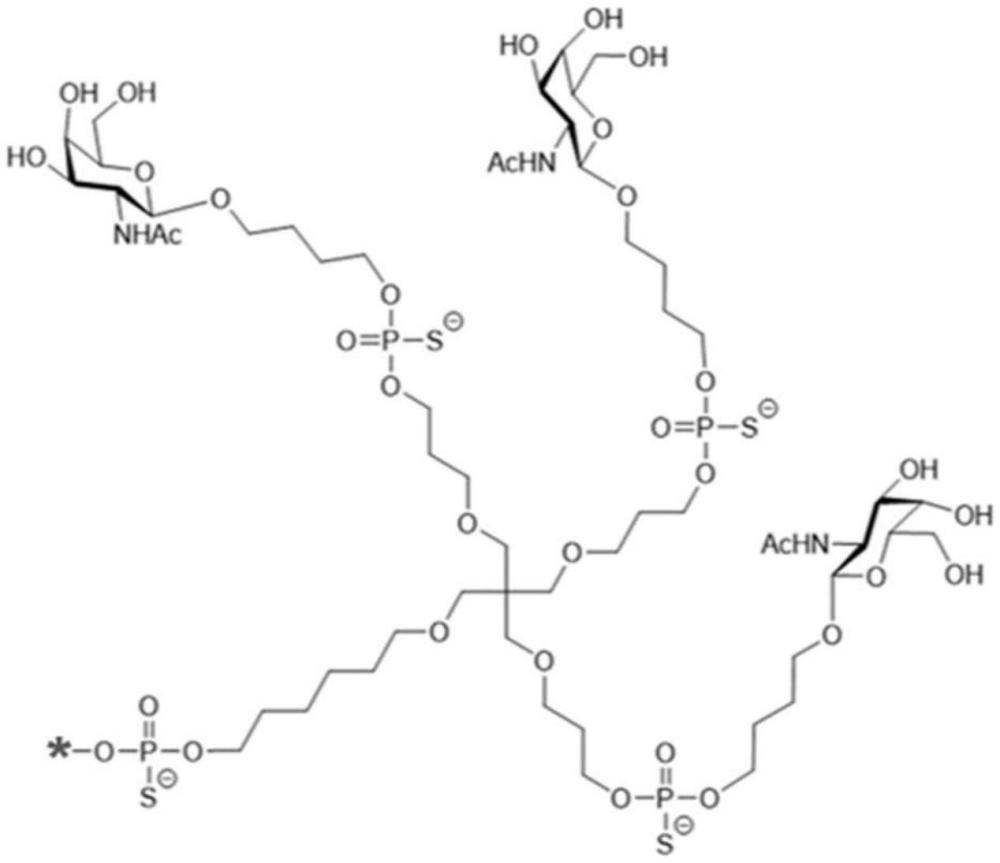
145、sln360
146、sln360为能够抑制人类lpa基因表达的双链rna(dsrna)或sirna。不希望受理论所束缚,拒信藉由rna干扰进行抑制。
147、sln360由以下组成:
148、(i)具有以下序列的第一(反义)链:
149、ma(ps)fu(ps)ma fa mc fu mc fu mg fu mc fc ma fu mu fa mc(ps)fc(ps)mg
150、及
151、(ii)具有以下序列的第二(有义)链:
152、[m]-mc mg mg mu ma ma fu fg fg ma mc ma mg ma mg mu mu(ps)ma(ps)mu
153、其中[m]为与第二链的5'端连接且具有以下结构的三触角配体部分:
154、
155、因此,配体部分[m]的末端硫代磷酸酯基直接键结(经由“*”指示的“自由”键)至第二链的5'端核苷酸的5'位(亦即,至第二链的5'端的mc残基的2'-o-甲基核糖部分的5'-碳)。
156、在上式的上下文中,使用以下缩写:
157、
158、在相邻核苷酸之间未特定指示基团时,其藉由常规磷酸二酯键联连接。因此,第一链在三个5'端末端核苷酸中的各者与三个3'端末端核苷酸中的各者之间含有硫代磷酸酯键联(亦即在链的各端含有2个硫代磷酸酯键联)。第一链的其他核苷酸藉由磷酸二酯键联连接。第二链在三个3'端末端核苷酸中的各者之间含有硫代磷酸酯键联(亦即仅在链的3'端含有2个硫代磷酸酯键联)。第一链的其他核苷酸藉由磷酸二酯键联连接。
159、序列以常规5'至3'方向显示。
160、第一及第二链分别由wo 2020/099476的seq id no:165及164所描述,该案将sln360描述为“缀合物21”。配体部分[m](包括其与第二链的硫代磷酸酯连接)在该文献中称为“[st23(ps)]3c6xlt(ps)”。
161、病状
162、与lp(a)脂蛋白水平升高(例如与含lp(a)粒子水平升高)相关的病状包括心血管疾病及一些癌症(包括前列腺癌)。
163、因此,病状可例如为心血管疾病(例如动脉粥样硬化性心血管疾病或动脉粥样硬化性脑血管疾病),诸如中风(例如缺血性中风)、动脉粥样硬化、血栓形成、冠心病、主动脉狭窄(例如钙化性主动脉狭窄)、高脂质血症、血脂异常、冠状动脉疾病、外周动脉疾病、腹部主动脉瘤、心脏衰竭(例如继发于缺血性心肌病的心脏衰竭)或家族性高胆固醇血症,全部均在与lp(a)水平升高相关时优选。
164、或者,病状可为癌症,例如前列腺癌。
165、病状与受试者中lp(a)(亦即,脂蛋白a)升高(例如与受试者中含lp(a)粒子水平升高)相关。受试者可为成人(18岁或以上)或儿童(18岁以下)。
166、应理解,lp(a)或含lp(a)粒子的相关水平通常在受试者的血清中测量。血清中含lp(a)粒子的期望水平一般描述为低于14mg/dl的水平。升高的含lp(a)粒子水平为如下水平:受试者血清中至少14,优选至少20,更优选地至少30,更优选至少40且最优选至少50mg/dl或至少60mg/dl含lp(a)粒子。
167、术语“含lp(a)粒子”及“lp(a)粒子”可互换使用。
168、医药组合物
169、sln360可调配用于例如以医药组合物的一部分、单独或与一种或多种其他药剂组合施用。医药组合物可包含医药学上可接受的赋形剂,诸如稳定剂、防腐剂、稀释剂、缓冲剂或其类似者。举例而言,sln360分子可与递送媒剂(例如脂质体)及/或赋形剂(诸如载剂或稀释剂)组合。亦可添加其他药剂,诸如防腐剂及稳定剂。递送核酸的方法为本领域已知的且在本领域技术人员的知识范围内。
170、医药组合物可为无菌可注射水性悬浮液或溶液,或呈冻干形式,或黏着、吸收或包括至任何其他合适的医学的载剂物质(诸如丸粒、锭剂、胶囊、纳米粒子、凝胶、锭剂、珠粒或类似结构)或至其中。
171、然而,简单的水溶液可为适当的,例如在6.4-8.4的生理学上可接受的ph值下。可能需要组合物的ph为7.6+/-0.1。
172、sln360或医药组合物可藉由任何适当途径,例如经由皮下、静脉内、经口、经直肠或腹膜内施用来施用(或经调配以用于施用)。其可藉由注射施用(或经调配以用于施用)。优选地,施用藉由皮下注射,例如递送至腹部、上臂或大腿中。
173、本发明进一步提供sln360的个别剂型,从而提供如本文所描述的sln360的个别剂量。优选地,个别剂型用于藉由皮下注射施用。其可为如所描述的水溶液,例如具有6.4-8.4的ph,例如具有7.6+/-0.1的ph。
174、术语“患者”、“受试者(subject)”及“个体(individual)”可互换使用且指人类或非人类动物。此类术语包括哺乳动物,诸如人类、非人类灵长类动物(例如类人猿、旧大陆猴或新大陆猴)、家畜动物(例如牛科动物、猪科动物)、伴侣动物(例如犬科动物、猫科动物)及啮齿动物(例如小鼠及大鼠)。然而,在本发明的上下文中,受试者通常为人类。受试者可为成人(18岁或以上)或儿童(18岁以下)。因此,除非上下文另外要求,否则术语lpa、lpa、lp(a)、“含lp(a)粒子”及“lp(a)粒子”通常应用于指人类蛋白质(或脂蛋白)及核酸。
175、如本文所用,“治疗(treating)”或“治疗(treatment)”及其语法变体指用于获得有益或所需要临床结果的方法。该术语可指减缓病状、病症或疾病的发作或发展速率,减少或缓解与其相关的症状,产生病状的完全或部分消退,或以上中的任一者的某一组合。出于本发明的目的,有益或所需要临床结果包括但不限于:症状减少或缓解、疾病程度减轻、疾病病况稳定(亦即未恶化)、疾病进展推迟或减缓、疾病病况改善或缓和及缓解(无论部分地或完全地),无论可检测或不可检测。“治疗”亦可意指相对于在未接受治疗的情况下的预期存活时间延长存活期。因此,需要治疗的受试者(例如人类)可为已罹患所讨论的疾病或病症的受试者。术语“治疗”包括与未进行治疗相比抑制或降低病理状态或症状的严重度增加,且未必意指暗示使相关疾病、病症或病状完全停止。
176、如本文所用,术语“预防”及其语法变体指一种用于抑制或预防病状、疾病或病症的发展、进展或发作次数或发作率的方法,且可关于病变及/或症状。出于本发明的目的,有益或所需要临床结果包括但不限于预防、抑制或减缓疾病的症状、进展或发展,无论可检测或不可检测。因此,需要预防的受试者可为尚未罹患所讨论的疾病或病症的受试者。术语“预防”包括与未进行治疗相比减缓疾病发作,且未必意指暗示永久性预防相关疾病、病症或病状。因此,在某些情形下,病状的“预防”指降低罹患病状的风险,或预防、抑制或延迟与病状相关的症状的发展。应理解,预防可视为治疗或疗法。
177、本发明的医药组合物及药剂可以治疗或预防有效量,亦即有效剂量向受试者施用。如本文所用,“有效量”、“预防有效量”、“治疗有效量”或“有效剂量”为组合物(例如治疗性组合物或药剂)在受试者中产生至少一种所需治疗作用(诸如预防或治疗目标病状或有利地缓解与病状相关的症状)的量。
178、如本文所用,术语“医药学上可接受的盐”指对施用所讨论的盐的患者或受试者无害的盐。其可为例如选自酸加成盐及碱性盐的盐。酸加成盐的实例包括氯化物盐、柠檬酸盐及乙酸盐。碱性盐的实例包括如下盐,其中阳离子选自碱金属阳离子,诸如钠或钾离子;碱土金属阳离子,诸如钙或镁离子;以及经取代的铵离子,诸如n(r1)(r2)(r3)(r4)+类型的离子,其中r1、r2、r3及r4将通常独立地表示氢,视情况经取代的c1-6烷基或视情况经取代的c2-6烯基。相关c1-6烷基的实例包括甲基、乙基、1-丙基及2-丙基。可能相关的c2-6烯基的实例包括乙烯基、1-丙烯基及2-丙烯基。医药学上可接受的盐的其他实例描述于“remington's pharmaceutical sciences”,第17版,alfonso r.gennaro(编),markpublishing company,easton,pa,usa,1985(及其最新版本);“encyclopaedia ofpharmaceutical technology”,第3版,james swarbrick(编),informa healthcare usa(inc.),ny,usa,2007;及j.pharm.sci.66:2(1977)中。“医药学上可接受的盐”定性保留母体化合物的所需生物活性,而相对于化合物不赋予任何非所需作用。医药学上可接受的盐的实例包括酸加成盐及碱加成盐。酸加成盐包括衍生于无毒无机酸的盐,诸如盐酸、硝酸、亚磷酸、磷酸、硫酸、氢溴酸、氢碘酸及其类似物;或衍生于无毒有机酸的盐,诸如脂族单羧酸及脂族二羧酸、苯基取代的烷酸、羟基烷酸、芳族酸、脂族及芳族磺酸及其类似者。碱加成盐包括衍生于碱土金属的盐,诸如钠、钾、镁、钙及其类似者;以及衍生于无毒有机胺的盐,诸如n,n'-二苯甲基乙二胺、n-甲基葡糖胺、氯普鲁卡因(chloroprocaine)、胆碱、二乙醇胺、乙二胺、普鲁卡因(procaine)及其类似者。
179、术语“医药学上可接受的载剂”包括标准医药学载剂中的任一者。用于治疗用途的医药学上可接受的载剂在医药领域中为熟知的,且描述于例如remington'spharmaceutical sciences,mack publishing co.(a.r.gennaro编,1985)中。举例而言,可使用弱酸性或生理ph下的无菌盐水及磷酸盐缓冲盐水。例示性ph缓冲剂包括磷酸盐、柠檬酸盐、乙酸盐、三(羟甲基)胺基甲烷(tris)、n-三(羟甲基)甲基-3-胺基丙磺酸(taps)、碳酸氢铵、二乙醇胺、组氨酸(其为优选的缓冲剂)、精氨酸、赖氨酸或乙酸盐或其混合物。该术语进一步涵盖美国药典(us pharmacopeia)中列举的用于动物(包括人类)的任何药剂。“医药学上可接受的载剂”包括任何及所有生理学上可接受,亦即兼容溶剂、分散介质、包衣、抗微生物剂、等渗剂及吸收延迟剂及其类似者。在某些实施例中,载剂适用于静脉内、肌肉内、皮下、非经肠、脊椎或表皮施用(例如藉由注射或输注)。视选择的施用途径而定,核酸可包覆在一种或多种材料中,旨在保护化合物免受酸及其他天然失活条件的作用,当藉由特定施用途径向受试者施用时,核酸可能暴露在此等条件下。
180、在本发明的情形下,术语“溶剂合物”指溶质(在此情况下,根据本发明的核酸化合物或其医药学上可接受的盐)与溶剂之间形成的既定化学计量的复合物。在此方面,溶剂可为例如水或另一医药学上可接受的(通常)小分子有机物种,诸如但不限于乙酸或乳酸。当所讨论的溶剂为水时,此类溶剂合物通常称为水合物。
181、现将参考以下非限制性表格、图式及实例描述本发明。
182、图和表
183、图1.患者通过试验流程。
184、图2a至图2b.a图显示对于安慰剂及各sln360剂量组而言,脂蛋白(a)浓度随着时间推移的变化。中值脂蛋白(a)浓度显示为实心圆,且框显示此等值中的各者的四分位数范围。星号显示在各时间点的平均浓度。b图.显示对于安慰剂及各sln360剂量组而言,脂蛋白(a)浓度随着时间推移的百分比变化。脂蛋白(a)浓度的中值百分比变化显示为实心圆,且框显示此等值中的各者的四分位数范围。星号显示在各时间点的浓度的平均百分比变化。
185、图3a至图3b.a图显示对于安慰剂及各sln360剂量组而言,低密度脂蛋白胆固醇随着时间推移的平均百分比变化。平均百分比变化显示为实心圆与显示为误差条的95%信赖区间。b图显示对于安慰剂及各sln360剂量组而言,脂蛋白元b随着时间推移的平均百分比变化。平均百分比变化显示为实心圆与显示为误差条的95%信赖区间。
186、图4.研究示意图。第5组:两个剂量,200mg q4周。第6组:两个剂量,300mg q8周。
187、图5.0-150天的时间平均结果。
188、图6.30-150天的时间平均结果。
189、表1.参与者的基线特征
190、表2.安全性评定
191、表3.主要功效结果:脂蛋白(a)浓度随着时间推移的变化
192、表4.sln360对于总胆固醇的影响
193、表5.sln360对于低密度脂蛋白胆固醇的影响
194、表6.sln360对于脂蛋白元(b)的影响
195、表7.sln360对于经氧化ldl的影响
196、表8.药物动力学参数
197、实例
198、方法
199、研究群体
200、年龄≥18岁且无已知动脉粥样硬化性心血管疾病(atheroscleroticcardiovascular disease;ascvd)、lp(a)浓度≥150nmol/l且身体质量指数为18至45kg/m2的成人符合参与条件。育龄妇女在筛选时需要具有阴性血清妊娠测试且在治疗前1天具有阴性尿液妊娠测试。所有参与者(男性及女性)同意自筛检期开始直至最后一次施用研究药物后3个月遵守避孕要求。排除以下参与者:中度或重度肝硬化、hiv或b型或c型肝炎阳性测试或可能会增加药物诱发的肝损伤的风险或影响sln360的药理学的其他肝病。若先前未诊断患有糖尿病,则参与者需要hba1c<6.5%,或若已知患有糖尿病,则需要<8.5%。
201、实验室排除标准包括血小板计数低于正常值下限,或丙氨酸转氨酶或天冬氨酸转氨酶>1.5×正常值上限(upper limit of normal;uln)。其他实验室排除标准为总胆红素>uln,除了患有吉尔伯特氏症候群(gilbert's syndrome)的参与者,或估计肾小球滤过率<60ml/min/1.73m2。可能会影响lp(a)水平的药品需要在入选前剂量稳定至少8周,包括抗雌激素或雌激素受体调节剂、pcsk9抑制剂、处方剂量烟碱酸、纤维酸酯、斯他汀类(statins)或依泽麦布(ezetimibe)。亦排除如下参与者:若其在第一次剂量的研究药物前90天(或10个半衰期,无论哪个更长)内已接受任何其他研究药剂或在12个月内已接受其他寡核苷酸疗法。排除如下参与者:在第一次剂量的研究药物前7天内具有临床上显著病痛、sars-cov-2阳性核酸测试、或可能干扰结果解释的任何不受控制的或严重疾病。
202、研究程序
203、此研究根据赫尔辛基宣告及委员会(declaration of helsinki and council)的国际医学科学组织国际伦理指南(international organizations of medical sciencesinternational ethical guidelines)进行。使用交互响应技术,将四个递增单一剂量组随机分组为藉由在腹部皮下注射给予的30mg、100mg、300mg或600mg sln360或安慰剂(氯化钠0.9%)。使用至多两个注射部位来施用所需剂量。对于各组而言,随机分配2名参与者接受安慰剂及6名受试者分配至sln360,其中各组中的前两名参与者使用前哨(sentinel)给药。描述研究设计的示意图提供于图4中。研究者、研究参与者及试验委托者对于研究药物不知情,但委派地点人员(例如地点药剂师)为非盲的。在剂量施用之后,在临床研究单位(clinical research unit;cru)监测参与者24小时,在此期间获得生命征象、简化身体检查、血液及尿液样本以及连续心电图。cru人员亦评定参与者的副作用及注射部位不良事件。
204、在药物施用之后,参与者安排在第7、14、30、45、60、90及150天问诊。在各次问诊时评定研究药物施用的任何副作用的存在及程度。在所有返回问诊时,获得血液样本用于脂蛋白(a)水平、其他生物标记、药物动力学分析及安全性实验室研究,且若有症状指示,则进行针对性身体检查。在roche c502自动分析仪上用粒子增强型浊度分析测量lp(a)浓度。此分析藉由五个独立标准品校准,其中各值以nmol/l为单位,可追踪至who/ifcc的lp(a)的参考材料,且已证实受apo(a)的粒径变化的影响最小。
205、研究终点
206、作为首次用于人体研究,sln360的安全性及耐受性定义为所关注的主要结果。安全性评定包括生命征象的变化、身体检查、化学反应的ecg及实验室评定、血液学、尿液分析及凝血参数。评定包括治疗引发的不良事件(treatment emergent adverse event;teae)及特别受关注的不良事件,其包括注射部位不良事件或任何鉴别的剂量限制性毒性。注射部位不良事件由研究人员使用不良事件常见术语标准(common terminology criteriafor adverse events;ctcae)9第5版及fda认可量表10来分级。
207、主要功效评定为自基线至给药后150天,sln360对于血浆脂蛋白(a)浓度的影响。次要目标包括评定sln360的药物动力学(pk)。探索性目标包括评定对于其他脂质参数(ldl-c、hdl-c、总胆固醇及三酸甘油酯)、脂蛋白元b、经氧化ldl、发炎标记及纤维蛋白溶酶原的影响。
208、统计分析
209、将各组的分配至安慰剂的受试者合并以产生总安慰剂治疗组。sln360治疗组按剂量分别呈现。叙述统计学用于概述治疗组的安全性及lp(a)变化。对于类别变量,呈现各类别内受试者的频率及百分比的概述表格。对于连续变量,参与者数目及概述统计资料按治疗组呈现。对于药物动力学影响,血浆sln360浓度包括最大血浆浓度(cmax)、达到峰值血浆浓度的时间(tmax)及至最后可测量浓度的浓度曲线下面积(auc(0-last))。不输入遗漏数据。未进行正式统计学测试且因此未报导p值。影响sln360的单一递增剂量的预定方案应与试验之后续多次递增剂量期分开报导。此报导描述单次递增剂量部分的结果。
210、结果
211、图1显示患者通过试验的流程。表1报导试验参与者的基线特征。参与者的平均(sd)年龄为50岁(13.5),且47%为男性。尽管参与者中无一者患有已知的预先存在的临床上明显心血管疾病,但9%中存在高血压且3%中存在糖尿病。基线特征在所有治疗组中呈现广泛类似。安慰剂、30mg、100mg、300mg及600mg治疗组的中值(iqr)基线lp(a)浓度分别为238(203,308)、171(142,219)、217(202,274)、285(195,338)及231(179,276)nmol/l。安慰剂、30mg、100mg、300mg及600mg治疗组的ldl-c的平均(sd)水平分别为99(48)、113(38)、121(46)、100(25)及108(54)mg/dl。
212、图2a及图2b显示在注射后150天,各治疗组的lp(a)浓度随着时间推移的绝对及百分比变化。表3显示在各时间点绝对及百分比变化的中值及iqr。安慰剂、30mg、100mg、300mg及600mg剂量的以nmol/l为单位的lp(a)的最大中值(iqr)变化分别为-20(-61,3)、-89(-119,-61)、-185(-226,-163)、-268(-292,-189)及-227(-270,-174)。安慰剂、30mg、100mg、300mg及600mg组的最大中值(iqr)百分比变化分别为-10%(-16,1%)、-46%(-64,-40%)、-86%(-92,-82%)、-96%(-98,-89%)及-98%(-98,-97%)。所有治疗组的lp(a)水平的百分比变化的最低点在给药后30至60天之间达成。(图2)。浓度逐渐自最低点上升,但对于100mg、300mg及600mg治疗组,直至150天并未恢复至基线值。在施用后150天,300mg及600mg剂量的中值lp(a)浓度分别低于基线>70%及>80%。
213、测定时间平均降低以进一步告知给药频率及更优选评价潜在临床益处。图5及图6分别显示时间平均数据,包括直至第150天(保守估计,因为其包括任何治疗作用前的初始基线)的总观测期;及第30-150天(更反映在初始给药达到最低点后的药物效果)的观测期。时间平均值视为适用于评估多次给药的累积效果,从而捕获药物效果的峰值及谷值。
214、sln360产生含脂蛋白元(b)脂蛋白的中等的剂量依赖性减少(表4-7)。在施用600mg剂量后,总胆固醇的平均水平最大降低了18%且ldl-c的平均水平最大降低了26%。(图3a及表4、5)。在较低剂量下观测到较小降低。脂蛋白元b的平均水平的最大降低为24%,其在600mg剂量后30天测量到;及19%,其在300mg剂量后14天测量到。(图3b及表6)。600mg剂量组中经氧化ldl的平均水平最大降低了20%,且300mg剂量组中为11%,其在持续至150天具有600mg组中的类似降低。(表7)。不存在sln360对于三酸甘油酯及hdl-c的影响的证据。表8显示sln360的血浆药物动力学广泛地与剂量成比例。
215、表2报导各治疗组的安全性结果,包括按ctcae量表分级的注射部位不良事件的评定。10
216、teae一般为轻度,最通常为低等级注射部位事件(1及2级)及头痛,其中无一者导致参与者退出。(表2)。在第45天,在第38天接受sars-cov-2疫苗之后,容许最低剂量组(30mg)中的单个参与者由于发热及严重头痛去医院,该发热及严重头痛由研究者视为sars-cov-2疫苗的影响。在第49天进行随后计划的第45天问诊,且发现参与者的丙氨酸转氨酶(alt)及天冬氨酸转氨酶(ast)具有>3×uln值,且胆红素无升高。ast及alt在常规第60天实验室测试时恢复至正常。
217、在施用后首个24小时内出现c反应性蛋白(crp)的短暂剂量依赖性增加。在600mg剂量组中,在24小时,crp自1.0mg/l中值上升至16.3mg/l,接着在第14天快速降低达到1.1mg/l。(未显示)。
218、嗜中性粒细胞亦在首个24小时期间增加,在第7天问诊恢复至正常。
219、在资料审查之后,src建议延长两个最高剂量组的参与者的lp(a)水平的追踪,自150天至365天(1年)。此等延长研究包括3名安慰剂受试者、5名第3组受试者(300mg;4名受试者完成)及6名第4组受试者(600mg)。在第365天,300mg及600mg组中的一些受试者仍呈现高达基线50%的lp(a)的实质上基因敲减,而安慰剂组中的受试者全部均在第365天恢复至基线。在第365天,两个最高剂量组中的任一者中未观测到与研究药物相关的新的安全性结果及严重副作用。
220、讨论
221、lp(a)浓度大于150nmol/l(大致60mg/dl)的患者包含大致20%的群体,且与发展ascvd及主动脉瓣狭窄的风险极大增加相关。4-5apollo试验登记血浆lp(a)浓度超过此临限值的参与者。基因测定血浆lp(a)水平,且其不受降低ldl-c及三酸甘油酯或升高hdl-c的生活方式干预(诸如膳食及运动)影响。在不存在有效lp(a)降低药物疗法的情况下,此危险因素在传统上已视为基本上不可治疗的。使用rna干扰的近期发展已使得有可能选择性地且实质地降低lp(a)。此等药物中第一个到达3期的反义链寡核苷酸(aso)派拉卡森(pelacarsen)在2期试验中每周一次注射,随后以每月疗法发展的情况下使lp(a)降低高达80%。8
222、当前试验检查使用降解编码脂蛋白元(a)产生的信使rna的sirna(sln360)预防肝组装lp(a)粒子的替代性方法。11尽管sln360仍处于早期研发中,但当前1期研究的初步结果鼓舞人心,其中在施用300mg及600mg剂量后,中值lp(a)浓度降低高达98%,且持续中值降低在第150天分别超过70%及80%。(表3及图2)。在数据审查之后,src建议延长两个最高剂量组(第3及4组)的参与者的lp(a)水平的追踪,自150天至一年。在第365天,在此等两个最高剂量组的受试者中未观测到新的与研究药物相关的安全性结果及严重副作用,且相较于安慰剂组中的受试者,各组的一些受试者中仍存在lp(a)的实质上基因敲减的迹象。在1期研究中,评估安全性及耐受性为主要目标。当前研究较小,仅包括无已知心血管疾病的32名参与者,在单次施用sln360后研究150天。由于此疗法靶向肝细胞中的lp(a)产生,所以该研究测量肝功能的若干标记以监测肝毒性。在研究期间,在接受最低剂量(30mg)的单个患者中观测到肝酶(ast及alt)短暂3倍升高的一次发作,暂时与sars-cov-2疫苗接种相关。先前已描述在covid疫苗接种后肝酶升高。12未观测到其他临床上重要的肝功能紊乱。关于肝安全性的确定性结论是不可能的,因为仅少量参与者进行短时间治疗。
223、类似于其他rnai疗法,观测到低等级注射部位不良事件(表2)。此等不良事件为自我限制性的且无持续作用,并不会导致参与者退出。在施用后前7天内观测到发炎生物标记(包括crp及嗜中性粒细胞)的短暂性剂量依赖性增加。此等短期增加的临床意义不明确。在一些先前aso疗法的初始研发期间,在较高每周给药下观测到血小板减少症,但我们在用此galnac sirna的当前研究中并未观测任何临床上相关血小板减少。13未来研究将需要用多次剂量持续较长暴露时间来治疗患者以更确定地确立此sirna治疗剂的安全性。
224、当前研究亦检查sln360对于一系列脂质及脂蛋白(包括ldl-c、apob、三酸甘油酯、hdl-c及经氧化ldl)的影响。ldl-c及apob两者均会适度地降低,最大约25%,在最高剂量下最明显。(图3a及图3b,表5及6)。预期ldl-c及apob会适度减少,因为当前分析亦测量lp(a)粒子内所含有的ldl-c及apob的一部分。14因此,随着lp(a)降低,所测量的ldl-c及apob浓度亦下降。经氧化ldl存在于lp(a)粒子中且为促炎性的,其可能导致动脉粥样化血栓形成性事件的风险。15经氧化ldl的平均值最大降低20%,且在低剂量组实质上仍低于基线持续45-60天及在600mg剂量组则达150天。(表7)。
225、经由rna干扰抑制翻译逐渐用于治疗药物研发以抑制肝产生特定目标蛋白。11sirna为双链rna,其中引导(反义链)及乘客(有义)链设计成用含有与引导链互补的序列的mrna特异性抑制目标基因的翻译。一旦sirna进入细胞,则将其并入rna诱导的静默复合物(rna-induced silencing complex;risc)中。将引导链及乘客链分开,使乘客链裂解及降解,且剩余单链sirna引导链与目标mrna结合,从而经由催化机制裂解,使得引导链为完整的且可用于降解目标mrna的其他复本(copy)。裂解的mrna离开risc且被细胞外切酶识别为异常的且降解。此方法防止此特定mrna翻译成蛋白质。以此方式,sirna疗法可具有极长的作用持续时间。最近公开的奥帕斯仑(olpasiran)(一种靶向lp(a)的不同sirna)1期研究亦显示lp(a)的较大的剂量依赖性且持久降低。16
226、此试验中使用的sirna与衍生自半乳糖的糖galnac结合,使得能够将sln360靶向递送至肝。此方法现用于当前出售或开发的大多数肝脏定向的rna干扰治疗剂中。galnac与在肝细胞表面上高度表达的去唾液酸糖蛋白受体结合,导致对缀合物的快速胞吞作用。在进入肝细胞之后,胞内体成熟期间的酸化引起将sirna递送至细胞的galnac配体的解离。肝细胞中sln360的选择性更新降低降解仅仅在肝细胞中表达的lpa mrna所需的此sirna的施用剂量,转而限制全身性暴露。
227、将需要较长暴露及重复给药来评定药效作用持续时间且进一步评估药物安全性。在患有稳定ascvd的受试者中进行sln360的多次递增剂量研究以进一步评定其作用(nct04606602)。尽管当前研究的规模较小,但单次剂量的作用量值及持续时间为有前景的且保证进一步研发。
228、本文中参考的所有文献均以全文引用的方式并入本文中。
229、参考文献
230、1.boerwinkle e,leffert cc,lin j,lackner c,chiesa g,and hobbshh.apolipoprotein(a)gene accounts for greater than 90%ofthe variation inplasma lipoprotein(a)concentrations.j clin invest.1992;90(1):52-60.doi.org/10.1172/jci115855
231、2.burgess s,ference ba,staley jr,freitag df,mason am,nielsen sf,willeit p,young r,surendran p,karthikeyan s,boltontr,peters je,kamstrup pr,-hansen a,benn m,langsteda,schnohr p,vedel-krogh s,kobylecki cj,fordi,packard c,trompet s,jukema jw,sattar n,di angelantonio e,saleheen d,howsonjmm,nordestgaard bg,butterworth as,danesh j;european prospectiveinvestigation into cancer and nutrition-cardiovascular disease(epic-cvd)consortium.association oflpa variants with risk of coronary disease and theimplicationsfor lipoprotein(a)-lowering therapies:a mendelianrandomizationanalysis.jama cardiol.2018 jul 1;3(7):619-627.doi:10.1001/jamacardio.2018.1470.pmid:29926099;pmcid:pmc6481553.
232、3.pia r.kamstrup,md,marianne benn,md,phd,anne-hansen,md,dmsc,and g.nordestgaard,md,dmsc.extreme lipoprotein(a)levels and riskof myocardialinfarction in the general population.the copenhagen cityheartstudy circulation.2008;117:176-184.
233、4.cybulska b,-latoszek l,penson pe,banach m.what do weknow about the role of lipoprotein(a)in atherogenesis 57years after itsdiscovery?prog cardiovasc dis.2020 may-jun;63(3):219-227.doi:10.1016/j.pcad.2020.04.004.epub 2020 apr8.pmid:32277995.
234、5.p.r.kamstrup,a.tybjaerg-hansen,b.g.nordestgaardelevated lipoprotein(a)and risk of aortic valve stenosis in the generalpopulation j am collcardiol,63(2014),pp.470-477
235、6.r.capoulade,k.l.chan,c.yeang,et al..oxidizedphospholipids,lipoprotein(a),and progression of calcific aortic valvestenosis.j am collcardiol,66(2015),pp.1236-1246
236、7.koschinsky ml,marcovina sm,may lf,gabel br.analysis of themechanism of lipoprotein(a)assembly.clin genet.1997 nov;52(5):338-46.doi:10.1111/j.1399-0004.1997.tb04351.x.pmid:9520124.
237、8.tsimikas s,ekarwatowska-prokopczuk e,gouni-berthold ietal.lipoprotein(a)reduction in persons with cardiovasculardisease.n engl j med2020;382:244-255 doi:10.1056/nejmoa1905239.
238、9.common terminology criteria for adverse events(ctcae)version 5.0published:november 27,2017ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_8.5x11.pdf
239、10.guidance for industry toxicity grading scale for healthyadult andadolescent volunteers enrolled in preventive vaccineclinical trialswww.fda.gov/media/73679/download
240、11.aaron d.springer and steven f.dowdy.nucleic acidtherapeutics.jun2018.109-118.http://doi.org/10.1089/nat.2018.0736
241、12.mann r,sekhon s,sekhon s.drug-induced liver injuryafter covid-19vaccine.cureus.2021;13(7):e16491.published2021 jul 19.doi:10.7759/cureus.16491
242、13.sewing s,roth ab,winter m,dieckmann a,bertinetti-lapatki c,tessiery,et al.(2017)assessing single-strandedoligonucleotide drug-induced effectsin vitro reveals key risk factorsfor thrombocytopenia.plos one 12(11):e0187574.doi.org/10.1371/journal.pone.0187574
243、14.yeang c,witztum jl,tsimikas s.novel method forquantification oflipoprotein(a)-cholesterol:implications forimproving accuracy of ldl-cmeasurements.j.lipid res.(2021)62100053
244、15.tsimikas s.,brilakis es,m.d.,miller er.etal.oxidizedphospholipids,lp(a)lipoprotein,and coronary artery disease.nengl jmed 2005;353:46-57 doi:10.1056/nejmoa043175
245、16.koren,m.j.,moriarty,p.m.,baum,s.j.et al.preclinicaldevelopment andphase 1 trial of a novel sirna targetinglipoprotein(a).nat med(2022).https://doi.org/10.1038/s41591-021-01634-w。
- 还没有人留言评论。精彩留言会获得点赞!