用于经由CAV-2介导的SCN1A表达盒的递送提供外源性Nav1.1活性的载体、组合物和方法与流程
背景技术:
1、dravet综合征(ds)是一种罕见且严重的遗传性神经形式的发育性癫痫脑病(dee)。患有ds的儿童在出生后的前六个月似乎发育正常,但随后开始表现出热性癫痫发作。在接下来的几个月期间,复发性难治性自发性癫痫发作变得越来越频繁,并且开始全面的发育迟缓。疾病进展包括智力障碍、行为和运动障碍以及高死亡率。这是一种更为人所知的罕见疾病,其中癫痫是主要症状之一。在学年早期,在疾病的慢性期期间,癫痫发作的频率下降,但非癫痫共病持续存在。
2、先前称为婴儿的严重肌阵挛性癫痫,ds在大多数情况下是由scn1a的两个拷贝之一中的功能缺失(lof)突变引起的。绝大多数病例是由scn1a的一个拷贝中的新生突变引起的,该突变导致lof并且因此导致电压门控钠通道nav1.1的活性的单倍剂量不足。由于这些突变,患有ds的患者未能产生足够水平的功能性nav1.1钠通道,从而阻止抑制性神经元正常放电。结果是大脑兴奋和抑制之间的不平衡,其导致难治性癫痫、智力障碍以及行为和运动障碍。
3、用于治疗ds的第一代疗法主要集中于解决症状,例如,通过使用抗癫痫药物改善癫痫发作控制。这包括针对传统癫痫靶点(诸如gaba受体)的化合物,以及靶向以前未用于癫痫的新途径的新型一流治疗剂。近年来,ds已受到制药行业的极大关注。在来自biocodex的diacomit(司替戊醇(stiripentol))和来自gw pharmaceuticals的epidiolex/epidyolex(大麻二酚口服制剂)的批准后,zogenix的fintepla(芬氟拉明(fenfluramine))最近成为fda和ema批准用于治疗ds中的癫痫发作的第三种药物。
4、重要的是,钠通道阻断剂(其通常是用于治疗癫痫的一线药物)在ds中是禁忌的并且可能加重疾病的严重程度。大多数患者必须联合服用三种或更多种抗癫痫药,最常见的是丙戊酸盐、氯巴占(clobazam)、司替戊醇和托吡酯(topiramate)和左乙拉西坦(levetiracetam)。这些药物中没有一种单独实现完全的癫痫发作抑制,并且仅少数(约10%)患者变为无癫痫发作。
5、在最先进的大麻二酚制剂epidiolex和最先进的血清素能药物fintepla的步骤之后,还有一类新兴的第二代治疗剂。这些化合物中的大多数也具有治疗其他形式的癫痫的潜力。
6、随着ds管线变得更成熟和竞争增加,焦点正在转向更少的症状治疗和更多的疾病靶向治疗。第三代治疗旨在恢复异常的nav1.1通道功能或表达水平。目前有几种类型的疾病靶向基因治疗方法正在开发中。
7、所谓的“通读疗法”,诸如ptc therapeutics和tevard biosciences生产的类型,使核糖体能够移过无义突变以完成功能蛋白。无义突变是将提前终止密码子引入到基因序列中,从而阻止细胞产生完整蛋白质的突变。尽管有希望,但研究者发起的研究评估了用于治疗由无义突变引起的ds的阿塔鲁伦(ataluren)的安全性和功效,并且表明阿塔鲁伦未能显示功效。
8、tevard biosciences宣布正在开发用于治疗ds和其他由单倍剂量不足和/或无义突变引起的罕见疾病的两种新型基于trna的基因治疗平台,这些疾病不适于基因治疗的传统方法。tevard的方法集中于mrna稳定和无义密码子抑制(或通读)。
9、stoke therapeutics正在开发针对ds的第一种疾病缓解治疗,一种靶向scn1a前mrna成熟的反义寡核苷酸(aso)治疗,其上调啮齿动物、人细胞系和非人灵长类动物中的nav1.1蛋白表达。领先的候选人使用stoke的tango(核基因输出的靶向增加)技术来靶向rna剪接并增加由单倍剂量不足引起的疾病中的蛋白表达。命名为stk-001的项目遵循与spinraza类似的方法,并且将经由鞘内注射施用到脊髓液中。
10、在具有scn1a单倍剂量不足的小鼠中,单次脑室内剂量的先导aso增加nav1.1的产生并且满足ds小鼠模型中的两个主要临床前终点,即癫痫发作减少和动物存活。stoke还显示了stk-001在非人灵长类动物中的生物分布和靶点参与(aes2019会议),并在2020年8月的1a/2b期研究中对第一名患者给药。
11、encoded therapeutics正在开发基于腺相关病毒(aav)的基因治疗方法以增加scn1a转录并挽救患有ds的患者的单倍剂量不足。命名为etx101的治疗有可能成为在stoketherapeutics的aso先导项目之后第二种进入ds治疗的临床试验的疾病缓解治疗。etx101被fda授予用于治疗scn1a+ds的孤儿药命名和罕见儿科疾病命名。
12、由于<5,000nt的有限克隆能力,scn1aorf对基于aav的基因治疗缺乏顺从性。encoded therapeutics试图通过表达工程化转录因子以上调这些细胞中的senia表达来克服aav病毒基因治疗的局限性,并在2019年展示了他们项目的临床前数据,显示在ds的小鼠模型中scn1a mrna和nav1.1通道的gaba能细胞特异性表达,从而导致癫痫发作和死亡率降低。在2020年12月,该公司还展示了关于etx101在非人灵长类动物中的生物分布的数据。
13、本公开涉及经由将scn1a表达盒载体递送到中枢神经系统(cns)中来提供外源性nav1.1的方法。无论潜在的scn1a突变如何,该策略都适合作为治疗方法。此外,由于该治疗补偿了nav1.1的lof,因此它可以潜在地改善ds癫痫和非癫痫共病以及阿尔茨海默病和其他nav1.1相关的病理状况。表达盒的最小尺寸为约7kbp。为了克服“大小”障碍,先前针对ds的基因治疗策略包括(i)经由转录激活增强内源性senia的表达(colasante等人,2019;han等人,2020;yamagata等人,2020);(ii)用于增加通道复合物功效的scn1b辅助亚基的过表达;以及(iii)反义寡核苷酸介导的scn8a下调。
14、虽然先前治疗ds的方法已经在“ds小鼠”中显示潜在的改善,但这些方法中的治疗潜力仅在当在无症状的、癫痫前期阶段期间出生后不久施用时的轻度ds的病例中显示。本质上,这些方法没有区分具有严重症状和轻度症状的模型。在ds病状严重情况下的临床功效还没有确定。此外,由于临床诊断很少在进展为复发性自发性癫痫发作之前得到证实,因此迫切需要预防严重顽固性癫痫发作和癫痫不明原因猝死(sudep)的发作的治疗。
15、在2020年,随着stoke therapeutics经由stk-001专门设计增加nav1.1活性的治疗的首次临床试验的启动,ds的临床试验发生了转变。在早期和晚期临床前开发中,还存在另外的遗传和潜在的疾病缓解治疗,包括基于aav的基因治疗。
16、与aav相比,腺病毒(adv)载体可以携带至多36kbp的外源序列。类似于aav载体,一些adv类型(例如,el缺失型和辅助依赖型cav-2载体)可以在啮齿动物和灵长类动物大脑中产生长期转基因表达。此外,注射到青春期ds小鼠的cns中的携带scn1a表达盒的人adv(hadv)是良好耐受的并减少了慢性期的癫痫。虽然aav载体已经在临床试验中显示出一些希望,但仍然存在安全性问题,包括所需要的极高剂量和aav载体整合到转导细胞的基因组中的趋势。与基于hadv的载体一样,大多数aav载体也容易被非神经元细胞(包括将抗原呈递到免疫细胞的那些细胞)吸收。此外,大多数潜在患者将具有识别保守aav表位的交叉反应性记忆t细胞。因此,使用aav和hadv作为神经元基因治疗载体可能造成风险。另外,最近的证据表明,aav载体并不像最初认为的那样安全,在aav介导的基因治疗后报道了肝毒性、血液学毒性、神经安全性问题和癌症问题,导致两项研究提前终止(mullard,2021)。
17、因此,需要基因转移载体以通过能够携带用于将scn1a递送到大脑的大表达盒的载体优先摄取神经元。
技术实现思路
1、绝大多数ds病例是由scn1a的一个拷贝中的新生突变引起的,该突变导致lof并且因此导致电压门控钠通道nav1.1的活性的单倍剂量不足。因此,其中将外源性nav1.1通道提供到cns神经元中的策略可以用作将是合适的治疗方法,而不管潜在的scn1a突变如何。此外,由于该治疗补偿了nav1.1的lof,因此它可以潜在地改善癫痫和非癫痫共病以及阿尔茨海默病和其他nav1.1相关的病理状况。
2、一种治疗方法是基因治疗,其中经由递送scn1a表达盒提供外源性nav1.1。基因治疗管线与载体功效密切相关。由于缺乏能够携带大表达盒的载体,因此几种罕见疾病几乎没有希望成为基因替代的靶标。由于nav1.1相关的病理状况(诸如ds和阿尔茨海默病)的复杂病理生理学,病因学方法(诸如基因治疗)具有独特的机会来获得这些患者生活的全面改善。然而,治疗的几个挑战包括大的(6kb)scn1aorf,其排除了一些病毒载体的有效表达,非神经元细胞中的超生理nav1.1水平可能是有害的、感染相关区域中的足够神经元并提供长期表达的可能性。本公开涉及一种基因转移载体和治疗方法,其将为ds、癫痫、阿尔茨海默病和其他与错误编码的nav1.1相关的遗传疾病和病理状况的临床试验铺平道路。
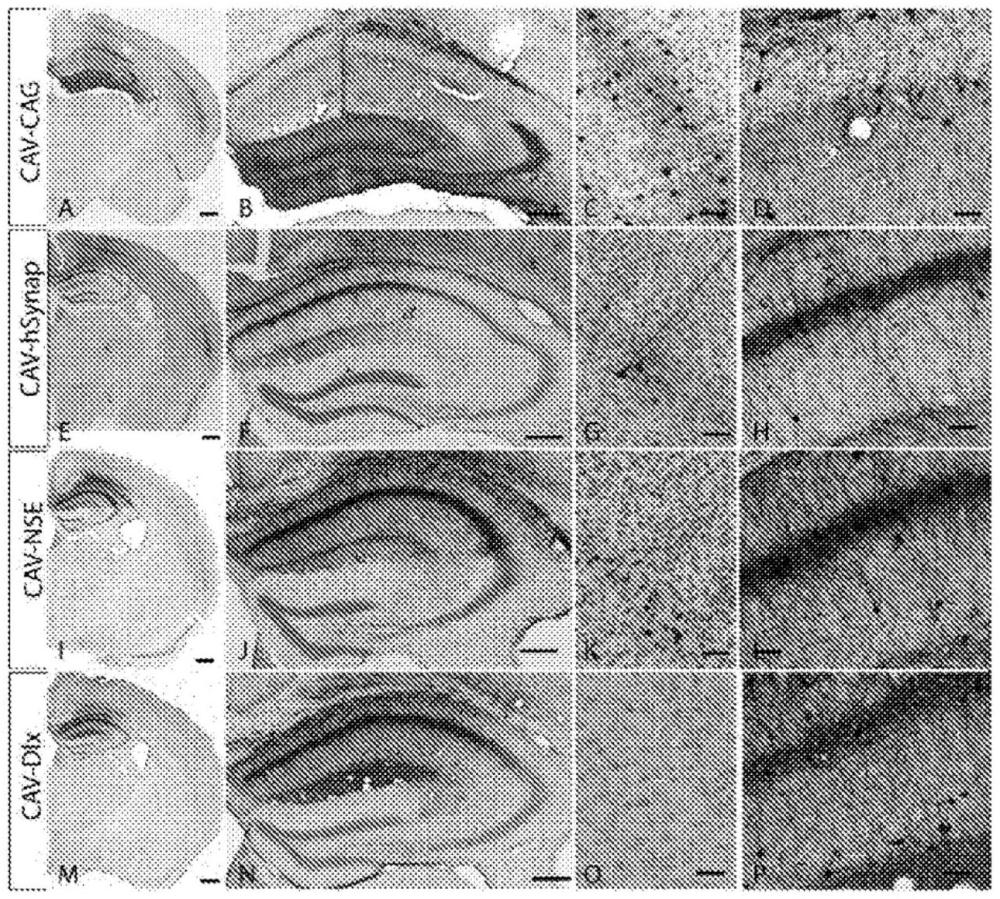
3、由于常用的载体scn1a的约6kbp orf,诸如腺相关病毒(aav)不太合适。与aav相比,adv载体可以携带至多36kbp的外源序列(cots等人,2013;del rio等人,2019;parks等人,1996)。adv介导的转基因表达在啮齿动物的大脑中也稳定至少1年(soudais等人,2004)。此外,注射到患有ds的青春期小鼠的cns中的携带scn1a的人adv是良好耐受的并减少了慢性期的癫痫(mora-jimenez等人,2021)。然而,hadv缺乏神经元特异性,依赖于不同的非神经元特异性启动子cag,并且仅在具有不太严重的ds表达的老年小鼠中显示改善癫痫症和行为问题的功效。
4、ds小鼠的死亡率为约50%-60%,大多数死亡集中在生命的第4周。存活超过p28的ds小鼠不太可能死亡,并且它们的癫痫发作频率降低。先前,已经对约5周的老年小鼠进行了研究,其中它们的大脑注射有携带scn1a表达盒的hadv。然而,由于ds的严重阶段对应于生命的第4周,通过治疗五周龄的青春期小鼠,这些研究预先选择了ds病状较轻的小鼠。这些研究与在癫痫最严重且过早死亡率发生较高时的疾病严重阶段的ds逆转无关。
5、本公开涉及犬腺病毒2型(cav-2)介导的scn1a orf递送,其用于在scn1a突变和nav1.1钠通道错误编码以及挽救ds的严重阶段和预防过早死亡的治疗中使用。例如,在某些实施方案中,本公开涉及cav-2介导的scn1a orf表达盒的递送,其用于在scn1a突变和nav1.1钠通道错误编码的治疗中使用。这能够挽救严重ds并预防过早死亡。它还将在阿尔茨海默病和其他nav1.1相关的病理状况的治疗中提供显著的治疗价值。
6、cav-2载体为基因转移到cns提供了显著的优势。首先,通过优先使用柯萨奇病毒和腺病毒受体(car)作为附着分子(其表达主要由脑实质中的神经元发现),将cav-2介导的基因转移限定于神经元。其次,35kbp的克隆能力提供了包括不同启动子序列的能力,使得能够控制各种亚神经元群中的表达。最后,由于其强大的逆向轴突运输能力,cav-2载体注射可以导致跨连接的大脑区域的表达。
7、在一些方面,本公开涉及一种cav-2载体,其包含scn1aorf的区域。本公开还涉及一种工程化的cav-2载体,其包含scn1aorf的区域并且还包含用于控制scn1aorf的表达的诱导型启动子区。本公开还涉及一种cav-2载体。在某些实施方案中,可以增强cav-2载体以用于选择性神经元转基因表达。本公开还涉及一种cav-2载体,其包含scn1a orf的区域,并且还可包含编码受控(例如,转录或翻译,或翻译后)scn1a转录、mrna加工、蛋白质稳定性或蛋白质靶向的区域。
8、在一些方面,本公开涉及cav-2介导的scn1a orf的cns递送(cav-2scn1a治疗),用于挽救ds和预防过早死亡。例如,本公开涉及cav-2scn1a治疗,用于在疾病的严重阶段期间挽救ds和预防患有ds的小鼠的过早死亡,以及用于纠正ds共病。重要的是,cav-2scn1a治疗的存活至ds慢性期的青春期小鼠以及严重癫痫发作的幼年小鼠中的外源性nav1.1活性提高了小鼠的存活率,减少了自发性癫痫发作和癫痫棘波频率的发生,并提高了热性癫痫发作的温度阈值。本公开涉及在兴奋性和抑制性神经元中有效递送scn1a表达盒作为挽救和治疗ds的可行治疗方法。本公开还涉及ds的治疗,并且具体地,在患有ds的动物模型中用cav-2介导的scn1a orf的cns递送进行治疗以纠正ds共病。
9、在一些方面,本公开涉及用于将scn1a orf转移到cns以治疗ds的cav-2载体的设计和用途。通过优先使用柯萨奇病毒和腺病毒受体(car)作为附着分子(其表达主要由脑实质中的神经元发现),将cav-2介导的基因转移限定于神经元。cav-2的克隆能力提供了包括不同启动子序列的能力,使得能够控制各种亚神经元群中的表达。另外的特征包括其逆向轴突运输能力,从而允许cav-2介导的转导导致跨多个连接的大脑区域的表达。
10、在另一方面,本公开涉及包含用于scn1a orf的表达盒中的合适启动子,该表达盒掺入到cav-2载体的序列中。启动子可以用于控制scn1a orf的表达水平的目的。启动子还可以基于在载体的神经元向性中进行修饰的需求来选择。cav-2序列还可以出于选择性神经元和稳定的长期表达的目的进行工程化。
11、在另一方面,本公开涉及一种用于产生工程化的cav-2scn1a治疗载体的方法。按照合作中心(cnrs,montpellier)开发的方法进行生产,该方法依赖于辅助cav-2载体的使用。该辅助载体与cav-2scn1a治疗载体一起复制,然而感染性辅助载体颗粒不被壳体化,因为其包装序列(侧接有lox序列)被cre重组酶消除。
12、在其他实施方案中,本公开涉及在兴奋性和/或抑制性神经元中有效递送scn1a表达盒作为ds的可行治疗方法。因此,本公开涉及一种策略,其中经由cav-2介导的scn1a orf的递送将外源性功能性nav1.1通道提供到cns神经元中,作为适用于儿童和青少年的治疗方法,而不管潜在的scn1a突变如何。此外,本公开涉及一种补偿nav1.1的lof的治疗,并且可以改善ds癫痫和非癫痫共病,并且实现ds的挽救和逆转,以及提供用于nav1.1相关的病理状况的治疗和治疗方法。
13、因此,基于前述和继续的描述,本发明在其各种实施方案中可包括以任何非互斥组合的以下特征中的一者或多者:
14、·一种用于提供外源性nav1.1钠通道的载体,其具有编码cav-2基因组的至少一部分的第一核酸序列;
15、·一种用于提供外源性nav1.1钠通道的载体,其具有编码功能性nav1.1钠通道的第二核酸序列;
16、·一种用于提供外源性nav1.1钠通道的载体,其具有编码转录控制区的第一调控序列,
17、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码至少一个启动子/增强子/延伸因子的启动子/增强子/延伸因子序列。
18、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码e2、e6、ef1、cag、hsyn、d1x5/6和nse,并且优选nse的启动子/增强子/延伸因子序列;
19、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码内源性scn1a启动子的启动子/增强子/延伸因子序列;
20、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码内源性scn1a增强子的启动子/增强子/延伸因子序列;
21、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码内源性scn1a转录因子的启动子/增强子/延伸因子序列;
22、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码内源性scn1a启动子的启动子/增强子/延伸因子序列;
23、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码内源性scn1a增强子的启动子/增强子/延伸因子序列;
24、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码e6的启动子/增强子/延伸因子序列;
25、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码ef1的启动子/增强子/延伸因子序列;
26、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码cag的启动子/增强子/延伸因子序列;
27、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码hsyn的启动子/增强子/延伸因子序列;
28、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码dlx5/6的启动子/增强子/延伸因子序列;
29、·一种用于提供外源性nav1.1钠通道的载体,其中转录控制区含有编码nse的启动子/增强子/延伸因子序列;
30、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列可操作地连接到第一调控序列以用于在哺乳动物细胞中控制scn1a开放阅读框(orf)的转录表达;
31、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列是序列id号12;
32、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列是序列id号14;
33、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列编码序列id号15;
34、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列编码序列id号16;
35、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列是工程化的scn1a orf;
36、·一种用于提供外源性nav1.1钠通道的载体,其中工程化的scn1a orf是通过从密码子修饰的scn1a orf中消除至少一个短重复序列而产生的;
37、·一种用于提供外源性nav1.1钠通道的载体,其中第二核酸序列是通过消除编码功能性nav1.1钠通道的跨膜部分的orf中的至少一个短重复序列而产生的;
38、·一种用于提供外源性nav1.1钠通道的载体,其中载体被设计用于在与scn1a突变相关的病理状况的治疗中使用;
39、·一种用于提供外源性nav1.1钠通道的载体,其具有nse启动子;
40、·一种用于提供外源性nav1.1钠通道的载体,其中载体在具有scn1a错义突变或scn1a截短突变的个体中具有治疗活性;
41、·一种用于提供外源性nav1.1钠通道的载体,其中载体被优化用于在神经元中优先表达scn1a orf;
42、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有dravet综合征的个体中具有治疗活性;
43、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有癫痫的个体中具有治疗活性;
44、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有阿尔茨海默病的个体中具有治疗活性;
45、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有自闭症谱系障碍的个体中具有治疗活性;
46、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有神经元功能障碍的个体中具有治疗活性;
47、·一种用于提供外源性nav1.1钠通道的载体,其中载体在患有网络功能障碍的个体中具有治疗活性;
48、·一种用于提供外源性nav1.1钠通道的载体,其中载体在内源性nav1.1功能缺失的个体中具有治疗活性;
49、·一种用于经由载体提供外源性nav1.1通道的方法,该方法包括施用治疗有效量的前述载体中的任一者,包括用于提供外源性nav1.1钠通道的载体;
50、·一种用于经由载体提供外源性nav1.1通道的方法,包括其中将载体施用到哺乳动物的中枢神经系统中;
51、·一种用于经由载体提供外源性nav1.1通道的方法,包括其中将载体施用到至少一个大脑区域中;
52、·一种用于经由载体提供外源性nav1.1通道的方法,包括其中将载体施用到海马中;
53、·一种用于经由载体提供外源性nav1.1通道的方法,包括其中将载体施用到丘脑中;
54、·一种用于经由载体提供外源性nav1.1通道的方法,其中载体在慢性形式的dravet综合征或其共病发展之前施用;
55、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用载体以治疗慢性形式的dravet综合征或其共病;
56、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用载体以治疗dravet综合征或其共病;
57、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用载体以预防dravet综合征或其共病的发展;
58、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有错义突变的个体;
59、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有无义突变的个体;
60、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有截短突变的个体;
61、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有缺失突变的个体;
62、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有移码突变的个体;
63、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有剪接位点突变的个体;
64、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有突变的个体;
65、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a的启动子/增强子/调控区中具有突变的个体;
66、·一种用于经由载体提供外源性nav1.1通道的方法,其中在施用载体之后,该方法还包括诱导功能性nav1.1钠通道的表达;
67、·一种用于经由载体提供外源性nav1.1通道的方法,其中将载体施用于在scn1a中具有错义突变或scn1a中具有截短突变的个体;
68、·一种用于经由载体提供外源性nav1.1通道的方法,其中在施用载体之后,该方法还包括监测哺乳动物的期望的临床结果,并且如果未获得期望的临床结果,则施用第二治疗有效量的载体;
69、·一种用于经由载体提供外源性nav1.1通道的方法,其中经由注射将载体施用到患者的大脑中;
70、·一种用于经由载体提供外源性nav1.1通道的方法,该方法包括施用治疗有效量的癫痫发作药物;
71、·一种用于经由载体提供外源性nav1.1通道的方法,该方法包括施用治疗有效量的阿尔茨海默病药物;
72、·一种用于经由载体提供外源性nav1.1通道的方法,该方法包括施用治疗有效量的癫痫药物;
73、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用治疗有效量的载体以治疗dravet综合征;
74、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用治疗有效量的载体以治疗癫痫;
75、·一种用于经由载体提供外源性nav1.1通道的方法,其中施用治疗有效量的载体以治疗阿尔茨海默病;
76、·一种用于经由载体提供外源性nav1.1通道以修饰大脑神经网络从而减轻病理状况的症状的方法。
77、·一种用于经由载体提供外源性nav1.1通道以修饰大脑神经网络从而减轻自闭症谱系障碍(asd)症状的方法。
78、·一种用于提供外源性nav1.1通道的组合物,该组合物包含前述载体中的任一者,或用于提供外源性nav1.1钠通道的载体。
- 还没有人留言评论。精彩留言会获得点赞!