与Ras超家族蛋白相互作用以用于治疗癌症、炎性疾病、RAS病和纤维化疾病的化合物的制作方法
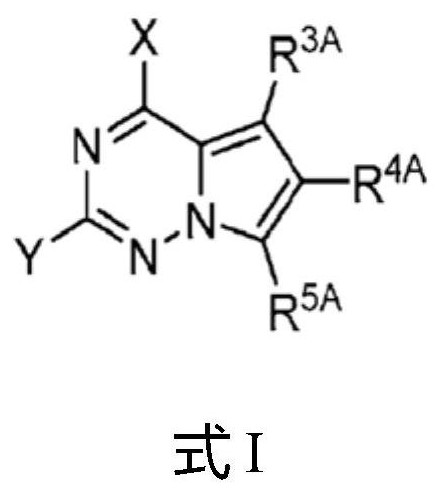
1.本文提供了式i的化合物或其药学上可接受的形式,以及包含它们的药物组合物。本文还提供了通过向受试者施用式i的化合物或其药学上可接受的形式来调节细胞靶标的活性的方法。本文进一步提供了通过向受试者施用式i的化合物或其药学上可接受的形式来治疗癌症、纤维化疾病和炎性疾病的方法。2.
技术实现要素:
本文提供了一种式i的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或or2a;y是咪唑基、吡啶基或8-10元稠合杂芳基;其中所述咪唑基任选地被1个r6a取代基取代并且任选地被1-2个r7a取代基取代;并且所述吡啶基或所述8-10元稠合杂芳基任选地被1-4个r7a取代基取代;r1a是氢或c1-6烷基,其中所述c1-6烷基任选地被1-4个r8a取代基取代;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、c3-7杂环烷基、c5-10元芳基、-s(o)2r15a、-p(o)r16ar17a或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基和5-10元杂芳基各自独立任选地被1-4个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或者r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,其中r1a和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、芳基或5-10元杂芳基,其中所述芳基和5-10元杂芳基各自独立任选地被1-4个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、-c(o)or14a、-c(o)nr12ar13a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是-oh、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基和5-10元杂芳基任选地被1-3个r8a取代基取代,或r12a和r13a组合形成包括它们均附接的氮原子的3-7元杂环烷基;r14a是氢、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r15a是c1-6烷基、c3-6环烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。本文还提供了一种式ii的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、-s(o)2r15a、-p(o)r16ar17a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,任选地其中r1a和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基或c1-6卤代烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r15a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;m是0、1或2;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。本文还提供了一种式iia的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基、-s(o)2r15a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基、5元、6元或9元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5元、6元或9元杂芳基,其中所述苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是c1-3烷基或c1-3杂烷基,其中所述c1-3烷基或c1-3杂烷基任选地被生物素酰胺取代;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr11ar12a或5-6元杂芳基,其中所述c1-6烷基或c1-6杂烷基任选地被生物素酰胺取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;r15a是c1-3烷基、c3-6环烷基或c1-4杂烷基;r16a和r17a各自独立地选自c1-3烷基或c1-3烷氧基,或r16a和r17a组合形成包括它们均附接的磷原子的5元杂环烷基;并且m是0或1。本文还提供了一种式iia(1)的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是5或6元杂芳基,其中所述5或6元杂芳基任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r8a选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或ri2a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;并且r18a是c1-3烷基或c3-6环烷基。本文还提供了一种式iib的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基,任选地其中r1a和r2a形成的所述4-6元杂环烷基与6元杂芳基稠合;r3a是c1-3烷基或苯基,其中所述c1-3烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是苯基或5元杂芳基,其中所述苯基和5元杂芳基各自独立任选地被1-3个ri0a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r1a和r2a组合形成r6a是甲基,m是0,并且rsa是h时,r3a和r4a中的至少一者不是未取代的苯基。本文还提供了一种式iic的化合物: 或其药学上可接受的形式,其中:r2a是氢、c1-6杂烷基或6元杂芳基,其中所述c1-6杂烷基和5-6元杂芳基各自任选地被1-3个r8a取代基取代;r3a是c1-3烷基或苯基,其中所述c1-3烷基或苯基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5或6元杂芳基,其中所述苯基和5或6元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r2a是h,r6a是甲基,m是0,并且rsa是h时,r3a和r4a中的至少一者不是未取代的苯基。本文还提供了一种式iii的化合物:或其药学上可接受的形式,其中:x是nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。本文还提供了一种式iiia的化合物: 或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。本文还提供了一种式iiib的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。本文还提供了一种式iiic的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;rsa是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。本文还提供了一种式iv的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、cs-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。本文还提供了一种式iva的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。本文还提供了一种式ivb的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;rsa和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。本文还提供了一种式ivc的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物,其选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据ras超家族活性测定,所述化合物是ras超家族活性的调节剂。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据erk1/2磷酸化测定,所述化合物抑制erk1/2的磷酸化。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据erk1/2磷酸化测定,所述化合物激活erk1/2的磷酸化。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或100%或更多。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据akt磷酸化测定,所述化合物抑制akt的磷酸化。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据akt磷酸化测定,所述化合物激活akt的磷酸化。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或100%或更多。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据磷酸-smad2/3抑制测定,所述化合物抑制smad2/3的磷酸化。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,根据磷酸-smad2/3抑制测定,所述化合物激活smad2/3的磷酸化。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或100%或更多。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据jnk激活测定,所述化合物抑制jnk。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据jnk激活测定,所述化合物激活jnk。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或100%或更多。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据mapk p38激活测定,所述化合物抑制mapk p38。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据mapk p38激活测定,所述化合物激活mapk p38。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或100%或更多。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据增殖测定,所述化合物抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1μm或更小、0.9μm或更小、0.8μm或更小、0.75μm或更小、0.7μm或更小、0.6μm或更小、0.5μm或更小、0.4μm或更小、0.3μm或更小、0.25μm或更小、0.2μm或更小、0.15μm或更小、或0.1μm或更小的ic50值抑制miapaca2的增殖。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据il-6定量测定,所述化合物抑制il-6。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据tnf-α定量测定,所述化合物抑制tnf-α。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,根据小鼠肝微粒体代谢稳定性测定,该化合物或其药学上可接受的形式在小鼠肝微粒体中的半衰期为10分钟或更长、20分钟或更长、30分钟或更长、40分钟或更长、或50分钟或更长。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,根据动力学溶解度测定,该化合物或其药学上可接受的形式在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为10μm或更大、20μm或更大、30μm或更大、40μm或更大、50μm或更大、60μm或更大、70μm或更大、80μm或更大、90μm或更大、100μm或更大、150μm或更大、或200μm或更大。本文还提供了式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,其中根据增殖测定,该化合物或其药学上可接受的形式抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以50nm或更小、40nm或更小、30nm或更小、20nm或更小、10nm或更小、1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制mm.r1的增殖。本文还提供了调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节半胱天冬酶活性的方法,其包括使所述半胱天冬酶与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节半胱天冬酶活性的方法,其包括使所述半胱天冬酶与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节akt活性的方法,其包括使akt蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节akt活性的方法,其包括使akt蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节jnk活性的方法,其包括使jnk蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节jnk活性的方法,其包括使jnk蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节il-6活性的方法,其包括使il-6蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节il-6活性的方法,其包括使il-6蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了调节tnf-α活性的方法,其包括使tnf-α蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节tnf-α活性的方法,其包括使tnf-α蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触。本文还提供了治疗受试者的癌症的方法,其包括向患有癌症的受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。本文还提供了治疗受试者的癌症的方法,其包括向患有癌症的受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物。本文还提供了治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。本文还提供了治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物。本文还提供了治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。本文还提供了治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物。本文还提供了本文提供的药物组合物,其包含治疗有效量的一种或多种本文提供的化合物(例如式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物)和药学上可接受的载体、稀释剂或赋形剂。3.具体实施方式3.1.定义为了便于理解本文阐述的公开内容,下文定义了许多术语。除非另有定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。所有专利、申请、公开的申请和其它出版物通过引用整体并入本文。在本文的术语具有多个定义的情况下,除非另有说明,否则以本节中的那些定义为准。除非上下文另外明确指出,否则单数形式“一”、“一种(个)”和“所述(该)”包括复数指示物。如本文所用,“受试者”是动物,诸如哺乳动物,包括人,诸如患者。如本文所用,生物活性是指化合物的体内活性或在体内施用化合物、组合物或其它混合物时产生的生理反应。因此,生物活性涵盖此类化合物、组合物和混合物的治疗效果和药代动力学行为。可在设计用于测试此类活性的体外系统中观察到生物活性。如本文所用,化合物的药学上可接受的衍生物包括但不限于其盐、酯、烯醇醚、烯醇酯、缩醛、缩酮、原酸酯、半缩醛、半缩酮、酸、碱、笼形包合物(clathrate)、溶剂化物或水合物。此类衍生物可以由本领域技术人员使用用于此类衍生化的已知方法容易地制备。生成的化合物可以施用于动物或人而没有实质毒性作用,并且是具有药物活性的或是前药。药学上可接受的盐包括但不限于胺盐,诸如但不限于n,n,n′-二苄基乙二胺、氯普鲁卡因(chloroprocaine)、胆碱、氨、二乙醇胺和其它羟烷基胺、乙二胺、n-甲基葡糖胺、普鲁卡因(procaine)、n-苄基苯乙胺、1-对氯苄基-2-吡咯烷-1′-基甲基苯并咪唑、二乙胺和其它烷基胺、哌嗪和三(羟甲基)氨基甲烷;碱金属盐,诸如但不限于锂盐、钾盐和钠盐;碱土金属盐,诸如但不限于钡盐、钙盐和镁盐;过渡金属盐,诸如但不限于锌盐;和无机盐,诸如但不限于磷酸氢钠和磷酸二钠;并且还包括但不限于无机酸的盐,诸如但不限于盐酸盐和硫酸盐;和有机酸的盐,诸如但不限于乙酸盐、乳酸盐、苹果酸盐、酒石酸盐、柠檬酸盐、抗坏血酸盐、琥珀酸盐、丁酸盐、戊酸盐、甲磺酸盐和富马酸盐。药学上可接受的酯包括但不限于酸性基团的烷基、烯基、炔基、芳基、芳烷基和环烷基酯,所述酸性基团包括但不限于羧酸根、磷酸根、次膦酸根、磺酸根、亚磺酸根和硼酸根。药学上可接受的烯醇醚包括但不限于式c=c(or)的衍生物,其中r是烷基、烯基、炔基、芳基、芳烷基和环烷基。药学上可接受的烯醇酯包括但不限于式c=c(oc(o)r)的衍生物,其中r是氢、烷基、烯基、炔基、芳基、芳烷基和环烷基。药学上可接受的溶剂化物和水合物是化合物与一个或多个溶剂分子或水分子,或1至约100、或1至约10、或1至约2、3或4个溶剂分子或水分子的复合物。如本文所用,治疗意指改善或以其它方式有益地改变疾病或病症的一种或多种症状的任何方式。治疗还涵盖本文组合物的任何药物用途,诸如用于治疗纤维化疾病,例如dmd的用途。如本文所用,通过施用特定化合物或药物组合物改善特定病症的症状是指可归因于组合物的施用或与组合物的施用相关的任何减轻,无论是永久的还是暂时的,持续的还是暂时的。如本文所用,并且除非另外指明,否则术语“管理”涵盖预防指定疾病或病症在已经患有该疾病或病症的受试者中复发,和/或延长已患该疾病或病症的受试者保持处于缓解期的时间。该术语涵盖调节该疾病或病症的阈值、发展和/或持续时间,或改变受试者对该疾病或病症应答的方式。如本文所用,术语“纤维化”或“纤维化疾病”可互换使用,并且是指其中结缔组织代替正常实质组织,导致相当大的组织重塑和永久性瘢痕组织形成的任何病理性伤口愈合过程。例如,在一些实施方案中,该纤维化疾病可以是肾的纤维化,诸如进行性肾病。在一些实施方案中,该纤维化疾病可以是心血管系统的纤维化,诸如动脉粥样硬化或再狭窄。在一些实施方案中,该纤维化疾病可以是肺纤维化。在一些实施方案中,该纤维化疾病可以是囊性纤维化。在一些实施方案中,该纤维化疾病可以是特发性纤维化,诸如特发性肺纤维化。在一些实施方案中,该纤维化疾病可以是肺纤维化,诸如进行性大块纤维化或辐射诱导的肺损伤。在一些实施方案中,该纤维化疾病可以是桥接纤维化。在一些实施方案中,该纤维化疾病可以是肝的纤维化,诸如肝硬化。在一些实施方案中,该纤维化疾病可以是肠的纤维化,诸如克罗恩病(crohn’s disease)。在一些实施方案中,该纤维化疾病可以是肌肉系统的纤维化,诸如杜氏肌营养不良(dmd)。在一些实施方案中,该纤维化疾病可以是脑的纤维化,诸如神经胶质瘢痕。在一些实施方案中,该纤维化疾病可以是关节纤维化,诸如动脉僵硬、膝纤维化或肩纤维化。在一些实施方案中,该纤维化疾病可以是皮肤的纤维化,诸如瘢痕瘤。在一些实施方案中,该纤维化疾病可以是骨髓的纤维化,诸如骨髓纤维变性。在一些实施方案中,该纤维化疾病可以是心脏的纤维化,诸如心肌纤维化。在一些实施方案中,该纤维化疾病可以是软组织的纤维化。在一些实施方案中,该纤维化疾病可以是腱的纤维化。在一些实施方案中,该纤维化疾病可以是淋巴结的纤维化。在一些实施方案中,该纤维化疾病可以是眼的纤维化。在一些实施方案中,该纤维化疾病可以是腹膜后腔的。在一些实施方案中,该纤维化疾病可以是硬皮病。在一些实施方案中,该纤维化疾病可以是手术瘢痕形成。如本文所用,“杜氏肌营养不良”(“dmd”)是指肌营养不良和所有形式的杜氏肌营养不良(dmd)。例如,在一些实施方案中,dmd可以是贝克肌营养不良(bmd),一种介于dmd和bmd之间的中间临床表现,或几乎没有临床骨骼或随意肌疾病的dmd相关的扩张型心肌病(心脏病)。如本文所用,ic50是指在测量此类反应的测定中特定测试化合物实现最大反应的50%抑制的量、浓度或剂量。如本文所用,kd是指在化合物(或配体)和蛋白质(或蛋白质的结合结构域)之间测量的平衡解离常数。如本文所用,“smad 2/3”共同意指受体调控的转录因子smad(r-smad)家族的成员,smad2和smad3。如本文所用,“mapk”意指丝裂原激活蛋白激酶,其包括应激激活的mapk蛋白,mapkp38或简称p38。如本文所用,“jnk”意指应激激活的mapk蛋白c-jun nh2末端激酶。如本文所用,“ras超家族”意指小鸟苷三磷酸酶(gtp酶)的蛋白质超家族,其由五个主要家族ras、rho、rab、ran和arf或其突变体组成。还包括五个主要家族的亚家族,例如rho主要家族的rac亚家族。不受理论束缚,蛋白质的ras超家族是具有实质氨基酸序列同源性的小gtp酶,其充当细胞表面受体和若干细胞内信号传导级联之间的信号转导因子。这些蛋白质参与必需细胞功能诸如细胞存活、增殖、运动性和细胞骨架组织的调控(参见karnoub等人,nat.rev.mol.cell biol.,9:517-531(2008))。这些蛋白质在调控许多生物过程中起重要作用,这些生物过程包括但不限于细胞生长、细胞分化、细胞迁移、脂质囊泡运输、纤维化、炎症和凋亡。研究已经主要基于氨基酸序列同源性定义了ras超家族的许多亚家族。这些亚家族常常以基于最常研究的类别成员的缩写方式提及。具有实质序列同源性的ras超家族的一个亚家族的gtp结合结构域通常称为ras家族或ras。ras蛋白有四种同种型,由三种不同的基因表达:h-ras(哈维肉瘤病毒癌基因)、n-ras(成神经细胞瘤癌基因)及剪接变体k-ras4a和k-ras4b(柯斯顿肉瘤病毒癌基因)(参见karnoub等人,同上)。具有实质序列同源性的ras超家族的另一亚家族的gtp结合结构域通常称为rho家族,并且包括称为rho、rac和cdc42的蛋白质和蛋白质组。不受理论束缚,所有ras同种型在负责gdp/gtp结合、gtp酶活性和效应子相互作用的所有区域中具有序列同一性,表明功能冗余。然而,研究清楚地证明,在正常生理过程中以及在发病机理中,每个ras同种型可以以独特的,不同于其它ras蛋白的方式起作用(quinlan等人,future oncol.,5:105-116(2009))。不受理论束缚,几种细胞表面受体激活ras,诸如受体酪氨酸激酶(rtk)、生长因子受体、细胞因子受体和整联蛋白。不受理论束缚,ras蛋白在分别由gtp和gdp的结合赋予的“开启”和“关闭”构象之间循环。在生理条件下,这两种状态之间的转变受鸟嘌呤核苷酸交换因子(gef),诸如非七激酶子(son of sevenless,sos)调控(bar-sagi d,trends endocrin.metab.5,165-169(1994)),这些鸟嘌呤核苷酸交换因子通过刺激gdp交换成gtp和通过加速ras介导的gtp水解为gdp的gtp酶激活蛋白(gap)来促进ras蛋白的激活。不受理论束缚,ras上具有核苷酸交换功能的sos区域跨越约500个残基,并且含有在sos和其它ras特异性gef诸如cdc25、sdc25和ras鸟嘌呤核苷酸释放因子(grf)中保守的序列嵌段(boguske等人,nature 366,643-654(1993))。不受理论束缚,一旦激活,ras就启动影响细胞生长、分化、增殖、凋亡和迁移的“mapk途径”(也称为ras-raf-mek-mapk/erk1/2途径)的信号传导。mapk途径通过激酶之间的一系列相互作用工作。在“开启”gtp结合状态下被ras激活的mapk激酶激酶(mapk3),诸如raf、mlk或tak,将mapk激酶(诸如mek)磷酸化并激活,然后该疾病将一种或多种mapk(诸如erk1/2)磷酸化并增加其活性。不受理论束缚,ras激活还启动影响细胞存活、增殖、迁移、抗凋亡和细胞周期调控的“akt途径”的信号传导。处于“开启”gtp结合状态的ras激活磷酸肌醇3-激酶(pi3k),其转而诱导磷脂酰肌醇(3,4,5)三磷酸(pip3)的产生。这些脂质用作带有普列克底物蛋白-同源性(ph)结构域的蛋白质的质膜停靠位点,所述蛋白质包括akt(也称为蛋白激酶b或pkb)及其上游激活剂pdk1。存在三种高度相关的akt同种型(akt1、akt2和akt3),它们使共有底物磷酸化,但也已经鉴定了同种型特异性akt底物。在膜上,akt受pdk1、pdk2和mtorc2磷酸化和激活。akt途径也可被受体酪氨酸激酶、整联蛋白、b和t细胞受体、细胞因子受体和直接相互作用并激活pi3k的g蛋白偶联受体激活。不受理论束缚,ras激活还与通过除磷酸肌醇3-激酶(pi3k)之外的其它分子途径的信号传导相关,诸如rac1 gef和ral-鸟嘌呤核苷酸解离刺激物(gds)。关于pi3k,其是调控细胞内信号传导的pi3k/akt/mtor途径的一部分,对于几种细胞功能诸如存活、抗凋亡和细胞周期调控很重要。不受理论束缚,ras及其下游途径,包括erk1/2和akt,已经受到广泛研究。它们与一系列疾病有因果关系,包括某些癌症、炎性病症、ras相关的自身免疫性白细胞增生性病症、ii型糖尿病和某些ras病。不受理论束缚,mapk,尤其是erk1/2的激活是炎症反应的组成部分。因此,本文提供的化合物(其是经由抑制ras和/或ras超家族成员的erk1/2抑制剂)可用于治疗炎性疾病。不受理论束缚,akt的激活是炎症反应的组成部分。因此,本文提供的化合物(其是经由抑制ras和/或ras超家族成员的akt抑制剂)可用于治疗炎性疾病。不受理论束缚,存在一种以上不同的异常ras激活途径,包括ras本身的突变激活,通过上游信号传导的野生型蛋白质的过度激活和终止蛋白质活性所需的gap功能的丧失。在文献中每年有一百万人死亡仅归因于k-ras中的突变。(frank mccormick.“k-ras protein as a drug target.”journal of molecular medicine(berhn)2016:94:253-258)不受理论束缚,ras与炎性疾病有因果关系,炎性疾病包括以下:类风湿性关节炎(abreu jr,de launay d,sanders me,grabiec am,sande van de mg,tak pp,reedquistma:the ras guanine nucleotide exchange factor rasgrf1 promotes matrixmetalloproteinase-3 production in rheumatoid arthritis synovial tissue(arthritis res ther.2009,11:r121-10.1186/ar2785),其上最常见的致残原因(hootmanjm,brault mw,helmick cg,theis ka,armour bs.prevalence and most common causesof disability among adults-united states 2005,mmwr,2009,58(16):421-6);动脉粥样硬化(fonarow g(2003),cleve.clin.j.med.70:431-434);炎症性肠病(ibd),诸如克罗恩病(ignacio cs,sandvik ak,bruland t,andreu-ballester jc,j.crohns colitis,2017 mar 16.doi:10);溃疡性结肠炎;脊柱关节炎;特发性肺纤维化;幼年型关节炎;银屑病;银屑病关节炎等。不受理论束缚,ras与ras相关的自身免疫性白细胞增生性病症(最初在推定的自身免疫淋巴组织增生综合征(alps)患者的子集中鉴定的非恶性临床综合征)有因果关系。(katherin calvo等人“jmml and rald(ras-associated autoimmuneleukoproliferative disorder):common genetic etiology yet clinically distinctentities”blood,2015年4月30日;125(18):2753-2758)不受理论束缚,ras信号传导在ras病中有因果关联。因此,本文提供的抑制ras超家族的一个或多个成员的功能的化合物可用于治疗包括1型神经纤维瘤病、努南综合征(noonan’s syndrome)和克斯提洛氏综合征(costello syndrome)在内的ras病。如本文所用,“ras”或“ras家族”或“ras亚家族”或“ras组”意指diras1;diras2;diras3;eras;gem;hras;kras;mras;nkiras1;nkiras2;nras;rala;ralb;rap1a;rap1b;rap2a;rap2b;rap2c;rasd1;rasd2;rasl10a;rasl10b;rasl11a;rasl11b;rasl12;rem1;rem2;rerg;rergl;rrad;rras;rras2,或其突变体。如本文所用,“rho”或“rho家族”或“rho亚家族”或“rho组”意指rhoa;rhob;rhobtb1;rhobtb2;rhobtb3;rhoc;rhod;rhof;rhog;rhoh;rhoj;rhoq;rhou;rhov;rnd1;rnd2;rnd3;rac1;rac2;rac3;cdc42,或其突变体。如本文所用,“rac”或“rac家族”或“rac亚家族”或“rac组”意指rac1;rac2;rac3;rhog,或其突变体。不受理论束缚,ras超家族的rho亚家族目前包括大约22种蛋白质,科学家通常将大多数蛋白质分成亚组,包括称为cdc42、rac和rho的亚组。(boureux a,vignal e,faures,fort p(2007).″evolution of the rho family of ras-like gtpases ineukaryotes″.mol biol evol 24(1):203-16)。不受理论束缚,rho亚家族的三个最常研究的成员是cdc42、rac 1和rhoa。不受理论束缚,cdc42组包括cdc42、tc10、tcl、chip和wrch-1。不受理论束缚,rac组包括rac1、rac2、rac3和rhog。不受理论束缚,rhoa组包括rhoa、rhob和rhoc。不受理论束缚,不包括在cdc42、rac或rho组中的其它rho亚家族gtp酶包括rhoe/rnd3、rhoh/ttf、rif、rhobtb1、rhobtb2、miro-1、miro-2、rhod、rnd1和rnd2。不受理论束缚,与其它ras超家族蛋白一样,rho亚家族gtp酶在分别由gtp和gdp的结合赋予的“开启”和“关闭”构象之间循环。在生理条件下,这两种状态之间的转变受鸟嘌呤核苷酸交换因子(gef)和gtp酶激活蛋白(gap)调控,鸟嘌呤核苷酸交换因子(gef)通过刺激gdp的释放和gtp的结合来促进rho亚家族蛋白的激活,gtp酶激活蛋白(gap)加速rho亚家族成员介导的gtp水解成gdp。鸟嘌呤核苷酸解离抑制剂(gdi)蛋白与rho蛋白形成大的复合物,帮助防止在膜内扩散并进入胞质溶胶,并因此充当锚并允许对rho激活的紧密空间控制。不受理论束缚,rho亚家族成员是影响大量下游途径的细胞内蛋白质,这些下游途径广泛涉及细胞骨架组织、细胞极性、迁移、转录和增殖,并且更具体地涉及膜和囊泡运输、细胞周期、微管稳定性、肌动蛋白膜连接、肌动蛋白聚合、肌球蛋白磷酸化、api依赖性基因表达、细胞粘附、细胞收缩性、细胞粘附和mtoc定向。(martin schwartz.“rho signallingat a glance.”journal of cell science.2004:(117:pp.5457-5458)和(bustelo xr,sauzeau v,berenjeno im(2007).″gtp-binding proteins of the rho/rac family:regulation,effectors and functions in vivo″bioessays.29(4):356-370)。不受理论束缚,将rho亚家族相关激酶(rock 1和rock2)暗示为多种促纤维化过程(包括与特发性肺纤维化相关的那些)的介质。(knipe rs,tager em和liao jk.“the rhokinases:critical mediators of multiple profibrotic processes and rationaltargets for new therapies for pulmonary fibrosis.”pharmacol rev.201567(1):103-17.)不受理论束缚,鉴于它们在疾病过程中的作用,已将rho亚家族成员鉴定为潜在治疗分子靶标。不受理论束缚,已将rho亚家族成员鉴定为癌症中的潜在治疗分子靶标。不受理论束缚,已将rho亚家族成员鉴定为纤维化疾病中的潜在治疗分子靶标。如本文所用,“gtp结合位点”或“gtp结合结构域”均意指蛋白质的结合gtp的区域,以及另一化合物可结合的所述蛋白质的周围区域,其中此类结合阻断gtp与所述蛋白质结合的能力。如本文所用,“gdp结合位点”或“gdp结合结构域”均意指蛋白质的结合gdp的区域,以及另一化合物可结合的所述蛋白质的周围区域,其中此类结合阻断gdp与所述蛋白质结合的能力。如本文所用,“鸟苷结合区”意指作为gdp结合结构域或gtp结合结构域的一部分的蛋白质的区域,该区域介导与gdp或gtp的鸟苷部分的相互作用。如本文所用,“金属区”意指作为gdp结合结构域或gtp结合结构域的一部分的蛋白质的区域,该区域靠近镁(mg202)结合位点。如本文所用,“替代tyr32构象”意指与kras晶体结构pdb编码:4epr相比,kras晶体结构pdb编码:3gft中tyr 32区域中gtp或gdp结合结构域的构象。不受理论束缚,如本文所用,“凋亡”是指在生理学和病理学中起重要作用的程序性细胞死亡过程。它在胚胎发育期间及以后被激活以消除不需要的或受损的细胞。凋亡也在预防癌症中起重要作用。凋亡控制的丧失允许肿瘤细胞存活更长时间并为它们提供积聚突变的时间,这些突变可增加癌症进展期间的侵袭力,刺激血管生成,去调控细胞增殖,并干扰分化。不受理论束缚,关于凋亡,已经证明小gtp酶的ras超家族的几个成员具有促凋亡和抗凋亡功能。gtp酶的rho家族的成员诸如rho、rac和cdc42可经由jnk或p38途径激活凋亡。另一方面,gtp酶的ras和rab家族的成员具有通过激活pi3k/akt/mtor存活途径介导的抗凋亡活性,其防止凋亡并导致增加的细胞增殖。此外,已经证明gtp酶激活蛋白(gap)可以通过调控凋亡相关蛋白和途径促进肿瘤细胞的凋亡。应注意,一些gap也发挥凋亡抑制作用并因此促进肿瘤进展。不受理论束缚,c-jun n末端激酶(jnk)途径是丝裂原激活蛋白激酶(mapk)信号传导途径的主要信号传导级联之一。它在许多细胞过程的控制中起作用,这些细胞过程包括增殖、胚胎发育和凋亡。jnk途径被环境应激(电离辐射、热、氧化应激诸如活性氧(ros)和dna损伤)、炎性细胞因子以及生长因子激活。jnk激活常常涉及gtp酶的rho家族,诸如rho、cdc42和rac。不受理论束缚,jnk通过c-jun/ap 1依赖性或p53/73蛋白依赖性机制的反式激活上调促凋亡基因来激活凋亡信号传导。在这些针对线粒体凋亡蛋白的途径中,激活的jnk通过不同的磷酸化事件直接调节线粒体促凋亡蛋白的活性。不受理论束缚,mapk信号传导途径的另一成员是p 38mapk(本文也称为mapkp38),其允许细胞解读广泛范围的外部信号并通过激活介导几种生物效应的下游途径来应答。该途径还在巨噬细胞和嗜中性粒细胞对凋亡和细胞因子释放的控制中起作用。不受理论束缚,凋亡可通过外在(死亡配体)和内在(线粒体)途径激活。bcl-2蛋白家族的成员,如bax和bak,调控和介导线粒体促成细胞死亡的内在凋亡过程。在凋亡刺激后,这些蛋白质被激活并在线粒体外膜处寡聚化以介导其透化。透化使得细胞色素c从线粒体中释放,进而诱导一系列生物化学反应,导致半胱天冬酶激活和随后的细胞死亡。不受理论束缚,凋亡的诱导,诸如在哺乳动物细胞中,可以通过几种机制介导,包括泛素蛋白酶体系统(ups)的抑制。ups系统是去除胞质、核和膜相关蛋白的主要蛋白水解途径,并在稳态中具有重要功能,包括防止错误折叠或有害蛋白的积聚。通过用泛素,通常用赖氨酸48连接的四泛素链共价标记靶向降解的蛋白质来选择靶向降解的蛋白质,随后在26s蛋白酶体内进行蛋白水解。26s蛋白酶体全酶由负责识别泛素信号并解折叠靶蛋白的19s调节颗粒(rp)和将解折叠的多肽水解成不同长度的短肽的20s核心颗粒(cp)组成。因此,已经将ups的损伤与包括癌症在内的几种病理状况相关联。肿瘤细胞的特征可以在于细胞周期检查点控制的丧失,并且由于致癌信号传导的过度激活和/或不利的微环境条件而常常经受升高水平的应激。因此,转化细胞在很大程度上可依赖于ups的正确功能而存活和增殖。抑制ups,诸如用蛋白酶体抑制剂已知,可诱导细胞死亡和凋亡。迄今为止,三种蛋白酶体抑制剂已经获得fda批准用于治疗多发性骨髓瘤癌症患者。据报道,三种蛋白酶体抑制剂velcade(硼替佐米)、kyprolis(卡非佐米)和ninlaro(伊沙佐米)靶向20s cp内的蛋白水解位点。不受理论束缚,如本文所用“半胱天冬酶”是指在天冬氨酸残基后裂解蛋白质的半胱氨酸蛋白酶家族中的一种或多种。所有半胱天冬酶都是在细胞中作为无催化活性的酶原合成的,并且必须经历裂解激活过程以得到大亚基和小亚基,这些亚基二聚化以产生活性酶。半胱天冬酶以包括所谓的上游半胱天冬酶2、8、9和10以及下游半胱天冬酶3、6和7的分层结构存在。活性半胱天冬酶-9启动半胱天冬酶裂解,半胱天冬酶裂解激活下游执行者半胱天冬酶3、6和7,其裂解其它细胞靶标并启动凋亡。在一些实施方案中,本文公开的化合物的抗增殖抑制活性通过诱导凋亡介导,如通过膜联蛋白v凋亡测定试剂盒所确定。应理解,本文提供的化合物可含有手性中心。此类手性中心可以是(r)构型或(s)构型,或者可以是其混合物。因此,本文提供的化合物可以是对映异构纯的,或是立体异构或非对映异构混合物。因此,本领域技术人员将认识到,对于在体内经历差向异构化的化合物,施用其(r)形式的化合物与施用其(s)形式的化合物等效。如本文所用,基本上纯意指足够均质而表现出不含易于检测的杂质,如通过本领域技术人员用于评估此类纯度的标准分析方法(诸如薄层色谱法(tlc)、凝胶电泳、高效液相色谱法(hplc)和质谱法(ms))所确定,或意指足够纯使得进一步纯化不会可检测地改变物质的酶活性和生物活性。纯化化合物以产生基本上化学纯的化合物的方法是本领域技术人员已知的。然而,基本上化学纯的化合物可以是立体异构体的混合物。在此类情况下,进一步纯化可增加化合物的比活性。本公开意在包括所有此类可能的异构体,以及它们的外消旋形式和光学纯形式。光学活性(+)和(-)、(r)-和(s)-或(d)-和(l)-异构体可以使用手性合成子或手性试剂制备,或使用常规技术诸如手性反相hplc拆分。当本文所述的化合物含有烯烃双键或其它几何不对称中心时,并且除非另外指明,否则希望化合物包括e几何异构体和z几何异构体两者。同样,所有互变异构形式也旨在包括在内。例如,式a包括但不限于以下三种互变异构结构。除非另有说明,如本文所用,任何保护基团、氨基酸和其它化合物的缩写是依照它们常用用法的公认缩写,iupac-iub生物化学命名委员会(参见,(1972)biochem.11:942-944),或iupac有机化学命名法(参见,favre ha和powell wh,nomenclature of organic chemistry:iupac recommendations and preferred names 2013,cambridge,uk:theroyal society of chemistry,2013:print isbn 978-0-85404-182-4,pdf eisbn 978-1-84973-306-9,doi 10.1039/9781849733069;有机化学命名法,章节a、b、c、d、e、f和h,pergamon press,oxford,1979.版权1979iupac;和iupac有机化合物命名指南(推荐1993),1993,blackwell scientific publications,版权1993 iupac)。如本文所用,烷基、烯基和炔基碳链,如果未指定,则含有1至20个碳、或1至16个碳,并且是直链或支链的。在某些实施方案中,2至20个碳的烯基碳链含有1至8个双键,并且在某些实施方案中,2至16个碳的烯基碳链含有1至5个双键。在某些实施方案中,2至20个碳的炔基碳链含有1至8个三键,并且在某些实施方案中,2至16个碳的炔基碳链含有1至5个三键。本文的示例性烷基、烯基和炔基包括但不限于甲基、乙基、丙基、异丙基、异丁基、正丁基、仲丁基、叔丁基、异戊基、新戊基、叔戊基、异己基、乙烯基、丙烯基、丁烯基、戊烯基、乙炔基和己炔基。如本文所用,低级烷基、低级烯基和低级炔基是指具有约1或约2个碳至约6个碳的碳链。如本文所用,“烷(烯)(炔)基”是指含有至少一个双键和至少一个三键的烷基。如本文所用,“杂烷基”是指在烃链中插入有一个或多个氧、硫(包括s(=o)和6(=o)2基团)或经取代或未取代的氮原子(包括-nr-和-n+rr-基团),在一个实施方案中在链中具有1至约20个原子,在另一个实施方案中具有1至12个原子的直链或支链脂族烃基,其中氮取代基是烷基、芳基、芳烷基、杂芳基、杂芳烷基、s(=o)2r′或cor′,其中r′是烷基、芳基、芳烷基、杂芳基、杂芳烷基、-oy或-nyy′,其中y和y′各自独立地是氢、烷基、芳基、杂芳基、环烷基或杂环基。如本文所用,“环烷基”是指饱和单环或多环环系,在某些实施方案中具有3至10个碳原子,在其它实施方案中具有3至6个碳原子;环烯基和环炔基是指分别包含至少一个双键和至少一个三键的单环或多环环系。在某些实施方案中,环烯基和环炔基基团可以含有3至10个碳原子,在进一步的实施方案中,环烯基基团含有4至7个碳原子,并且在进一步的实施方案中,环炔基基团含有8至10个碳原子。环烷基、环烯基和环炔基的环系可以由一个环或两个环或更多个环组成,这些环可以以稠合、桥接或螺接的方式连接在一起。“环烷(烯)(炔)基”是指含有至少一个双键和至少一个三键的环烷基基团。在一些实施方案中,环烷基环是不饱和的或部分饱和的。如本文所用,“碳环”是指其中构成该环的所有原子为碳原子的单环或多环环系,诸如苯或环丙烷。在一些实施方案中,碳环是不饱和的或部分饱和的。如本文所用,“经取代的烷基”、“经取代的烯基”、“经取代的炔基”、“经取代的环烷基”、“经取代的环烯基”和“经取代的环炔基”分别是指被一个或多个取代基,在某些实施方案中被一至三个或四个取代基取代的烷基、烯基、炔基、环烷基、环烯基和环炔基,其中这些取代基如本文所定义。如本文所用,“芳基”是指含有6至19个碳原子的芳族单环或多环基团。芳基基团包括但不限于诸如芴基、经取代的芴基、苯基、经取代的苯基、萘基和经取代的萘基的基团。如本文所用,“杂芳基”是指在某些实施方案中约5至约15元的单环或多环芳族环系,其中该环系中的一个或多个(在一个实施方案中1至3个)原子是杂原子,即除碳以外的元素,包括但不限于氮、氧或硫。杂芳基基团可任选与苯环稠合。杂芳基基团包括但不限于呋喃基、咪唑基、嘧啶基、四唑基、噻吩基、吡啶基、吡咯基、n-甲基吡咯基、喹啉基和异喹啉基。在某些实施方案中,该杂芳基可任选与杂环烷基环稠合。在某些实施方案中,该杂芳基可以是部分饱和的杂芳基,诸如与杂环烷基环稠合的苯环,例如与四氢呋喃基环稠合的苯环。如本文所用,“杂环烷基”、“杂环基”或“杂环”是指在一个实施方案中为3至10元,在另一个实施方案中为4至7元,在再一个实施方案中为5至6元的单环或多环非芳族环系,其中该环系中的一个或多个(在某些实施方案中1至3个)原子是杂原子,即除碳以外的元素,包括但不限于氮、氧或硫。在杂原子是氮的实施方案中,氮任选地被氢、烷基、烯基、炔基、芳基、杂芳基、芳烷基、杂芳烷基、环烷基、杂环基、环烷基烷基、杂环基烷基、酰基、胍基、脒基、磺酰基取代,或者氮可被季铵化以形成铵基团,其中取代基如上所选择。在一些实施方案中,杂环基环是饱和的。在一些实施方案中,杂环基环是不饱和的或部分饱和的。如本文所用,“经取代的芳基”、“经取代的杂芳基”和“经取代的杂环基”分别是指被一个或多个取代基,在某些实施方案中被一至三个或四个取代基取代的芳基、杂芳基和杂环基基团,其中这些取代基如本文所定义。如本文所用,“芳烷基”或“芳基烷基”是指其中烷基的一个氢原子被芳基基团置换的烷基基团。如本文所用,“杂芳烷基”是指其中烷基的一个氢原子被杂芳基基团置换的烷基基团。如本文所用,“卤基”、“卤素”或“卤化物”是指f、cl、br或i。如本文所用,“卤代烷基”是指其中一个或多个氢原子被卤素置换的烷基基团。此类基团包括但不限于氯甲基、三氟甲基和1-氯-2-氟乙基。如本文所用,“卤代烷氧基”是指其中r是卤代烷基基团的ro。如本文所用,“羟烷基”是指其中一个或多个氢原子被羟基基团(-oh)置换的烷基基团。如本文所用,“环烷氧基”是指其中r是环烷基基团的-or基团。如本文所用,“羧基”是指二价基团-c(o)o-。如本文所用,“氨基羰基”是指-c(o)nh2。如本文所用,“烷基氨基羰基”是指-c(o)nhr,其中r是烷基,包括低级烷基。如本文所用,“二烷基氨基羰基”是指-c(o)nr′r,其中r′和r独立地是烷基,包括低级烷基;“甲酰胺”是指式-nr′cor的基团,其中r′和r独立地是烷基,包括低级烷基。如本文所用,“芳基烷基氨基羰基”是指-c(o)nrr′,其中r和r′中的一者是芳基,包括低级芳基,诸如苯基,并且r和r′中的另一者是烷基,包括低级烷基。如本文所用,“芳基氨基羰基”是指-c(o)nhr,其中r是芳基,包括低级芳基,诸如苯基。如本文所用,“羟基羰基”是指-cooh。如本文所用,“烷氧基羰基”是指-c(o)or,其中r是烷基,包括低级烷基。如本文所用,“芳氧基羰基”是指-c(o)or,其中r是芳基,包括低级芳基,诸如苯基。如本文所用,“烷氧基”和“烷硫基”是指ro-和rs-,其中r是烷基,包括低级烷基。如本文所用,“芳氧基”和“芳硫基”是指ro-和rs-,其中r是芳基,包括低级芳基,诸如苯基。在没有指定任何给定取代基的数目的情况下(例如,“卤代烷基”),可以存在一个或多个取代基。例如,“卤代烷基”可包括一个或多个相同或不同的卤素。如本文所用,“环状结构”可以是环烷基、碳环、杂环、芳基或杂芳基基团。除非另有说明,如本文所用,任何保护基团、氨基酸和其它化合物的缩写是依照它们常用用法的公认缩写,iupac-iub生物化学命名委员会(参见,(1972)biochem.11:942-944),或iupac有机化学命名法(参见,favre ha和powell wh,nomenclature of organic chemistry:iupac recommendations and preferred names 2013,ca mbridge,uk:theroyal society of chemistry,2013:print isbn 978-0-85404-182-4,pdf eisbn 978-1-84973-306-9,doi 10.1039/9781849733069;有机化学命名法,章节a、b、c、d、e、f和h,pergamon press,oxford,1979.版权1979 iupac;和iupac有机化合物命名指南(推荐1993),1993,blackwell scientific publications,版权1993iupac)。术语“受试者”是指动物,包括但不限于灵长类动物(例如,人)、牛、猪、绵羊、山羊、马、狗、猫、兔、大鼠或小鼠。术语“受试者”和“患者”在本文中可互换使用,例如指哺乳动物受试者,诸如人类受试者,在一个实施方案中是指人。术语“治疗”意在包括减轻或消除病症、疾病或病状,或与该病症、疾病或病状相关的一种或多种症状;或减轻或根除该病症、疾病或病状本身的起因。术语“预防”意在包括延迟和/或排除病症、疾病或病状和/或其伴随症状发作;阻止受试者获得病症、疾病或病状;或降低受试者获得病症、疾病或病状的风险的方法。术语“治疗有效量”意在包括当施用时足以预防所治疗的病症、疾病或病状的一种或多种症状的发展或在一定程度上减轻所治疗的病症、疾病或病状的一种或多种症状的化合物的量。术语“治疗有效量”还指足以引起研究人员、兽医、医生或临床医师所寻求的生物分子(例如,蛋白质、酶、rna或dna)、细胞、组织、系统、动物或人的生物或医学反应的化合物的量。治疗有效量的本文提供的化合物可以以一个剂量施用(即,单剂量施用)或随时间分开施用(即,连续施用或多次亚剂量施用)。可以重复单剂量施用、连续施用或多次亚剂量施用,例如,以维持化合物在生物分子(例如,蛋白质、酶、rna或dna)、细胞、组织、系统、动物或人中的水平。术语“药学上可接受的载体”、“药学上可接受的赋形剂”、“生理学上可接受的载体”或“生理学上可接受的赋形剂”是指药学上可接受的材料、组合物或媒介物,诸如液体或固体填充剂、稀释剂、溶剂或包封材料。在一个实施方案中,每种组分在与药物制剂的其它成分相容的意义上是“药学上可接受的”,并且适合与人和动物的组织或器官接触使用而没有过度毒性、刺激、过敏反应、免疫原性或其它问题或并发症,与合理的益处/风险比相称。参见,remington:the science and practice of pharmacy,第22版;loyd等人编辑;thepharmaceutical press,2012;handbook of pharmaceutical excipients,第7版;rowe等人编辑;the pharmaceutical press,2012;handbook of pharmaceutical additives,第3版;ash和ash编辑;synapse information resources,inc.,2007;pharmaceuticalpreformulation and formulation,第2版;gibson编辑;crc press llc,2009。如本文所用,本文公开的化合物的“药学上可接受的形式”包括但不限于本文公开的化合物的药学上可接受的盐、溶剂化物、异构体和同位素体(即,同位素标记的衍生物)。在一个实施方案中,“药学上可接受的形式”包括但不限于如本文所公开的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物的药学上可接受的盐、溶剂化物、异构体和同位素体(即,同位素标记的衍生物)。术语“约”或“大约”意指如本领域普通技术人员确定的特定值的可接受误差,这部分地取决于如何测量或确定该值。在某些实施方案中,术语“约”或“大约”意指在1、2、3或4个标准偏差内。在某些实施方案中,术语“约”或“大约”意指在给定值或范围的50%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%或0.05%内。术语“重量百分比”或“重量%”是指组合物(例如,药物组合物)中指定组分(例如,活性化合物或赋形剂)的重量占组合物总重量的百分比。因此,组合物中所有组分的重量百分比的总和为100%。术语“活性成分”和“活性物质”是指单独或与一种或多种药学上可接受的赋形剂组合施用施用于受试者以治疗、预防或改善病状、病症或疾病的一种或多种症状的化合物。如本文所用,“活性成分”和“活性物质”可以是本文所述化合物的光学活性异构体或同位素变体。术语“药物”、“治疗剂”和“化学治疗剂”是指施用于受试者以治疗、预防或改善病状、病症或疾病的一种或多种症状的化合物或其药物组合物。在某些实施方案中,“光学活性”和“对映体活性”是指具有不少于约50%、不少于约70%、不少于约80%、不少于约90%、不少于约91%、不少于约92%、不少于约93%、不少于约94%、不少于约95%、不少于约96%、不少于约97%、不少于约98%、不少于约99%、不少于约99.5%或不少于约99.8%的对映体过量的分子集合。在某些实施方案中,基于所讨论的外消旋体的总重量,该化合物包含约95%或更多的一种对映异构体和约5%或更少的另一种对映异构体。在描述光学活性化合物时,前缀r和s用于表示分子关于其手性中心的绝对构型。(+)和(-)用于表示该化合物的旋光度,即,光学活性化合物使偏振光平面旋转的方向。前缀(-)指示该化合物是左旋的,即该化合物向左或逆时针旋转偏振光平面。(+)前缀指示该化合物是右旋的,即该化合物向右或顺时针旋转偏振光平面。然而,旋光度的符号(+)和(-)与分子的绝对构型r和s无关。术语“外消旋体”应理解为是指一对对映异构体的等摩尔混合物。它没有表现出光学活性。外消旋体的化学名称或化学式用前缀(±)-或rac-(或rac.或racem-)或用符号rs和sr与对映异构体的化学名称或化学式区分开。参见iupac recommendations 1996,basictermino logy of stereochemistry,pure&appl.chem.,第68卷第12期,第2193-2222页,1996。本文公开的含有两个具有已知相对构型的不对称中心的外消旋化合物使用构型描述符r,s或r,r命名,前面是前缀rac-。例如,以下外消旋化合物a命名为rac-(1r,3s)-1-溴-3-氯环己烷,并且是对映异构体(1r,3s)-1-溴-3-氯环己烷和(1s,3r)-1-溴-3-氯环己烷的1∶1混合物。根据cahn-ingold-prelog规则,使用小写r/s立体描述符来描述假非对称中心(参见r.s.cahn,c.k.ingold and v.prelog,angew.chem.intemat.ed.eng.5,385-415,511(1966);及v.prelog和g.helmchen,angew.chem internat.ed.eng.21,567-583(1982))。例如,以下化合物b命名为(1s,4s)-1-溴-4-氯环己烷。本文包括的化合物名称使用版本20.0.0.38、20.1.0.112和22.2.0.3348由相应的化学结构产生。如果化学结构与本文公开的名称之间存在差异,则应以结构为准。术语“同位素变体”是指在构成此类化合物的一个或多个原子处含有非天然比例的同位素的化合物。在某些实施方案中,化合物的“同位素变体”含有非天然比例的一种或多种同位素,包括但不限于氢(1h)、氘(2h)、氚(3h)、碳-11(11c)、碳-12(12c)、碳-13(13c)、碳-14(14c)、氮-13(13n)、氮-14(14n)、氮-15(i5n)、氧-14(14o)、氧-15(i5o)、氧-16(16o)、氧-17(17o)、氧-18(18o)、氟-17(17f)、氟-18(18f)、硫-32(32s)、硫-33(33s)、硫-34(34s)、硫-35(35s)、硫-36(33s)、氯-35(35cl)、氯-36(36cl)和氯-37(37cl)。在某些实施方案中,化合物的“同位素变体”是稳定形式,即非放射性的。应理解,在本文提供的化合物中,任何氢可为例如2h,或任何碳可为例如13c,或任何氮可为例如15n,并且任何氧可为18o,其中根据技术人员的判断可行。在某些实施方案中,化合物的“同位素变体”含有非天然比例的氘。在一些实施方案中,化合物的药学上可接受的衍生物是同位素变体。术语“溶剂化物”是指由一个或多个溶质分子(例如,本文提供的化合物)和一个或多个溶剂分子形成的复合物或聚集体,溶剂分子以化学计量或非化学计量的量存在。合适的溶剂包括但不限于水、甲醇、乙醇、正丙醇、异丙醇和乙酸。在某些实施方案中,该溶剂是药学上可接受的。在一个实施方案中,该复合物或聚集体为结晶形式。在另一个实施方案中,该复合物或聚集体为非结晶形式。在溶剂是水的情况下,该溶剂化物是水合物。水合物的实例包括但不限于半水合物、一水合物、二水合物、三水合物、四水合物和五水合物。短语“其同位素变体;或其药学上可接受的盐;或其药学上可接受的溶剂化物”具有与短语“其中提及的化合物的同位素变体;或其中提及的化合物的药学上可接受的盐;或其中提及的化合物的同位素变体的药学上可接受的盐;或其中提及的化合物的药学上可接受的溶剂化物;或其中提及的化合物的同位素变体的药学上可接受的溶剂化物;或其中提及的化合物的药学上可接受的盐的药学上可接受的溶剂化物;或其中提及的化合物或其变体的同位素变体或其变体的药学上可接受的盐的药学上可接受的溶剂化物”相同的含义。3.2.化合物本文提供了一种式i的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或or2a;y是咪唑基、吡啶基或8-10元稠合杂芳基;其中所述咪唑基任选地被1个r6a取代基取代并且任选地被1-2个r7a取代基取代;并且所述吡啶基或所述8-10元稠合杂芳基任选地被1-4个r7a取代基取代;r1a是氢或c1-6烷基,其中所述c1-6烷基任选地被1-4个r8a取代基取代;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、c3-7杂环烷基、c5-10元芳基、-s(o)2r15a、-p(o)r16ar17a或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基和5-10元杂芳基各自独立任选地被1-4个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或者r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,其中rμa和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、芳基或5-10元杂芳基,其中所述芳基和5-10元杂芳基各自独立任选地被1-4个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、-c(o)or14a、-c(o)nr12ar13a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是-oh、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基和5-10元杂芳基任选地被1-3个r8a取代基取代,或r12a和r13a组合形成包括它们均附接的氮原子的3-7元杂环烷基;r14a是氢、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r15a是c1-6烷基、c3-6环烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。在一些实施方案中,式i的化合物是这样的:y是任选地被1个r6a取代基取代并且任选地被1-2个r7a取代基取代的咪唑基。在一些实施方案中,式i的化合物是这样的:y是c连接的咪唑基,其在咪唑基环的氮处被1个r6a取代基取代并且任选地在咪唑基环的碳处被1-2个r7a取代基取代。在一些实施方案中,式i的化合物是式ia的化合物:或其药学上可接受的形式。在一些实施方案中,式i的化合物是式ib的化合物:或其药学上可接受的形式。在一些实施方案中,式i的化合物是这样的:y是任选地被1-4个r7a取代基取代的吡啶基。在一些实施方案中,式i的化合物是式ib的化合物:或其药学上可接受的形式。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:r4a和r5a中不超过一者是氢。在一些实施方案中,该化合物是这样的:r5a是氢、甲基、乙基或异丙基。在一些实施方案中,该化合物是这样的:r5a是氢。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:r6a是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a或-c(o)or14a,其中该c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。在一些实施方案中,该化合物是这样的:r6a是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中该c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。在一些实施方案中,该化合物是这样的:r6a是甲基、乙基或异丙基,其中该甲基、乙基和异丙基各自独立任选地被1-3个r8a取代,其中r8a是-oh、c1-3烷氧基或c1-3卤代烷氧基。在一些实施方案中,该化合物是这样的:r6a是甲基、乙基或异丙基。在一些实施方案中,该化合物是这样的:r6a是甲基。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中该c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。在一些实施方案中,该化合物是这样的:r7a是甲基、乙基或异丙基,其中该甲基、乙基和异丙基各自独立任选地被1-3个r8a取代,其中r8a是-oh、c1-3烷氧基或c1-3卤代烷氧基。在一些实施方案中,该化合物是这样的:r7a是甲基、乙基或异丙基。在一些实施方案中,该化合物是这样的:r7a是甲基。在一些实施方案中,该化合物是这样的,m是4。在一些实施方案中,该化合物是这样的,m是3。在一些实施方案中,该化合物是这样的,m是2。在一些实施方案中,该化合物是这样的,m是1。在一些实施方案中,该化合物是这样的,m是0。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:x是-or2a。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:x是-nr1ar2a。在一些实施方案中,该化合物是这样的:x是-nr1ar2a,并且r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基。在一些实施方案中,该化合物是这样的:r1a是氢或c1-3烷基。在一些实施方案中,该化合物是这样的:r1a是甲基、乙基或异丙基。在一些实施方案中,该化合物是这样的:r1a是氢。在一些实施方案中,该化合物是这样的:r2a是c1-4烷基、c4-5环烷基、c1-4杂烷基或5-6元杂芳基,其中该c1-4烷基、c4-5环烷基、c1-4杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代。在一些实施方案中,该化合物是这样的:r2a是5-6元杂芳基,其中每个独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。在一些实施方案中,该化合物是这样的:r2a是选自以下的5-6元杂芳基:吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基或噻二唑基,其中各自独立任选地被1-3个r8a取代基取代。在一些实施方案中,该5-6元杂芳基被2个独立的r8a取代基取代,这些取代基组合形成包括各自附接的一个或多个原子的与5-6元杂芳基稠合的5-6元环烷基。在一些实施方案中,该5-6元杂芳基被2个独立的r8a取代基取代,这些取代基组合形成包括各自附接的一个或多个原子的与5-6元杂芳基稠合的5-6元杂环烷基。在一些实施方案中,2个r8a取代基组合形成吡唑并[5,1-b]噁唑基环。在一些实施方案中,2个r8a取代基组合形成2,3-二氢吡唑并[5,1-b]噁唑基环。在一些实施方案中,该5-6元杂芳基是吡唑基。在一些实施方案中,该化合物是这样的:r8a独立地选自c1-6烷基、c1-6卤代烷基、c3-6环烷基、-nr12ar13a、-(co)r11a、氧代、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基或c3-6环烷氧基。在一些实施方案中,该化合物是这样的:r8a独立地选自c1-4烷基、c1-4卤代烷基、c3-5环烷基、-nr12ar13a、-(co)r11a、氧代、c1-4羟烷基、c1-4杂烷基、3-5元杂环烷基、c1-4烷氧基或c3-5环烷氧基。在一些实施方案中,该化合物是这样的:r8a独立地选自甲基、乙基、异丙基、环丙基、环丁基、-nr12ar13a、-(co)r11a、氧代、c2-3羟烷基、c2-4杂烷基、甲氧基、乙氧基、异丙氧基、环丙氧基或环丁氧基。在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:x是:-oh、-nh2、在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:x是:-oh、-nh2、在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:r3a是c1-4烷基、c3-6环烷基、c1-4杂烷基、苯基、5-6元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中该c1-4烷基、c3-6环烷基、c1-4杂烷基、苯基和5-6元杂芳基各自独立任选地被1-3个r9a取代基取代。在一些实施方案中,该化合物是这样的:r9a独立地选自c1-4烷基、c3-5环烷基、-(co)r11a、c1-4羟烷基、c1-4杂烷基、4-6元杂环烷基、c1-4烷氧基或c3-5环烷氧基。在一些实施方案中,该化合物是这样的:r9a独立地选自甲基、乙基、异丙基、环丙基、环丁基、-(co)r11a、c2-3羟烷基、c2-4杂烷基、甲氧基、乙氧基、异丙氧基、环丙氧基、环丁氧基、咪唑基或哌啶基。在一些实施方案中,该化合物是这样的:r3a是:-ch3、未取代的苯基、(4-甲氧基)-苯基、异丙基、环丙基、在一些实施方案中,该化合物是这样的:r3a是:-ch3、未取代的苯基、异丙基、环丙基、在一些实施方案中,式i、式ia、式ib或式ic的化合物是这样的:r4a是苯基或5-10元杂芳基,其中该苯基或5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。在一些实施方案中,该化合物是这样的:r4a是任选地被1-3个r10a取代基取代的苯基。在一些实施方案中,该化合物是这样的:r4a是任选地被1-3个r10a取代基取代的5-6元杂芳基。在一些实施方案中,该化合物是这样的:r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基。在一些实施方案中,该化合物是这样的:r10a独立地选自卤基、c1-4烷基、c3-5环烷基、c1-4卤代烷基、c1-4羟烷基、c1-4杂烷基、3-5元杂环烷基、-oh、c1-4烷氧基、c3-5环烷氧基、c1-4卤代烷氧基或-nr12ar13a。在一些实施方案中,该化合物是这样的:r10a独立地选自卤基、甲基、乙基、异丙基、环丙基、环丁基、c1-3卤代烷基、c2-3羟烷基、c2-4杂烷基、-oh、甲氧基、乙氧基、异丙氧基、环丙氧基、环丁氧基、c1-4卤代烷氧基或-nr12ar13a。在一些实施方案中,该化合物是这样的:r12a和r13a各自独立地选自氢、c1-4烷基、c3-5环烷基、c1-4羟烷基、c1-4杂烷基、-oh或c1-4烷氧基。在一些实施方案中,该化合物是这样的:r12a和r13a各自独立地选自氢、甲基、乙基、异丙基、环丙基、环丁基、甲氧基或乙氧基。在一些实施方案中,该化合物是这样的:r12a和r13a各自独立地选自氢或甲基。在一些实施方案中,该化合物是这样的:r12a和r13a各自是氢。在一些实施方案中,该化合物是这样的:r4a是:氢、未取代的苯基、在一些实施方案中,该化合物是这样的:r4a是:氢、未取代的苯基、在一些实施方案中,式i的化合物是式ii的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、-s(o)2r15a、-p(o)r16ar17a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,任选地其中r1a和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基或c1-6卤代烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r15a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;m是0、1或2;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。在一些实施方案中,式i的化合物是式iia的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基、-s(o)2r15a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基、5元、6元或9元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5元、6元或9元杂芳基,其中所述苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是c1-3烷基或c1-3杂烷基,其中所述c1-3烷基或c1-3杂烷基任选地被生物素酰胺取代;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr11ar12a或5-6元杂芳基,其中所述c1-6烷基或c1-6杂烷基任选地被生物素酰胺取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;r15a是c1-3烷基、c3-6环烷基或c1-4杂烷基;r16a和r17a各自独立地选自c1-3烷基或c1-3烷氧基,或r16a和r17a组合形成包括它们均附接的磷原子的5元杂环烷基;并且m是0或1。在一些实施方案中,式iia的化合物是这样的:r1a和r2a连同它们附接的氮具有以下结构:-nh2、r3a是-ch3、未取代的苯基、异丙基、环丙基、r4a是氢、未取代的苯基、rsa是氢;r6a是甲基、-ch2ch2nh2或r7a是甲基;并且m是0或1。在一些实施方案中,式iia的化合物是这样的:r1a和r2a连同它们附接的氮具有以下结构:-nh2、r3a是-ch3、未取代的苯基、异丙基、环丙基、r4a是氢、未取代的苯基、r5a是氢;r6a是甲基、-ch2ch2nh2或并且m是0。在一些实施方案中,式i的化合物是式iia(1)的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是5或6元杂芳基,其中所述5或6元杂芳基任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r8a选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;并且r18a是c1-3烷基或c3-6环烷基。在一些实施方案中,式iia(1)的化合物是这样的:r18a是甲基、乙基、异丙基或环丙基。在一些实施方案中,式iia(1)的化合物是这样的:r18a是甲基。在一些实施方案中,式iia(1)的化合物是这样的:r18a是乙基。在一些实施方案中,式iia(1)的化合物是这样的:r18a是异丙基。在一些实施方案中,式iia(1)的化合物是这样的:r18a是环丙基。在一些实施方案中,式iia(1)的化合物是这样的:r8a选自c1-6烷基、c3-6环烷基、3-6元杂环烷基、c1-6烷氧基或c3-6环烷氧基、-nr12ar13a或5-6元杂芳基。在一些实施方案中,式iia(1)的化合物是这样的:r2a是吡啶基、嘧啶基、吡唑基(pyrazyl)或吡唑基(pyrazolyl),其中该吡啶基、嘧啶基、吡唑基(pyrazyl)或吡唑基(pyrazolyl)任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。在一些实施方案中,式iia(1)的化合物是这样的,r2a是任选地被1-2个r8a取代基取代的吡啶基。在一些实施方案中,式iia(1)的化合物是这样的,r2a是在一些实施方案中,式iia(1)的化合物是这样的,r2a是任选地被1-2个r8a取代基取代的嘧啶基。在一些实施方案中,式iia(1)的化合物是这样的:r2a是在一些实施方案中,式iia(1)的化合物是这样的,r2a是任选地被1-2个r8a取代基取代的吡唑基(pyrazyl)。在一些实施方案中,式iia(1)的化合物是这样的,r2a是任选地被1-2个r8a取代基取代的吡唑基(pyrazolyl)。在一些实施方案中,式iia(1)的化合物是这样的,r2a是在一些实施方案中,式iia(1)的化合物是这样的,2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5元环烷基或5元杂环烷基。在一些实施方案中,式iia(1)的化合物是这样的,r1a和r2a连同它们附接的氮具有以下结构:在一些实施方案中,式iia(1)的化合物是这样的,r1a和r2a连同它们附接的氮具有以下结构:在一些实施方案中,式iia(1)的化合物选自化合物6、57、58、62、63、64、68、84、91、100、102、104、107、124、126、136、137、141、142、143、144、145、157、221、222、226、235、238、252、255、260、265、267和268。在一些实施方案中,式iia(1)的化合物选自化合物6、84、100、102、104、124、221、222、235、238、252、255、260和267。在一些实施方案中,式i的化合物是式iib的化合物: 或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基,任选地其中r1a和r2a形成的所述4-6元杂环烷基与6元杂芳基稠合;r3a是c1-3烷基或苯基,其中所述c1-3烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是苯基或5元杂芳基,其中所述苯基和5元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r1a和r2a组合形成r6a是甲基,m是0,并且rsa是h时,r3a和r4a中的至少一者不是未取代的苯基。在一些实施方案中,式iib的化合物是这样的:r1a和r2a组合形成r3a是-ch3、未取代的苯基、(4-甲氧基)-苯基或异丙基;r4a是r5a是氢;r6a是甲基;并且m是0。在一些实施方案中,式iib的化合物是这样的:r1a和r2a组合形成r3a是-ch3或未取代的苯基;r4a是r5a是氢;r6a是甲基;并且m是0。在一些实施方案中,式i的化合物是式iic的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6杂烷基或6元杂芳基,其中所述c1-6杂烷基和5-6元杂芳基各自任选地被1-3个r8a取代基取代;r3a是c1-3烷基或苯基,其中所述c1-3烷基或苯基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5或6元杂芳基,其中所述苯基和5或6元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r2a是h,r6a是甲基,m是0,并且rsa是h时,r3a和r4a中的至少一者不是未取代的苯基。在一些实施方案中,式iic的化合物是这样的:r2a连同其附接的氧具有以下结构:-oh、r3a是-ch3或未取代的苯基;r4a是氢、未取代的苯基、r5a是氢;r6a是甲基;并且m是0。在一些实施方案中,式i的化合物是式iii的化合物:或其药学上可接受的形式,其中:x是nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。在一些实施方案中,式i的化合物是式iiia的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个ri0a取代基取代,任选地其中2个独立的ri0a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。在一些实施方案中,式i的化合物是式iiib的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。在一些实施方案中,式i的化合物是式iiic的化合物: 或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。在一些实施方案中,式i的化合物是式iv的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;ria是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或ria和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。在一些实施方案中,式i的化合物是式iva的化合物: 或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。在一些实施方案中,式iva的化合物是这样的:r1a和r2a连同它们附接的氮具有以下结构:r3a是-ch3或苯基;r4a是rsa是氢;r7a是甲基;并且m是0。在一些实施方案中,式i的化合物是式ivb的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。在一些实施方案中,式ivb的化合物是这样的:r1a和r2a组合形成r3a是-ch3或苯基;r4a是r5a是氢;r7a是甲基;并且m是0。在一些实施方案中,式i的化合物是式ivc的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个ri0a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。在一些实施方案中,式ivc的化合物是这样的:r2a是氢;r3a是-ch3;r4a是rsa是氢;r7a是甲基;m是0。在一个实施方案中,式i、ia、ii或iib的化合物是这样的,y、x、r1a、r2a、r3a、r4a和rsa取代基的组合不形成:在一个实施方案中,式i、ia、ii或iib的化合物不是在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物具有不超过1000g/mol的分子量(mw)。在一个实施方案中,该化合物具有不超过900g/mol、不超过800g/mol、不超过700g/mol、不超过600g/mol或不超过500g/mol的mw。在一个实施方案中,该化合物具有不超过900g/mol的mw。在一个实施方案中,该化合物具有不超过800g/mol的mw。在一个实施方案中,该化合物具有不超过700g/mol的mw。在一个实施方案中,该化合物具有不超过600g/mol的mw。在一个实施方案中,该化合物具有不超过500g/mol的mw。在一个实施方案中,该化合物具有不超过450g/mol的mw。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在一个实施方案中,根据ras超家族活性测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式是ras超家族活性的调节剂。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节45%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节75%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节90%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节95%或更多。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约50%至约60%。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约60%至约70%。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约70%至约80%。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约80%至约90%。在一个实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节约90%至约100%。在一个实施方案中,该化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一个实施方案中,根据erk1/2磷酸化测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制erk1/2的磷酸化。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制75%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制80%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制85%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制90%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制95%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约50%至约60%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约60%至约70%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约70%至约80%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制约80%至约90%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erkl/2的磷酸化抑制约90%至约100%。在一个实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,根据erk1/2磷酸化测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式激活erk1/2的磷酸化。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或约100%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活75%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活85%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活90%或更多。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活95%或更多。在一个实施方案中,根据erk l/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活等于或大于100%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约50%至约60%。在一个实施方案中,根据erk l/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约60%至约70%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约70%至约80%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约80%至约90%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约90%至约100%。在一个实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活约100%或更多。在一个实施方案中,该化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一个实施方案中,根据akt磷酸化测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制akt的磷酸化。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制75%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制85%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制90%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制95%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约50%至约60%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约60%至约70%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约70%至约80%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约80%至约90%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制约90%至约100%。在一个实施方案中,该化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,该化合物在一个实施方案中,根据akt磷酸化测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式激活akt的磷酸化。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或约100%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活75%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活85%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活90%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活95%或更多。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活等于或大于100%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约50%至约60%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约60%至约70%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约70%至约80%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约80%至约90%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约90%至约100%。在一个实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活约100%或更多。在一个实施方案中,该化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、112、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、13/、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。在一个实施方案中,根据磷酸-smad2/3抑制测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制smad2/3的磷酸化。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制75%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制80%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制85%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制90%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制95%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约50%至约60%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约60%至约70%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约70%至约80%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约80%至约90%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制约90%至约100%。在一个实施方案中,该化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一个实施方案中,根据磷酸-smad2/3抑制测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式激活smad2/3的磷酸化。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据磷酸-smad2/3抑制测定,所述化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或约100%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活75%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活85%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活90%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活95%或更多。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活等于或大于100%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约50%至约60%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约60%至约70%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约70%至约80%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约80%至约90%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约90%至约100%。在一个实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活约100%或更多。在一个实施方案中,该化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。在一个实施方案中,根据jnk激活测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制jnk。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制30%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制50%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制75%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制85%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制90%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制95%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约50%至约60%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约60%至约70%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约70%至约80%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约80%至约90%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制约90%至约100%。在一个实施方案中,该化合物选自化合物29、30、32、33和34或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物29、32、33和34或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物29、32和34或其药学上可接受的形式。在一个实施方案中,根据jnk激活测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式激活jnk。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或约100%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活30%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活50%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活75%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活85%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活90%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活95%或更多。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活等于或大于100%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约50%至约60%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约60%至约70%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约70%至约80%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约80%至约90%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约90%至约100%。在一个实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活约100%或更多。在一个实施方案中,该化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一个实施方案中,根据mapk p38激活测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制mapkp38。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapkp38抑制30%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制50%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制75%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapkp38抑制85%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制90%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约50%至约60%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约60%至约70%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约70%至约80%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约80%至约90%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制约90%至约100%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制95%或更多。在一个实施方案中,该化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。在一个实施方案中,根据mapk p38激活测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式激活mapkp38。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、或约100%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活30%或更多。在一个实施方案中,根据mapkp38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活50%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活75%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活85%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活90%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活95%或更多。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活等于或大于100%。在一个实施方案中,根据mapkp38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约50%至约60%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约60%至约70%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约70%至约80%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约80%至约90%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约90%至约1000%。在一个实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活约100%或更多。在一个实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一个实施方案中,根据增殖测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1.25μm或更小、1.1μm或更小、1μm或更小、0.9μm或更小、0.8μm或更小、0.75μm或更小、0.7μm或更小、0.6μm或更小、0.5μm或更小、0.4μm或更小、0.3μm或更小、0.25μm或更小、0.2μm或更小、0.15μm或更小、或0.1μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约1.25μm至约1.1μm、约1.1μm至约1μm、约1.0μm至约0.9μm、约0.9μm至约0.8μm、约0.8μm至约0.75μm、约0.75μm至约0.7μm、约0.7μm至约0.6μm、约0.6μm至约0.5μm、约0.5μm至约0.4μm、约0.4μm至约0.3μm、约0.3μm至约0.25μm、约0.25μm至约0.2μm、约0.2μm至约0.15μm、约0.15μm至约0.1μm、约0.1μm至约0.01μm、约0.01μm至约0.001μm、约0.001μm至约0.0001μm或小于约0.0001μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1.25μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.6μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.5μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.4μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.3μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.25μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.20μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.15μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.10μm或更小的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约1.25μm至约1.1μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约1.1μm至约1μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约1.0μm至约0.9μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.9μm至约0.8μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.8μm至约0.75μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.75 m至约0.7μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.7μm至约0.6μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.6μm至约0.5μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.5μm至约0.4μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.4μm至约0.3μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.3μm至约0.25μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.25μm至约0.2μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.2μm至约0.15μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.15μm至约0.1μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.1μm至约0.01μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.01μm至约0.001μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以约0.001μm至约0.0001μm的ic50值抑制miapaca2的增殖。在一个实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以小于约0.0001μm的ic50值抑制miapaca2的增殖。在一个实施方案中,该化合物选自化合物6、13、22、26、29、30、32、33、34、42、45、46、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、214、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物6、13、22、26、29、30、32、33、34、42、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物6、13、22、32、34、48、49、50、53、54、55、56、57、58、59、62、63、64、65、68、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、106、107、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、156、157、158、165、169、170、174、175、196、209、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、255、257、263、264、265、266、267、268、270、271、274和276或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物6、48、49、50、53、54、55、57、58、62、63、64、65、68、73、76、79、82、84、89、91、94、95、97、98、100、102、104、106、107、110、112、113、114、115、117、118、120、122、123、124、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、156、157、158、165、169、170、196、221、222、224、226、227、228、230、231、232、233、234、235、236、237、238、239、240、243、244、245、248、249、250、252、255、257、263、265、266、267和268或其药学上可接受的形式。在一个实施方案中,根据il-6定量测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制il-6。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制75%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制85%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制90%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制95%或更多。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约50%至约60%。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约60%至约70%。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约70%至约80%。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约80%至约90%。在一个实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制约90%至约100%。在一个实施方案中,该化合物选自化合物1、4、6、13、19、20、22、23、27、29、30、31、32、33、34、40、42、45、46、67、81、82、85、86、89、93、99、104、105、111、113、143、149、160、161、163、164、166、173、175、176、177、192、193、194、196、199、201、203、204、206、207、208、209、210、217、219、238、247、248、249、250、257、260、263、264、265、268、269、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,根据tnf-α定量测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制tnf-α。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制75%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制85%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制90%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制95%或更多。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约50%至约60%。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约60%至约70%。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约70%至约80%。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约80%至约90%。在一个实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制约90%至约100%。在一个实施方案中,该化合物选自化合物4、23、29、30、31、32、33、42、45、46、93、99、149、166、196、203、207、209、210、219、269、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,根据动力学溶解度测定,在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为10μm或更大、20μm或更大、30μm或更大、40μm或更大、50μm或更大、60μm或更大、70μm或更大、80μm或更大、90μm或更大、100μm或更大、150μm或更大、或200μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为10μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为20μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为30μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为40μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为50μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为60μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为70μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为80μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为90μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为100μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为150μm或更大。在一个实施方案中,根据动力学溶解度测定,该化合物在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为200μm或更大。在一个实施方案中,该化合物选自化合物53、55、57、58、84、91、100、102、116、118、124、137、141、142、145、158、221、222、255和267或其药学上可接受的形式。在一个实施方案中,该化合物选自化合物91、102、118和255或其药学上可接受的形式。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式,根据小鼠肝微粒体代谢稳定性测定,在小鼠肝微粒体中的半衰期为10分钟或更长、20分钟或更长、30分钟或更长、40分钟或更长、或50分钟或更长。在一个实施方案中,根据小鼠肝微粒体代谢稳定性测定,该化合物在小鼠肝微粒体中的半衰期为10分钟或更长。在一个实施方案中,根据小鼠肝微粒体代谢稳定性测定,该化合物在小鼠肝微粒体中的半衰期为20分钟或更长。在一个实施方案中,根据小鼠肝微粒体代谢稳定性测定,该化合物在小鼠肝微粒体中的半衰期为30分钟或更长。在一个实施方案中,根据小鼠肝微粒体代谢稳定性测定,该化合物在小鼠肝微粒体中的半衰期为40分钟或更长。在一个实施方案中,根据小鼠肝微粒体代谢稳定性测定,该化合物在小鼠肝微粒体中的半衰期为50分钟或更长。在一个实施方案中,该化合物选自化合物6、102、104、124、126、128、129、137、141、142、144、145、156、157、224、226、227、235、238、248、255、265和267或其药学上可接受的形式。在一个实施方案中,根据增殖测定,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制nci-h358、a375、gp2d、bt549或mm.r 1的增殖。在一个实施方案中,根据增殖测定,该化合物抑制nci-h358的增殖。在一个实施方案中,根据增殖测定,该化合物抑制a375的增殖。在一个实施方案中,根据增殖测定,该化合物抑制gp2d的增殖。在一个实施方案中,根据增殖测定,该化合物抑制mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以50nm或更小、40nm或更小、30nm或更小、20nm或更小、10nm或更小、1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以50nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以40nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以30nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以20nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以10nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以1nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以0.1nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以0.01nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以1nm或更小的ic50值抑制mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以0.1nm或更小的ic50值抑制mm.r1的增殖。在一个实施方案中,根据增殖测定,该化合物以0.01nm或更小的ic50值抑制mm.r1的增殖。在一个实施方案中,该化合物选自化合物6、58、84、100、102、104、124、221、222、235、238、252、255和267或其药学上可接受的形式。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物的药学上可接受的形式是所述化合物的异构体、同位素变体、药学上可接受的盐、多晶型物或溶剂合物。在一个实施方案中,该化合物的药学上可接受的形式不包括盐形式。在一个实施方案中,该化合物的异构体是该化合物的非对映异构体或对映异构体。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物是该化合物的互变异构体。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物是外消旋体或非对映异构体的混合物。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物是单一对映异构体或单一非对映异构体。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物是(r)对映异构体。在一个实施方案中,该化合物具有大于10%的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、98%或更多或99%或更多对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有15%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有25%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有50%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有75%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有90%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有95%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有98%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有99%或更多的对映异构体过量的(r)对映异构体。在一个实施方案中,该化合物具有约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%对映异构体过量的(r)对映异构体。在一个实施方案中,式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物是(s)对映异构体。在一个实施方案中,所述化合物具有大于10%的(s)对映异构体的对映异构体过量。在一个实施方案中,该化合物具有15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、98%或更多或99%或更多对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有15%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有25%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有50%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有75%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有90%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有95%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有98%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有99%或更多的对映异构体过量的(s)对映异构体。在一个实施方案中,该化合物具有约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%对映异构体过量的(s)对映异构体。3.3.调节细胞靶标活性的方法本文提供了调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该ras超家族蛋白存在于细胞中。在一些实施方案中,该方法包括使该ras超家族蛋白与根据ras超家族活性测定,在20μm下将一种或多种ras超家族蛋白的活性调节45%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该ras超家族蛋白与根据ras超家族活性测定,在20μm下将一种或多种ras超家族蛋白的活性调节50%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一些实施方案中,本文提供的方法抑制ras超家族蛋白。在本文提供的方法的一些实施方案中,该ras超家族蛋白是ras蛋白或其突变体。在一些实施方案中,该ras蛋白是diras i;diras2;diras3;eras;gem;hras;kras;mras;nkirasi;nkiras2;nras;rala;ralb;rapia;rapib;rap2a;rap2b;rap2c;rasdi;rasd2;raslioa;rasliob;rasli ia;rasliib;rasl 12;remi;rem2;rerg;rergl;rrad;rras;或rras2。在一些实施方案中,该ras蛋白是hras;kras;或nras,或其突变体。在一些实施方案中,该ras蛋白是kras突变体。在一些实施方案中,该kras突变体是kras g12d突变体、krasg12c突变体或kras q61h突变体。在一些实施方案中,该ras蛋白是hras或其突变体。在一些实施方案中,该ras蛋白是nras或其突变体。在本文提供的方法的一些实施方案中,该ras超家族蛋白是rac蛋白或其突变体。在一些实施方案中,该rac蛋白是rac1;rac2;rac3;rhog,或其突变体。在一些实施方案中,该rac蛋白是野生型rac1。在本文提供的方法的一些实施方案中,该ras超家族蛋白是rho蛋白或其突变体。在一些实施方案中,该rho蛋白是rhoa;rhob;rhobtb1;rhobtb2;rhobtb3;rhoc;rhod;rhof;rhoh;rhoj;rhoq;rhou;rhov;rnd1;rnd2;rnd3;cdc42,或其突变体。在一些实施方案中,该rho蛋白是野生型rhoa。在本文提供的方法的一些实施方案中,该ras超家族蛋白是cdc42蛋白或其突变体。在本文提供的方法的一些实施方案中,该ras超家族蛋白是rheb蛋白或其突变体。在本文提供的方法的一些实施方案中,该ras超家族蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。在一些实施方案中,该受试者患有癌症。在一些实施方案中,该受试者是人。在本文提供的方法的一些实施方案中,调节发生在患有癌症的受试者中。在一些实施方案中,该癌症是实体瘤。在一些实施方案中,该癌症是血源性肿瘤(或血液癌症)。在一些实施方案中,该癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。在一些实施方案中,该癌症是胰腺癌。在一些实施方案中,该癌症是结肠癌。在一些实施方案中,该癌症是三阴性乳腺癌。在一些实施方案中,该癌症是多发性骨髓瘤。在一些实施方案中,该癌症是依赖于ras超家族蛋白的癌症。本文提供了调节半胱天冬酶活性的方法,其包括使半胱天冬酶与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节半胱天冬酶活性的方法,其包括使所述半胱天冬酶与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、19/、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在一些实施方案中,本文提供的方法激活半胱天冬酶。在一些实施方案中,半胱天冬酶是半胱天冬酶3、半胱天冬酶6或半胱天冬酶9。在本文提供的方法的一些实施方案中,半胱天冬酶的接触发生在细胞中。在一些实施方案中,半胱天冬酶活性的调节诱导细胞的凋亡。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。在一些实施方案中,该受试者患有癌症。在一些实施方案中,调节发生在患有癌症的受试者中。在一些实施方案中,该癌症是实体瘤。在一些实施方案中,该癌症是血源性肿瘤(或血液癌症)。在一些实施方案中,该癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤、多发性骨髓瘤。在一些实施方案中,该癌症是胰腺癌。在一些实施方案中,该癌症是结肠癌。在一些实施方案中,该癌症是三阴性乳腺癌。在一些实施方案中,该癌症是多发性骨髓瘤。在一些实施方案中,该受试者是人。本文提供了调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节erk1/2活性的方法的某些实施方案中,该方法抑制erk1/2蛋白的磷酸化。在一些实施方案中,该方法包括使该erk1/2蛋白与根据erk1/2磷酸化测定,在10μm下将该erk1/2蛋白的磷酸化抑制80%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该erk1/2蛋白与根据erk1/2磷酸化测定,在10μm下将该erk1/2蛋白的磷酸化抑制85%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在本文所述的调节erk1/2活性的方法的某些实施方案中,该方法激活erk1/2蛋白的磷酸化。在一些实施方案中,该方法包括使该erk1/2蛋白与根据erk1/2磷酸化测定,在10μm下将该erk1/2蛋白的磷酸化激活45%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该erk1/2蛋白与根据erk1/2磷酸化测定,在10μm下将该erk1/2蛋白的磷酸化激活50%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该erk1/2蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节akt活性的方法,其包括使akt蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节akt活性的方法,其包括使akt蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、1l0、111、112、1l3、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、19/、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节akt活性的方法的某些实施方案中,该方法抑制akt蛋白的磷酸化。在一些实施方案中,该方法包括使该akt蛋白与根据akt磷酸化测定,在10μm下将该akt蛋白的磷酸化抑制85%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。在本文所述的调节akt活性的方法的某些实施方案中,该方法激活akt蛋白的磷酸化。在一些实施方案中,该方法包括使该akt蛋白与根据akt磷酸化测定,在10μm下将该akt蛋白的磷酸化激活50%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、1l2、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、137、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该akt蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节smad2/3活性的方法的某些实施方案中,该方法抑制smad2/3蛋白的磷酸化。在一些实施方案中,该方法包括使该smad2/3蛋白与根据磷酸-smad2/3抑制测定,在10μm下将该smad2/3蛋白的磷酸化抑制80%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该smad2/3蛋白与将该smad2/3蛋白的磷酸化抑制85%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在本文所述的调节smad2/3活性的方法的某些实施方案中,该方法激活smad2/3蛋白的磷酸化。在一些实施方案中,该方法包括使该smad2/3蛋白与根据磷酸-smad2/3抑制测定,在10μm下将该smad2/3蛋白的磷酸化激活50%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该smad2/3蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节jnk活性的方法,其包括使jnk蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节jnk活性的方法,其包括使jnk蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节jnk活性的方法的某些实施方案中,该方法抑制jnk蛋白的磷酸化。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化抑制30%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化抑制75%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化抑制约100%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物29、30、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32和34或其药学上可接受的形式。在本文所述的调节jnk活性的方法的某些实施方案中,该方法激活jnk蛋白的磷酸化。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化激活30%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化激活75%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该jnk蛋白与根据jnk激活测定,将该jnk蛋白的磷酸化激活约100%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该jnk蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节mapk p38活性的方法的某些实施方案中,该方法抑制mapk p38蛋白的磷酸化。在一些实施方案中,该方法包括使该mapk p38蛋白与根据mapk p38激活测定,在10μm下将该mapk p38的磷酸化抑制30%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该mapk p38蛋白与根据mapk p38激活测定,在10μm下将该mapk p38的磷酸化抑制约100%的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。在本文所述的调节mapk p38活性的方法的某些实施方案中,该方法激活mapk p38蛋白的磷酸化。在一些实施方案中,该方法包括使该mapk p38蛋白与根据mapk p38激活测定,在10μm下将该mapk p38的磷酸化激活30%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该mapk p38蛋白与根据mapk p38激活测定,在10μm下将该mapk p38的磷酸化激活75%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该方法包括使该mapk p38蛋白与根据mapk p38激活测定,在10μm下将该mapkp38的磷酸化激活约100%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该mapk p38蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节il-6活性的方法,其包括使il-6蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节il-6活性的方法,其包括使il-6蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节il-6活性的方法的某些实施方案中,该方法抑制il-6活性。在一些实施方案中,该方法包括使该il-6蛋白与根据il-6定量测定,在10μm下将il-6活性抑制75%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物1、4、6、13、19、20、22、23、27、29、30、31、32、33、34、40、42、45、46、67、81、82、85、86、89、93、99、104、105、111、113、143、149、160、161、163、164、166、173、175、176、177、192、193、194、196、199、201、203、204、206、207、208、209、210、217、219、238、247、248、249、250、257、260、263、264、265、268、269、270、271、272、273和274或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该il-6蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。本文提供了调节tnf-α活性的方法,其包括使tnf-α蛋白与有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式接触。本文还提供了调节tnf-α活性的方法,其包括使tnf-α蛋白与有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物接触,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文所述的调节il-6活性的方法的某些实施方案中,该方法抑制tnf-α活性。在一些实施方案中,该方法包括使该tnf-α蛋白与根据tnf-α定量测定,在10μm下将tnf-α活性抑制75%或更多的化合物或其药学上可接受的形式接触。在一些实施方案中,该化合物选自化合物4、23、29、30、31、32、33、42、45、46、93、99、149、166、196、203、207、209、210、219、269、270、271、272、273和274或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该tnf-α蛋白的接触发生在细胞中。在一些实施方案中,该细胞在受试者体内。在一些实施方案中,该细胞是哺乳动物细胞。在一些实施方案中,该细胞是人细胞。3.4.治疗癌症的方法不受理论束缚,癌症的特征主要在于源自给定正常组织的异常细胞的数目增加,这些异常细胞侵入相邻组织,或恶性细胞经淋巴或血源性传播到区域淋巴结和远处部位。临床数据和分子生物学研究指示,癌症是以微小的肿瘤前变化开始的多步骤过程,其在某些条件下可进展成瘤形成。肿瘤病变可以克隆性进化并且发展出递增的侵入、生长、转移和异质性能力,特别是在肿瘤细胞逃避宿主免疫监视的条件下。(roitt,i.,brostoff,j.和kale,d.,immunology,17.1-17.12(第3版,mosby,st.louis,mo.,1993))不受理论束缚,肿瘤发展的各个阶段通常可以描述如下:a)当正常群体内的细胞维持扩大其增殖倾向的遗传突变时,肿瘤进化开始。b)此类遗传改变的细胞和它们的后代继续表现正常,但它们过度繁殖并导致称为增生的病状。改变的细胞还可以分泌信号传导因子或引起其局部细胞环境和细胞外环境(包括但不限于免疫系统对它们的反应)变化的其它分子。此类环境影响又可影响改变的细胞的活力、增殖和进一步的突变。在一定时间(数月或数年)后,这些改变的细胞中非常小的一部分可维持另外的突变,随后丧失对细胞生长的控制和对其环境的进一步潜在影响。c)这些细胞的后代不仅过度增殖而且在形状和取向上出现异常。现在认为该组织表现出称为发育异常的病状。一定时间后,一个或多个附加突变可进一步改变细胞行为和细胞对其环境的影响。d)受影响的和遗传改变的细胞在生长和外观上变得更加异常。如果肿瘤块不通过组织之间的任何边界侵入,则将其称为原位肿瘤。这种肿瘤可以无限期地保持受限,然而,一些细胞可获得更多的突变。e)如果遗传变化允许肿瘤块开始侵入下层组织并将细胞抛入血液或淋巴中,则产生恶性或侵袭性肿瘤。缺陷细胞可以在整个身体中安置新的肿瘤部位(转移)。不受理论束缚,转移代表称为侵袭-转移级联的多步骤细胞生物学过程的最终产物,该过程涉及癌细胞扩散到解剖学上远离的器官部位及其随后适应外来组织微环境。这些事件中的每一个事件都是由肿瘤细胞内遗传和/或表观遗传改变的获得和非肿瘤基质细胞的共同选择驱动的,非肿瘤基质细胞一起赋予初期转移细胞产生宏观转移所需的性状。(volastyan,s.等人,cell,2011,第147卷,275-292)不受理论束缚,多种癌症影响全身的不同组织,这在医学文献中有详细描述。超过85%的人类癌症是实体瘤,包括癌、肉瘤和淋巴瘤。不同类型的实体瘤以形成它们的细胞类型而命名。实例包括肺癌、结肠癌、直肠癌、胰腺癌、前列腺癌、乳腺癌、脑癌和肠癌。其它人类肿瘤源自参与形成免疫细胞和其它血细胞的细胞,包括白血病和骨髓瘤。随着一般群体年龄增长,随着新癌症的发展,以及随着易感群体的生长,癌症的发病率连续攀升。因此对可用于治疗患有癌症的受试者的新方法和新组合物存在巨大需求。不受理论束缚,当前癌症疗法可涉及手术、化学疗法、激素疗法、生物疗法、靶向疗法、免疫疗法和/或放射治疗以根除患者中的肿瘤细胞(参见例如,stockdale,1998,medicine,第3卷,rubenstein和federman编辑,第12章第iv节;及baudino ta“targetedcancer therapy:the next generation of cancer treatment”,curr drug discovtechno1.2015;12(1):3-20)。不受理论束缚,此类疗法可独立使用或组合使用。疗法的选择将取决于癌症的历史和性质、患者的状况以及在该情形下所考虑的治疗剂和方法的预期功效和不良作用。不受理论束缚,关于化学疗法,存在可用于治疗不同癌症的多种化学治疗剂和递送此类药剂的方法。大多数第一代化学治疗剂不是肿瘤特异性的,具有广泛的全身作用,有毒,并且可引起显著的且通常危险的副作用,包括严重的恶心、骨髓抑制和免疫阻抑。不受理论束缚,即使施用化学治疗剂的组合,许多肿瘤细胞也对化学治疗剂也具有耐性或变得有耐性。事实上,对治疗方案中使用的特定化学治疗剂具有耐性的细胞常常证明对其它药物也具有耐性,即使那些药剂通过与特定治疗中使用的那些药物不同的机制起作用。这种现象称为多药耐药性。由于耐药性,许多癌症证明是标准化学治疗方案难治的。因此,对用于治疗、预防和管理癌症的替代化合物、组合物和方法的存在显著需要。不受理论束缚,尽管手术切除和辅助疗法可治愈良好限制的原发性肿瘤,但转移性疾病由于其全身性及播散性肿瘤细胞对现有治疗剂的耐性而在很大程度上是不可治愈的。这解释了超过90%的癌症死亡率可归因于转移,而不是产生这些恶性病变的原发性肿瘤的原因。本文提供了治疗受试者的癌症的方法,其包括向患有癌症的受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。本文还提供了治疗受试者的癌症的方法,其包括向患有癌症的受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物,如下文所公开的。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节一种或多种ras超家族蛋白的活性的化合物或其药学上可接受的形式。在一些实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制一种或多种ras超家族蛋白的活性。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节45%或更多。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节50%或更多。在一些实施方案中,该化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节erk1/2活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化激活45%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节akt活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、112、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、137、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节smad2/3活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节jnk活性的化合物或药学上可接受的形式。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32和34或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用调节mapk p38活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活75%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,本文公开的化合物抑制细胞增殖,诸如在细胞活力测定中抑制细胞增殖。在一些实施方案中,根据本文公开的治疗方法施用本文公开的化合物的抗增殖活性以治疗癌症,包括实体瘤、软瘤和血源性肿瘤。在本文提供的治疗癌症的方法的一些实施方案中,该方法施用抑制miapaca2的增殖的化合物或其药学上可接受的形式。在一些实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1.25μm或更小、1.1μm或更小、1μm或更小、0.9μm或更小、0.8μm或更小、0.75μm或更小、0.7μm或更小、0.6μm或更小、0.5μm或更小、0.4μm或更小、0.3μm或更小、0.25μm或更小、0.2μm或更小、0.15μm或更小、或0.1μm或更小的ic50值抑制miapaca2的增殖。在一些实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1.1μm或更小的ic50值抑制miapaca2的增殖。在一些实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以1.0μm或更小的ic50值抑制miapaca2的增殖。在一些实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.60μm或更小的ic50值抑制miapaca2的增殖。在一些实施方案中,根据增殖测定,该化合物或其药学上可接受的形式以0.15μm或更小的ic50值抑制miapaca2的增殖。在一些实施方案中,该化合物选自化合物6、13、22、26、29、30、32、33、34、42、45、46、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、214、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、13、22、26、29、30、32、33、34、42、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、13、22、32、34、48、49、50、53、54、55、56、57、58、59、62、63、64、65、68、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、106、107、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、156、157、158、165、169、170、174、175、196、209、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、255、257、263、264、265、266、267、268、270、271、274和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、48、49、50、53、54、55、57、58、62、63、64、65、68、73、76、79、82、84、89、91、94、95、97、98、100、102、104、106、107、110、112、113、114、115、117、118、120、122、123、124、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、156、157、158、165、169、170、196、221、222、224、226、227、228、230、231、232、233、234、235、236、237、238、239、240、243、244、245、248、249、250、252、255、257、263、265、266、267和268或其药学上可接受的形式。在本文提供的方法的一些实施方案中,该癌症是实体瘤。在一些实施方案中,该癌症是血源性肿瘤(或血液癌症)。在一些实施方案中,该癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。在一些实施方案中,该癌症是胰腺癌。在一些实施方案中,该癌症是结肠癌。在一些实施方案中,该癌症是三阴性乳腺癌。在一些实施方案中,该癌症是多发性骨髓瘤。在本文提供的方法的一些实施方案中,该癌症是依赖于ras超家族蛋白的癌症。在一些实施方案中,该ras超家族蛋白是ras蛋白或其突变体。在一些实施方案中,该ras蛋白是diras i;diras2;diras3;eras;gem;hras;kras;mras;nkirasi;nkiras2;nras;rala;ralb;rapia;rapib;rap2a;rap2b;rap2c;rasdi;rasd2;raslioa;rasliob;rasli ia;rasliib;rasl 12;remi;rem2;rerg;rergl;rrad;rras;或rras2。在一些实施方案中,该ras蛋白是hras;kras;或nras,或其突变体。在一些实施方案中,该ras蛋白是kras突变体。在一些实施方案中,该kras突变体是kras g12d突变体、kras g12c突变体或kras q61h突变体。在一些实施方案中,该ras蛋白是hras或其突变体。在一些实施方案中,该ras蛋白是nras或其突变体。在一些实施方案中,该ras超家族蛋白是rac蛋白或其突变体。在一些实施方案中,该rac蛋白是rac1;rac2;rac3;rhog,或其突变体。在一些实施方案中,该rac蛋白是野生型rac1。在一些实施方案中,该ras超家族蛋白是rho蛋白或其突变体。在一些实施方案中,该rho蛋白是rhoa;rhob;rhobtb1;rhobtb2;rhobtb3;rhoc;rhod;rhof;rhoh;rhoj;rhoq;rhou;rhov;rnd1;rnd2;rnd3;cdc42,或其突变体。在一些实施方案中,该rho蛋白是野生型rhoa。在一些实施方案中,该ras超家族蛋白是cdc42蛋白或其突变体。在一些实施方案中,该ras超家族蛋白是rheb蛋白或其突变体。在本文提供的方法的一些实施方案中,施用激活受试者的癌细胞中的半胱天冬酶活性。在一些实施方案中,激活诱导癌细胞的凋亡。在一些实施方案中,该受试者是人。本文还提供了治疗先前已治疗癌症但对标准疗法无反应的受试者以及先前尚未治疗的受试者的方法。还提供了治疗受试者的方法,而与受试者的年龄无关,但是一些疾病或病症在某些年龄组中更常见。还提供了治疗已进行手术以试图治疗所讨论的疾病或病状的受试者以及尚未进行手术的受试者的方法。因为患有癌症的受试者具有不一致的临床表现和不同的临床结局,所以给予受试者的治疗可以根据他/她的预后而变化。熟练的临床医师将能够在不进行过度实验的情况下容易地确定可有效用于治疗患有癌症的个体受试者的特定第二药剂、手术类型和基于非药物的标准疗法的类型。如本文所用,术语“癌症”包括但不限于实体瘤和血源性肿瘤。术语“癌症”是指皮肤组织、器官、血液和血管的疾病,包括但不限于膀胱癌、骨癌、血癌、脑癌、乳腺癌、宫颈癌、胸癌、结肠癌、子宫内膜癌、食道癌、眼癌、头癌、肾癌、肝癌、淋巴结癌、肺癌、口腔癌、颈癌、卵巢癌、胰腺癌、前列腺癌、直肠癌、胃癌、睾丸癌、喉癌和子宫癌。具体的癌症包括但不限于晚期恶性肿瘤、淀粉样变性、成神经细胞瘤、脑膜瘤、血管外皮细胞瘤、多发性脑转移、多形性成胶质细胞瘤、成胶质细胞瘤、脑干神经胶质瘤、预后不良的恶性脑肿瘤、恶性神经胶质瘤、复发性恶性神经胶质瘤、间变性星形细胞瘤、间变性少突神经胶质瘤、神经内分泌肿瘤、直肠腺癌、dukes c和d结直肠癌、不可切除的结直肠癌、转移性肝细胞癌、卡波西肉瘤(kaposi’s sarcoma)、核型急性髓系白血病、霍奇金淋巴瘤(hodgkin’s lymphoma)、非霍奇金淋巴瘤、皮肤t细胞淋巴瘤、皮肤b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、低级别滤泡性淋巴瘤、恶性黑素瘤、恶性间皮瘤、恶性胸腔积液间皮瘤综合征、腹膜癌、乳头状浆液性癌、妇科肉瘤、软组织肉瘤、硬皮病、皮肤血管炎、朗格汉斯细胞组织细胞增生症、平滑肌肉瘤、进行性骨化性纤维异常症、激素难治性前列腺癌、切除的高危软组织肉瘤、不可切除的肝细胞癌、华氏巨球蛋白血症(waldenstrom’s macroglobulinemia)、冒烟性骨髓瘤、无痛性骨髓瘤、输卵管癌、雄激素非依赖型前列腺癌、雄激素依赖型iv期非转移性前列腺癌、激素不敏感型前列腺癌、化学疗法不敏感型前列腺癌、乳头状甲状腺癌、滤泡状甲状腺癌、髓样甲状腺癌和平滑肌瘤。在某些实施方案中,该癌症是实体瘤。在某些实施方案中,该实体瘤是转移性的。在某些实施方案中,该实体瘤是耐药性的。在某些实施方案中,该实体瘤是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。在某些实施方案中,该癌症是血源性肿瘤(或血液癌症)。在某些实施方案中,该血源性肿瘤是转移性的。在某些实施方案中,该血源性肿瘤是耐药性的。在某些实施方案中,该癌症是白血病。在某些实施方案中,该癌症是多发性骨髓瘤。在一个实施方案中,本文提供的方法涵盖通过施用治疗有效量的本文提供的化合物或其衍生物来治疗、预防或管理各种类型的白血病,诸如慢性淋巴细胞白血病(cll)、慢性髓细胞性白血病(cml)、急性成淋巴细胞白血病(all)、急性髓细胞性白血病(aml)和急性成髓细胞性白血病(aml)。在一些实施方案中,本文提供的方法涵盖治疗、预防或管理受试者的急性白血病。在一些实施方案中,急性白血病是急性髓性白血病(aml),其包括但不限于未分化的aml(mo)、成髓细胞性白血病(m 1)、成髓细胞性白血病(m2)、早幼粒细胞性白血病(m3或m3变型(m3v))、骨髓单核细胞性白血病(m4或具有嗜酸粒细胞增多的m4变型(m4e))、单核细胞性白血病(m5)、红白血病(m6)和巨核细胞白血病(m7)。在一个实施方案中,急性髓性白血病是未分化的aml(m0)。在一个实施方案中,急性髓性白血病是成髓细胞性白血病(m1)。在一个实施方案中,急性髓性白血病是成髓细胞性白血病(m2)。在一个实施方案中,急性髓性白血病是早幼粒细胞性白血病(m3或m3变型(m3v))。在一个实施方案中,急性髓性白血病是骨髓单核细胞性白血病(m4或具有嗜酸粒细胞增多的m4变型(m4e))。在一个实施方案中,急性髓性白血病是单核细胞性白血病(m5)。在一个实施方案中,急性髓性白血病是红白血病(m6)。在一个实施方案中,急性髓性白血病是巨核细胞白血病(m7)。因此,治疗、预防或管理受试者的急性髓性白血病的方法包括向受试者单独或组合施用有效治疗、预防或管理急性髓性白血病的量的本文提供的化合物或其衍生物的步骤。在一些实施方案中,这些方法包括向受试者以有效治疗、预防或管理急性髓性白血病的量,与第二活性剂组合施用本文提供的化合物或其衍生物的步骤。在一些实施方案中,本文提供的方法涵盖治疗、预防或管理受试者的急性淋巴细胞白血病(all)。在一些实施方案中,急性淋巴细胞白血病包括起源于骨髓(b细胞)、胸腺(t细胞)和淋巴结的母细胞的白血病。急性淋巴细胞白血病可根据法国-美洲-英国(fab)形态学分类方案分类为l1-看起来成熟的成淋巴细胞(t细胞或前b细胞),l2-不成熟和多形性(不同形状)的成淋巴细胞(t细胞或前b细胞)和l3-成淋巴细胞(b细胞;伯基特细胞)。在一个实施方案中,急性淋巴细胞白血病起源于骨髓的母细胞(b细胞)。在一个实施方案中,急性淋巴细胞白血病起源于胸腺(t细胞)。在一个实施方案中,急性淋巴细胞白血病起源于淋巴结。在一个实施方案中,急性淋巴细胞白血病是以看起来成熟的成淋巴细胞(t细胞或前b细胞)为特征的l1型。在一个实施方案中,急性淋巴细胞白血病是以未成熟和多形性(各种形状)的成淋巴细胞(t细胞或前b细胞)为特征的l2型。在一个实施方案中,急性淋巴细胞白血病是以成淋巴细胞(b-细胞;伯基特细胞)为特征的l3型。在某些实施方案中,急性淋巴细胞白血病是t细胞白血病。在一个实施方案中,t细胞白血病是外周t细胞白血病。在另一个实施方案中,t细胞白血病是t细胞成淋巴细胞性白血病。在另一个实施方案中,t细胞白血病是皮肤t细胞白血病。在另一个实施方案中,t细胞白血病是成人t细胞白血病。因此,治疗、预防或管理受试者的急性淋巴细胞白血病的方法包括向受试者单独施用或与第二活性剂组合施用有效治疗、预防或管理急性淋巴细胞白血病的量的本文提供的化合物或其衍生物的步骤。在一些实施方案中,这些方法包括向受试者以有效治疗、预防或管理急性淋巴细胞白血病的量,与第二活性剂组合施用本文提供的化合物或其衍生物的步骤。在一些实施方案中,本文提供的方法涵盖治疗、预防或管理受试者的慢性骨髓性白血病(cml)。这些方法包括向受试者施用有效治疗、预防或管理慢性骨髓性白血病的量的本文提供的化合物或其衍生物的步骤。在一些实施方案中,这些方法包括向受试者以有效治疗、预防或管理慢性骨髓性白血病的量,与第二活性剂组合施用本文提供的化合物或其衍生物的步骤。在一些实施方案中,本文提供的方法涵盖治疗、预防或管理受试者的慢性淋巴细胞白血病(cll)。这些方法包括向受试者施用有效治疗、预防或管理慢性淋巴细胞白血病的量的本文提供的化合物或其衍生物的步骤。在一些实施方案中,这些方法包括向受试者以有效治疗、预防或管理慢性淋巴细胞白血病的量,与第二活性剂组合施用本文提供的化合物或其衍生物的步骤。在某些实施方案中,本文提供了在肾功能受损的受试者中治疗、预防和/或管理疾病的方法。在某些实施方案中,本文提供了在肾功能受损的受试者中治疗、预防和/或管理癌症的方法。在某些实施方案中,本文提供了为由于但不限于疾病、衰老或其它受试者因素而肾功能受损的受试者提供适当的剂量调整的方法。在某些实施方案中,本文提供了治疗、预防和/或管理淋巴瘤(包括非霍奇金淋巴瘤)的方法。在一些实施方案中,本文提供了使用预后因子治疗或管理非霍奇金淋巴瘤(nhl),包括但不限于弥漫性大b细胞淋巴瘤(dlbcl)的方法。在某些实施方案中,本文提供了在有肾功能受损或其症状的受试者中治疗、预防和/或管理多发性骨髓瘤(包括复发性/难治性多发性骨髓瘤)的方法,其包括向患有复发性/难治性多发性骨髓瘤伴肾功能受损的受试者施用治疗有效量的本文提供的化合物或其衍生物。在某些实施方案中,待用本文提供的方法之一治疗的受试者在施用本文提供的化合物或其衍生物之前尚未用抗癌疗法治疗。在某些实施方案中,待用本文提供的方法之一治疗的受试者在施用本文提供的化合物或其衍生物之前已经用抗癌疗法治疗。在某些实施方案中,待用本文提供的方法之一治疗的受试者已发展出对抗癌疗法的耐药性。本文提供的方法涵盖治疗患者,而与受试者的年龄无关,但是一些疾病或病症在某些年龄组中更常见。如本文所讨论的,ras信号传导在ras病中有因果关系。因此,本文提供的抑制ras超家族的一个或多个成员的功能的化合物可用于治疗包括1型神经纤维瘤病、努南综合征和克斯提洛氏综合征在内的ras病。3.5.治疗纤维化的方法纤维化或构成瘢痕组织的细胞外基质分子的积聚是组织损伤的常见结果。纤维化可发生在体内的许多组织中,通常是由于炎症或损伤。肺纤维化、肾纤维化和肝硬化是常见的纤维化疾病,它们完全代表了大量未满足的医学需要。(friedman sl,sheppard d,duffield js,violette 6.sci transl med 2013年1月9日;5(167):167sr1)。不受理论束缚,纤维化,也称为纤维化瘢痕形成,是一种病理性伤口愈合过程,其中结缔组织代替正常实质组织,导致相当多的组织重构(re-modeling)及永久性瘢痕组织的形成。重复的损伤、慢性炎症和修复易发生纤维化,其中过量的细胞外基质(ecm)组分,诸如胶原和糖胺聚糖,积聚并导致形成可干扰器官和组织正常功能的永久性纤维化瘢痕。纤维发生的机制包括炎症以及其它途径,并且通常涉及受影响细胞(包括上皮细胞、成纤维细胞、内皮细胞和巨噬细胞)的肌动蛋白细胞骨架的重组(reorganization)。不受理论束缚,肌动蛋白丝组装和肌动球蛋白收缩由丝氨酸/苏氨酸激酶(rock1和rock2)的rho相关卷曲螺旋形成蛋白激酶(rock)家族指导,因此rho与纤维发生相关。组织纤维化是发病和死亡的主要原因。美国45%的死亡可归因于纤维化病症。(wynn ta.“fibrotic disease and the th 1/th2paradigm.”nat rev immunol 2004aug:4(8):583-594.)治疗通常是姑息性的。不受理论束缚,特发性肺纤维化(ipf)的特征在于进行性肺部瘢痕形成、短的中值存活期和有限的治疗选择,从而产生对新的药理学疗法的巨大需要。认为是由对肺上皮的重复性环境损伤引起的。如上所述,纤维化可发生在体内的许多组织中,通常是由于炎症或损伤。实例包括:肾纤维化、心血管系统纤维化、肺纤维化、囊性纤维化、特发性纤维化、肺纤维化、桥接纤维化、肝纤维化、肠纤维化、肌肉系统纤维化、脑纤维化、关节纤维化、皮肤纤维化、骨髓纤维化、心脏纤维化、软组织纤维化、腱纤维化、淋巴结纤维化、眼睛纤维化、腹膜后腔纤维化、硬皮病和手术瘢痕形成。不受理论束缚,组织修复过程是一个复杂过程,对ecm合成和降解的严格调节确保维持正常组织架构。然而,如果组织损伤严重或是重复性,或者如果伤口愈合反应本身变得失调,则该过程可导致进行性不可逆的纤维化反应。当免疫细胞诸如巨噬细胞和表面间称为间质的受损组织释放刺激成纤维细胞的可溶性因子时,开始纤维化。最佳表征的促纤维化介质是转化生长因子-β(tgf-β配体,诸如tgf-β1、tgf-β2和tgf-β3)、骨形态发生蛋白(bmp)和激活素。不受理论束缚,促纤维化tgf-β及其相关配体结合i型和ii型跨膜tgf-β受体的异聚复合物,每种受体配备有细胞内激酶结构域。当配体结合时,ii型受体激酶磷酸化并由此激活i型受体,其也称为激活素受体样激酶(alk)。在该激活复合物的下游,经典信号传导途径由转录因子smad家族组成,其中smad2和smad3被i型tgf-β受体磷酸化和激活。激活的smad2/3(rsmads)与smad4形成三聚体复合物,该三聚体复合物易位至细胞核以调节靶基因表达。不受理论束缚,纤维化的其它可溶性介质包括结缔组织生长因子(ctgf)、血小板源性生长因子(pdgf)和白细胞介素10(il-10)。不受理论束缚,抑制tgf-β1信号传导途径及smad2和3磷酸化和激活代表用于治疗纤维化的潜在治疗方法。杜氏肌营养不良(dmd)是以进行性肌肉退化和无力为特征的遗传病症,该进行性肌肉退化和无力是由于帮助保持肌肉细胞完好的称为抗肌萎缩蛋白的蛋白质的改变引起的。dmd是称为抗肌萎缩蛋白病的四种病状之一。属于该组的三种疾病是贝克肌营养不良(bmd,dmd的轻度形式);一种介于dmd和bmd之间的中间临床表现;及几乎没有临床骨骼或随意肌疾病的dmd相关的扩张型心肌病(心脏病)。dmd主要影响男孩,但在极少数情况下它也可能影响女孩。在欧洲和北美洲,dmd的患病率为大约每100,000个个体有6个。肌无力是dmd的主要症状。症状发作是在儿童早期,通常在2至3岁之间。该疾病首先影响近端肌肉,稍后影响远端肢体肌肉。通常,下部外部肌肉在上部外部肌肉之前受到影响。稍后,心脏和呼吸肌受到影响。进行性无力和脊柱侧凸导致肺功能受损,肺功能受损最终可引起急性呼吸衰竭。贝克肌营养不良(bmd)与dmd类似,但通常在十几岁或早期成年期发作。与dmd相比,bmd的病程较慢且较不可预测。dmd由法国神经病学家guillaume benjamin amand duchenne在1860年代首次描述,但直到1980年代关于任何种类肌肉营养不良的原因也知之甚少。1986年,研究人员鉴定了x染色体上突变时会导致dmd的特定基因。1987年,鉴定了与该基因相关的蛋白并命名为抗肌萎缩蛋白。肌细胞中野生型抗肌萎缩蛋白的缺乏导致它们是脆性的并且容易受损。dmd具有x连锁隐性遗传模式,并且由称为携带者的母体传代。直到相对较近的时候,患有dmd的男孩通常不能活过十几岁。由于心脏和呼吸护理以及靶向治疗产品的进步,预期寿命正在增加并且活到30岁出头变得更加普遍,但是对降低发病率和延长寿命的治疗剂仍然存在未满足的需要。不受理论束缚,当骨骼肌由于dmd而不能再生时,受损的肌肉最终被纤维化组织替代。这种纤维化的发展部分地由tgf-β1信号传导途径介导,因此该途径可以是dmd的治疗靶标。不受理论束缚,越来越多的公开研究也表明,应激激活的mapk蛋白p-38 mapk和c-jun nh2末端激酶(jnk)的药理学激活也可代表治疗dmd相关纤维化的治疗方法。不受理论束缚,靶向疗法是也称为精准医疗的基础,精准医疗是一种使用关于人的基因和蛋白质的信息来预防、诊断和治疗疾病的医疗形式。此类治疗剂有时称为“分子靶向药物”、“分子靶向疗法”或类似名称。发现它们的过程通常称为“合理药物设计”。这种概念也可称为“个性化医疗”。不受理论束缚,细胞中导致某一终点或细胞功能的分子间的一系列作用称为分子途径。不受理论束缚,分子靶向药物与途径中的特定靶分子或结构相关的一组靶分子相互作用;从而调节该途径的终点效应,诸如疾病相关过程;并且从而,产生治疗益处。不受理论束缚,分子靶向药物可以是小分子或生物制剂,通常是抗体。它们可以单独使用或与其它治疗剂和方法组合使用。不受理论束缚,因为它们靶向特定的分子或一组相关分子,并且通常被设计成使它们与其它分子的相互作用最小化,所以靶向治疗剂可具有较少的不良副作用。不受理论束缚,纤维变性病症诸如特发性肺纤维化、肝纤维化和系统性硬化症的一些治疗靶向炎性途径。本文提供了治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。本文还提供了治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节一种或多种ras超家族蛋白的活性的化合物或其药学上可接受的形式。在一些实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制一种或多种ras超家族蛋白的活性。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节45%或更多。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节50%或更多。在一些实施方案中,该化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节erk1/2活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化激活45%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节akt活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、112、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、137、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节smad2/3活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节jnk活性的化合物或药学上可接受的形式。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32和34或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节mapk p38活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活75%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节il-6活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制il-6。在一些实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制75%或更多。在一些实施方案中,该化合物选自化合物1、4、6、13、19、20、22、23、27、29、30、31、32、33、34、40、42、45、46、67、81、82、85、86、89、93、99、104、105、111、113、143、149、160、161、163、164、166、173、175、176、177、192、193、194、196、199、201、203、204、206、207、208、209、210、217、219、238、247、248、249、250、257、260、263、264、265、268、269、270、271、272、273和274或其药学上可接受的形式。在本文提供的治疗纤维化疾病的方法的一些实施方案中,该方法施用调节tnf-a活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制tnf-α。在一些实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制75%或更多。在一些实施方案中,该化合物选自化合物4、23、29、30、31、32、33、42、45、46、93、99、149、166、196、203、207、209、210、219、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,根据本文公开的任何方法施用的式i的化合物治疗、预防或抑制受试者的纤维化。在一些实施方案中,根据本文公开的任何方法施用的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式抑制所述受试者的肝脏、肺、皮肤、软组织、腱、淋巴结、肺、肾、心脏、眼或腹膜后腔中的纤维化。在一些实施方案中,根据本文公开的任何方法施用的化合物治疗、预防或改善受试者的纤维化疾病的一种或多种症状。在一些实施方案中,根据本文公开的任何方法施用的化合物治疗、预防或改善受试者的纤维化疾病。在一些实施方案中,该纤维化疾病选自:肾纤维化、心血管系统纤维化、肺纤维化、囊性纤维化、特发性纤维化、肺纤维化、桥接纤维化、肝纤维化、肠纤维化、肌肉系统纤维化、脑纤维化、关节纤维化、皮肤纤维化、骨髓纤维化、心脏纤维化、软组织纤维化、腱纤维化、淋巴结纤维化、眼睛纤维化、腹膜后腔纤维化、硬皮病和手术瘢痕形成。在一些实施方案中,该纤维化疾病是肾的纤维化。在一些实施方案中,肾的纤维化是进行性肾病。在一些实施方案中,该纤维化疾病是心血管系统的纤维化。在一些实施方案中,心血管系统的纤维化是动脉粥样硬化或再狭窄。在一些实施方案中,该纤维化疾病是肺纤维化。在一些实施方案中,该纤维化疾病是囊性纤维化。在一些实施方案中,该纤维化疾病是特发性纤维化。在一些实施方案中,该特发性纤维化是特发性肺纤维化。在一些实施方案中,该纤维化疾病是肺的纤维化。在一些实施方案中,肺的纤维化是进行性大块纤维化和辐射诱导的肺损伤。在一些实施方案中,该纤维化疾病是桥接纤维化。在一些实施方案中,该纤维化疾病是肝脏的纤维化。在一些实施方案中,肝脏的纤维化是肝硬化。在一些实施方案中,该纤维化疾病是肠的纤维化。在一些实施方案中,肠的纤维化是克罗恩病。在一些实施方案中,该纤维化疾病是肌肉系统的纤维化。在一些实施方案中,肌肉系统的纤维化是杜氏肌营养不良(dmd)。在一些实施方案中,杜氏肌营养不良是贝克肌营养不良(bmd)、dmd与bmd之间的中间临床表现或dmd相关的扩张型心肌病。在一些实施方案中,该纤维化疾病是脑部的纤维化。在一些实施方案中,脑部的纤维化是胶质瘢痕。在一些实施方案中,该纤维化疾病是关节的纤维化。在一些实施方案中,关节的纤维化是动脉僵硬。在一些实施方案中,关节的纤维化是膝的纤维化。在一些实施方案中,关节的纤维化是肩部的纤维化。在一些实施方案中,该纤维化疾病是皮肤的纤维化。在一些实施方案中,皮肤的纤维化是瘢痕瘤(keloid)。在一些实施方案中,该纤维化疾病是骨髓的纤维化。在一些实施方案中,骨髓的纤维化是骨髓纤维化(myelofibrosis)。在一些实施方案中,该纤维化疾病是心脏的纤维化。在一些实施方案中,心脏的纤维化是心肌纤维化。在一些实施方案中,该纤维化疾病是软组织的纤维化。在一些实施方案中,该纤维化疾病是腱的纤维化。在一些实施方案中,该纤维化疾病是淋巴结的纤维化。在一些实施方案中,该纤维化疾病是眼的纤维化。在一些实施方案中,该纤维化疾病是腹膜后腔的。在一些实施方案中,该纤维化疾病是硬皮病。在一些实施方案中,该纤维化疾病是手术瘢痕形成。3.6.治疗炎症的方法炎症是身体组织对有害刺激(诸如病原体、受损细胞或刺激物,涉及免疫细胞、血管和分子介质)的复杂保护性生物反应。炎症的功能是消除细胞损伤的初始原因,从最初的损伤和炎症过程中清除坏死的细胞和受损的组织,并启动组织修复。(ferrero-miliani l,nielsen oh,andersen ps,girardin se;nielsen;andersen;girardin(2007年2月)clin.exp.immunol.147、炎症分为急性或慢性。急性炎症是身体对有害刺激的初始反应,并且通过增加血浆和白细胞(特别是粒细胞)从血液进入损伤组织的运动来实现。一系列生物化学事件使炎症反应传播和成熟,涉及局部血管系统、免疫系统和损伤组织内的各种细胞。称为慢性炎症的长期炎症的特征在于组织从炎症过程中同时破坏和愈合。其导致存在于炎症部位的细胞类型(诸如单核细胞)的进行性转变,以及细胞因子(诸如tnf-α、il-6和crp)的全身浓度增加。(petersen,a.m.;pedersen,b.k.(2005).j appl physiol.98(4):1154-1162)炎症中涉及许多蛋白质。它们中的任一种蛋白质对可能损害或以其它方式异常调节其正常功能和表达的遗传突变敏感。小分子和生物制剂都用于治疗炎性疾病。然而,大多数治疗在很大程度上是姑息性的。仍然有明确的未满足的医学需求来寻找可以机械地减少慢性炎性疾病的治疗。本文提供了治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式。本文还提供了治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的包含式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式的药物组合物。在一些实施方案中,该化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节一种或多种ras超家族蛋白的活性的化合物或其药学上可接受的形式。在一些实施方案中,根据ras超家族活性测定,该化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制一种或多种ras超家族蛋白的活性。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节45%或更多。在一些实施方案中,根据ras超家族活性,该化合物或其药学上可接受的形式在20μm下将一种或多种ras超家族蛋白的活性调节50%或更多。在一些实施方案中,该化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节erk1/2活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活erk1/2蛋白的磷酸化。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erk1/2蛋白的磷酸化激活45%或更多。在一些实施方案中,根据erk1/2磷酸化测定,该化合物或其药学上可接受的形式在10μm下将erkl/2蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节akt活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活akt蛋白的磷酸化。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据akt磷酸化测定,该化合物或其药学上可接受的形式在10μm下将akt蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、112、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、137、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节smad2/3活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制80%或更多。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化抑制85%或更多。在一些实施方案中,该化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活smad2/3蛋白的磷酸化。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据磷酸-smad2/3抑制测定,该化合物或其药学上可接受的形式在10μm下将smad2/3蛋白的磷酸化激活50%或更多。在一些实施方案中,该化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节jnk活性的化合物或药学上可接受的形式。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,该化合物或其药学上可接受的形式抑制jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33和34或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32和34或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活jnk蛋白的磷酸化。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活30%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活75%或更多。在一些实施方案中,根据jnk激活测定,该化合物或其药学上可接受的形式在10μm下将jnk蛋白的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节mapk p38活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化抑制约100%。在一些实施方案中,该化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式激活mapk p38蛋白的磷酸化。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活30%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活75%或更多。在一些实施方案中,根据mapk p38激活测定,该化合物或其药学上可接受的形式在10μm下将mapk p38的磷酸化激活约100%或更多。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在一些实施方案中,该化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节il-6活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制il-6。在一些实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据il-6定量测定,该化合物或其药学上可接受的形式在10μm下将il-6抑制75%或更多。在-些实施方案中,该化合物选自化合物1、4、6、13、19、20、22、23、27、29、30、31、32、33、34、40、42、45、46、67、81、82、85、86、89、93、99、104、105、111、113、143、149、160、161、163、164、166、173、175、176、177、192、193、194、196、199、201、203、204、206、207、208、209、210、217、219、238、247、248、249、250、257、260、263、264、265、268、269、270、271、272、273和274或其药学上可接受的形式。在本文提供的治疗炎性疾病的方法的一些实施方案中,该方法施用调节tnf-α活性的化合物或其药学上可接受的形式。在一些实施方案中,该化合物或其药学上可接受的形式抑制tnf-α。在一些实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。在一些实施方案中,根据tnf-α定量测定,该化合物或其药学上可接受的形式在10μm下将tnf-α抑制75%或更多。在一些实施方案中,该化合物选自4、23、29、30、31、32、33、42、45、46、93、99、149、166、196、203、207、209、210、219、269、270、271、272、273和274或其药学上可接受的形式。在一个实施方案中,该炎性疾病是炎症相关的癌症发展。如本文所公开的,本文提供的化合物可用于治疗癌症。公认的是,免疫炎性状态作为肿瘤发展的中间阶段的关键介质。还众所周知,慢性炎症可能使个体易患癌症。慢性炎症由多种因素引起,包括细菌、病毒和寄生虫感染。炎症持续的时间越长,相关癌发生的风险越高。抗炎性癌症疗法防止癌变前细胞完全变成癌性的或阻止现有肿瘤扩散到身体的远处部位。因此,在一个实施方案中,本文提供的化合物可用于治疗炎性癌症。此类癌症和使易感细胞易于发生肿瘤性转化的慢性炎性病症包括胃腺癌(胃炎)、粘膜相关淋巴组织(malt)淋巴瘤(胃炎)、膀胱、肝和直肠癌(血吸虫病),胆管癌和结肠癌(胆管炎)、胆囊癌(慢性胆囊炎)、卵巢癌和宫颈癌(盆腔炎性疾病、慢性宫颈炎)、皮肤癌(骨髓炎)、结直肠癌(炎性肠病)、食道癌(反流性食管炎、巴雷特食管)、膀胱癌(膀胱炎症(膀胱炎))、间皮瘤和肺癌(石棉沉着病、硅肺)、口腔鳞状细胞癌(牙龈炎、扁平苔藓)、胰腺癌(胰腺炎、蛋白酶突变)、外阴鳞状细胞癌(苔癣硬化)、唾液腺癌(涎腺炎)、肺癌(支气管炎)和malt淋巴瘤(舍格伦综合征、桥本氏甲状腺炎)。shacter等人,2002,oncology,16(2),217-26。在某些实施方案中,本文提供的化合物可用于治疗气道中的炎性疾病,诸如非特异性支气管高反应性、慢性支气管炎、囊性纤维化和急性呼吸窘迫综合征(ards)。在某些实施方案中,本文提供的化合物可用于治疗哮喘和特发性肺部纤维化或特发性肺纤维化(ipf)、肺纤维化和间质性肺病。如本领域技术人员已知的,当在伤口修复的瞬时过程中细胞有助于细胞外基质(ecm、)的沉积时,成纤维细胞分化成称为成肌纤维细胞的细胞类型发生在伤口愈合期间。在慢性炎性疾病诸如哮喘中,常常发生病理组织重塑,并且是由患病组织中增加成肌纤维细胞数目的功能介导的,参见hinz,b.等人am jpathol.2007;170:1807-1816。在某些实施方案中,本文提供的化合物预防或减少tgf-β诱导的成肌纤维细胞分化,如通过α平滑肌肌动蛋白(α-sma)(成肌纤维细胞分化的标志(serini,g.和gabbiani,g.1999;exp.cell res.250:273-283))的表达测量的。在某些实施方案中,本文提供的化合物可用于治疗银屑病、慢性斑块状银屑病、银屑病关节炎、棘皮症、特应性皮炎、各种形式的湿疹、接触性皮炎(包括过敏性皮炎)、系统性硬化症(硬皮病)、伤口愈合和药疹。在一个实施方案中,该疾病是炎症、关节炎、类风湿性关节炎、脊柱关节病、痛风性关节炎、骨关节炎、幼年型关节炎和其它关节炎病状、系统性红斑狼疮(sle)、皮肤相关病状、湿疹、舍格伦综合征(syndrome)、烧伤、皮炎、神经炎症、过敏性疼痛、自身免疫性肌炎、神经性疼痛、发烧、肺部病症、肺部炎症、成人呼吸窘迫综合征、肺结节病、哮喘、硅肺病、慢性肺部炎性疾病和慢性阻塞性肺病(copd)、心血管疾病、动脉硬化、心肌梗塞(包括心肌梗塞后适应症)、血栓形成、充血性心力衰竭、心脏再灌注损伤以及与高血压和/或心力衰竭相关的并发症诸如血管器官损伤、再狭窄、心肌病、中风(包括缺血性中风和出血性中风)、再灌注损伤、肾再灌注损伤、缺血(包括中风和脑缺血,以及由心脏/冠状动脉分流术引起的缺血)、神经变性病症、肝病和肾炎、胃肠病状、炎性肠病、克罗恩病、胃炎、肠易激综合征、溃疡性结肠炎、溃疡性疾病、胃溃疡、病毒和细菌感染、败血症、败血性休克、革兰氏阴性败血症、疟疾、脑膜炎、hiv感染、机会性感染、继发于感染或恶性肿瘤的恶病质、继发于获得性免疫缺陷综合征(aids)的恶病质、aids、arc(aids相关综合征)、肺炎、疱疹病毒、感染引起的肌痛、流感、自身免疫性疾病、移植物抗宿主反应和同种异体移植物排斥、骨吸收疾病的治疗、骨质疏松症、多发性硬化、急性痛风、肺炎、心肌炎、心包炎、肌炎、湿疹、脱发、白癜风、大疱性皮肤病、动脉粥样硬化、抑郁症、视网膜炎、葡萄膜炎、巩膜炎、肝炎、胰腺炎、原发性胆汁性肝硬化、硬化性胆管炎、爱迪生氏病(addison′s disease)、垂体炎、甲状腺炎、i型糖尿病、巨细胞动脉炎、肾炎(包括狼疮性肾炎)、累及器官的血管炎(诸如肾小球肾炎)、脉管炎(包括巨细胞动脉炎)、韦格纳肉芽肿(wegener′s granulomatosis)、结节性多动脉炎、白塞氏病(behcet′s disease)、川崎病(kawasaki disease)、高安氏动脉炎(takayasu′s arteritis)、累及器官的脉管炎、移植器官的急性排斥、内毒素血症、全身炎症反应综合征(sirs)、多器官功能障碍综合征、中毒性休克综合征、急性肺损伤、ards(成人呼吸窘迫综合征)、急性肾衰竭、暴发性肝炎、烧伤、急性胰腺炎、术后综合征、结节病、赫氏反应(herxheimer reaction)、脑炎、脊髓炎、与病毒感染如流感、带状疱疹、单纯疱疹、冠状病毒相关的sirs或干眼综合征(或干燥性角结膜炎(kc s))。在某些实施方案中,本文提供的化合物可用于治疗慢性或急性的神经性疼痛和伤害性疼痛,诸如但不限于异常性疼痛、炎性疼痛、炎性痛觉过敏、疱疹后神经痛、神经病、神经痛、糖尿病性神经病、hiv相关的神经病、神经损伤、类风湿性关节炎性疼痛、骨关节炎性疼痛、烧伤、背痛、眼部疼痛、内脏疼痛、癌症疼痛、牙痛、头痛、偏头痛、腕管综合征、纤维肌痛、神经炎、坐骨神经痛、骨盆超敏反应、骨盆疼痛、手术后疼痛、中风后疼痛和痛经。在某些实施方案中,本文提供的化合物可用于治疗阿尔茨海默病(ad)、轻度认知损害(mci)、年龄相关的记忆损害(aami)、多发性硬化、帕金森病(parkinson′s disease)、血管性痴呆、老年性痴呆、aids痴呆、皮克病(pick′s disease)、由脑血管病症引起的痴呆、皮质基底节变性、肌萎缩性侧索硬化(als)、亨廷顿病(huntington′s disease)、与创伤性脑损伤相关的cns功能减弱。在一个实施方案中,本文提供的化合物可用于治疗阿尔茨海默病(ad)、强直性脊柱炎、关节炎(骨关节炎、类风湿性关节炎(ra)、银屑病关节炎)、哮喘、动脉粥样硬化、克罗恩病、结肠炎、皮炎、憩室炎、纤维肌痛、肝炎、肠易激综合征(ibs)、系统性红斑狼疮(sle)、肾炎、帕金森病、溃疡性结肠炎。当用于治疗炎性疾病时,本文提供的化合物可以如本文所述用于治疗癌症的剂量、施用途径施用和/或施用以实现pk谱。在一个实施方案中,该炎性疾病是炎症相关的癌症发展。如本文所公开的,本文提供的化合物可用于治疗癌症。公认的是,免疫炎性状态作为肿瘤发展的中间阶段的关键介质。还众所周知,慢性炎症可能使个体易患癌症。慢性炎症由多种因素引起,包括细菌、病毒和寄生虫感染。炎症持续的时间越长,相关癌发生的风险越高。抗炎性癌症疗法防止癌变前细胞完全变成癌性的或阻止现有肿瘤扩散到身体的远处部位。因此,在一个实施方案中,本文提供的化合物可用于治疗炎性癌症。此类癌症和使易感细胞易于发生肿瘤性转化的慢性炎性病症包括胃腺癌(胃炎)、粘膜相关淋巴组织(malt)淋巴瘤(胃炎)、膀胱、肝和直肠癌(血吸虫病),胆管癌和结肠癌(胆管炎)、胆囊癌(慢性胆囊炎)、卵巢癌和宫颈癌(盆腔炎性疾病、慢性宫颈炎)、皮肤癌(骨髓炎)、结直肠癌(炎性肠病)、食道癌(反流性食管炎、巴雷特食管)、膀胱癌(膀胱炎症(膀胱炎))、间皮瘤和肺癌(石棉沉着病、硅肺)、口腔鳞状细胞癌(牙龈炎、扁平苔藓)、胰腺癌(胰腺炎、蛋白酶突变)、外阴鳞状细胞癌(苔癣硬化)、唾液腺癌(涎腺炎)、肺癌(支气管炎)和malt淋巴瘤(舍格伦综合征、桥本氏甲状腺炎)。shacter等人,2002,oncology,16(2),217-26。在某些实施方案中,本文提供的化合物可用于治疗气道中的炎性疾病,诸如非特异性支气管高反应性、慢性支气管炎、囊性纤维化和急性呼吸窘迫综合征(ards)。在某些实施方案中,本文提供的化合物可用于治疗哮喘和特发性肺部纤维化或特发性肺纤维化(ipf)、肺纤维化和间质性肺病。如本领域技术人员已知的,当在伤口修复的瞬时过程中细胞有助于细胞外基质(ecm)的沉积时,成纤维细胞分化成称为成肌纤维细胞的细胞类型发生在伤口愈合期间。在慢性炎性疾病诸如哮喘中,常常发生病理组织重塑,并且是由患病组织中增加成肌纤维细胞数目的功能介导的,参见hinz,b.等人am jpathol.2007;170:1807-1816。在某些实施方案中,本文提供的化合物预防或减少tgf-β诱导的成肌纤维细胞分化,如通过α平滑肌肌动蛋白(α-sma)(成肌纤维细胞分化的标志(serini,g.和gabbiani,g.1999;exp.cell res.250:273-283))的表达测量的。在某些实施方案中,本文提供的化合物可用于治疗银屑病、慢性斑块状银屑病、银屑病关节炎、棘皮症、特应性皮炎、各种形式的湿疹、接触性皮炎(包括过敏性皮炎)、系统性硬化症(硬皮病)、伤口愈合和药疹。在一个实施方案中,该疾病是炎症、关节炎、类风湿性关节炎、脊柱关节病、痛风性关节炎、骨关节炎、幼年型关节炎和其它关节炎病状、系统性红斑狼疮(sle)、皮肤相关病状、湿疹、舍格伦综合征(syndrome)、烧伤、皮炎、神经炎症、过敏性疼痛、自身免疫性肌炎、神经性疼痛、发烧、肺部病症、肺部炎症、成人呼吸窘迫综合征、肺结节病、哮喘、硅肺病、慢性肺部炎性疾病和慢性阻塞性肺病(copd)、心血管疾病、动脉硬化、心肌梗塞(包括心肌梗塞后适应症)、血栓形成、充血性心力衰竭、心脏再灌注损伤以及与高血压和/或心力衰竭相关的并发症诸如血管器官损伤、再狭窄、心肌病、中风(包括缺血性中风和出血性中风)、再灌注损伤、肾再灌注损伤、缺血(包括中风和脑缺血,以及由心脏/冠状动脉分流术引起的缺血)、神经变性病症、肝病和肾炎、胃肠病状、炎性肠病、克罗恩病、胃炎、肠易激综合征、溃疡性结肠炎、溃疡性疾病、胃溃疡、病毒和细菌感染、败血症、败血性休克、革兰氏阴性败血症、疟疾、脑膜炎、hiv感染、机会性感染、继发于感染或恶性肿瘤的恶病质、继发于获得性免疫缺陷综合征(aids)的恶病质、aids、arc(aids相关综合征)、肺炎、疱疹病毒、感染引起的肌痛、流感、自身免疫性疾病、移植物抗宿主反应和同种异体移植物排斥、骨吸收疾病的治疗、骨质疏松症、多发性硬化、急性痛风、肺炎、心肌炎、心包炎、肌炎、湿疹、脱发、白癜风、大疱性皮肤病、动脉粥样硬化、抑郁症、视网膜炎、葡萄膜炎、巩膜炎、肝炎、胰腺炎、原发性胆汁性肝硬化、硬化性胆管炎、爱迪生氏病(addison′s disease)、垂体炎、甲状腺炎、i型糖尿病、巨细胞动脉炎、肾炎(包括狼疮性肾炎)、累及器官的血管炎(诸如肾小球肾炎)、脉管炎(包括巨细胞动脉炎)、韦格纳肉芽肿(wegener′s granulomatosis)、结节性多动脉炎、白塞氏病(behcet′s disease)、川崎病(kawasaki disease)、高安氏动脉炎(takayasu′s arteritis)、累及器官的脉管炎、移植器官的急性排斥、内毒素血症、全身炎症反应综合征(sirs)、多器官功能障碍综合征、中毒性休克综合征、急性肺损伤、ards(成人呼吸窘迫综合征)、急性肾衰竭、暴发性肝炎、烧伤、急性胰腺炎、术后综合征、结节病、赫氏反应(herxheimer reaction)、脑炎、脊髓炎、与病毒感染如流感、带状疱疹、单纯疱疹、冠状病毒相关的sirs或干眼综合征(或干燥性角结膜炎(kc s))。在某些实施方案中,本文提供的化合物可用于治疗慢性或急性的神经性疼痛和伤害性疼痛,诸如但不限于异常性疼痛、炎性疼痛、炎性痛觉过敏、疱疹后神经痛、神经病、神经痛、糖尿病性神经病、hiv相关的神经病、神经损伤、类风湿性关节炎性疼痛、骨关节炎性疼痛、烧伤、背痛、眼部疼痛、内脏疼痛、癌症疼痛、牙痛、头痛、偏头痛、腕管综合征、纤维肌痛、神经炎、坐骨神经痛、骨盆超敏反应、骨盆疼痛、手术后疼痛、中风后疼痛和痛经。在某些实施方案中,本文提供的化合物可用于治疗阿尔茨海默病(ad)、轻度认知损害(mci)、年龄相关的记忆损害(aami)、多发性硬化、帕金森病(parkinson′s disease)、血管性痴呆、老年性痴呆、aids痴呆、皮克病(pick′s disease)、由脑血管病症引起的痴呆、皮质基底节变性、肌萎缩性侧索硬化(als)、亨廷顿病(huntington′s disease)、与创伤性脑损伤相关的cns功能减弱。在一个实施方案中,本文提供的化合物可用于治疗阿尔茨海默病(ad)、强直性脊柱炎、关节炎(骨关节炎、类风湿性关节炎(ra)、银屑病关节炎)、哮喘、动脉粥样硬化、克罗恩病、结肠炎、皮炎、憩室炎、纤维肌痛、肝炎、肠易激综合征(ibs)、系统性红斑狼疮(sle)、肾炎、帕金森病、溃疡性结肠炎。3.7.药物组合物本文提供的药物组合物含有治疗有效量的一种或多种本文提供的化合物(例如式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物)和药学上可接受的载体、稀释剂或赋形剂。可以将化合物配制成用于口服施用的合适的药物制剂,诸如溶液、混悬剂、片剂、分散片、丸剂、胶囊、粉剂、缓释制剂或酏剂,或者配制成用于眼用或肠胃外施用的无菌溶液或混悬剂,以及配制成透皮贴片制备物和干粉吸入剂。通常,使用本领域众所周知的技术和程序将上述化合物配制成药物组合物(参见,例如,ansel’s pharmaceutical dosageforms and drug delivery systems,2021年第十二版)。在这些组合物中,将有效浓度的一种或多种化合物或药学上可接受的盐与合适的药物载体或媒介物混合。在某些实施方案中,这些组合物中化合物的浓度在施用时有效递送治疗、预防或改善本文公开的疾病或病症的一种或多种症状和/或进展的量。通常,这些组合物配制用于单剂量施用。为了配制组合物,将重量分数的化合物以有效浓度溶解、悬浮、分散或以其它方式混合于所选媒介物中,使得所治病状得以缓解或改善。适于施用本文提供的组合物的药物载体或媒介物包括本领域技术人员已知的适于特定施用模式的任何此类载体。另外,这些化合物可以作为唯一的药物活性成分配制在该组合物中,或者可以与其它活性成分组合。脂质体混悬剂,包括组织靶向脂质体,诸如肿瘤靶向脂质体,也可适合作为药学上可接受的载体。这些可以根据本领域技术人员已知的方法制备。例如,脂质体制剂可以如本领域已知的那样制备。简言之,脂质体诸如多层囊泡(mlv)可以通过在烧瓶内部干燥卵磷脂酰胆碱和脑磷脂酰丝氨酸(7:3摩尔比)而形成。添加本文提供的化合物在缺乏二价阳离子的磷酸盐缓冲盐水(pbs)中的溶液,振荡烧瓶直至脂质膜分散。洗涤所得囊泡以去除未包封的化合物,通过离心沉淀,然后重悬于pbs中。在药学上可接受的载体中包含的活性化合物的量足以在对所治受试者不存在不期望的副作用的情况下发挥治疗上有用的效果。治疗有效浓度可以通过在本文所述的体外和体内系统中测试化合物凭经验确定,然后从中外推用于人类的剂量。在一些实施方案中,活性化合物以实现药物的治疗有效浓度的方法施用。在一些实施方案中,伴随诊断(参见例如,olsen d和jorgensen jt,front.oncol.,2014年5月16日,4:105,doi:10.3389/fonc.2014.00105)用于确定在特定受试者或受试者群体中活性化合物的治疗浓度和安全特性。药物组合物中活性化合物的浓度将取决于活性化合物的吸收、组织分布、失活和排泄速率,化合物的物理化学特征,给药方案和施用量以及本领域技术人员已知的其它因素。例如,递送的量足以改善本文公开的疾病或病症的一种或多种症状。在某些实施方案中,治疗有效剂量应产生约0.1ng/ml至约50-100μg/ml的活性成分血清浓度。在一个实施方案中,药物组合物提供每天每千克体重约0.001mg至约2000mg化合物的剂量。制备药物剂量单位形式以提供每剂量单位形式约1mg至约1000mg和在某些实施方案中约10至约500mg的必需活性成分或必需成分的组合。活性成分可以一次施用,或者可以分成许多较小的剂量,按时间间隔施用。应当理解,治疗的精确剂量和持续时间随所治疾病而变化,并且可以使用已知的测试方案或通过从体内或体外测试数据外推而凭经验确定。应注意,浓度和剂量值也可随着待缓解的病状的严重程度而变。还应理解,对于任何特定受试者,应该根据个体需要和施用或监督组合物施用的人的专业判断,随着时间推移调整具体剂量方案,并且本文所述的浓度范围仅为示例性的,并且不旨在限制要求保护的组合物的范围或实践。因此,将有效浓度或有效量的一种或多种本文所述的化合物或其药学上可接受的盐与用于全身、外敷或局部施用的合适药物载体或媒介物混合以形成药物组合物。包括有效改善一种或多种症状或有效治疗、延迟进展或预防的量的化合物。该组合物中活性化合物的浓度将取决于活性化合物的吸收、组织分布、失活、排泄速率,给药方案,施用量,特定制剂以及本领域技术人员已知的其它因素。这些组合物旨在通过合适的途径施用,包括但不限于口服、肠胃外、皮下、静脉内、肌内、腹膜内、鞘内、粘膜、皮肤、透皮、口腔、直肠、外敷、局部、鼻或吸入。对于口服施用,可以配制胶囊和片剂。这些组合物为液体、半液体或固体形式,并且以适于每种施用途径的方式配制。用于肠胃外、皮内、皮下或外敷应用的溶液或混悬剂可包括以下组分中的任一种:无菌稀释剂,诸如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇、二甲基乙酰胺或其它合成溶剂;抗微生物剂,诸如苯甲醇和对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸和亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸(edta);缓冲剂,诸如乙酸盐、柠檬酸盐和磷酸盐;以及用于调节张力的试剂,诸如氯化钠或右旋糖。肠胃外制备物可封装在由玻璃、塑料或其它合适材料制成的安瓿、笔、一次性注射器或单剂量或多剂量小瓶中。在化合物表现出不足的溶解度的情况下,可以使用使化合物增溶的方法。此类方法是本领域技术人员已知的,并且包括但不限于使用共溶剂诸如二甲亚砜(dmso),使用表面活性剂诸如或溶解在碳酸氢钠水溶液中。在混合或添加化合物时,所得混合物可以是溶液、悬浮液、乳液等。所得混合物的形式取决于许多因素,包括预期施用模式及化合物在所选载体或媒介物中的溶解度。有效浓度足以改善所治疾病、病症或病状的症状,并且可以凭经验确定。提供药物组合物用于以单位剂量形式向人和动物施用,单位剂量形式诸如片剂、胶囊、丸剂、粉剂、粒剂、无菌肠胃外溶液或混悬剂和口服溶液或混悬剂,以及含有适量化合物或其药学上可接受的盐的油水乳剂。将药学上的治疗活性化合物及其盐以单位剂量形式或多剂量形式配制并施用。如本文所用的单位剂量形式是指适于人和动物受试者并且如本领域已知的单独包装的物理离散单位。每个单位剂量含有足以产生期望治疗效果的预定量的治疗活性化合物,以及所需的药物载体、媒介物或稀释剂。单位剂量形式的实例包括安瓿和注射器以及单独包装的片剂或胶囊。单位剂量形式可以按其分数或倍数施用。多剂量形式是包装在单个容器中的多个相同的单位剂量形式,以分开的单位剂量形式施用。多剂量形式的实例包括小瓶、瓶装片剂或胶囊或者品脱或加仑的瓶子。因此,多剂量形式是在包装中未分开的多个单位剂量。也可制备缓释制备物。缓释制备物的合适实例包括含有本文提供的化合物的固体疏水性聚合物的半渗透性基质,所述基质为成形制品的形式,例如薄膜或微胶囊。缓释基质的实例包括离子电渗疗法贴片、聚酯、水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇))、聚交酯、l-谷氨酸和l-谷氨酸乙酯的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物(诸如lupron depottm(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球))和聚-d-(-)-3-羟基丁酸。虽然聚合物诸如乙烯-乙酸乙烯酯和乳酸-乙醇酸使得分子能够释放100天以上,但是某些水凝胶释放蛋白质的时间期限较短。当封装的化合物长时间留在体内时,由于在37℃下暴露于潮湿环境中,它们可能会变性或聚集,导致生物活性丧失及其结构可能发生变化。可根据所涉作用机制设计合理的策略进行稳定化。例如,如果发现聚集机制是通过硫基-二硫化物交换的分子间s--s键形成,则可以通过修饰巯基残基,从酸性溶液中冻干,控制水分含量,使用适当的添加剂,并开发特定聚合物基质组合物来实现稳定化。可制备含有0.005%至100%范围内的活性成分且余量由无毒载体组成的剂型或组合物。对于口服施用,药学上可接受的无毒组合物通过掺入任何通常采用的赋形剂形成,赋形剂诸如药物级甘露醇、乳糖、淀粉、硬脂酸镁、滑石、纤维素衍生物、交联羧甲基纤维素钠、葡萄糖、蔗糖、碳酸镁或糖精钠。此类组合物包括溶液、混悬剂、片剂、胶囊、粉剂和缓释制剂,诸如但不限于植入物和微囊化递送系统,和生物可降解的、生物相容性聚合物,诸如胶原、乙烯乙酸乙烯酯、聚酐、聚乙醇酸、聚原酸酯、聚乳酸等。制备这些组合物的方法是本领域技术人员已知的。所考虑的组合物可含有约0.001%至100%的活性成分,在某些实施方案中,含有约0.185%或约75%-95%的活性成分。可以将这些活性化合物或药学上可接受的盐与保护化合物免于从体内快速消除的载体一起制备,诸如延时释放制剂或包衣。这些组合物可包括其它活性化合物以获得期望的性质组合。本文提供的化合物或如本文所述的其药学上可接受的盐还可有利地出于治疗或预防目的与本领域中已知在治疗一种或多种上文提及的疾病或医学病状(诸如与氧化应激相关的疾病)中具有价值的另一药理学药剂一起施用。应理解,此类组合疗法构成本文提供的组合物和治疗方法的另一方面。本文提供的不含乳糖的组合物可以含有本领域众所周知的赋形剂,并且例如在美国药典(usp)sp(xxi)/nf(xvi)中列出。一般来说,不含乳糖的组合物含有药学上相容且药学上可接受的量的活性成分、粘合剂/填充剂和润滑剂。示例性的不含乳糖的剂型含有活性成分、微晶纤维素、预胶化淀粉和硬脂酸镁。还涵盖含有本文提供的化合物的无水药物组合物和剂型。例如,水(例如,5%)的添加在药学领域中被广泛接受作为模拟长期储存的手段,以确定诸如保质期或制剂随时间的稳定性的特征。参见例如,jens t.carstensen,drug stability:principles&practice,第2版,marcel dekker,ny,ny,1995,第379-80页。实际上,水和热加速一些化合物的分解。因此,水对制剂的影响可能具有重大意义,因为在制剂的制造、处理、包装、储存、运输和使用期间通常遇到水分和/或湿气。本文提供的无水药物组合物和剂型可使用无水或含低水分的成分及低水分或低湿度条件制备。包含乳糖和至少一种包含伯胺或仲胺的活性成分的药物组合物和剂型如果预期在制造、包装和/或储存期间与水分和/或湿气大量接触,则是无水的。应制备和储存无水药物组合物以保持其无水性质。因此,使用已知防止暴露于水的材料包装无水组合物,使得它们可以包含在合适的处方试剂盒中。合适包装的实例包括但不限于密封箔、塑料、单位剂量容器(例如、小瓶)、泡罩包装和条带包装。制品本文提供的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式以及包含它们与药学上可接受的载体、稀释剂或赋形剂的药物组合物可包含在药物试剂盒或药物包装(有时称为制品)中。此类制品可用于治疗、预防或改善本文公开的疾病或病症的一种或多种症状或进展,并且标签指示该化合物或其药学上可接受的盐用于治疗、预防或改善本文公开的疾病或病症的一种或多种症状或进展。在某些实施方案中,本文提供了一种药物试剂盒,该药物试剂盒当由开业医生使用时,可简化向受试者施用适量的活性成分。在某些实施方案中,本文提供的药物试剂盒包括容器和本文提供的化合物的剂型,该化合物包括其单一对映异构体或非对映异构体的混合物;或其药学上可接受的盐、溶剂化物或前药。在某些实施方案中,该药物试剂盒包括包含本文提供的化合物的剂型的容器,该化合物包括其单一对映异构体或非对映异构体的混合物;或其药学上可接受的盐、溶剂合物或前药,在容器中包含本文所述的一种或多种其它治疗剂。本文提供的药物试剂盒还可包括用于施用活性成分的装置。此类装置的实例包括但不限于注射器、无针注射器滴袋、贴片和吸入器。本文提供的试剂盒还可以包括用于施用活性成分的避孕套。本文提供的药物试剂盒还可包括可用于施用一种或多种活性成分的药学上可接受的媒介物。例如,如果活性成分以必须重构用于肠胃外施用的固体形式提供,则该试剂盒可以包含合适媒介物的密封容器,活性成分可以溶解在合适媒介物中以形成适于肠胃外施用的不含颗粒的无菌溶液。药学上可接受的媒介物的实例包括但不限于:水性媒介物,包括但不限于注射用水usp、氯化钠注射液、林格氏注射液、右旋糖注射液、右旋糖和氯化钠注射液和乳酸林格氏注射液;水混溶性媒介物,包括但不限于乙醇、聚乙二醇和聚丙二醇;和非水性媒介物,包括但不限于玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。3.8.给药本文提供的式i、ia、ib、ic、ii、iia、iia(1)、iib、iic、iii、iiia、iiib、iiic、iv、iva、ivb或ivc的化合物或其药学上可接受的形式和包含它们的药物组合物可以如下所述的某些治疗或预防有效量、某些时间间隔、某些剂型和某些剂量施用方法给药。在某些实施方案中,该化合物的治疗或预防有效量为每天约0.005至约1,000mg、每天约0.01至约500mg、每天约0.01至约250mg、每天约0.01至约100mg、每天约0.1至约100mg、每天约0.5至约100mg、每天约1至约100mg、每天约0.01至约50mg、每天约0.1至约50mg、每天约0.5至约50mg、每天约1至约50mg、每天约0.02至约25mg、每天约0.05至约10mg、每天约0.05至约5mg、每天约0.1至约5mg或每天约0.5至约5mg。在某些实施方案中,治疗或预防有效量为每天约0.1、约0.2、约0.5、约1、约2、约3、约4、约5、约6、约7、约8、约9、约10、约15、约20、约25、约30、约40、约45、约50、约60、约70、约80、约90、约100或约150mg。在一个实施方案中,本文提供的化合物或其衍生物对于本文所述的病状的推荐日剂量范围在每天约0.5mg至约50mg的范围内,在一个实施方案中,作为单一每日一次剂量或全天以分剂量给予。在一些实施方案中,剂量范围为每天约1mg至约50mg。在其它实施方案中,剂量范围为每天约0.5mg至约5mg。每天的具体剂量包括每天0.1、0.2、0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50mg。在一个具体实施方案中,推荐的起始剂量可以是每天0.5、1、2、3、4、5、10、15、20、25或50mg。在另一个实施方案中,推荐的起始剂量可以是每天0.5、1、2、3、4或5mg。剂量可递增至每天15、20、25、30、35、40、45和50mg。在一个具体实施方案中,该化合物可以以约25mg/天的量施用。在一个特定实施方案中,该化合物可以以约10mg/天的量施用。在一个特定实施方案中,该化合物可以以约5mg/天的量施用。在一个特定实施方案中,该化合物可以以约4mg/天的量施用。在一个特定实施方案中,该化合物可以以约3mg/天的量施用。在某些实施方案中,治疗或预防有效量为约0.001至约100mg/kg/天、约0.01至约50mg/kg/天、约0.01至约25mg/kg/天、约0.01至约10mg/kg/天、约0.01至约9mg/kg/天、0.01至约8mg/kg/天、约0.01至约7mg/kg/天、约0.01至约6mg/kg/天、约0.01至约5mg/kg/天、约0.01至约4mg/kg/天、约0.01至约3mg/kg/天、约0.01至约2mg/kg/天、约0.01至约1mg/kg/天或约0.01至约0.05mg/kg/天。施用剂量也可以以除mg/kg/天以外的单位表示。例如,肠胃外施用的剂量可以表示为mg/m2/天。本领域的普通技术人员将容易知道如何鉴于受试者的身高或体重或两者将剂量从mg/kg/天转换为mg/m2/天(参见,例如,nair ab,jacob s.a simple practiceguide for do se conversion between animals and human.j basic clin pharma2016;7:27-31)。例如,对于60kg的人,1mg/kg/天的剂量大约等于37mg/m2/天。在某些实施方案中,施用的化合物的量足以提供范围为约0.001至约500μm、约0.002至约200μm、约0.005至约100μm、约0.01至约50μm、约1至约50μm、约0.02至约25μm、约0.05至约20μm、约0.1至约20μm、约0.5至约20μm或约1至约20μm的化合物的稳态血浆浓度。在其它实施方案中,施用的化合物的量足以提供范围为约5至约100nm、约5至约50nm、约10至约100nm、约10至约50nm或约50至约100nm的化合物的稳态血浆浓度。如本文所用,术语“稳态血浆浓度”是在施用本文提供的化合物或其衍生物一段时间后达到的浓度。一旦达到稳态,在化合物的血浆浓度的时间依赖性曲线上存在较小的峰和谷。在某些实施方案中,施用的化合物的量足以提供范围为约0.001至约500μm、约0.002至约200μm、约0.005至约100μm、约0.01至约50μm、约1至约50μm、约0.02至约25μm、约0.05至约20μm、约0.1至约20μm、约0.5至约20μm或约1至约20μm的化合物的最大血浆浓度(峰浓度)。在某些实施方案中,施用的化合物的量足以提供范围为约0.001至约500μm、约0.002至约200μm、约0.005至约100μm、约0.01至约50μm、约1至约50μm、约0.01至约25μm、约0.01至约20μm、约0.02至约20μm、约0.02至约20μm或约0.01至约20μm的化合物的最小血浆浓度(谷浓度)。在某些实施方案中,施用的化合物的量足以提供范围为约100至约100,000ng*hr/ml、约1,000至约50,000ng*hr/ml、约5,000至约25,000ng*hr/ml或约5,000至约10,000ng*hr/ml的化合物的曲线下面积(auc)。本文提供的方法涵盖治疗患者,而与受试者的年龄无关,但是一些疾病或病症在某些年龄组中更常见。根据待治疗的疾病和受试者的病状,本文提供的化合物或其衍生物可通过口服、肠胃外(例如,肌内、腹膜内、静脉内、civ、脑池内注射或输注、皮下注射或植入)、吸入、经鼻、阴道、直肠、舌下或外敷(例如,透皮或局部)施用途径施用。本文提供的化合物或其衍生物可以单独配制或与适于每种施用途径的药学上可接受的赋形剂、载体、佐剂和媒介物一起配制成合适的剂量单位。在一个实施方案中,口服施用本文提供的化合物或其衍生物。在另一个实施方案中,胃肠外施用本文提供的化合物或其衍生物。在又一个实施方案中,静脉施用本文提供的化合物或其衍生物。本文提供的化合物或其衍生物可以作为单一剂量递送,诸如单一快速浓注或口服片剂或丸剂;或随着时间推移而递送,例如随着时间推移连续输注或随着时间推移作为分次推注剂量递送。如有必要,可以重复施用化合物,例如,直到受试者经历稳定的疾病或消退,或直到受试者经历疾病进展或不可接受的毒性。例如,实体瘤的稳定疾病通常意指可测量病变的垂直直径从最后一次测量开始尚未增加25%或更多。response evaluationcriteria in solid tumors(recist)guidelines,journal of the national cancerinstitute 92(3):205 216(2000)。稳定疾病或其缺乏通过本领域已知的方法确定,诸如评价患者症状,身体检查,使用x-射线、cat、pet或mri扫描成像的肿瘤的可视化和其它通常接受的评价方式。本文提供的化合物或其衍生物可每天施用一次(qd),或分成多个日剂量,诸如每天两次(bid)、每天三次(tid)和每天四次(qid)。另外,施用可以是连续的(即,连续数日每天施用或每一天施用)、间歇的,例如循环(即,包括无药物休息数日、数周或数月)。如本文所用,术语“每天”旨在意指治疗性化合物(诸如本文提供的化合物或其衍生物)每天施用一次或多于一次,例如持续一段时间。术语“连续”旨在意指每天施用治疗性化合物,诸如本文提供的化合物或其衍生物,持续至少10天至52周的不间断时间。如本文所用的术语“间歇的”或“间歇地”旨在意指以定期或不定期的间隔停止和开始。例如,本文提供的化合物或其衍生物的间歇给药是每周施用一至六天,周期施用(例如,连续二至八周每天施用,然后不给药的休息期长达一周)或隔天施用。如本文所用的术语“循环”旨在意指治疗性化合物,诸如本文提供的化合物或其衍生物,每天或连续施用,但是有休息期。在一些此类实施方案中,施用是每天一次,持续二至六天,然后是不施用的休息期持续五至七天。在一些实施方案中,施用频率在约日剂量至约月剂量的范围内。在某些实施方案中,施用是每天一次、每天两次、每天三次、每天四次、每隔一天一次、每周两次、每周一次、每两周一次、每三周一次或每四周一次。在一个实施方案中,本文提供的化合物或其衍生物每天施用一次。在另一个实施方案中,本文提供的化合物或其衍生物每天施用两次。在又一个实施方案中,本文提供的化合物或其衍生物每天施用三次。在再一个实施方案中,本文提供的化合物或其衍生物每天施用四次。在某些实施方案中,本文提供的化合物或其衍生物每天施用一次,持续一天至六个月、一周至三个月、一周至四周、一周至三周或一周至两周。在某些实施方案中,本文提供的化合物或其衍生物每天施用一次,持续一周、两周、三周或四周。在一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续4天。在一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续5天。在一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续6天。在一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续一周。在另一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续两周。在又一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续三周。在再一个实施方案中,本文提供的化合物或其衍生物每天施用一次,持续四周。与第二活性剂的组合疗法本文提供的化合物或其衍生物还可以与可用于治疗和/或预防癌症、炎性疾病、ras病或纤维化疾病的其它治疗剂组合或以组合使用。在一个实施方案中,本文提供了一种治疗、预防或管理癌症、炎性疾病、ras病和纤维化疾病的方法,其包括向受试者施用本文提供的化合物或其衍生物;与一种或多种第二活性剂组合。如本文所用,术语“与......组合”包括使用多于一种疗法(例如,一种或多种预防剂和/或治疗剂)。然而,术语“与......组合”的使用不限制向患有疾病或病症的受试者施用疗法(例如,预防剂和/或治疗剂)的顺序。第一疗法(例如,预防剂和/或治疗剂诸如本文提供的化合物,本文提供的化合物,例如本文提供的化合物或其衍生物)可以在向受试者施用第二疗法(例如,预防剂和/或治疗剂)之前(例如,之前5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周),同时或之后(例如,之后5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)施用。本文还考虑了三联疗法。向受试者施用本文提供的化合物或其衍生物和一种或多种第二活性剂可以通过相同或不同的施用途径同时或依序进行。用于特定活性剂的特定施用途径的适合性将取决于活性剂本身(例如,它是否可以口服施用而在进入血流之前不分解)和所治疾病或病症。本文提供的化合物或其衍生物的施用途径独立于第二疗法的施用途径。在一个实施方案中,口服施用本文提供的化合物或其衍生物。在另一个实施方案中,静脉施用本文提供的化合物或其衍生物。因此,根据这些实施方案,本文提供的化合物或其衍生物口服或静脉施用,并且第二疗法可以口服、胃肠外、腹膜内、静脉内、动脉内、透皮、舌下、肌内、直肠、经颊、鼻内、脂质体、经由吸入、阴道、眼内、经由导管或支架的局部递送、皮下、脂肪内、关节内、鞘内或以缓释剂型施用。在一个实施方案中,本文提供的化合物或其衍生物和第二疗法通过相同的施用模式,口服或iv施用。在另一个实施方案中,本文提供的化合物或其衍生物通过一种施用模式,例如通过iv施用,而第二药剂通过另一种施用模式,例如口服施用。在一个实施方案中,第二活性剂以约1至约1000mg、约5至约500mg、约10至约350mg或约50至约200mg的量每天一次或两次静脉或皮下施用。第二活性剂的具体量将取决于所使用的具体药剂、所治疗或管理的疾病的类型、疾病的严重程度和分期,以及本文提供的化合物或其衍生物和同时施用给受试者的任何任选的附加活性剂的量。在本文提供的方法和组合物中,一种或多种第二活性成分或药剂可与本文提供的化合物或其衍生物一起使用。第二活性剂可以是大分子(例如,蛋白质)或小分子(例如,合成的无机分子、有机金属分子或有机分子)。大分子活性剂的实例包括但不限于造血生长因子、细胞因子及单克隆和多克隆抗体,特别是针对癌抗原的治疗性抗体。典型的大分子活性剂是生物分子,诸如天然存在的或合成的或重组的蛋白质。在一个实施方案中,本文提供的化合物或其衍生物可以在使用常规疗法之前、期间或之后以约0.1至约150mg、约1至约25mg、或约2至约10mg范围的量单独地或与第二活性剂组合每天口服施用。4.实施例现在将参考具体实施例描述本公开,这些实施例不应当解释为以任何方式限制。分析方法:nmr:质子核磁共振波谱(nmr)是在400mhz或500mhz下记录的。13c nmr波谱是在100mhz或125mhz下记录的。化学位移(δ)以百万分率(ppm)给出,并以四甲基硅烷作为参考在前场列出。峰描述为单峰(s)、双峰(d)、三重峰(t)、四重峰(q)、五重峰(quint)、多重峰(m)和宽峰(br.)。nmr波谱的所有分配都基于1d nmr数据。lcms规范和方法细节:1)supor_30-酸性01应用:m/z高达600的所有化合物的初始纯度检查柱:agilent poroshell 120 sb-c18 4.6x30mm 2.7μm柱温:60℃流动相:a-水(0.1%甲酸),b-乙腈(0.1%甲酸)流速:3ml/分钟梯度:0.01分钟-1%b,1.5分钟-100%b,1.73分钟-100%bms电离模式:电喷雾电离(esi)ms扫描范围:83-600m/zuv检测:215nm、254nm、280nm2)por1k_30-酸性02应用:m/z高达1000的所有化合物的初始纯度检查柱:agilent poroshell 120 sb-c18 4.6x30mm 2.7μm柱温:60℃流动相:a-水(0.1%甲酸),b-乙腈(0.1%甲酸)流速:3ml/分钟梯度:0.01分钟-1%b,1.5分钟-100%b,1.73分钟-100%bms电离模式:电喷雾电离(esi)ms扫描范围:83-1000m/zuv检测:215nm、254nm、280nm3)supor_30f-酸性03应用:强烈保留m/z高达1000的化合物柱:agilent poroshell 120 sb-c18 4.6x30mm 2.7温度:60℃流动相:a-水(0.1%甲酸),b-乙腈(0.1%甲酸)流速:3ml/分钟梯度:0.01分钟-1%b,1.5分钟-100%b,2.2分钟-100%bms电离模式:电喷雾电离(esi)ms扫描范围:83-1000m/zuv检测:215nm、254nm、280nm4)n_supor_30-中性01应用:在酸性条件下不稳定的化合物柱:agilent poroshell 120 sb-c18 4.6x30mm 2.7μm柱温:60℃流动相:a-水,b-乙腈流速:3ml/分钟梯度:0.01分钟-1%b,1.5分钟-100%b,1.73分钟-100%bms电离模式:电喷雾电离(esi)ms扫描范围:83-600m/zuv检测:215nm、254nm、280nm4)ac-gemini_2,3_n-碱性01应用:在酸性/中性条件下保留性差的极性化合物柱:gemini nx-c18 4,6x50mm 5微米柱温:25℃流动相:a-10mm nh4ac的水溶液,ph=10,b-乙腈流速:2.3ml/分钟梯度:0.01分钟-1%b,1.5分钟-100%b,1.73分钟-100%b。ms电离模式:电喷雾电离(esi)ms扫描范围:83-600m/zuv检测:215nm、254nm、280nm5)6分钟_4-6x30_1-5-酸性04应用:m/z高达1000的所有化合物的初始纯度检查柱:agilent poroshell 120 sb-c18 4.6x30mm 2.7μm柱温:60℃流动相:a-水(0.1%甲酸),b-乙腈(0.1%甲酸)流速:1.5ml/分钟梯度:0.01分钟-1%b,5.00分钟-100%b,5.99分钟-100%bms电离模式:电喷雾电离(esi)ms扫描范围:83-1000m/zuv检测:215nm、254nm、280nm6)lcms uplc柱:4.6x50mm zorbax sb-c18 1.8微米温度:50℃流动相:溶剂a:ch3cn+h2o+fa 0.1%(900:100:2)溶剂b:h2o+fa 0.1%(1000:2)流速:3ml/分钟梯度:
时间
a(%)
b(%)
0,00
3,0
97.0
0,01
3,0
97.0
4,00
100,0
0,0
4.60
100,0
0,0
4.61
3,0
97.0
4,7
3,0
97.0
ms电离模式:电喷雾电离(esi)ms扫描范围:83-1000m/zuv检测:215nm、254nm、280nm4.1合成实施例实例a1:中间体a1的合成步骤a:(5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-基)氨基甲酸叔丁酯a1b。在室温下向5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-甲酸a1a(2.00g,13.15mmol)在t-buoh(50ml)、dmf(1ml)的混合物中的搅拌溶液中添加et3n(3.64ml,26.3mmol),随后添加dppa(5.42g,19.7mmol),并将所得反应混合物缓慢加热至90℃持续12小时。将反应混合物减压浓缩,得到粗产物,将粗产物用h2o(20ml)淬灭,并将水层用乙酸乙酯(2x20ml)萃取,用盐水(20ml)洗涤并且经无水na2so4干燥并减压蒸发,得到粗制物质。通过反相c-18柱色谱法(50%ch3cn的h2o溶液)纯化获得的粗制物质,得到呈灰白色固体的(5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-基)氨基甲酸叔丁酯a1b(0.80g,27%产率)。1h nmr(400mhz,dmso-d6)δ9.38(s,1h),5.97(s,1h),3.91(t,j=7.20hz,2h),2.78(t,j=7.60hz,2h),2.46-2.40(m,2h),1.43(s,9h)。步骤b:5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-胺a1。在0℃下向(5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-基)氨基甲酸叔丁酯a1b(0.8g,3.58mmol)在cf3ch2oh(8ml)中的搅拌溶液中添加tmscl(0.67ml,5.38mmol),并且缓慢温热至室温并搅拌2小时。减压蒸发溶剂,得到粗品,将粗品用饱和nahco3溶液(10ml)中和,用ch2cl2(2x20ml)萃取。将有机层用盐水(10ml)洗涤,经无水na2so4干燥并将合并的有机层减压蒸发,得到呈灰白色固体的5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-胺a1(0.35g,79%产率)。1h-nmr(400mhz,cdcl3)δ5.34(s,1h),3.96(t,j=7.20hz,2h),3.17(brs,2h),2.80(t,j=8.04hz,2h),2.51-2.44(m,2h)。ms(esi+apci;多模式):计算值[m+1]124。实测值[m+1]124。实例a2:中间体a2的合成步骤a:2-((6-氨基嘧啶-4-基)氧基)乙-1-醇a2。向6-氯嘧啶-4-胺a2a(1.00g,7.75mmol)在乙-1,2-二醇(15ml)中的混合物中添加t-kobu(1.30g,11.62mmol)并且将所得反应混合物加热至110℃持续16小时。将反应混合物用h2o(10ml)淬灭,将水层用ch2cl2(2x20ml)萃取,用盐水(10ml)洗涤,经无水na2so4干燥并将合并的有机层减压蒸发得到粗制物质。使用硅胶组合快速柱色谱法(10%meoh的ch2cl2溶液)纯化粗制物质,得到不纯的物质,将其使用反相c-18柱色谱法(30-50%ch3cn的h2o溶液)再纯化,得到呈白色固体的2-((6-氨基嘧啶-4-基)氧基)乙-1-醇a2(0.50g,41.6%产率)。1h-nmr(400mhz,dmso-d6)δ8.07(d,j=0.80hz,1h),6.61(s,2h),5.68(d,j=0.80hz,1h),4.82(t,j=5.60hz,1h),4.18(t,j=5.20hz,2h),3.66-3.62(m,2h)。ms(esi+apci;多模式):计算值[m+1]156。实测值[m+1]156。实例a3:中间体a3的合成步骤a:4-氯嘧啶-2-胺a3b。在0℃向2-氨基嘧啶-4(3h)-酮a3a(10.0g,90.09mmol)在甲苯(200ml)中的搅拌溶液中添加pocl3并缓慢加热至120℃持续5小时。将反应混合物减压浓缩,得到粗残余物,将粗残余物用饱和nahco3溶液(20ml)淬灭,并且将所得固体过滤并用h2o(30ml)洗涤,并且真空干燥,得到呈褐色固体的4-氯嘧啶-2-胺a3b(4.60g,粗品),将其不经任何纯化直接按原样用于下一步骤。步骤b:4-(2-(二甲基氨基)乙氧基)嘧啶-2-胺a3。向4-氯嘧啶-2-胺a3b(4.60g,35.65mmol)和2-(二甲基氨基)乙-1-醇在dmf(50ml)中的混合物中添加k2co3(9.84g,71.31mmol)并加热至80℃持续16小时。将反应混合物倒入碎冰中,并将所得固体过滤,用h2o(30ml)洗涤,随后用mtbe(30ml):己烷(30ml)洗涤并真空干燥,得到呈浅褐色固体的4-(2-(二甲基氨基)乙氧基)嘧啶-2-胺a3(0.90g,14%产率{2步})。1h-nmr(400mhz,dmso-d6)δ7.94(d,j=5.60hz,1h),6.53(s,2h),5.98(d,j=5.60hz,1h),4.28(t,j=5.60hz,2h),2.56(t,j=5.60hz,2h),2.20(s,6h)。实例a4:中间体a4的合成步骤a:4-(二氟甲氧基)吡啶-2-胺a4。将氢氧化钠(18.16g,454.06mmol)一次性添加至2-氨基吡啶-4-醇a4a(10.0g,90.82mmol)于二噁烷(150ml)和水(50ml)中的搅拌溶液中,引起放热至50℃。然后经9分钟将氯二氟甲烷快速鼓泡到反应中,引起逐渐放热至70℃。反应冷却至室温后,将其用乙醚(150ml)和水(150ml)稀释,并且分离各层。有机相用水、盐水洗涤,并且经na2so4干燥并真空浓缩,得到呈褐色固体的4-(二氟甲氧基)吡啶-2-胺a4(700.0mg,90.0%纯度,3.93mmol,4.3%产率)。实例a5:中间体a5的合成步骤a:4-(2,2,2-三氟乙氧基)吡啶-2-胺a5将氢化钠(0.21g,5.25mmol)(60%在矿物油中)逐份添加到2,2,2-三氟乙基三氟甲磺酸酯(1.05g,4.54mmol)和2-氨基吡啶-4-醇a4a(500.0mg,4.54mmol)在dmf(5ml)中的溶液中。将混合物在室温下搅拌16小时,然后用水(45ml)稀释并通过etoac(3*15ml)萃取3次。有机相用水、盐水洗涤,并且经na2so4干燥并真空浓缩,得到呈褐色固体的4-(2,2,2-三氟乙氧基)吡啶-2-胺a5(410.0mg,90.0%纯度,1.92mmol,42.3%产率)。实例a6:中间体a6的合成步骤a:3-溴-1-环丙基-1h-吡唑(a6a)。将2-(吡啶-2-基)吡啶(21.25g,136.08mmol)和乙酸铜ii)(24.72g,136.08mmol)在dce(320ml)中的悬浮液温热至50℃并搅拌10分钟。然后,添加3-溴-1h-吡唑(a6a)(20.0g,136.08mmol)、环丙基硼酸(35.07g,408.24mmol)和碳酸钠(31.73g,299.38mmol)在dce(100ml)中的混合物。将反应混合物在65℃下搅拌18小时。然后,使获得的混合物冷却至室温,通过硅藻土熔块过滤,并用etoac漂洗。减压浓缩滤液。将残余物在etoac和nh4cl(水溶液)之间分配,并且将有机层用nh4cl(水溶液)、na2co3(水溶液)和盐水洗涤并经na2so4干燥。将残余物真空干燥并通过快速柱色谱法纯化(m=30g interchim;330g sio2、己烷/甲基叔丁基醚(mtbe),mtbe为0~20%,流速100ml/分钟,rv=6,2-8,5cv),得到3-溴-1-环丙基-1h-吡唑(a6a)(10.7g,95.0%纯度,54.35mmol,39.9%产率)。步骤b:1-环丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑(a6)。将3-溴-1-环丙基-1h-吡唑(a6a)(10.7g,57.21mmol)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1,3,2-二氧杂环戊硼烷(15.25g,60.07mmol),[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(2.34g,2.86mmol)和乙酸钾(11.23g,114.42mmol)在二噁烷(150ml)中的混合物脱气,温热至100℃,并搅拌18小时。真空去除挥发物。将残余物悬浮在etoac中,通过硅藻土垫过滤,用etoac漂洗。减压浓缩滤液,得到1-环丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑(a6)(21.0g,51.0%纯度,45.75mmol,80%产率)并且无需进一步纯化即使用。实施例1:化合物1的合成步骤a:4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b。在0℃下将1-碘吡咯烷-2,5-二酮(33.95g,150.91mmol)逐份添加到3-甲基-1h-吡咯-2-甲酸甲酯1a(20.0g,143.73mmol)在dmf(100.0ml)中的溶液中。将反应混合物在室温下搅拌16小时。然后,将混合物倒入冰水中。通过过滤收集所形成的沉淀物,用水(2×50ml)洗涤并真空干燥得到呈黄色粉末的4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b(29.0g,109.41mmol,76.1%产率)。步骤b:4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1d。在ar气氛下将4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b(26.94g,101.64mmol)、1-异丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑1c(24.0g,101.64mmol)、碳酸铯(66.24g,203.29mmol)和pd(dppf)cl2(8.3g,10.16mmol)溶于脱气二噁烷(80ml)中。经由注射器添加3.8ml水并将反应混合物在80℃下搅拌16小时。将混合物冷却至室温,通过硅藻土垫过滤并减压浓缩。将残余物通过柱色谱法(用hex∶etoac 20∶1至1∶2洗脱)纯化,得到呈深黄色粉末的4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1d(7.5g,30.33mmol,29.8%产率)。步骤c:1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1e。在0℃下向4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1d(5.8g,22.19mmol)在dmf(75ml)中的溶液中添加氢化钠(1.15g,48.09mmol)。将所得混合物在室温下搅拌1小时,并在0℃下滴加o-(2,4-二硝基苯基)羟胺(5.75g,28.85mmol)在dmf(50ml)中的溶液。将反应混合物在室温(rt)下搅拌过夜。然后,在冷却至0℃下将nh4cl水溶液(20ml)滴加到反应混合物中。将产物用etoac(3×35ml)萃取并将合并的有机层用水(5x20ml)洗涤。将有机萃取物经na2so4干燥并真空浓缩,得到1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1e(4.9g,73.5%纯度,13.03mmol,58.7%产率)。步骤d:6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇1f。将氢化钠(1.77g,73.71mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1e(5.8g,22.11mmol)和1-甲基-1h-咪唑-2-甲腈(2.37g,22.11mmol)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后,将混合物冷却至室温,倒入冰水中并用乙酸(6.64g,110.56mmol)中和。通过过滤收集形成的沉淀物,用水(2×10ml)洗涤并通过柱色谱法纯化(hex∶etoac 10∶1至etoac 100%洗脱),得到呈深黄色固体的6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇1f(1.8g,5.34mmol,24.1%产率)。步骤e:4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g。将6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇1f(1.8g,5.34mmol)溶于三氯氧磷(9.81g,64.01mmol,5.97ml,12.0当量)中。将混合物在100℃下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3(ph~9!)中和。将混合物用dcm萃取三次,经na2so4干燥并减压浓缩,得到呈深褐色油状物的4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(1.3g,3.65mmol,68.5%产率)。步骤g:rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(1)。一般程序:将dipea(163.29mg,1.26mmol,220.0μl,3.0当量)一次性添加到4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol)和适当的相应胺(505.37μmol,1.2当量)在dmf(2ml)中的溶液中。将混合物在100℃下搅拌16小时。将混合物通过hplc纯化。以4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol)开始并使用用rac(1r,3s)-3-甲氧基环戊-1-胺(505.37μmol,1.2当量)的一般程序生成rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(1)(16.9mg,9%产率,100%纯度)。lcms(esi):计算值[m+1]435.3,实测值[m+1]435.21h nmr(dmso-d6,600mhz):δ(ppm)1.45(m,6h),1.95(m,6h),2.67(s,3h),3.24(s,3h),3.92(m,4h),4.51(m,1h),4.73(m,1h),6.50(d,1h),6.84(m,1h),6.93(d,1h),7.23(d,1h),7.76(d,1h),7.87(s,1h)。实施例2-实施例5:化合物2-5的合成按照实施例1步骤g中描述的一般程序,用适当的相应胺(505.37μmol,1.2当量)处理4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol),生成表1中所示的实施例化合物(2)-(5)。化合物(2)-(5)的分析数据也示于表1中。实施例6:化合物6的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(6)。一般程序:将氢化钠(25.32mg,1.06mmol,1.5当量)(60%在矿物油中)逐份(在3分钟内)添加到4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(如实施例1步骤e中所述制备(150.0mg,421.56μmol)和适当的相应胺(633.12μmol,1.5当量)在dmf(2ml)中的溶液中。将反应混合物在100℃下搅拌16小时。然后,将混合物冷却至室温,倒入氯化铵(67.73mg,1.27mmol)在水中的冷溶液中。通过过滤收集形成的沉淀物,用水(2×2ml)洗涤并通过hplc纯化。按照以4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol)(如实施例1步骤e中所述制备)开始的一般程序并使用6-甲氧基嘧啶-4-胺(633.12μmol,1.5当量),生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(6)(14.6mg,7.20%产率,100%纯度)。lcms(esi):计算值[m+1]445.2,实测值[m+1]445.21h nmr(dmso-d6,400mhz)δ1.74(dd,6h),3.06(s,3h),4.28(s,3h),4.50(s,3h),4.76-4.85(m,1h),6.82(t,1h),7.74(s,1h),7.89(d,1h),7.91-7.98(m,1h),8.02(t,1h),8.54(s,1h),8.89(s,1h)。实施例7:化合物7的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(7)。在以上实施例6步骤a中描述的一般程序中使用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(如实施例1步骤e中所述制备)和作为相应胺的6-甲氧基吡啶-2-胺,生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(7)(3.7mg,2.0%产率,97%纯度)。lcms(esi):计算值[m+1]444.2,实测值[m+1]444.2。实施例8:化合物8的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(8)。将氢化钠(30.38mg,1.27mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸甲酯1e(如实例1步骤c中所述制备)(100.0mg,381.23μmol)和吡啶-2-甲腈(39.54mg,379.81μmol)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后,将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集获得的沉淀物,用水(2×10ml)洗涤并通过柱色谱法纯化(己烷∶etoac 10∶1至etoac 100%洗脱),得到呈深黄色固体的6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(8)(13.0mg,38.88μmol,10.2%产率,100%纯度)。lcms(esi):计算值[m+1]335.2,实测值[m+1]335.21h nmr(dmso-d6,400mhz)δ1.43(m,6h),2.67(s,3h),4.49(m,1h),6.51(d,1h),7.62(m,1h),7.78(m,1h),7.91(s,1h),8.04(dd,1h),8.20(m,1h),8.80(m,1h),11.02(br s,1h)。实施例9:化合物9的合成步骤a:4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a。将6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(8)(如实施例8步骤a中所述制备)(2.99g,8.96mmol)溶于三氯氧磷(16.48g,107.48mmol,10.02ml,12.0当量)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3(ph~9!)中和。将混合物用dcm萃取三次,经na2so4干燥并减压浓缩,得到呈深褐色油状物的4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(2.5g,7.09mmol,79.1%产率)。获得物质不经进一步纯化即用于下一步骤。步骤b:rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(9)。一般程序:将dipea(148.4mg,1.15mmol,200.0μl,4.0当量)一次性添加到4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(101.38mg,287.35μmol)和适当的相应胺(431.02μmol,1.5当量)在dmf(2ml)中的溶液中。将混合物加热至100℃,并在该温度下搅拌16小时。将混合物通过hplc纯化。按照用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(101.38mg,287.35μmol)并使用rac(1r,3s)-3-甲氧基环戊-1-胺(431.02μmol,1.5当量)作为相应胺的一般程序,生成rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(9)(15.8mg,12.7%产率,100%纯度)。lcms(esi):计算值[m+1]432.3,实测值[m+1]432.2 1h nmr(dmso-d6,400mhz)δ1.46(d,6h),1.83-2.00(m,4h),2.02-2.13(m,2h),2.71(s,3h),3.29(s,3h),3.93-4.01(m,1h),4.53(p,1h),4.84-4.95(m,1h),6.52(d,1h),6.88(d,1h),7.43-7.51(m,1h),7.80(d,1h),7.88-7.98(m,2h),8.27(d,1h),8.68(d,1h)。实施例10-实施例12:化合物10-12的合成按照实施例9步骤b中描述的一般程序,用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(101.38mg,287.35μmol)和适当的相应胺(431.02μmol,1.5当量),生成表1中所示的实施例化合物(10)-(12)。化合物10-12的分析数据也示于表1中。实施例13:化合物13的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(13)。一般程序:将氢化钠(25.55mg,1.06mmol)(60%在矿物油中)逐份(在3分钟内)添加到4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(如实施例9步骤a中所述制备)(150.0mg,425.15μmol)和适当的相应胺(638.75μmol,1.5当量)在dmf(2ml)中的溶液中。将反应混合物加热至100℃,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入氯化铵(68.34mg,1.28mmol)在水中的冷溶液中。通过过滤收集形成的沉淀物,用水(2×10ml)洗涤并通过hplc纯化。按照用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(150.0mg,425.15μmol)和作为相应胺的6-甲氧基嘧啶-4-胺(638.75μmol,1.5当量)的一般程序,生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(13)(30.8mg,16.4%产率,100%纯度)。lcms(esi):计算值[m+1]442.2,实测值[m+1]442.21h nmr(dmso-d6,400mhz)δ1.47(d,6h),2.86(s,3h),3.94(s,3h),4.47-4.65(m,1h),6.47(s,1h),6.56(s,1h),7.63(s,1h),7.81(d,1h),7.89-8.11(m,2h),8.21(d,1h),8.52-8.85(m,2h),14.85(s,1h)。实施例14:化合物14的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(14)。按照以上实施例13步骤a中描述的一般程序,以4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪9a(如实施例9步骤a中所述制备)(150.0mg,425.15μmol)和作为相应胺的6-甲氧基吡啶-2-胺(638.75μmol,1.5当量),生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-5-甲基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(14)(30.8mg,16.4%产率,100%纯度)。lcms(esi):计算值[m+1]441.2,实测值[m+1]441.2 1h nmr(dmso-d6,400mhz)δ1.47(d,6h),2.86(s,3h),3.94(s,3h),4.47-4.65(m,1h),6.47(s,1h),6.56(s,1h),7.63(s,1h),7.81(d,1h),7.89-8.11(m,2h),8.21(d,1h),8.52-8.85(m,2h),14.85(s,1h)。实施例15:化合物15的合成步骤a:4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15b。将4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b(如实施例1步骤a中所述制备)(5.0g,18.86mmol)、2-(2-氯-3-甲氧基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷15a(6.08g,22.64mmol)、碳酸铯(12.29g,37.73mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(1.54g,1.89mmol)在二噁烷/h2o(100/5ml)中的混合物在氩气气氛下在100℃下加热过夜。将反应混合物浓缩,并且将粗制化合物通过快速色谱法纯化,得到基4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15b(3.05g,57.8%产率)。步骤b:1-氨基-4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15c。在0℃下向4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15b(2.4g,8.58mmol)在dmf(70ml)中的溶液中添加氢化钠(686.39mg,28.6mmol)。30分钟后,在0℃下逐份添加o-(二苯基氧膦基)羟胺(4.0g,17.16mmol)。将反应混合物在60℃下搅拌过夜。然后,将该混合物冷却,过滤并且将滤液减压蒸发,得到1-氨基-4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15c(1.7g,65.4%产率)。步骤c:6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(15)。在0℃下向1-氨基-4-(2-氯-3-甲氧基苯基)-3-甲基-1h-吡咯-2-甲酸甲酯15c(499.72mg,1.7mmol)和1-甲基-1h-咪唑-2-甲腈(217.93mg,2.03mmol)在二噁烷(20ml)中的溶液中添加氢化钠(169.53mg,7.06mmol)。将反应混合物在100℃下加热过夜。冷却至0℃后,将nh4cl溶液(5ml)滴加至反应混合物中,然后用etoac(3×15ml)萃取。将有机萃取物经na2so4干燥,真空浓缩,得到6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(15)(610.0mg,64%纯度,1.06mmol,62.3%产率)。少量通过hplc纯化用于生物测定(100%纯度)。lcms(esi):计算值[m+1]370.1,实测值[m+1]370.01h nmr(dmso-d6,400mhz)δ2.30(s,1h),3.87(s,3h),3.98(s,3h),6.95(d,1h),7.10(s,1h),7.29(d,1h),7.35(dd,1h),7.45(s,1h),7.58(s,1h),11.05(br s,1h)。实施例16:化合物16的合成步骤a:4-氯-6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪16a。向6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(15)(如实施例15步骤c中所述制备,无需纯化即使用)(926.77mg,2.51mmol)在三氯氧磷(3.84g,25.06mmol,2.34ml,10.0当量)中的溶液中添加dipea(972.02mg,7.52mmol,1.31ml,3.0当量)。将反应混合物在100℃下搅拌过夜,然后真空浓缩,用nahco3水溶液洗涤至ph 7并用chcl3(3x15ml)萃取。将合并的有机层经na2so4干燥饼真空浓缩,得到4-氯-6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪16a(1.1g,50.0%纯度,1.42mmol,56.5%产率)。步骤b:6-(2-氯-3-甲氧基苯基)-n-(2-甲氧基乙基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(16)。将4-氯-6-(2-氯-3-甲氧基苯基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪16a(355.6mg,915.91μmol)溶于dmso(7ml)中,并在室温下添加2-甲氧基乙胺(137.6mg,1.83mmol,160.0μl,2.0当量),随后添加dipea(355.12mg,2.75mmol,480.0μl,3.0当量)。将混合物在100℃下加热过夜。然后,将混合物冷却并通过hplc(20%-80%0-6分钟h2o/meoh,流速:30ml/分钟;柱:sunfire c18)纯化,得到呈黄色胶状物的6-(2-氯-3-甲氧基苯基)-n-(2-甲氧基乙基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(16)(34.0mg,8.7%产率,100%纯度)。lcms(esi):计算值[m+1]427.2,实测值[m+1]427.0 1h nmr(dmso-d6,400mhz)δ2.32(s,3h),3.30(s,3h),3.59(t,2h),3.74-3.80(m,2h),3.90(s,3h),3.96(s,3h),6.94-7.00(m,2h),7.16-7.21(m,2h),7.28(s,1h),7.37(t,1h),7.72(s,1h)。实施例17:化合物17的合成步骤a:4-溴-3-苯基-1h-吡咯-2-甲酸甲酯17b。向3-苯基-1h-吡咯-2-甲酸甲酯17a(5.0g,24.85mmol)在thf/h2o4∶1(100ml)中的溶液中添加n-溴代琥珀酰亚胺(4.42g,24.85mmol)。将反应混合物在室温下剧烈搅拌15分钟,然后添加水(50ml)和etoac(200ml)。将反应混合物用两份etoac(100ml)萃取。将有机层合并,经无水硫酸钠干燥并减压浓缩。4-溴-3-苯基-1h-吡咯-2-甲酸甲酯17b(5.0g,70.0%纯度,12.49mmol,50.3%产率)无需纯化即用于下一步骤。步骤b:4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17c。将4-溴-3-苯基-1h-吡咯-2-甲酸甲酯17b(5.0g,17.85mmol)、1-异丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑1c(5.06g,21.42mmol)、[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(1.46g,1.78mmol)、碳酸铯(11.63g,35.7mmol)悬浮于脱气二噁烷∶水(50ml∶10ml)中。将混合物在氩气下在100℃下加热过夜。冷却至室温后,将混合物用乙酸乙酯(100ml)稀释,将有机层用水(100ml)和饱和盐水(100ml)洗涤,经硫酸镁干燥,过滤并真空浓缩,得到4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17c(5.7g,56.0%纯度,10.32mmol,57.8%产率)。步骤c:1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17d。将4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17c(3.2g,10.34mmol)、氢化钠(620.52mg,25.86mmol)在dmf(50ml)中的混合物冷却至0℃并添加o-(二苯基氧膦基)羟胺(2.89g,12.41mmol)。使混合物温热至60℃并搅拌16小时。将混合物倒入冰冷水(150ml)中并用etoac(100ml)萃取。将有机层用水(100ml)洗涤,经na2so4干燥并减压蒸发,在甲基叔丁基醚和己烷(10/3)中结晶后获得1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17d(3.1g,90.0%纯度,6.69mmol,64.7%产率)。步骤d:6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(17)。将1-甲基-1h-咪唑-2-甲腈(990.77mg,9.25mmol)和1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸酯17d(2.5g,7.71mmol)溶于dmf(50ml)中,并添加氢化钠(616.59mg,25.69mmol)。将混合物在80℃下搅拌16小时。然后将混合物蒸发,并将残余物用水(80ml)稀释。将产物用etoac(80ml)萃取。将有机层经na2so4干燥并蒸发,得到6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(17)(2.6g,60.0%纯度,3.91mmol,50.7%产率)。少量物质通过hplc纯化用于生物测定(100%纯度)。lcms(esi):计算值[m+1]400.2,实测值[m+1]400.2 1h nmr(dmso-d6,400mhz)δ1.32(m,6h),4.00(s,3h),4.32(m,1h),5.65(s,1h),7.08(s,1h),7.30(m,5h),7.42(s,1h),7.51(s,1h),7.88(s,1h),11.22(br s,1h)。实施例18:化合物18的合成步骤a:4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a。将原材料6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(17)(如实施例17步骤d中所述制备的粗产物(2.5g,6.26mmol)悬浮于三氯氧磷(9.59g,62.58mmol,5.83ml,10.0当量)中,并在室温下添加dipea(2.43g,18.77mmol,3.27ml,3.0当量)。将反应混合物在100℃下加热16小时。将溶液冷却至室温,减压蒸发,倒入冰(25ml)中并用冰冷氨水(20ml,20%-25%的氨水)稀释,将产物用氯仿(2×50ml)萃取并蒸发。获得呈褐色浆料的4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(2.8g,52.0%纯度,3.48mmol,55.7%产率)。步骤b:rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐(18)。一般程序:将4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(202.8mg,485.29μmol)溶于dmso(2ml)和三乙胺(196.02mg,1.94mmol,270.0μl,4.0当量)中,并在室温下添加适当的相应胺(1.5当量)。将混合物在100℃加热过夜(16小时),冷却并通过hplc纯化。按照一般程序,使用4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(202.8mg,485.29μmol)和作为相应胺的rac(1r,3s)-3-甲氧基环戊-1-胺(1.5当量),生成(在转化为hcl盐之后)rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐(18)(7.00mg,1.70%产率,97%纯度)。lcms(esi):计算值[m+1]497.3,实测值[m+1]497.2 1h nmr(cd3od,400mhz,)61.46-1.53(m,7h),1.60-1.79(m,3h),1.92-2.01(m,1h),2.03-2.16(m,1h),3.01(s,3h),3.73-3.80(m,1h),4.39(s,3h),4.55(p,1h),4.81-4.86(m,1h),5.65(d,1h),7.42-7.49(m,2h),7.54-7.60(m,4h),7.68(d,1h),7.75(d,1h),8.17(s,1h)。实施例19-实施例21:化合物19-21的合成按照实施例18步骤b中描述的一般程序,用氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(202.8mg,485.29μmol)和适当的相应胺(1.5当量),生成表1中所示的实施例化合物(19)-(21)。化合物(19)-(21)的分析数据也示于表1中。实施例22:化合物22的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(22)。一般程序:在ar气氛下,向4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(如实施例18中所述制备)(259.87mg,621.87μmol)和适当的相应胺(518.22μmol,1当量)在无水dmf(5.0ml)中的溶液中添加氢化钠(31.09mg,1.3mmol)。将反应混合物在80℃下搅拌15小时。将混合物冷却,用水(20ml)稀释并浓缩至干。将残余物通过hplc纯化(20%-80%0-6分钟h2o/meoh,流速:30ml/分钟;柱:sunfire c18),得到产物。按照一般程序,使用4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(259.87mg,621.87μmol)和作为相应胺的6-甲氧基嘧啶-4-胺(518.22μmol,1当量),生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(22)(4.60mg,2.30%产率,99%纯度)。lcms(esi):计算值[m+1]507.3,实测值[m+1]507.2 1h nmr(cd3od,400mhz)δ1.49(d,6h),3.95(s,3h),4.12(s,3h),4.44-4.57(m,1h),5.66(d,1h),7.19(s,1h),7.32(s,1h),7.48(d,1h),7.52-7.65(m,5h),8.12(s,1h),8.25(s,2h)。实施例23:化合物23的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(23)。按照实施例22步骤a中描述的一般程序,使用4-氯-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪18a(如实施例18步骤a中所述制备)(259.87mg,621.87μmol)和作为相应胺的6-甲氧基吡啶-2-胺(518.22μmol,1当量),生成6-(1-异丙基-1h-吡唑-3-基)-n-(6-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(23)(6.00mg,2.30%产率,100%纯度)。lcms(esi):计算值[m+1]506.3,实测值[m+1]506.2。实施例24:化合物24的合成步骤a:6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇24a。将吡啶-2-甲腈(1.44g,13.87mmol)和1-氨基-4-(1-异丙基-1h-吡唑-3-基)-3-苯基-1h-吡咯-2-甲酸甲酯17b(如实施例17步骤a中所述制备)(3.75g,11.56mmol)溶于dmf(15ml)中并添加氢化钠(1.16g,48.17mmol)。将混合物在80℃下搅拌并加热16小时。然后将混合物用水(40ml)稀释并用etoac(3×50ml)萃取。将有机层干燥并蒸发,得到6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇24a(5.0g,34.0%纯度,4.29mmol,37.1%产率)。步骤b:4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪24b。将原材料6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇24a(5.0g,12.61mmol)悬浮于三氯氧磷(19.34g,126.13mmol,11.76ml,10.0当量)中并在室温下添加dipea(4.89g,37.84mmol,6.59ml,3.0当量)。将反应混合物在100℃下加热16小时。将溶液冷却至室温,减压蒸发,倒入冰(100ml)中并用冰冷氨水(20ml,20%-25%的氨水)稀释。将产物用氯仿(2×100ml)萃取并减压蒸发,得到呈褐色浆料的4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪24b(6.0g,48.0%纯度,6.94mmol,55%产率)。步骤c:rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(24)。一般程序:将4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪24b(400.0mg,964.11μmol)溶于dmso(7ml)中,并在室温下添加dipea(415.8mg,3.22mmol,560.0μl,4.0当量)和适当的相应胺(1.0当量)。将混合物在100℃下加热过夜,冷却并通过hplc纯化,得到产物。按照一般程序,使用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪24b和作为相应胺的rac(1r,3s)-3-甲氧基环戊-1-胺(1.0当量),生成外消旋rac 6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(24)(7.30mg,1.80%产率,98%纯度)。lcms(esi):计算值[m+1]494.3,实测值[m+1]494.4 1h nmr(cd3od,400mhz)δ1.40-1.51(m,7h),1.56(d,1h),1.66-1.74(m,2h),1.99-2.13(m,2h),3.04(s,3h),3.72-3.81(m,1h),4.49(hept,1h),4.85-4.86(m,1h),5.61(d,1h),7.37-7.48(m,3h),7.48-7.58(m,4h),7.97(td,1h),8.07(s,1h),8.44(d,1h),8.65-8.70(m,1h)。实施例25-实施例27:化合物25-27的合成按照实施例24步骤c中描述的一般程序,用4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-苯基-2-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪24b(400.0mg,964.11μmol)和适当的相应胺(1.0当量),生成表1中所示的实施例化合物(25)-(27)。化合物(25)-(27)的分析数据也示于表1中。实施例28:化合物28的合成步骤a:4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28a。将4-溴-3-苯基-1h-吡咯-2-甲酸甲酯17b(如实施例17步骤a中所述制备)(8.5g,30.34mmol)、2-(2-氯-3-甲氧基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷15a(9.78g,36.41mmol)、碳酸铯(19.77g,60.69mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(2.48g,3.03mmol)在二噁烷/h2o(170/10ml)中的混合物在氩气气氛下在100℃下加热过夜。将反应混合物蒸发,并且将粗制化合物通过快速色谱法(己烷-etoac作为溶剂混合物)进行纯化,得到4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28a(7.7g,85.56%纯度,19.28mmol,63.5%产率)。步骤b:1-氨基-4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28b。在0℃下向4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28a(7.7g,22.53mmol)在dmf(70ml)中的溶液中添加氢化钠(1.8g,75.09mmol)。30分钟后,在0℃下逐份添加氨基二苯基亚膦酸酯(10.51g,45.06mmol)。将反应混合物在60℃下搅拌过夜,然后冷却,过滤并且将滤液减压蒸发,得到1-氨基-4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28b(6.5g,80.22%纯度,14.61mmol,64.9%产率)。步骤c:6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(28)。将1-甲基-1h-咪唑-2-甲腈(3.24g,30.27mmol)和1-氨基-4-(2-氯-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸甲酯28b(9.0g,25.22mmol)溶于dmf(40ml)中并且添加氢化钠(2.52g,105.1mmol)。将混合物在80℃下搅拌加热16小时。然后将混合物蒸发,用水(100ml)稀释并用etoac(3×150ml)萃取。将有机层干燥并蒸发,得到6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(28)(13.0g,50%纯度,15.05mmol,59.7%产率)。少量通过hplc纯化用于生物测定(100%纯度)。lcms(esi):计算值[m+1]432.1,实测值[m+1]432.5 1h nmr(dmso-d6,400mhz)δ3.82(s,3h),4.00(s,3h),6.77(m,1h),7.07(m,1h),7.20(m,7h),7.52(m,1h),7.88(s,1h),11.30(br s,1h)。实施例29:化合物29的合成步骤a:4-氯-6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪29a。将6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(28)(如实施例28步骤c所述制备;粗产物)(13.0g,30.1mmol)悬浮于三氯氧磷(46.15g,301.01mmol,28.06ml,10.0当量)中并在室温下添加dipea(11.67g,90.3mmol,15.73ml,3.0当量)。将反应混合物在100℃下加热16小时。然后,将溶液冷却至室温,减压蒸发,倒入冰(200ml)中并用冰冷氨水(200ml,20%-25%的氨水)稀释。将产物用氯仿(2×200ml)萃取并减压蒸发,得到呈褐色浆料的4-氯-6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪29a(17.0g,36.42%纯度,13.75mmol,45.7%产率)。步骤b:6-(2-氯-3-甲氧基苯基)-n-(2-甲氧基乙基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(29)。一般程序:将4-氯-6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪29a(500.08mg,1.11mmol)溶于dmso(7ml)中,并在室温下添加dipea(430.36mg,3.33mmol,580.0μl,3.0当量)和适当的相应胺(1.33mmol)。将混合物在100℃下加热过夜,冷却并通过hplc(20%-80%0-6分钟h2o/meoh,流速:30ml/分钟;柱:sunfire c18)纯化,得到纯产物。按照一般程序,制备6-(2-氯-3-甲氧基苯基)-n-(2-甲氧基乙基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(29)(30.00mg,5.50%产率,97%纯度)。lcms(esi):计算值[m+1]489.2,实测值[m+1]489.2 1hnmr(dmso-d6,400mhz)δ3.14(s,3h),3.37-3.43(m,2h),3.59-3.64(m,2h),3.83(s,3h),3.98(s,3h),5.83-5.90(m,1h),6.81(d,1h),7.01(s,1h),7.05(d,1h),7.19(t,1h),7.26(d,2h),7.31(s,1h),7.34-7.42(m,3h),7.93(s,1h)。实施例30-实施例34:化合物30-34的合成按照实施例29步骤b中描述的一般程序,用4-氯-6-(2-氯-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪29a(500.08mg,1.11mmol)和适当的相应胺(1.33mmol)生成表1中所示的实施例化合物(30)-(34)。化合物(30)-(34)的分析数据也示于表1中。实施例35:化合物35的合成步骤a:3-溴-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35b。向(r)-吡咯烷-1,2-二甲酸1-叔丁基2-甲酯(40.0g,174.46mmol)在ccl4(500ml)中的溶液中一次性添加n-溴代琥珀酰亚胺(108.68g,610.62mmol)。使反应混合物回流1小时,然后冷却并过滤。蒸发滤液并通过快速色谱法纯化粗制化合物,得到3-溴-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35b(6.37g,20.94mmol,12%产率)。步骤b:3-(丙-1-烯-2-基)-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35c。将3-溴-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35b(6.37g,20.96mmol)、4,4,5,5-四甲基-2-(丙-1-烯-2-基)-1,3,2-二氧杂环戊硼烷(5.28g,31.44mmol,5.91ml,1.5当量)、碳酸钠(4.44g,41.92mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(855.87mg,1.05mmol)于二噁烷/h2o(120/10ml)中的混合物在100℃下在氩气氛下加热过夜。蒸发反应混合物,并通过快速色谱法纯化粗制化合物,得到3-(丙-1-烯-2-基)-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35c(4.2g,80.0%纯度,12.66mmol,60.4%产率)。步骤c:3-异丙基-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35d。将3-(丙-1-烯-2-基)-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35c(2.1g,7.92mmol)溶于meoh(30ml)中并与10%pd/c(0.42g)在h2气氛下在室温下搅拌3小时。将反应混合物脱气并过滤。减压浓缩滤液,得到3-异丙基-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35d(2.05g,78.6%纯度,6.03mmol,76.1%产率)。步骤d:3-异丙基-1h-吡咯-2-甲酸甲酯35e。在0℃下向3-异丙基-1h-吡咯-1,2-二甲酸1-(叔丁基)2-甲酯35d(5.0g,18.7mmol)在dcm(40ml)中的溶液中添加2,2,2-三氟乙酸(31.99g,280.52mmol,21.66ml,15.0当量)。将反应混合物在室温下搅拌过夜,然后减压浓缩,得到3-异丙基-1h-吡咯-2-甲酸甲酯35e(2.9g,44.3%纯度,7.68mmol,41.1%产率)。步骤e:4-溴-3-异丙基-1h-吡咯-2-甲酸甲酯35f。在0℃下向3-异丙基-1h-吡咯-2-甲酸甲酯35e(2.9g,17.34mmol)在dmf(25ml)中的溶液中添加n-溴代琥珀酰亚胺(3.09g,17.34mmol)。将反应混合物在室温下搅拌过夜,然后倒入水中,用etoac萃取三次。将合并的etoac用水和盐水洗涤,经na2so4干燥,并且真空浓缩,得到4-溴-3-异丙基-1h-吡咯-2-甲酸甲酯35f(1.26g,73.0%纯度,3.74mmol,21.6%产率)。步骤f:3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35g。将4-溴-3-异丙基-1h-吡咯-2-甲酸甲酯35f(1.26g,5.12mmol)、1-异丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑1c(1.21g,5.12mmol)、碳酸铯(3.34g,10.24mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(418.19mg,512.08μmol)在二噁烷/h2o(25/3ml)中的混合物在100℃下在氩气氛下加热过夜。将反应混合物蒸发,并且将粗制化合物通过快速色谱法(己烷-etoac作为溶剂混合物)进行纯化,得到3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35g(1.28g,68.1%纯度,3.17mmol,61.8%产率)。步骤g:1-氨基-3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35h。在0℃下向3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35g(513.97mg,1.87mmol)在dmf(20ml)中的溶液中添加氢化钠(149.32mg,6.22mmol)。30分钟后,在0℃下逐份添加氨基二苯基亚膦酸酯(870.61mg,3.73mmol)。将反应混合物在60℃下搅拌过夜,然后冷却,过滤并且将滤液减压蒸发,得到1-氨基-3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35h(550.0mg,63.31%纯度,1.2mmol,64.2%产率)。步骤h:5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇35i。将1-氨基-3-异丙基-4-(1-异丙基-1h-吡唑-3-基)-1h-吡咯-2-甲酸甲酯35h(549.84mg,1.89mmol)和1-甲基-1h-咪唑-2-甲腈(243.4mg,2.27mmol)溶于二噁烷(20ml)中,并在0℃下添加氢化钠(189.35mg,7.89mmol)。将反应混合物在80℃下加热过夜。冷却至0℃后,将nh4cl溶液(5ml)滴加至反应混合物中,然后用etoac(3×15ml)萃取。将有机萃取物经na2so4干燥,真空浓缩,得到5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇35i(620.0mg,58.7%纯度,995.92μmol,52.6%产率)。步骤i:4-氯-5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪35j。向在三氯氧磷(2.61g,17.04mmol,1.59ml,10.0当量)中的5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇35i(622.57mg,1.7mmol)中添加dipea(660.38mg,5.11mmol,890.0μl,3.0当量)。将反应混合物在100℃下搅拌过夜,然后真空浓缩,用nahco3溶液洗涤至ph 7并用chcl3(3x15ml)萃取。将合并的chcl3经na2so4干燥,并真空浓缩,得到4-氯-5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪35j(800.0mg,43.7%纯度,910.71μmol,53.5%产率)。步骤j:5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-n-(2-甲氧基乙基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(35)。一般程序:向4-氯-5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪35j(411.56mg,1.07mmol)和适当的相应胺(1.5当量)在dmso(5ml)中的溶液中添加dipea(415.52mg,3.22mmol,560.0μl,3.0当量)。将反应混合物在90℃下搅拌过夜。通过hplc(2-10分钟60%-75%甲醇,流速30ml/分钟(泵装载4ml/分钟甲醇),柱sun fire c18 100×19mm)纯化产物,得到产物。按照一般程序,制备5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-n-(2-甲氧基乙基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(35)(13.20mg,2.80%产率,100%纯度)。lcms(esi):计算值[m+1]423.3,实测值[m+1]423.4 1h nmr(dmso-d6,400mhz)δ1.30-1.39(m,6h),1.46(d,6h),3.31(s,3h),3.61(t,2h),3.70-3.83(m,3h),3.94-4.01(m,3h),4.46-4.60(m,1h),6.40(d,1h),6.97(s,1h),7.27(s,1h),7.77(d,1h),7.82(s,1h)。实施例36:化合物36的合成步骤a:rac 5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(36)。按照实施例35步骤j中描述的一般程序,将5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪35j(如实施例35步骤i中所述制备)转化为rac 5-异丙基-6-(1-异丙基-1h-吡唑-3-基)-n-((1r,3s)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(36)(12.70mg,2.60%产率,100%纯度)。lcms(esi):计算值[m+1]463.3,实测值[m+1]463.4 1h nmr(dmso-d6,400mhz)δ1.33-1.40(m,6h),1.46(d,6h),1.80-2.03(m,6h),3.29(s,3h),3.61-3.74(m,1h),3.94-4.00(m,4h),4.46-4.61(m,1h),4.84-4.92(m,1h),6.40(d,1h),6.98(s,1h),7.28(s,1h),7.77(d,1h),7.81(s,1h)。实施例37:化合物37的合成步骤a:1-氨基-3-甲基-1h-吡咯-2-甲酸甲酯37a。在0℃下向3-甲基-1h-吡咯-2-甲酸甲酯(15.0g,107.8mmol)在dmf(200ml)中的溶液中添加氢化钠(8.62g,359.33mmol)。1小时后,添加氨基二苯基亚膦酸酯(50.28g,215.6mmol)。将反应混合物在60℃下搅拌过夜,然后冷却,过滤并且将滤液减压蒸发,得到1-氨基-3-甲基-1h-吡咯-2-甲酸甲酯37a(12.9g,80.0%纯度,66.94mmol,62.1%产率)。步骤b:5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇37b。将氢化钠(6.23g,259.45mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-3-甲基-1h-吡咯-2-甲酸甲酯37a(12.0g,77.84mmol)和1-甲基-1h-咪唑-2-甲腈(8.34g,77.84mmol,8.34ml,1.0当量)在二噁烷(20ml)中的溶液中。将反应混合物加热至回流,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2×1o ml)洗涤并真空干燥。获得5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇37b(9.5g,41.44mmol,53.2%产率)。步骤c:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪37c。将5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇37b(1.0g,4.36mmol)溶于三氯氧磷(8.02g,52.32mmol,4.88ml,12.0当量)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3水溶液中和。通过过滤收集形成的沉淀物,用水(2×5ml)洗涤并真空干燥。获得4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪37c(450.0mg,1.82mmol,41.7%产率)。步骤d:5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺三氟乙酸盐(37)。将4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪37c(250.0mg,1.01mmol)溶于20ml 10%nh3的ipa溶液中。将混合物在密封管中加热48小时,然后蒸发并将残余物在水中研磨。将固体过滤并通过hplc(2-10分钟10%-50%meoh+tfa,流速30ml/分钟(泵装载4ml/分钟水),柱sun fire c18 100×19mm)纯化。获得5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺三氟乙酸盐(37)(5.4mg,23.66μmol,2.3%产率,100%纯度)。lcms(esi):计算值[m+1]229.1,实测值[m+1]229.1 1h nmr(dmso-d6,400mhz)δ2.55(s,3h),4.31(s,3h),6.61(s,1h),7.62(m,3h)。实施例38:化合物38的合成步骤a:n-(6-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(38)。将氢化钠(24.15mg,1.01mmol)(60%在矿物油中)逐份(在3分钟内)添加到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪37c(如实施例37步骤c中所述制备)(99.7mg,402.55μmol)和6-甲氧基吡啶-2-胺(74.96mg,603.82μmol)在dmf(2ml)中的溶液中。将反应混合物加热至100℃,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入氯化铵(64.6mg,1.21mmol)在水中的冷溶液中。通过过滤收集形成的沉淀物,用水(2×10ml)洗涤并通过hplc(2-10分钟55%-80%甲醇+nh3,流速30ml/分钟(泵装载4ml/分钟甲醇),柱sun fire c18 100×19mm)纯化。获得n-(6-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(38)(15.8mg,47.11μmol,11.7%产率)(15.80mg,11.70%产率,100%纯度)。lcms(esi):计算值[m+1]336.2,实测值[m+1]336.2 1h nmr(dmso-d6,400mhz):δ(ppm)2.56(s,3h),4.00(s,3h),4.12(s,3h),6.40(m,1h),6.50(d,1h),6.75(d,1h),7.08(m,1h),7.50(m,2h),7.68(dd,1h),13.10(m,1h)。实施例39:化合物39的合成步骤a:1-氨基-3-苯基-1h-吡咯-2-甲酸乙酯39b。在0℃下向1-氨基-3-苯基-1h-吡咯-2-甲酸乙酯39a(12.0g,55.75mmol)在dmf(150ml)中的溶液中添加氢化钠(4.46g,185.82mmol)。30分钟后,在0℃下逐份添加氨基二苯基亚膦酸酯(26.0g,111.49mmol)。将反应混合物在60℃下搅拌过夜,然后冷却,过滤并且将滤液减压蒸发,得到1-氨基-3-苯基-1h-吡咯-2-甲酸乙酯39b(15.9g,45.28%纯度,31.27mmol,56.1%产率)。步骤b:2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(39)。将1-氨基-3-苯基-1h-吡咯-2-甲酸乙酯39b(15.0g,65.14mmol)和1-甲基-1h-咪唑-2-甲腈(8.37g,78.17mmol)溶于二噁烷(150ml)中并且在0℃下添加氢化钠(6.51g,271.43mmol)。将反应混合物在100℃下加热过夜。冷却至0℃后,将nh4cl溶液(25ml)滴加至反应混合物中,然后用etoac(3×75ml)萃取。将有机萃取物经na2so4干燥,真空浓缩。将产物从mtbe中重结晶,得到2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(39)(7.9g,85%纯度,23.14mmol,35.5%产率)。少量通过hplc纯化用于生物测定(100%纯度)。计算值[m+1]292.1,实测值[m+1]292.0 1h nmr(dmso-d6,400mhz):δ(ppm)4.03(s,3h),6.83(d,1h),7.14(d,1h),7.32(m,1h),7.39(m,2h),7.50(d,1h),7.72(m,1h),7.82(m,2h)。实施例40:化合物40的合成步骤a:4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪40a。向2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇(39)(如实施例39步骤b中所述制备;粗产物)(500.32mg,1.72mmol)中添加三氯氧磷(2.63g,17.17mmol,1.6ml,10.0当量)。将反应混合物在100℃下搅拌过夜,然后真空浓缩,用nahco3水溶液洗涤至ph 7并用chcl3(3x15ml)萃取。将合并的chcl3经na2so4干燥,并真空浓缩,得到4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪40a(500.0mg,92.0%纯度,1.49mmol,86.5%产率)。步骤b:n-(6-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(40)。一般程序:在0℃下向dmf(10ml)中适当的相应胺(1.1当量)中添加氢化钠(52.23mg,2.18mmol)。30分钟后,添加4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪40a(269.67mg,870.59μmol)。将反应混合物在50℃下搅拌过夜。通过hplc(2-10分钟60%-85%甲醇+nh3,流速30ml/分钟(泵装载4ml/分钟甲醇),柱sunfire c18100×19mm)纯化产物,得到纯产物。按照一般程序,获得n-(6-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(40)(32.90mg,9.00%产率,100%纯度)。lcms(esi):计算值[m+1]398.2,实测值[m+1]398.2 1h nmr(dmso-d6,400mhz):δ(ppm)3.68(s,3h),4.00(s,3h),6.53(d,1h),6.95(m,1h),7.12(m,1h),7.41(m,1h),7.52(m,1h),7.65(m,4h),7.75(dd,1h),8.03(m,2h),8.33(d,1h)。实施例41:化合物41的合成步骤a:2-(1-甲基-1h-咪唑-2-基)-5-苯基-4-(2-(吡咯烷-1-基)乙氧基)吡咯并[2,1-f][1,2,4]三嗪(41)。按照实施例40步骤b中描述的一般程序,除了使用2-(吡咯烷-1-基)乙-1-醇代替胺外,用4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪40a(如实施例40步骤a中所述制备)生成2-(1-甲基-1h-咪唑-2-基)-5-苯基-4-(2-(吡咯烷-1-基)乙氧基)吡咯并[2,1-f][1,2,4]三嗪(41)(12.90mg,4.90%产率,97%纯度)。lcms(esi):计算值[m+2]/2=195.1,实测值[m+2]/2=195.2 1h nmr(dmso-d6,400mhz)δ1.60-1.66(m,4h),2.39-2.44(m,4h),2.81(t,2h),4.02(s,3h),4.65(t,2h),7.05(d,1h),7.06(d,1h),7.32(t,1h),7.37(s,1h),7.40(t,2h),7.69(s,1h),7.71(d,1h),8.08(d,1h)。实施例42:化合物42的合成步骤a:3-苯基-1h-吡咯-2-甲酸乙酯42b。在ar下向乙炔基苯42a(40.0g,391.65mmol)在nmp(400ml)中的溶液中添加碳酸银(10.8g,39.16mmol)和2-异氰基乙酸乙酯(66.45g,587.47mmol)。将反应混合物在80℃下搅拌过夜,然后冷却并过滤。向滤液中添加水(400ml)并用dcm(400ml)萃取一次。用水(10*150ml)洗涤dcm。将有机层干燥并减压蒸发。通过快速色谱法(sio2,己烷-mtbe作为溶剂混合物)纯化粗制化合物,得到3-苯基-1h-吡咯-2-甲酸乙酯42b(5.4g,89.0%纯度,22.33mmol,5.7%产率)。步骤b:4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42c。向3-苯基-1h-吡咯-2-甲酸乙酯42b(5.4g,25.09mmol)在dmf(50ml)中的溶液中添加n-溴代琥珀酰亚胺(4.46g,25.09mmol),用冰冷却。将反应混合物在室温(rt)下搅拌过夜,然后倒入水(150ml)中。用tbme(3*75ml)萃取产物。将合并的tbme用水(5*50ml)洗涤,干燥并减压蒸发,得到4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42c(5.8g,70.9%纯度,13.98mmol,55.7%产率)。步骤c:4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42d.将4-溴-3-苯基-1h-吡咯-2-甲酸酯42c(5.7g,19.38mmol)、2-氟-3-甲氧基苯基硼酸(3.29g,19.38mmol)、碳酸铯(12.63g,38.76mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(1.58g,1.94mmol)的混合物在100℃下在氩气气氛下加热过夜。蒸发反应混合物并通过快速色谱法(sio2,己烷-mtbe作为溶剂混合物)纯化粗制化合物,得到4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42d(3.3g,82.5%纯度,8.02mmol,41.4%产率)。步骤d:1-氨基-4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42e。在0℃下向4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42d(2.2g,6.48mmol)在dmf(30ml)中的溶液中添加氢化钠(337.02mg,14.04mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(1.68g,8.43mmol)。将反应混合物在室温(rt)下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*25ml)萃取,将合并的etoac用水(7*15ml)洗涤,干燥并减压蒸发,得到1-氨基-4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42e(2.3g,78.1%纯度,5.07mmol,78.2%产率)。步骤e:6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇42f。在用冰冷却下,向1-氨基-4-(2-氟-3-甲氧基苯基)-3-苯基-1h-吡咯-2-甲酸乙酯42e(3.3g,9.31mmol)和1-甲基-1h-咪唑-2-甲腈(997.34mg,9.31mmol)在二噁烷(35ml)中的混合物中添加氢化钠(744.81mg,31.04mmol)。将反应混合物在80℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*20ml)萃取,干燥并减压蒸发,得到6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇42f(4.0g,51.6%纯度,4.97mmol,53.4%产率)。步骤f:4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪42g。将原材料6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇42f(4.0g,9.62mmol)悬浮于三氯氧磷(14.76g,96.23mmol,8.97ml,10.0当量)中,并在室温下添加乙基双(丙-2-基)胺(3.73g,28.87mmol,5.03ml,3.0当量)。将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3水溶液中,并将产物用氯仿(3*50ml)萃取,蒸发,得到4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪42g(3.1g,53.5%纯度,3.82mmol,39.7%产率)。步骤h:6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(42)。将4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪42g(248.89mg,573.66μmol)、(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(78.94mg,573.66μmol)和乙基双(丙-2-基)胺(222.6mg,1.72mmol,300.0μl,3.0当量)在dmso(5ml)中的混合物在100℃下加热18小时,然后冷却并通过hplc(2-10分钟30-60 h2o-meoh+nh3;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun fire c18)纯化,得到呈黄色胶状物的6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(42)(20.3mg,95.0%纯度,38.68μmol,6.7%产率)。lcms(esi):计算值[m+1]499.3,实测值[m+1]499.2。实施例43:化合物43的合成步骤a:rac 6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(43)。将4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪42g(如实施例42步骤f中所述制备)(198.91mg,458.47μmol)、rac(1r,3r)-3-甲氧基环戊-1-胺盐酸盐(69.52mg,458.47μmol)和乙基双(丙-2-基)胺(178.08mg,1.38mmol,240.0μl,3.0当量)在dmso(5.0ml)中的混合物在100℃下加热18小时,然后通过hplc(2-10分钟30-60h2o-meoh+nh3;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun firec18)纯化,得到呈黄色胶状物的rac6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(43)(16.6mg,95.0%纯度,30.77μmol,6.7%产率)。lcms(esi):计算值[m+1]513.3,实测值[m+1]513.2。实施例44:化合物44的合成步骤a:6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-(2-甲氧基乙氧基)环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(44)。将4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪42g(250.0mg,576.22μmol)、(1r,3r)-3-(2-甲氧基乙氧基)环丁-1-胺(83.76mg,576.85μmol)和乙基双(丙-2-基)胺(223.66mg,1.73mmol)在dmso(5ml)中的混合物在100℃下加热18小时,然后冷却并通过hplc(2-10分钟40%-70%h2o-乙腈+nh3;泵装载4.0ml甲醇),柱:sun fire c18)纯化,得到呈浅褐色胶状物的6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-(2-甲氧基乙氧基)环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(44)(20.8mg,95.0%纯度,36.42μmol,6.3%产率)。lcms(esi):计算值[m+1]433.2,实测值[m+1]433.2 1h nmr(400mhz,cd3od)δ1.85(m,2h),2.37(m,2h),3.35(s,3h),3.45(m,2h),3.51(m,2h),3.86(s,3h),3.99(quin,1h),4.10(s,3h),4.65(quin,1h),6.67(dd,1h),6.90(m,2h),7.09(d,1h),7.20(m,1h),7.45(m,5h),7.89(d,1h)。实施例45:化合物45的合成步骤a:3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45b。在ar下向2-乙炔基吡啶45a(38.0g,368.5mmol)在nmp(400ml)中的溶液中添加碳酸银(10.16g,36.85mmol)和2-异氰基乙酸乙酯(50.02g,442.2mmol)。将反应混合物在80℃下搅拌过夜,然后冷却并过滤。向滤液中添加水(300ml)并用dcm(400ml)萃取一次。用水(10*150ml)洗涤dcm。将有机层干燥并减压蒸发。通过快速色谱法(sio2,己烷-mtbe作为溶剂混合物)纯化粗制化合物,得到3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45b(53.0g,92.9%纯度,227.7mmol,61.8%产率)。步骤b:4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45c。在用冰冷却下,向3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45b(11.5g,53.18mmol)在dmf(100ml)中的溶液中添加n-溴代琥珀酰亚胺(8.52g,47.86mmol)。将反应混合物在室温(rt)下搅拌过夜,然后倒入水(200ml)中。将产物用tbme(3*100ml)萃取,将合并的tbme用水(5*50ml)洗涤,干燥并减压蒸发,得到4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45c(11.3g,68.4%纯度,26.19mmol,49.2%产率)。步骤c:1-氨基-4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45d。在0℃下向4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45c(15.7g,53.2mmol)在dmf(150ml)中的溶液中添加氢化钠(2.77g,115.26mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(13.77g,69.16mmol)。将反应混合物在室温(rt)下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*75ml)萃取,将合并的etoac用水(7*30ml)洗涤,干燥并减压蒸发,得到1-氨基-4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酯45d(16.0g,49.6%纯度,25.59mmol,48.1%产率)。步骤d:6-溴-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇45e。在用冰冷却下,向1-氨基-4-溴-3-(吡啶-2-基)-1h-吡咯-2-甲酸乙酉旨45d(16.0g,51.59mmol)和1-甲基-1h-咪唑-2-甲腈(5.53g,51.59mmol)在二噁烷(200ml)中的混合物中添加氢化钠(4.13g,171.96mmol)。将反应混合物在80℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*100ml)萃取,干燥并减压蒸发,得到6-溴-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇45e(14.5g,49.3%纯度,19.26mmol,37.3%产率)。步骤e:6-溴-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪45f。将原材料6-溴-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇45e(14.5g,39.06mmol)悬浮于三氯氧磷(59.89g,390.62mmol,36.41ml,10.0当量)中并将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3水溶液中,将产物用氯仿(3*50ml)萃取并蒸发,得到6-溴-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪45f(8.0g,51.2%纯度,10.51mmol,26.9%产率)。步骤f:6-溴-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺45g。将6-溴-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪45f(298.45mg,765.97μmol)、(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(105.4mg,765.98μmol)和乙基双(丙-2-基)胺(296.8mg,2.3mmol,400.0μl,3.0当量)在dmso(5ml)中的混合物在100℃下加热18小时。然后,将混合物冷却并通过hplc(2-10分钟50%-85%h2o-甲醇+nh3;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun fire c18)纯化,得到6-溴-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺45g(29.5mg,98.0%纯度,63.63μmol,8.3%产率)。步骤g:6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(45)。在ar下将6-溴-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺45g(30.0mg,66.03μmol)、2-氟-3-甲氧基苯基硼酸(13.47mg,79.27μmol)、碳酸铯(43.05mg,132.12μmol)和pd(dppf)cl2(5.39mg,6.61μmol)溶于脱气二噁烷(1.0ml)中。经由注射器添加0.05ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过hplc(2-10分钟10-70%h2o-甲醇+fa;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun fire c18)。获得呈浅褐色固体的6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(45)(2.4mg,4.8μmol,7.3%产率)。lcms(esi):计算值[m+1]500.2,实测值[m+1]500.0。实施例46:化合物46的合成步骤a:rac 6-溴-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺46a。将6-溴-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪45f(如实施例45步骤e中所述制备)(300.0mg,769.95μmol)、rac(1r,3r)-3-甲氧基环戊-1-胺(88.77mg,770.79μmol)和乙基双(丙-2-基)胺(298.86mg,2.31mmol)在dmso(5ml)中的混合物在100℃下加热18小时,然后冷却并通过hplc(2-10分钟50-85%h2o-甲醇+nh3;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun fire c18)纯化,得到rac 6-溴-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺46a(46.7mg,97.7%纯度,97.42μmol,12.6%产率)。步骤b:rac 6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(46)。在ar下将rac 6-溴-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺46a(47.0mg,100.35μmol)、2-氟-3-甲氧基苯基硼酸(20.45mg,120.36μmol)、碳酸铯(65.36mg,200.59μmol)和pd(dppf)cl2(8.19mg,10.03μmol)溶于脱气二噁烷(1.0ml)中。经由注射器添加0.05ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过hplc(2-10分钟55-85%h2o-甲醇+nh3;流速30ml/分钟;(泵装载4.0ml甲醇),柱:sun fire c18)纯化。获得呈米色固体的rac 6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环戊基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(46)(0.017g,34.84μmol,36.5%产率)。lcms(esi):计算值[m+1]514.3,实测值[m+1]514.2。实施例47:化合物47的合成步骤a:3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47b。在氩气下,向3-乙炔基-1-甲基-1h-吡唑47a(15.0g,141.34mmol)在nmp(200ml)中的溶液中添加碳酸银(3.9g,14.13mmol)和2-异氰基乙酸乙酯(20.78g,183.75mmol)。将反应混合物在80℃下搅拌过夜,然后冷却并过滤。向滤液中添加水(200ml)并用dcm(200ml)萃取一次。用水(10*75ml)洗涤dcm。将有机层干燥并减压蒸发。通过快速色谱法(sio2,己烷-mtbe作为溶剂混合物)纯化粗制化合物,得到3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47b(7.3g,91.7%纯度,30.53mmol,21.6%产率)。步骤b:4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸酯乙基4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47c。在用冰冷却下,向3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47b(7.3g,33.3mmol)在dmf(80ml)中的溶液中逐份添加n-溴代琥珀酰亚胺(5.93g,33.3mmol)。将反应混合物在室温下搅拌过夜,然后倒入水(40ml)中,用tbme(3*50ml)萃取。将合并的tbme用水(5*20ml)洗涤,干燥并减压蒸发,得到4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47c(8.1g,72.0%纯度,19.56mmol,58.7%产率)。步骤c:4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47d。将4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯4-溴-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47c(8.1g,27.17mmol)、2-氟-3-甲氧基苯基硼酸(5.08g,29.88mmol)、氟化钾(4.74g,81.5mmol)、乙酸钯(ii)(452.26mg,2.72mmol)和双(金刚烷-1-基)(丁基)磷烷(1.95g,5.43mmol)在二噁烷/h2o(160ml/10ml)中的混合物在100℃下在氩气气氛下加热过夜。蒸发反应混合物并通过快速色谱法(3io2,己烷-mtbe作为溶剂混合物)纯化粗制化合物,得到4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47d(5.5g,76.2%纯度,12.21mmol,44.9%产率)。步骤d:1-氨基-4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47e。在0℃下向4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47d(5.5g,16.02mmol)在dmf(75ml)中的溶液中添加氢化钠(832.96mg,34.71mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(4.15g,20.83mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*50ml)萃取,将合并的etoac用水(7*20ml)洗涤,干燥并减压蒸发,得到1-氨基-4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47e(5.6g,60.1%纯度,9.39mmol,58.6%产率)。步骤e:6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇47f。向1-氨基-4-(2-氟-3-甲氧基苯基)-3-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯47e(5.6g,15.63mmol)和1-甲基-1h-咪唑-2-甲腈(1.67g,15.63mmol)在二噁烷(75ml)中的混合物中添加氢化钠(1.25g,52.09mmol),用冰冷却。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*50ml)萃取,干燥并减压蒸发,得到6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇47f(4.5g,40.8%纯度,4.38mmol,28%产率)。步骤f:4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪47g。将原材料6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇47f(1.0g,2.38mmol)悬浮于三氯氧磷(3.66g,23.84mmol)中,并在室温下添加乙基双(丙-2-基)胺(924.48mg,7.15mmol)。将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3溶液中,将产物用氯仿(3*20ml)萃取并蒸发,得到4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪47g(500.0mg,40.5%纯度,462.48μmol,19.4%产率)。步骤g:6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(47)。将4-氯-6-(2-氟-3-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪47g(500.0mg,1.14mmol)、(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(157.17mg,1.14mmol)和乙基双(丙-2-基)胺(442.86mg,3.43mmol)在dmso(5ml)中的混合物在100℃下搅拌过夜。将粗产物通过hplc(2-10分钟30%-50%h2o-mecn+nh3;流速30ml/分钟((泵装载4ml mecn);柱:sunfire c18100*195μm)纯化,得到呈浅褐色固体的6-(2-氟-3-甲氧基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(47)(34.9mg,95.0%纯度,65.97μmol,5.8%产率)。lcms(esi):计算值[m+1]503.2,实测值[m+1]503.2.1h nmr(dmso-d6,400mhz)δ2.40(m,4h),3.18(s,3h),3.87(s,3h),3.95(m,6h),4.15(m,1h),4.65(m,1h),5.51(m,1h),6.93(dd,1h),7.00(s,1h),7.19(m,2h),7.30(d,1h),7.65(d,1h),7.85(d,1h),11.15(d,1h)。实施例48:化合物48的合成步骤a:3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48b。将4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b(如实施例1步骤a中所述制备)(2.35g,8.87mmol)、3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶48a(2.0g,9.75mmol)、碳酸铯(5.78g,17.73mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(723.97mg,886.53μmol)在二噁烷/h2o(20ml/3ml)中的混合物在氩气气氛下在100℃下加热过夜。蒸发反应混合物,并通过快速色谱法(sio2,己烷-atoac作为溶剂混合物)纯化粗制化合物,得到3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48b(1.0g,84.5%纯度,3.91mmol,44.1%产率)。步骤b:1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48c。在0℃下向3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48b(1g,4.62mmol)在dmf(20ml)中的溶液中添加氢化钠(240.36mg,10.02mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(1.2g,6.01mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*20ml)萃取,将合并的etoac用水(7*10ml)洗涤,干燥并减压蒸发,得到1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48c(1.05g,96.8%纯度,4.4mmol,95.1%产率)。步骤c:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇48d。在用冰冷却下,向1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸甲酯48c(1.05g,4.54mmol)和1-甲基-1h-咪唑-2-甲腈(486.4mg,4.54mmol)在二噁烷(30ml)中的混合物中添加氢化钠(363.24mg,15.14mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*20ml)萃取,干燥并减压蒸发,得到5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇48d(1.0g,57.5%纯度,1.88mmol,41.3%产率)。步骤d:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪48e。将原材料5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇48d(998.85mg,3.26mmol)悬浮于三氯氧磷(5.0g,32.61mmol,3.04ml,10.0当量)中并将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3溶液中,将产物用氯仿(3*20ml)萃取并蒸发,得到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪48e(600.0mg,79.7%纯度,1.47mmol,45.2%产率)。步骤e:n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(48)。在用冰冷却下,向4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪48e(600.0mg,1.85mmol)和6-甲氧基嘧啶-4-胺(231.23mg,1.85mmol)在dmf(15ml)中的混合物中添加氢化钠(147.82mg,6.16mmol)。将反应混合物在室温下搅拌过夜,然后倒入水中,用etoac(3*15ml)萃取,在na2so4下干燥并蒸发。将粗产物通过hplc(2-10分钟30%-80%h2o-mecn;流速30ml/分钟(泵装载4ml mecn),柱:sunfire100*19mm,5μm)纯化,得到呈粉红色固体的n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(48)(27.1mg,95.0%纯度,62.27μmol,3.4%产率)。lcms(esi):计算值[m+1]414.2,实测值[m+1]414.2。实施例49:化合物49的合成步骤a:3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49b。将4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b(如实施例1步骤a中所述制备)(3.0g,11.32mmol)、4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶49a(2.55g,12.45mmol)、碳酸铯(7.38g,22.64mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(924.51mg,1.13mmol)在二噁烷/h2o(20ml/3ml)中的混合物在氩气气氛下在100℃下加热过夜。将反应混合物蒸发,并且将粗制化合物通过快速色谱法纯化,得到3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49b(850.0mg,83.8%纯度,3.29mmol,29.1%产率)。步骤b:1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49c。在0℃下向3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49b(849.98mg,3.93mmol)在dmf(20ml)中的溶液中添加氢化钠(204.38mg,8.52mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(1.02g,5.11mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*25ml)萃取,将合并的etoac用水(7*15ml)洗涤,干燥并减压蒸发,得到1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49c(760.0mg,68.8%纯度,2.26mmol,57.5%产率)。步骤c:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇49d。在用冰冷却下,向1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸甲酯49c(760.21mg,3.29mmol)和1-甲基-1h-咪唑-2-甲腈(352.12mg,3.29mmol)在二噁烷(20ml)中的混合物中添加氢化钠(262.97mg,10.96mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*20ml)萃取,干燥并减压蒸发,得到5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇49d(720.0mg,82.2%纯度,1.93mmol,58.8%产率)。步骤d:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪49e。将原材料5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇49d(719.66mg,2.35mmol)悬浮于三氯氧磷(3.6g,23.5mmol,2.19ml,10.0当量)中并将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3溶液中,将产物用氯仿(3*20ml)萃取并蒸发,得到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪49e(60.0mg,53.7%纯度,99.21μmol,4.2%产率)。步骤e:n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(49)。在用冰冷却下,向4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪49e(60.01mg,184.79μmol)和6-甲氧基嘧啶-4-胺(23.12mg,184.79μmol)在dmf(5ml)中的混合物中添加氢化钠(14.78mg,615.98μmol)。将反应混合物在室温下搅拌过夜,然后倒入水中,用etoac(3*10ml)萃取,在na2so4下干燥并蒸发。将粗产物通过hplc(2-10分钟50-85%h2o-甲醇+nh3;流速30ml/分钟(泵装载4ml mecn),柱:sunfire 100*19mm,5μm)纯化,得到呈浅褐色胶状物的n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(49)(4.3mg,95.0%纯度,9.88μmol,5.3%产率)。lcms(esi):计算值[m+1]414.2,实测值[m+1]414.2。实施例50:化合物50的合成步骤a:4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50c。在ar下将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如同实施例1步骤a中4-碘-3-甲基-1h-吡咯-2-甲酸甲酯1b一样制备,除了用3-甲基-1h-吡咯-2-甲酸乙酯代替3-甲基-1h-吡咯-2-甲酸甲酯1a开始以外)(4.5g,16.12mmol)、2-甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶50b(4.55g,19.35mmol)、pd(dppf)cl2(1.32g,1.61mmol)和碳酸铯(10.51g,32.25mmol)悬浮在脱气二噁烷(90ml)中。经由注射器添加4.5ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过柱色谱法(sio2,用hex∶etoac 20∶1至1∶2洗脱)纯化。获得呈浅黄色粉末的4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50c(1.0g,3.84mmol,23.8%产率)。步骤b:1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50d。在0℃下向4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50c(1.0g,3.84mmol)在dmf(20ml)中的溶液中添加氢化钠(199.82mg,8.33mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(994.8mg,5.0mmol)。将反应混合物在室温(rt)下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*25ml)萃取,将合并的etoac用水(7*15ml)洗涤,干燥并减压蒸发,得到1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50d(1.1g,80.9%纯度,3.23mmol,84.1%产率)。步骤c:6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇50e。将氢化钠(319.64mg,13.32mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯50d(1.1g,4.0mmol)和1-甲基-1h-咪唑-2-甲腈(428.01mg,4.0mmol)在二噁烷(5ml)中的溶液中。将反应混合物加热至回流,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*10ml)洗涤并真空干燥。获得6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇50e(400.0mg,1.19mmol,29.8%产率)。步骤d:4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪50f。将6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇50e(150.0mg,445.97μmol)溶于三氯氧磷(819.4mg,5.34mmol,500.0μl,12.0当量)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空干燥。获得4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪50f(100.0mg,80.0%纯度,225.48μmol,50.6%产率)。步骤e:6-(2-甲氧基吡啶-4-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(50)。将氢化钠(18.04mg,751.66μmol)(60%在矿物油中)逐份添加到4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪50f(100.0mg,281.85μmol)和6-甲氧基嘧啶-4-胺(28.22mg,225.5μmol)在dmf(1ml)中的溶液中。将混合物在室温下搅拌16小时。将混合物用浓nh4cl水溶液淬灭。通过过滤收集形成的沉淀物,用水(2*3ml)洗涤并通过hplc(2-10分钟40-55%h2o-mecn+nh3;流速30ml/分钟(泵装载4.0ml mecn+nh3);柱:sunfire100*19mm,5μm)。获得呈黄色固体的6-(2-甲氧基吡啶-4-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(50)(16.0mg,36.08μmol,16%产率)。lcms(esi):计算值[m+1]444.2,实测值[m+1]444.2.1h nmr(dmso-d6,400mhz)δ2.76(s,3h),3.14(s,3h),3.80-3.85(m,6h),6.72(d,1h),6.90(m,2h),7.12(m,2h),7.72(s,1h),8.13(d,1h),8.32(s,1h)。实施例51-实施例61:化合物51-61的合成按照实施例1步骤g中描述的一般程序,用适当的相应胺(505.37μmol,1.2当量)处理4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol),生成表1中所示的实施例化合物(51)-(62)。化合物(51)-(62)的分析数据也示于表1中。实施例63:化合物63的合成n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(63)化合物63根据与上文描述的那些类似的制备。(100%纯度)lcms(esi):计算值[m+1]417.2,实测值[m+1]417.2实施例64:化合物64的合成6-(1-乙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(64)根据类似于上文描述的方法制备化合物64。(97%纯度)lcms(esi):计算值[m+1]431.2,实测值[m+1]431.2实施例65:化合物65的合成6-(6-甲氧基吡啶-2-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(65)。根据类似于上文描述的方法制备化合物65。(100%纯度)lcms(esi):计算值[m+1]444.2,实测值[m+1]444.0实施例66:化合物66的合成6-(6-甲氧基吡啶-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(66)根据类似于上文描述的方法制备化合物66。(94%纯度)lcms(esi):计算值[m+1]444.2,实测值[m+1]444.2.实施例67-实施例93:化合物67-93的合成按照实施例1步骤g中描述的一般程序,用适当的相应胺(505.37μmol,1.2当量)处理4-氯-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪1g(150.0mg,421.56μmol),生成表1中所示的实施例化合物(67)-(93)。化合物(67)-(93)的分析数据也示于表1中。实施例94:化合物94的合成n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(94)化合物94使用与实施例1、实施例48、实施例49和实施例50中描述的那些相似的程序制备。(100%纯度)lcms(esi):计算值[m+1]414.1,实测值[m+1]414.2实施例95:化合物95的合成6-(1-(二氟甲基)-1h-吡唑-3-基)-n-(4-甲氧基嘧啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(95)化合物95使用与实施例1、实施例48、实施例49和实施例50中描述的那些相似的程序制备。(95%纯度)lcms(esi):计算值[m+1]453.1,实测值[m+1]453.2。实施例96:化合物96的合成n-(4-(2-(二甲基氨基)乙氧基)嘧啶-2-基)-6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(96)化合物96使用与前述实施例中描述的那些相似的程序制备。实施例97:化合物97的合成2-((6-((6-(1-异丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-基)氨基)嘧啶-4-基)氧基)乙-1-醇(97)化合物97使用与前述实施例中描述的那些相似的程序制备。实施例98:化合物98的合成6-(1-(二氟甲基)-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(98)化合物98使用与前述实施例中描述的那些相似的程序制备。实施例99:化合物99的合成程序a:步骤a:4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a。在0℃下向3-甲基-1h-吡咯-2-甲酸乙酯99a(5.00g,32.67mmol)在dmf(50ml)中的搅拌溶液中逐份添加nis(6.98g,31.04mmol)。在完成nis添加后,将所得反应混合物在室温下在黑暗条件下搅拌4小时。4小时后,在良好搅拌下将反应混合物倒在冰冷的水上。过滤沉淀出的固体,用h2o(2x50ml)洗涤,随后用己烷(2x50ml)洗涤并真空干燥,得到呈灰白色固体的4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(7.50g,82%产率)。1h nmr(400mhz,dmso-d6)δ11.90(brs,1h),7.10(s,1h),4.20(m,2h),2.20(s,3h),1.30(t,3h)。步骤b:3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c。向4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(10.00g,35.98mmol)在1,4-二噁烷∶h2o(5∶1,200ml)中的搅拌溶液中添加cs2co3(29.23g,89.92mmol),所得反应混合物用氩气脱气5分钟,随后添加pd(dppf)cl2(1.30g,0.05mmol)并将所得反应混合物在60℃下搅拌1小时。在2小时内向上述反应混合物中滴加1-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑99b(9.73g,46.76mmol)在1,4-二噁烷(50ml)中的溶液并将所得反应混合物加热至80℃保持16小时。反应完成后,减压去除所有挥发物,留下粗制物质,将其通过组合快速柱色谱法(50%乙酸乙酯的己烷溶液)纯化,得到呈灰白色固体的3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c(5.00g,48%产率)。1h nmr(400mhz,dmso-d6)δ11.55(brs,1h),7.62(d,j=2.0hz,1h),7.16(d,j=3.2hz,1h),6.35(s,1h),4.26(m,2h),3.80(s,3h),2.47(s,3h),1.31(t,3h)。ms(esi+apci;多模式):计算值[m+1]234。实测值[m+1]234。步骤c:1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d。在0℃下向3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c(10.00g,42.91mmol)在dmf(100ml)中的搅拌溶液中,添加t-buok(1m在thf中的溶液)(5.76g,51.48mmol)(经5分钟的时段)并且在30分钟时(在相同温度下)搅拌,随后在相同温度下添加(氨基氧基)二苯基氧化膦(11.99g,51.50mmol)。添加完成后,使所得反应混合物达到室温并在室温下搅拌6小时。将反应混合物用饱和nh4cl溶液(100ml)淬灭,用乙酸乙酯(2x100ml)萃取水层。合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏,得到粗制1-氨基-3-甲基-4-(1-甲基-ih-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d(7.00g,粗品),其无需任何纯化即用于下一步骤。ms(esi+apci;多模式):计算值[m+1]249。实测值[m+1]249。步骤d:3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99e。在0℃下向粗制1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d(7.00g,28.22mmol)在ch2cl2(140ml)中的搅拌溶液中添加dipea(12.30ml,70.56mmol)、1-甲基-1h-咪唑-2-甲酸(3.91g,31.04mmol),随后添加t3p(50%的etoac溶液)(44.87ml,70.56mmol)。添加完成后,使所得反应混合物达到室温并搅拌12小时。将反应混合物用h2o(100ml)淬灭,用ch2cl2(2x100ml)萃取水层。将合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏出,得到粗制物质。使用50%乙酸乙酯的己烷溶液作为洗脱液,通过组合快速柱色谱法纯化所获得的粗制物质,得到呈灰白色固体的3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99e(6.00g,39%{2步}产率)。1h nmr(400mhz,dmso-d6)δ11.60(s,1h),7.70(d,j=2.0hz,1h),7.50(s,1h),7.30(s,1h),7.10(s,1h),6.40(s,1h),4.10(m,2h),3.90(s,3h),3.80(s,3h),2.47(s,3h),1.00(t,3h)。ms(esi+apci;多模式):计算值[m+1]357。实测值[m+1]357。步骤e:3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸99f。向3-甲基-1-(1-甲基-1h-咪唑-2-甲酰氨基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99e(6.00g,16.85mmol)在etoh∶thf∶h2o(1∶1∶1{180ml})中的搅拌溶液中添加naoh(2.69g,67.4mmol)并加热至65℃保持24小时。减压蒸发过量的溶剂,留下粘性物质,将其用稀hcl中和,过滤沉淀出的固体,用水洗涤并真空干燥,得到呈灰白色固体的粗制3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸99f(5.50g粗品)。ms(esi+apci;多模式):计算值[m-1]327。实测值[m-1]327。步骤f:n-(2-氨基甲酰基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺99g。在室温下,向粗制3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸99f(5.50g,16.7mmol)在dmf(100ml)中的搅拌溶液中添加hatu(7.64g,20.12mmol)、nh4cl(2.68g,50.3mmol),随后添加dipea(6.48g,50.3mmol)并且搅拌12小时。将反应混合物用h2o(100ml)淬灭,用乙酸乙酯(2x100ml)萃取水层。合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏,得到呈褐色粘性物质的粗制n-(2-氨基甲酰基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺99g(10)(7.70g粗品),其无需任何进一步纯化即用于下一步骤。ms(esi+apci;多模式):计算值[m-1]326。实测值[m+1]326。步骤g:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h。向粗制n-(2-氨基甲酰基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺99f(7.70g,23.54mmol)在etoh∶h20的混合物(1∶1;200ml)中的搅拌溶液中添加koh(3.95g,70.64mmol)并将所得混合物加热至100℃保持16小时。减压蒸馏出过量的etoh,留下水层;用稀hcl将水层的ph调节至中性,过滤沉淀出的固体,用水(25ml)洗涤,得到粗制物质。通过组合快速柱色谱法(50%-100%乙酸乙酯的己烷溶液)纯化所获得的粗制物质,得到呈浅黄色固体的5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h(2.50g,48%{经3步}产率)。1h nmr(400mhz,dmso-d6)δ11.10(s,1h),7.90(d,j=2.0hz,1h),7.70(s,1h),7.50(s,1h),7.10(s,1h),5.60(s,1h),4.00(s,3h),3.80(s,3h),2.60(s,3h)。ms(esi+apci;多模式):计算值[m+1]310。实测值[m+1]310。步骤h:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪(99)。将5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h(2.00g,6.451mmol)和pocl3(20ml)的混合物在100-110℃加热18小时。减压蒸馏出过量的pocl3,留下粘性深褐色物质,将其在ch2cl2(20ml)中稀释并用nahco3水溶液(50ml)碱化至ph=8-9。再次用ch2cl2(2x100ml)萃取获得的粗制物质,将合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥,并减压浓缩,得到粗制物质,将其用mtbe(20ml)研磨,随后用己烷(20ml)研磨,得到呈黄褐色固体的4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪化合物(99)(1.50g,71%产率)。1h nmr(400mhz,dmso-d6)δ8.53(s,1h),7.79(d,j=2.4hz,1h),7.40(s,1h),7.09(s,1h),6.70(s,1h),3.99(s,3h),3.92(s,3h),2.83(s,3h)。ms(esi+apci;多模式):计算值[m+1]328。实测值[m+1]328。程序b:步骤a:4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a。将n-碘代琥珀酰亚胺(35.62g,158.31mmol)逐份添加到3-甲基-1h-吡咯-2-甲酸乙酯(1)(25.0g,163.21mmol)在dmf(600ml)中的溶液中。将混合物在环境温度下搅拌16小时。将混合物倒入冰水中。通过硅藻土过滤形成的沉淀并真空干燥。获得4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(33.0g,118.25mmol,72.5%产率)。步骤b:3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c。在ar气氛下将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(21.24g,76.1mmol)、1-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑99c(19.0g,91.32mmol)、pd(dppf)cl2·2dcm(6.21g,7.61mmol)和碳酸铯(49.59g,152.2mmol)溶于脱气二噁烷(600ml)中。经由注射器添加30ml水。将反应混合物加热至100℃,并在该温度下搅拌48小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过柱色谱法(sio2,用hex∶etoac 20∶1至1∶4洗脱)纯化。获得3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c(7.0g,30.01mmol,39.4%产率)。步骤c:1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d。在0℃下将氢化钠(913.91mg,38.08mmol)(60%于矿物油中)逐份添加到3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99c(4.1g,17.58mmol)在dmf(10ml)中的溶液中。将混合物在室温下搅拌1小时。然后将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(4.55g,22.85mmol)。将混合物在室温搅拌16小时。然后将混合物倒入冰水中,用etoac(10ml)稀释,用水(5*5ml)洗涤,真空干燥并通过hplc(0-2-10分钟30%-50%h2o/meoh/0.1nh4oh,流速30ml/分钟((泵装载4ml meoh);柱:chromatorex c18 smb100-5t100*19mm,5μm)纯化。获得1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d(3.8g,15.31mmol,87.1%产率)。步骤d:5-甲基-2-(1-甲基-ih-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h。将氢化钠(1.48g,61.76mmol)(60%在矿物油中)逐份(在3分钟中)添加到1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d(4.6g,18.53mmol)和1-甲基-1h-咪唑-2-甲腈(2.38g,22.23mmol,2.38ml)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后,将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀,用水(2*10ml)洗涤并真空干燥,并且通过快速色谱法(sio2,己烷-etoac)纯化。获得5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h(1.85g,5.98mmol,32.3%产率)。1h nmr(500mhz,dmso-d6)δ(ppm)2.65(s,3h),3.82(s,3h),3.97(s,3h),6.50(d,1h),7.12(s,1h),7.47(d,1h),7.58(d,1h),7.87(d,1h),11.04(br s,1h)。lcms(esi):ms计算值[m+1]310.2。实测值[m+1]310.2;rt=1.112分钟。步骤e:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪(99)。将5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h(1.85g,5.98mmol)溶于三氯氧磷(9.17g,59.8mmol,5.57ml)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀,用水(2*20ml)洗涤并真空干燥。获得4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪获得化合物(99)(1.7g,5.19mmol,86.7%产率)。lcms(esi):ms计算值[m+1]328.0。实测值[m+1]328.0;rt=1.014分钟。实施例100:化合物100的合成步骤a:n-(5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(100)。在0℃下,向5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-胺a1(0.033g,0.274mmol,1.50当量)在无水thf(1ml)中的搅拌溶液中添加nahmds(2.0m在thf中)(0.2ml,0.366mmol,2.0当量),并将所得混合物在室温下搅拌15分钟。在另一个圆底烧瓶中,将4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪化合物99(0.06g,0.183mmol,1.0当量)溶于无水dmf(1ml)中,然后滴加到上述反应混合物中,并在室温下搅拌2小时。蒸馏出过量的thf,用10%氯化铵溶液(2ml)稀释,过滤沉淀出的固体,用水(2x5ml)洗涤。将获得的固体在乙腈(15ml)中搅拌10分钟,过滤,然后冻干,得到呈灰白色固体的n-(5,6-二氢-4h-吡咯并[1,2-b]吡唑-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(100)(0.038g,42%产率,99%纯度)。1h nmr(400mhz,dmso-d6)δ2.24-2.14(m,2h),2.52-2.55(m,1h),2.64-2.60(m,1h),2.75(s,1h),2.88(s,3h),3.52-3.32(m,1h),3.87-3.86(s,3h),4.04(m,3h),4.11-4.09(m,1h),5.84-5.64(m,1h),6.42-6.40(m,2h),7.12-7.06(m,1h),7.42(s,1h),7.60-7.59(m,1h),12.63(brs,1h)。ms(esi+apci;多模式):计算值[m+1]415。实测值[m+1]415。实施例101:化合物101的合成步骤a:2-((6-((5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-基)氨基)嘧啶-4-基)氧基)乙1-醇(101)。在0℃下向2-((6-氨基嘧啶-4-基)氧基)乙-1-醇a2(0.043g,0.278mmol,1.30当量)在无水dmf(1ml)中的搅拌溶液中添加nah(60%在矿物油中)(0.017g,0.428mmol,2.0当量),在室温下搅拌15分钟,然后在氮气气氛下,将化合物(99)(0.07g,0.214mmol,1.0当量)在无水dmf(1ml)中的溶液滴加到上述反应混合物中。在完成添加后,将所得反应混合物在室温下搅拌2小时。2小时后,用饱和nh4cl溶液(5ml)淬灭反应混合物,过滤沉淀出的固体。将获得的固体在meoh∶acn的混合物(1∶1;10ml)中搅拌30分钟。将固体过滤并进行冻干,得到呈灰白色固体的2-((6-((5-甲基-2-(1-甲基-ih-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-基)氨基)嘧啶-4-基)氧基)乙-1-醇即化合物(101)(0.037g,32%产率,纯度98%)。1h nmr(400mhz,dmso-d6)δ2.84(s,3h),3.74(d,j=8.00hz,2h),3.88(s,3h),4.06(s,3h),4.39(s,2h),4.53(s,1h),6.46-6.51(m,1h),7.10-7.17(m,1h),7.28-7.42(m,1h),7.66(s,1h),7.79-8.15(m,2h),8.51-8.58(m,1h),14.16(bs,1h)。ms(esi+apci;多模式):计算值[m+1]447。实测值[m+1]447。实施例102:化合物102的合成步骤a:n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(102)。将氢化钠(40.3mg,1.68mmol)(60%在矿物油中)一次性添加到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪(99)(113.73mg,916.11μmol)(如实施例99程序b步骤e中所述制备)在dmf(1.0ml)中的溶液中。将混合物在环境温度下搅拌0.30分钟。一次性添加在dmf(2.0ml)中的4-甲氧基吡啶-2-胺(113.73mg,916.11μmol)并搅拌16小时,然后用浓nh4cl淬灭并通过hplc(0-2-9分钟48-55-75%meoh/h2o+nh4oh;流速30ml/分钟(泵装载4ml/分钟meoh);柱:cromatorex c18 smb100-5t 100*19,5μm)纯化。获得呈黄色固体的n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(102)(36.0mg,79.66μmol,17.4%产率)。1h nmr(500mhz,cd3od)δ(ppm)2.81(s,3h),3.98(s,3h),4.16(s,3h),4.26(s,3h),6.68(s,1h),7.23(d,1h),7.51(s,1h),7.70(s,1h),7.75(m,2h),8.41(m,2h),未观察到nh。lcms(esi):ms计算值[m+1]416.2。实测值[m+1]416.2。实施例103:化合物103的合成步骤a:n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐(103)。将diea(155.82mg,1.21mmol,210.0μl)一次性添加到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪99(98.55mg,300.67μmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(82.75mg,601.34μmol)在dmf(1ml)中的溶液中。将混合物加热至100℃,并在该温度下搅拌16小时。将混合物通过hplc(0-2-10分钟10-60%h2o/acn/0.1hcl,流速30ml/分钟(泵装载4ml acn);柱:chromatorex c18smb100-5t 100*19mm,5μm)纯化。获得浅米色胶状物的n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐即化合物(103)(28.7mg,73.13μmol,24.3%产率,97%纯度)。1h nmr(500mhz,dmso-d6)δ2.39(m,4h),1.78(s,3h),3.19(s,3h),3.88(s,3h),4.05(m,1h),4.23(s,3h),4.99(quinn,1h),6.63(d,1h),7.50(m,1h),7.74(d,1h),7.77(m,1h),7.83(s,1h),8.04(s,1h)。lcms(esi):ms计算值[m+1]393.2。实测值[m+1]393.0。表1中的实施例104-实施例111使用与实施例100中描述的那些相似的程序制备。表1中的实施例112-实施例113使用与实施例101中描述的那些相似的程序制备。表1中的实施例114-实施例129使用与实施例102中描述的那些相似的程序制备。表1中的实施例130-实施例133使用与实施例103中描述的那些相似的程序制备。实施例134:化合物134的合成步骤a:4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134a。在ar下将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯(50a)(如实施例99程序b步骤a中所述制备)(4.0g,14.33mmol)、1-环丙基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑a6(3.69g,15.77mmol)、碳酸铯(9.34g,28.67mmol)和pd(dppf)cl2·2dcm(1.17g,1.43mmol)溶解在脱气二噁烷(80ml)中。经由注射器添加3.8ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过柱色谱法(用hex∶etoac 20∶1至1∶3洗脱)纯化。获得呈深黄色油状物的4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134a(2.5g,9.64mmol,67.3%产率)。步骤b:1-氨基-4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134b。在0℃下,将氢化钠(98.71mg,4.11mmol)(60%在矿物油中)逐份(在3分钟内)添加至4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134a(640.0mg,2.47mmol)在dmf(10ml)中的溶液中。将混合物在该温度下搅拌30分钟,然后一次性添加o-(2,4-二硝基苯基)羟胺(491.42mg,2.47mmol)。将反应混合物在室温下搅拌16小时。然后将混合物冷却至室温,倒入冰水中并用etoac(3*20ml)萃取3次。将有机相用盐水洗涤5次,然后干燥。真空蒸发溶剂。获得粗制的1-氨基-4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134b(700.0mg)并且无需进一步纯化即用于下一步骤。步骤c:6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(134)。将氢化钠(204.18mg,8.51mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-4-(1-环丙基-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯134b(700.0mg,2.55mmol)和1-甲基-1h-咪唑-2-甲腈(328.08mg,3.06mmol)在二噁烷(10ml)中的溶液中。将反应混合物回流加热16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*10ml)洗涤并真空干燥,并且通过快速色谱法(sio2,己烷-etoac)纯化。获得6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(134)(100.0mg,298.18μmol,两步产率12%)。实施例135:化合物135的合成步骤a:4-氯-6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪135a。将6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(134)(100.0mg,298.18μmol)溶于三氯氧磷(551.25mg,3.6mmol)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空干燥。获得4-氯-6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪135a(100.0mg,282.64μmol,94.3%产率)并且无需纯化即用于下一步骤。步骤b:6-(1-环丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(135)。将氢化钠(24.86mg,1.04mmol)(60%在矿物油中)逐份添加到4-氯-6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪135a和6-甲氧基嘧啶-4-胺(70.7mg,565.0μmol)在dmf(1ml)中的溶液中。将混合物在室温下搅拌16小时,然后用浓nh4cl水溶液淬灭。通过过滤收集形成的沉淀物,用水(2*3ml)洗涤并通过hplc(0-2-9分钟53-60-85%水-meoh/h2o+nh4oh;流速30ml/分钟(泵装载4ml meoh);柱:chromatorex c18 smb100-5t 100*19mm,5μm)纯化。获得呈黄色固体的6-(1-环丙基-1h-吡唑-3-基)-n-(6-甲氧基嘧啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(135)(30.0mg,67.8μmol,两步的产率为22.7%)。1h nmr(500mhz,dmso-d6)δ(ppm)1.01(m,4h),2.77(s,3h),3.90(m,7h),6.45(m,1h),7.02(m,3h),7.59(m,1h),7.72(m,1h),8.30(m,1h)。lcms(esi):ms计算值[m+1]443.0。实测值[m+1].443.0。rt=1.134分钟。用于文库化合物的一般程序:在室温下向氢化钠(22mg,0.55mmol)(60%在矿物油中的分散体)在无水dmf(1.5ml)中的悬浮液中添加适当的相应胺(0.45mmol)在dmf(1.0ml)中的溶液。将获得的混合物在室温下搅拌30分钟,随后一次性添加4-氯-6-(1-环丙基-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪135a(80.0mg,226.11μmol)。将所得混合物在40℃下搅拌18小时。然后,将所得混合物用meoh(0.5ml)淬灭并进行hplc纯化。表1中的实施例136-实施例150使用实施例135步骤b中描述的一般程序制备。表1:化合物和分析数据表注:*量和产率分别是指在相应化合物合成的最后一步获得的最终总量和产率。实施例151:化合物151的合成步骤a:3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151b。在ar下将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如实施例99程序a步骤a中所述制备)(20.0g,76.1mmol)、3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶151a(17.64g,86mmol)、[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(5.85g,7.17mmol)和碳酸铯(49.59g,143.3mmol)溶于脱气二噁烷(400ml)。经由注射器添加20ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过柱色谱法(用hex∶etoac 20∶1至1∶5洗脱)纯化,得到3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151b(9.5g,41.26mmol,57.6%产率)。步骤b:1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151c。在0℃下将氢化钠(0.158g,6.58mmol)(60%在矿物油中)逐份添加至3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151b(0.7g,3.04mmol)在dmf(5ml)中的溶液中。将混合物在室温下搅拌1小时。然后将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(0.787g,3.95mmol)。将混合物在室温搅拌16小时。然后将混合物倒入冰水中,用etoac(10ml)稀释,用水(5*5ml)洗涤,真空干燥并通过快速色谱法(sio2,己烷-etoac)纯化,得到1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151c(0.6g,2.45mmol,57.6%产率)。步骤c:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇151d。将氢化钠(521.75mg,21.74mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-3-甲基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯151c(1.6g,6.52mmol)和1-甲基-1h-咪唑-2-甲腈(838.00mg,7.83mmol)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*10ml)洗涤并真空干燥,得到5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇151d(900.0mg,2.94mmol,45%产率)。步骤d:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪151e。5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇151d(800.0mg,2.61mmol)处于三氯氧磷(16.01g,104.44mmol,9.74ml)中。将混合物加热至100℃,并在该温度下搅拌36小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空干燥,得到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪151e(700.0mg,2.16mmol,82.5%产率)。步骤e:n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(151)。使用实施例103步骤a中描述的程序,(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(84.8mg,616.25μmol)、4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪151e(100.0mg,307.91μmol)和diea(199.11mg,1.54mmol),产生呈黄色固体的n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(151)(39.6mg,33%产率)(100%纯度)。lcms(esi):计算值[m+1]390.2。实测值[m+1]390.2。实施例152-实施例158将4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪151e(100.0mg,307.91μmol)用适当的相应胺(1.2当量)处理,生成表c中所示的实施例化合物(152)-(158)。实施例152-155使用实施例103中描述的程序。实施例156-158使用实施例102中描述的程序。实施例159:化合物159的合成。步骤a:3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159b。将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如实施例99程序a步骤a所述制备)(30g,0,107mol)和吡啶-4-基硼酸159a(15,86g,0,129mol)溶于二噁烷/水的脱气混合物(按体积9/1)中。在ar流下添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷加合物(9.4g,0.0129mol)和碳酸铯(84.1g,0.258mol)。将混合物在100℃下搅拌过夜,然后用etoac稀释,用盐水洗涤并蒸发。将粗产物通过fcc(hex∶etoac 4∶1)纯化,得到3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159b。(1g,4.3mmol)。步骤b:1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159c。将3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159b(1g,4.3mmol)溶于dmf中并将混合物冷却至0℃。逐份添加氢化钠(160mg,5.2mmol)并将混合物在室温下搅拌至停止放出气体(20分钟),然后将其再次冷却并在0-+5℃下滴加o-(2,4-二硝基苯基)羟胺(0.8546mg,4.3mmol)在dmf中的溶液。将混合物在室温下搅拌过夜,然后倒入饱和氯化铵溶液中,用etoac萃取,用水、盐水洗涤并蒸发。粗产物1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159c无需进一步纯化即使用。步骤c:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇159d。将1-氨基-3-甲基-4-(吡啶-4-基)-1h-吡咯-2-甲酸乙酯159c(1g,4.08mmol)和1-甲基-1h-咪唑-2-甲腈(518.1mg,4.83mmol)溶于二噁烷中。逐份添加氢化钠(212.8mg,8.866mmol)并将混合物在100℃下加热过夜。将粗产物通过fcc(chcl3∶meoh,梯度洗脱(tlc20∶1 rf=0.6,第一片))纯化,得到5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇159d(400.0mg,95.0%纯度,1.307mmol)。步骤d:4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪159e。5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇159d(800.0mg,2.61mmol)处于三氯氧磷(16.01g,104.44mmol,9.74ml)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空干燥,得到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪159e(700.0mg,2.16mmol,82.5%产率)。步骤e:n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(159)。将diea(155.82mg,1.21mmol,210.0μl)一次性添加到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪159e(97.57mg,300.42μmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(82.68mg,600.84μmol)在dmf(1ml)中的溶液中。将混合物加热至100℃,并在该温度下搅拌16小时。将混合物通过hplc纯化,得到n-((1r,3r)-3-甲氧基环丁基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(吡啶-4-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(159)(20.0mg,51.35μmol,17.1%产率)(纯度100%)。lcms(esi):计算值[m+1]390.2。实测值[m+1]390.2。1h nmr(500mhz,dmso-d6)δ(ppm)2.29(m,2h),2.41(m,2h),2.64(s,3h),3.11(s,3h),4.00(m,4h),4.80(m,1h),6.96(d,1h),7.23(m,2h),7.49(m,2h),8.05(d,1h),8.58(m,2h)。实施例160:化合物160的合成步骤a:4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160b。在ar下将4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如实施例99程序a步骤a中所述制备)(4.5g,16.12mmol)、2-甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶160a(4.55g,19.35mmol)、pd(dppf)cl2·2dcm(1.32g,1.61mmol)和碳酸铯(10.51g,32.25mmol)溶于脱气二噁烷(90ml)中。经由注射器添加4.5ml水。将反应混合物加热至80℃,并在该温度下搅拌16小时。将混合物冷却至室温,通过硅藻土过滤并浓缩。将残余物通过柱色谱法(用己烷∶etoac 20∶1至1∶2洗脱)。获得呈浅黄色粉末的4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160b(1.0g,3.84mmol,23.8%产率)。步骤b:1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160c。在0℃下向4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160b(1.0g,3.84mmol)在dmf(20ml)中的溶液中添加氢化钠(199.82mg,8.33mmol)。1小时后,滴加在dmf中的o-(2,4-二硝基苯基)羟胺(994.8mg,5.0mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*25ml)萃取,将合并的etoac用水(7*15ml)洗涤,干燥并减压蒸发,得到1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160c(1.1g,80.9%纯度,3.23mmol,84.1%产率)。步骤c:6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇160d。将氢化钠(319.64mg,13.32mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-4-(2-甲氧基吡啶-4-基)-3-甲基-1h-吡咯-2-甲酸乙酯160c(1.1g,4.0mmol)和1-甲基-1i-咪唑-2-甲腈(428.01mg,4.0mmol)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*10ml)洗涤并真空干燥,得到6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇160d(400.0mg,1.19mmol,29.8%产率)。步骤d:4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪160e。将6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇160d(3.0g,8.92mmol)溶于三氯氧磷(54.71g,356.82mmol,33.26ml)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空干燥,得到4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪160e(2.2g,6.12mmol,69.5%产率)。步骤e:n-((1r,3r)-3-甲氧基环丁基)-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(160)。使用芳基化程序a,diea(288.04mg,2.23mmol)、4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪160e(200.0mg,556.77μmol)和(1r,3r)-3-甲氧基环丁-1-胺(77.01mg,668.61μmol)得到呈黄色固体的n-((1r,3r)-3-甲氧基环丁基)-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(160)(11.4mg,4.8%产率)(纯度99%)。lcms(esi)计算值[m+1]420.2。实测值[m+1]420.2。1h nmr(500mhz,dmso-d6)δ(ppm)2.38(m,2h),2.41(m,2h),2.60(s,3h),3.12(s,3h),3.88(s,3h),3.91(s,3h),4.80(m,1h),6.92(m,2h),7.11(d,1h),7.25(m,2h),8.02(m,2h),8.15(d,1h)。实施例161-164使用实施例103中描述的程序,用适当的相应胺(1.2当量)处理4-氯-6-(2-甲氧基吡啶-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪160e(200.0mg,556.77μmol),生成表c中所示的实施例化合物(161)-(164)。实施例165:化合物165的合成步骤a:4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165b。在ar气氛下,将4-碘-3-甲基-1h-吡咯-2-甲酸甲酯(6.0g,22.6mmol)、1-异丙基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑165a(5.4g,22.6mmol)、cs2co3(14.7g,45.2mmol)和pd(dppf)cl2(1.7g,2.26mmol)悬浮于脱气二噁烷(18.0ml)中。搅拌2分钟后,添加脱气的h2o(0.9ml)。将反应混合物在80℃下搅拌4天。将混合物冷却至室温,通过硅藻土过滤并减压浓缩,得到6.88g黑色油状物。通过硅胶柱色谱法纯化该产物(255g)∶甲苯∶丙酮9∶1级分1(500ml);甲苯:丙酮9:1级分2-20(各100ml)。合并级分7-19并蒸发,得到1.83g(32.7%)呈深色油状物的4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165b。步骤b:1-氨基-4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165c。用戊烷(2×4ml)洗涤60%nah(437mg,10.9mmol),在氩气下干燥并悬浮于无水dmf(40ml)中。然后在0℃下滴加4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165b(1.8g;7.28mmol)在dmf(9ml)中的溶液。所得混合物在室温下搅拌1小时。将反应混合物冷却至0℃并一次性添加ph2(o)ponh2(2.2g;9.46mmol)。将反应混合物在60℃下搅拌18小时。冷却至室温后,添加水(100ml)并将混合物用醚(3×100ml)萃取。将合并的有机层经na2so4干燥并且浓缩,获得826mg呈橙色油状物的1-氨基-4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165c。1h nmr(cdcl3,400mhz)δ7.52(d,j=0.8hz,1h),7.41(d,j=0.8hz,1h),6.98(s,1h),5.54(s,2h),4.51(p,j=6.72hz,1h),3.37(s,3h),2.35(s,3h),1.53(d,j=6.66hz,6h)。步骤c:6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇165d。用戊烷(2×5ml)洗涤60%nahh(396mg,9.9mmol),在氩气下干燥并悬浮在无水的1,4-二噁烷(2.0ml)中,然后添加1-氨基-4-(1-异丙基-1h-吡唑-4-基)-3-甲基-1h-吡咯-2-甲酸甲酯165c(800mg;3.0mmol)在无水1,4-二噁烷(6.0ml)中的溶液。将所得混合物在室温下搅拌0.5小时,并添加1-甲基-1i-咪唑-2-甲腈(321mg;3.0mmol)在无水1,4-二噁烷(4.0ml)中的溶液。将反应混合物在回流下搅拌20小时。冷却至室温后,添加水(10ml),将混合物用acoh(0.5ml)中和并用chcl3(3×25ml)萃取。将合并的有机层经na2so4干燥并浓缩,获得833mg深色油状物。通过硅胶柱色谱法纯化该产物(45g):甲苯∶丙酮 7∶3级分1-2(各100ml);甲苯∶丙酮 1∶1级分3-4(各25ml)。将纯级分3蒸发,得到17mg呈沉淀物的6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇165d。也将不纯的级分2蒸发,得到290mg橙色油状物。向该产物中添加et2o,获得99mg呈白色沉淀物的6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇165d。1h nmr(cdcl3,400mhz)δ7.67(d,j=0.8hz,1h),7.58(d,j=0.8hz,1h),7.43(s,3h),7.12(d,j=1.07hz,1h),7.04(d,j=1.1hz,1h),7.55(p,j=6.7hz,1h),4.07(s,3h),2.63(s,3h),1.56(d,j=6.74hz,2h)。步骤d:4-氯-6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪165e。将6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇165d(37mg,0.11mmol)溶于三氯氧磷(800mg,5,28mmol,48.0当量)中。将混合物在100℃下搅拌16小时。将反应混合物倒入冰水(5ml)中并用k2co3(ph~9!)中和。将混合物用二氯甲烷萃取三次,经na2so4干燥并减压浓缩,得到呈橙色油状物的4-氯-6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪165e 40mg(100%产率)。步骤e:6-(1-异丙基-1h-吡唑-4-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(165)。将4-甲氧基吡啶-2-胺(35mg,0.25mmol)在无水dmf(1.0ml)中的溶液添加到氢化钠(13mg,0.54mmol)在无水dmf(1.5ml)中的悬浮液中。将混合物在室温下在氩气气氛中搅拌1小时。然后向混合物中添加4-氯-6-(1-异丙基-1h-吡唑-4-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪165e(50mg,0.14mmol)在无水dmf(1.5ml)中的溶液。将混合物在70℃下加热2小时,然后在60℃下加热16小时。然后将反应混合物倒入水(20ml)中并用乙醚(15ml-15ml-10ml)萃取三次。将合并的有机层用水(5x5ml)洗涤,经na2so4干燥并蒸发至干,得到31mg(48%)深黄色固体的粗制6-(1-异丙基-1h-吡唑-4-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(165)。将材料(约30mg粗品)溶于热的甲基叔丁基醚(10ml)中,并将溶液在氩气流中浓缩至5ml。将浓缩的溶液在冰箱中放置过夜进行结晶。将形成的晶体滤出,用mtbe洗涤并在氩气流中干燥,得到黄色固体的6-(1-异丙基-1h-吡唑-4-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(165)(17mg,27%产率,93%纯度)。ms计算值[m+1]444.2。实测值[m+1]444.2。1h nmr(cdcl3,600mhz)δ7.67(s,1h),7.57(s,1h),7.18(s,1h),7.01(s,1h),6.56(s,1h),4.55(p,j=6.7hz,1h),4.08(s,3h),3.95(s,3h),2.79(s,3h),1.67(d,j=6.7hz,6h)。实施例166:化合物166的合成步骤a:3-((苯磺酰基)甲基)吡啶166b。将乙酸钾(13.22g,134.97mmol)一次性添加到3-(氯甲基)吡啶盐酸盐(20.0g,122.7mmol)和苯亚磺酸钠(22.13g,134.97mmol)在ipa(300ml)中的搅拌溶液中。将混合物加热至80℃并在该温度下搅拌过夜。然后将反应混合物真空浓缩,用冰水(150ml)稀释并用etoac(3*150ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥并真空浓缩,得到呈黄色固体的3-((苯磺酰基)甲基)吡啶166b(19.9g,95.0%纯度,81.04mmol,66%产率)。lcms(esi)rt=1.567分钟。计算值[m+1]234.2。实测值[m+1]234.0。[m+h]+ m/z:计算值234.2;实测值234.0;rt=1.567分钟。步骤b:(z)-2-(2-(苯磺酰基)-2-(吡啶-3-基)乙烯基)吡啶166c。在-78℃下向thf(600ml)中的3-((苯磺酰基)甲基)吡啶166b(17.5g,75.09mmol)中添加lihmds(1.1m在thf/乙苯中,150ml),并将混合物搅拌45分钟。向该溶液中添加吡啶-2-甲醛(12.06g,112.64mmol),并将该混合物搅拌1小时。添加氯膦酸二乙酯(15.5g,90.11mmol),并将混合物搅拌1小时。然后在-78℃下添加lihmds(1.1m在thf/乙苯中,150ml),并将混合物搅拌至环境温度。将所得混合物倒入饱和nh4c1水溶液(400ml)中并用etoac(3*300ml)萃取。将有机相用水、盐水洗涤,并经na2so4干燥,然后真空浓缩并通过fcc(interchim;330g sio2,氯仿/乙腈(含0~30%乙腈),流速=127ml/分钟,rv=8.5-12cv),得到(z)-2-(2-(苯磺酰基)-2-(吡啶-3-基)乙烯基)吡啶166c(6.7g,95.0%纯度,19.74mmol,26.3%产率)。lcms(esi)rt=0.955分钟。计算值[m+1]322.2。实测值[m+1]322.2。步骤c:3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166d。在(-10℃)将叔丁醇钾(3.49g,31.17mmol)逐份添加到(z)-2-(2-(苯磺酰基)-2-(吡啶-3-基)乙烯基)吡啶166c(6.7g,20.78mmol)和2-异氰基乙酸乙酯(3.52g,31.17mmol)在无水thf(140ml)中的溶液中,并在室温下搅拌过夜。然后将反应混合物用冰水(100ml)稀释并用etoac(3*1000ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166d(6.7g,75.0%纯度,17.13mmol,82.4%产率)。lcms(esi)rt=1.285分钟。计算值[m+1]294.2。实测值[m+1]294.2。步骤d:1-氨基-3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166e。在0℃下,将氢化钠(1.3g,32.5mmol)(60%在矿物油中)逐份添加到3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166d(6.7g,22.84mmol)在dmf(70ml)中的溶液中。将混合物在室温搅拌1小时。然后将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(4.43g,22.27mmol)。将混合物在室温搅拌16小时。然后将混合物倒入冰水中,并用etoac(3*20ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到呈深色油状物的1-氨基-3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166e(7.3g,70.0%纯度,16.57mmol,96.7%产率)。lcms(esi)rt=1.298分钟。计算值[m+1]309.2。实测值[m+1]309.2。步骤e:2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇166f。将氢化钠(1.94g,0.04mmol)(60%在矿物油中)逐份添加到1-氨基-3-(吡啶-2-基)-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯166e(7.47g,24.23mmol)和1-甲基-1h-咪唑-2-甲腈(2.72g,25.44mmol)在无水二噁烷(80ml)中的溶液中。然后将反应混合物加热至80℃,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入冰水中,用乙酸中和并用etoac(3*50ml)萃取。将有机相用水、盐水洗涤,经na2so4肝脏,真空浓缩,得到2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇166f(1.2g,90.0%纯度,2.92mmol,17.2%产率)并且无需进一步纯化即用于下一步骤。步骤f:4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪166g。向2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇166f(1.2g,3.25mmol)在ch3cn(45ml)中的溶液中,滴加三氯氧磷(5.33g,35.09mmol)。将混合物加热至80℃并在该温度下搅拌16小时,然后真空浓缩,倒入冰水(25ml)中并用nahco3中和。通过过滤收集形成的沉淀物,用水(2*20ml)洗涤并真空干燥,得到呈黄色固体的4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪166g(500.0mg,75.0%纯度,966.93μmol,33.1%产率)。lcms(esi)rt=1.528分钟。计算值[m+1]388.2。实测值[m+1]388.2。步骤g:n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(166)。将氢化钠(43mg,1.07mmol)(60%在矿物油中)逐份添加到4-甲氧基吡啶-2-胺(108.54mg,874.86μmol)在dmf(1ml)中的溶液中。将混合物在室温下搅拌30分钟,然后一次性添加4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪166g(170.0mg,438.34μmol),并搅拌过夜。此后,将所得混合物用饱和nh4cl淬灭。通过过滤收集形成的沉淀物,用水(2*1ml)洗涤并通过hplc(柱:xbridge beh c18 100*19mm,5μm(系统0-2-10分钟;33%-40%-75%h2o/meoh/0.1nh4oh;流速30ml/分钟((泵装载4ml meoh))),得到n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(166)(6.5mg,95.0%纯度,12.99μmol,3%产率)。lcms(esi)rt=0.929分钟。计算值[m+1]476.2。实测值[m+1]476.0。1h nmr(500mhz,cd3od)δ(ppm)3.89(s,3h),4.01(s,3h),6.59(d,1h),6.91(m,1h),7.10(m,3h),7.39(m,2h),7.69(m,1h),7.82(s,1h),8.02(d,1h),8.40(m,3h),8.74(s,1h)。实施例167-168将4-氯-2-(1-甲基-1h-咪唑-2-基)-5-(吡啶-2-基)-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪166g用适当的相应胺(1.2当量)根据实施例102中描述的程序处理,生成实施例化合物(167),并根据实施例103中描述的程序,生成实施例化合物(168)。实施例化合物(167)和实施例化合物(168)与分析数据一起示于表c中。实施例169:化合物169的合成步骤a:3-((苯磺酰基)甲基)吡啶169b。将乙酸钾(6.58g,67.06mmol)一次性添加到3-(氯甲基)吡啶盐酸盐169a(10.0g,60.96mmol)和苯亚磺酸钠(11.01g,67.06mmol)在异丙醇(150ml)中的搅拌溶液中。将混合物加热至80℃,并在该温度下搅拌过夜。然后将反应混合物真空浓缩,用冰水(150ml)稀释并用etoac(3*150ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥并真空浓缩,得到呈黄色固体的3-((苯磺酰基)甲基)吡啶169b(9.8g,95.0%纯度,39.91mmol,65.5%产率)。步骤b:(z)-3,3′-(1-(苯磺酰基)乙烯-1,2-二基)二吡啶169c。在室温下,将3-((苯磺酰基)甲基)吡啶169b(8.3g,35.58mmol)和吡啶-3-甲醛(7.62g,71.16mmol)在无水meoh(100ml)中的混合物滴加到甲醇钠(2.5g,46.25mmol)在meoh(200ml)中的溶液中,并搅拌过夜。然后将反应混合物真空浓缩,用冰水(150ml)稀释。将水酸化至ph 5并用etoac(3*150ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(interchim,220g sio2,氯仿/乙腈(30%-100%),流速=100ml/分钟,4,9-12,5cv)纯化,得到呈白色固体的(z)-3,3′-(1-(苯磺酰基)乙烯-1,2-二基)二吡啶169c(4.8g,95.0%纯度,14.14mmol,39.8%产率)。步骤c:3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169d。在0℃下将2-异氰基乙酸乙酯(1.8g,15.91mmol,1.74ml,1.0当量)滴加到(z)-3,3′-(1-(苯磺酰基)乙烯-1,2-二基)二吡啶169c(5.13g,15.91mmol)和2-甲基丙-2-醇(1.18g,15.91mmol)在无水thf(100ml)中的溶液中,并在室温下搅拌过夜。然后将反应混合物用冰水(100ml)稀释并用etoac(3*100ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(a:interchim;80g sio2甲基叔丁基醚/甲醇(0~20%甲醇),流速=65ml/分钟,rv=8-12cv)纯化,得到呈黄色固体3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169d(940.0mg,95.0%纯度,3.04mmol,19.1%产率)。步骤d:1-氨基-3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169e。在0℃下,将氢化钠(165mg,4.125mmol)(60%在矿物油中)逐份添加到3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169d(940.0mg,3.2mmol)在dmf(30ml)中的溶液中。将混合物在室温搅拌1小时。然后将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(829.46mg,4.17mmol)。将混合物在室温搅拌16小时。然后将该混合物倒入冰水中,得到呈深色油状物的1-氨基-3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169e(1.2g,66.0%纯度,2.57mmol,80.2%产率)。步骤e:2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇169f。将氢化钠(0.311g,7.75mmol)(60%在矿物油中)逐份添加到1-氨基-3,4-二(吡啶-3-基)-1h-吡咯-2-甲酸乙酯169e(1.2g,3.89mmol)和1-甲基-1h-咪唑-2-甲腈(330.23mg,3.08mmol)在无水二噁烷(12ml)中的溶液中。然后将反应混合物加热至80℃,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入冰水中,用乙酸中和并用etoac(3*15ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过hplc((柱:chromatorex c18 smb100-5t 100*19mm,5μm)系统0-2-10分钟;23-30-55h2o/meoh,流速30ml/分钟(泵装载4ml meoh))纯化;得到2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇169f(121.6mg,329.2μmol,12.8%产率)。步骤f:4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪169g。向2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇169f(840.0mg,2.27mmol)在ch3cn(20ml)中的溶液中,滴加三氯氧磷(1.39g,9.1mmol)。将混合物加热至80℃并在该温度下搅拌16小时,然后真空浓缩,倒入冰水(5ml)中并用nahco3中和。通过过滤收集形成的沉淀物,用水(2*20ml)洗涤并真空干燥,得到呈黑色固体的4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪169g(700.0mg,73.0%纯度,1.32mmol,57.9%产率)。步骤g:n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(169)。用氢化钠(34mg,0.85mmol)(60%在矿物油中)、4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪169g(101.14mg,260.78μmol)和4-甲氧基吡啶-2-胺(178.08mg,1.38mmol)执行实施例102中描述的程序,得到呈米色固体的n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]嗪-4-胺(169)(2.9mg,2.2%产率)(92%纯度)lcms(esi)rt=0.691分钟。ms计算值[m+1]476.2。实测值[m+1]476.2。实施例170-171将4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪169g(101.14mg,260.78μmol)用适当的相应胺(1.2当量)根据实施例102中描述的程序处理,生成实施例化合物(170),并根据实施例103中描述的程序,生成实施例化合物(171)。实施例化合物(170)和实施例化合物(171)示于表c中。实施例172:化合物172的合成来自实施例99程序b步骤d的5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇99h作为实施例化合物(172)纯化(100%纯度)lcms(esi)计算值[m+1]310.2。实测值[m+1]310.2。1h nmr(500mhz,dmso-d6)δ(ppm)2.65(s,3h),3.82(s,3h),3.97(s,3h),6.50(d,1h),7.12(s,1h),7.47(d,1h),7.58(d,1h),7.87(d,1h),11.04(br s,1h)。实施例173:化合物173的合成步骤a:3-(1-甲基-1h-吡唑-3-基)丙酸乙酯173b。在-78℃下向3-乙炔基-1-甲基-1h-吡唑173a(5.0g,47.14mmol)在thf中的溶液中滴加n-buli(2.5m,20.7ml)并且将溶液在-78℃下搅拌15分钟,随后添加氯甲酸乙酯(7.67g,70.7mmol,6.76ml)。使混合物温热至0℃保持30分钟。然后,将混合物用h2o淬灭,用etoac(50ml)稀释,用h2o(2x20ml)洗涤,经na2so4干燥并减压蒸发,得到3-(1-甲基-1h-吡唑-3-基)丙炔酸乙酯173b(7.2g,82.0%纯度,33.13mmol,70.3%产率)。lcms计算值[m+1]179.0。实测值[m+1]179.0。rt=1.121分钟。步骤b:4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173c。在ar气氛下,向3-(1-甲基-1h-吡唑-3-基)丙炔酸乙酯173b(2.0g,11.23mmol)在二噁烷(30ml)中的溶液中添加1,3-双(二苯基膦基)丙烷(694.48mg,1.68mmol)和2-异氰基乙酸乙酯(1.9g,16.84mmol,1.84ml)。将反应混合物在100℃下搅拌过夜,然后冷却至室温。减压蒸发挥发物。将残余物用etoac(50ml)稀释并用水(3x15ml)洗涤。将etoac在na2so4下干燥,减压蒸发,得到粗制化合物,将该粗制化合物通过快速色谱法纯化,得到4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173c(1.4g,95%纯度,42.8%产率)。1h nmr(500mhz,cdcl3)δ(ppm)1.38(m,6h),3.81(s,3h),4.32(m,4h),6.27(s,1h),7.11(d,1h),7.27(d,1h),9.36(br s,1h)。步骤c:1-氨基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173d。在0℃下向4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173c(17.5g,60.07mmol)在dmf(170ml)中的溶液中添加氢化钠(3.12g,130.16mmol)。1小时后,逐份添加o-(2,4-二硝基苯基)羟胺(15.55g,78.1mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*50ml)萃取,将合并的etoac用水(7*20ml)洗涤,干燥并减压蒸发,得到1-氨基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173d(16.7g,86.3%纯度,78.3%产率)。lcms(esi)rt=1.067分钟。ms计算值[m+1]307.0。实测值[m+1]307.0。步骤d:4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173e。将1-氨基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2,3-二甲酸二乙酯173d(10.41g,33.98mmol)和1-甲基-1h-咪唑-2-甲腈(3.64g,33.98mmol,3.64ml)溶于二噁烷(150ml)中并且添加氢化钠(2.72g,113.28mmol)。将反应混合物在100℃下搅拌16小时。然后,将混合物冷却至室温并添加nh4cl水溶液。用etoac(70ml*3)萃取产物。将水层真空浓缩,得到4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173e(6.3g,31.8%纯度,17.3%产率)。lcms(esi):rt=0.864分钟。ms计算值[m+1]340.0。实测值[m+1]340.0。步骤e:4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173f。在用冰冷却下,向4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173e(6.39g,18.84mmol)在meoh(70ml)中的溶液中滴加亚硫酰氯(3.36g,28.26mmol,2.05ml)。将反应混合物在65℃下搅拌过夜。然后,减压蒸发挥发物。将100ml的ch3cn添加到粗制化合物中,从固体中过滤并将滤液真空浓缩,得到4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173f(4.5g,62.5%纯度,44.1%产率)。lcms(esi)rt=1.001分钟。ms计算值[m+1]354.0。实测值[m+1]354.0。步骤f:4-氯-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173g。将4-羟基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173f(3.8g,10.75mmol)悬浮于三氯氧磷(16.48g,107.5mmol,10.02ml)中并将反应混合物在100℃下加热16小时。将溶液冷却至室温。减压蒸发挥发物。将残余物倒入冰中并添加k2co3直至ph 5。用氯仿(3x50ml)萃取产物并减压蒸发,得到4-氯-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173g(3.7g,38.5%纯度,30.2%产率)。lcms(esi)rt=0.930分钟。ms计算值[m+1]372.2。实测值[m+1]372.2。步骤g:4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173h。在用冰冷却下,向4-氯-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173g(2.16g,5.82mmol)和4-甲氧基吡啶-2-胺(865.36mg,6.98mmol)在无水dmf(25ml)中的溶液中添加氢化钠(464.67mg,19.36mmol)。将反应混合物在室温下搅拌3小时。然后,将混合物倒入饱和nh4cl溶液(20ml)中并减压蒸发。将30ml乙醇添加到粗制化合物中并过滤沉淀物,在空气中干燥,得到4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173h(2.5g,56.6%纯度,53.2%产率)。lcms(esi)rt=0.859分钟。计算值[m+1]460.0。实测值[m+1]460.0。步骤h:4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173i。向4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173h(2.5g,5.44mmol)在meoh(15ml)中的溶液中,添加氢氧化钠(435.32mg,10.89mmol)在水(15ml)中的溶液。将反应混合物在室温下搅拌过夜。反应完成后,减压蒸发meoh并用5m hcl将水溶液酸化至ph 5。然后,用二氯甲烷(3x10ml)萃取产物。蒸发水,得到4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173i(1.95g,93.4%,75.2%产率)。lcms(esi)rt=0.766分钟。ms计算值[m+1]446.2。实测值[m+1]446.2。步骤i:n-乙基-4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酰胺(173)。一般程序:在室温下向4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173i(120.67mg,271.06μmol)在ch3cn(15ml)中的悬浮液中添加1-甲基-1h-咪唑(55.62mg,677.85μmol,50.0μl)和tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)(114.01mg,407.14μmol)。将所得混合物搅拌10分钟并在用冰冷却下添加适当的胺(580.83μmol)。将反应混合物在室温下搅拌过夜。然后,减压去除ch3cn,并将粗制化合物用hplc(柱:chromatorex c18 smb100-5t100*19mm,5μm;3%-10%-55%0-2-10分钟h2o/meoh,流速30ml/分钟((泵装载4ml meoh)纯化。使用一般程序用乙胺(26.17mg,580.83μmol,40.0μl),得到n-乙基-4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酰胺(173)(3.6mg,95%纯度,2.8%产率)(100%纯度)。lcms(esi)rt=0.831分钟。计算值[m+1]473.2。实测值[m+1]473.2。实施例174-实施例179根据实施例173步骤i中描述的一般程序,在室温下向4-((4-甲氧基吡啶-2-基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸173i在ch3cn中的悬浮液中,添加1-甲基-1h-咪唑和tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)。将所得混合物搅拌10分钟并在用冰冷却下添加适当的胺。反应量示于表a中,并且实施例化合物(174)-实施例化合物(179)的分析数据和结构示于表c中。表a:实施例180:化合物180的合成步骤a:rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯(180)。向4-氯-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯173g(2.3g,6.18mmol)在ch3cn中的悬浮液中添加diea(2.4g,18.54mmol,3.23ml)和rac(1s,3s)-3-甲氧基环戊-1-胺(712.02mg,6.18mmol)。将反应混合物在80℃下搅拌过夜,然后减压蒸发。添加ch2cl2(70ml)并用水(3x15ml)洗涤。将有机层在na2so4下干燥并蒸发,得到所需产物(2.55g,19.4%纯度,17.8%产率)。通过hplc纯化少量得到11.7mg(98%纯度)rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯(180)。lcms(esi)计算值[m+1]451.2。实测值[m+1]451.2。实施例181:化合物181的合成步骤a:rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸181a。向rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸甲酯(180)(2.55g,5.66mmol)在meoh(20ml)中的溶液中,添加在20ml水中的氢氧化钠(452.88mg,11.32mmol)。将反应混合物在室温下搅拌过夜,然后蒸发meoh。用etoac(3x15ml)萃取水,然后用2n hcl将水酸化至ph 5,用二氯甲烷(3x15ml)萃取并蒸发水层,得到粗制化合物,将其通过快速色谱法(sio2,己烷-etoac)纯化,得到rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸181a(0.7g,100%纯度,28.3%产率)。步骤b:rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)-n-(2,2,2-三氟乙基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酰胺(181)。在室温下向rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸181a(220.0mg,504.05μmol)在ch3cn(20ml)中的悬浮液中,添加1-甲基-1h-咪唑(165.63mg,2.02mmol)和tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)(212.26mg,756.51μmol)。10分钟后,在用冰冷却下添加2,2,2-三氟乙烷-1-胺盐酸盐(102.52mg,756.51μmol)。将反应混合物在室温下搅拌过夜,然后减压蒸发ch3cn,并将粗制化合物通过hplc(0-2-10分钟;48-55-80%h2o/mecn/0.1%nh4oh,流速30ml/分钟((泵装载4ml mecn);柱:xbridge beh c18 100*19mm,5μm)纯化,得到呈米色固体的rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)-n-(2,2,2-三氟乙基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酰胺(181)(3.3mg,95%纯度,1.3%产率)(纯度100%)。lcms(esi)rt=1.103分钟。计算值[m+1]518.2。实测值[m+1]518.2。实施例182-实施例185。根据实施例181步骤b中描述的一般程序,在室温下向rac 4-(((1s,3s)-3-甲氧基环戊基)氨基)-2-(1-甲基-ih-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-5-甲酸181a在ch3cn中的悬浮液中,添加1-甲基-1h-咪唑和tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)。将所得混合物搅拌10分钟并在用冰冷却下添加适当的胺。反应量示于表b中,并且实施例化合物(182)-实施例化合物(185)的分析数据和结构示于表c中。表b:实施例186:化合物186的合成步骤a:n-(4-(2-叠氮基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺186a。将氢化钠(50.36mg,2.1mmol)(60%在矿物油中)一次性添加到4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪99(如实施例99程序b步骤e中所述制备)(250.0mg,762.73μmol)和4-(2-叠氮基乙氧基)吡啶-2-胺(205.08mg,1.14mmol)在dmf(5ml)中的溶液中。将混合物在室温下搅拌16小时。将混合物用浓nh4cl水溶液淬灭。通过过滤收集形成的沉淀物,用mecn研磨并真空干燥。获得n-(4-(2-叠氮基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺186a(120.0mg,255.05μmol,33.4%产率)。步骤b:n-(4-(2-氨基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺二氢盐酸盐186b。向n-(4-(2-叠氮基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺186a(120.0mg,255.05μmol)的溶液中溶解3ml ofthf,并在室温下逐份添加三苯基磷烷(80.01mg,305.07μmol)。将混合物搅拌30分钟并一次性添加水(45.8mg,2.54mmol)。将混合物在室温下搅拌16小时,然后浓缩并用0.5m hcl水溶液(10ml)稀释。将溶液用etoac(5ml)萃取3次。真空干燥水相。获得n-(4-(2-氨基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺二氢盐酸盐186b并且无需进一步纯化即用于下一步骤。步骤c:n-(2-((2-((5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-基)氨基)吡啶-4-基)氧基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(186)。向生物素(5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酸)186c(47.71mg,195.29μmol)在dmf(2ml)中的溶液中一次性添加tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)(89.11mg,234.35μmol)。然后一次性添加diea(126.14mg,975.99μmol,170.0μl),并且将混合物搅拌15分钟。添加n-(4-(2-氨基乙氧基)吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺二盐酸盐186b(101.05mg,195.29μmol),并将混合物在室温下搅拌16小时。hplc纯化(0-2-10分钟13%-20%-45%h2o/mecn/0.1%nh4oh,流速30ml/分钟((泵装载4ml mec n/0.1%nh4oh);柱:xbridge beh c18 100*19mm,5μm)后,获得呈橄榄固体的n-(2-((2-((5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-基)氨基)吡啶-4-基)氧基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(186)(60.0mg,89.45μmol,两步35%产率)(98%纯度)。lcms(es i)rt=0.777分钟。ms计算值[m+1]671.2。实测值[m+1]671.2。实施例187:化合物187的合成步骤a:3-甲基-4-(1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯187b。在ar气氛下将3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑187a(34.79g,179.23mmol)、4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如实施例50步骤a中所述制备)(25.0g,89.61mmol)、碳酸钠(18.99g,179.23mmol)和双(4-(二-叔丁基磷烷基)-n,n-二甲基苯胺)二氯化钯(1.27g,1.79mmol)溶于脱气ch3cn(700ml)中。然后,经由注射器添加70ml水。将反应混合物加热至70℃,并在该温度下搅拌18小时。将混合物冷却至室温,通过硅藻土垫过滤并减压浓缩滤液。将残余物通过fcc(interchim;80g,c18,水/乙腈(含0~60%乙腈),流速=60ml/分钟,rv=11-13cv)纯化,得到3-甲基-4-(1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯187b(970.0mg,90.0%纯度,3.98mmol,4.4%产率)。lcms(esi)rt=1.024分钟。计算值[m+1]220.2。实测值[m+i]220.2。步骤b:4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187c。将1-叠氮基-2-溴乙烷(492.59mg,3.31mmol)一次性添加到3-甲基-4-(1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯187b(690.0mg,3.15mmol)和diea(610.13mg,4.72mmol)于ch3cn(15ml)中的搅拌溶液中。将混合物加热至80℃,并在该温度下搅拌过夜。然后将反应混合物真空浓缩,用冰水(150ml)稀释并用etoac(3*150ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(interchim,80g sio2,己烷/mtbe(20%-84%),流速=60ml/分钟,rv=17,2-23,1cv)纯化,得到4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187c(290.0mg,95.0%纯度,955.58μmol,30.3%产率)。lcms(esi)rt=1.035分钟。ms计算值[m+1]289.2。实测值[m+1]289.2。步骤c:1-氨基-4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187d。在0℃下将氢化钠(0.06g,1.5mmol)(60%在矿物油中)逐份添加到4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187c(290.0mg,1.01mmol)在dmf(8ml)中的溶液中。将混合物在室温搅拌1小时。然后,将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(300.19mg,1.51mmol)。将混合物在室温搅拌16小时。然后将混合物倒入冰水中并用etoac(3*100ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到呈深色油状物的1-氨基-4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187d(570.0mg,50.0%纯度,939.6μmol,93.4%产率)。lcms(esi)rt=2.871分钟。ms计算值[m+1]304.2。实测值[m+1]304.2。步骤d:6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇187e。将氢化钠(0.15g,3.75mmol)(60%在矿物油中)逐份添加到1-氨基-4-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-3-甲基-1h-吡咯-2-甲酸乙酯187d(570.0mg,1.88mmol)和1-甲基-1h-咪唑-2-甲腈(151.16mg,1.41mmol)在无水二噁烷(8ml)中的溶液中。然后,将反应混合物加热至80℃并在该温度下搅拌16小时。将混合物冷却至室温,倒入冰水中,用乙酸中和并用etoac(3*30ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(interchim;40g sio2,氯仿/乙腈(含0~60%乙腈),流速=40ml/分钟,11.9-14.5)纯化,得到6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇187e(210.0mg,85.0%纯度,489.89μmol,52%产率)。lcms(esi)rt=1.208分钟。ms计算值[m+1]365.2。实测值[m+1]365.2。[步骤e:6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪187f。向6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇187e(220.0mg,604.15μmol)在ch3cn(15ml)中的溶液中滴加三氯氧磷(4.58g,30.17mmol)。将混合物加热至80℃并在该温度下搅拌16小时,然后真空浓缩,倒入冰水(15ml)中并用nahco3(水溶液)中和,并用etoac(3*15ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到呈黄色固体的6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪187f(220.0mg,70.0%纯度,402.29μmol,66.7%产率)。lcms(esi)rt=2.807分钟:ms计算值[m+1]383.2。实测值[m+1]383.2。步骤f:6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺187g。将氢化钠(57mg,1.425mmol)(60%在矿物油中)逐份添加到4-甲氧基吡啶-2-胺(100.2mg,807.67μmol)在dmf(1ml)中的溶液中。将混合物在室温下搅拌30分钟,然后一次性添加6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-4-氯-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪187f(220.0mg,575.74μmol),并搅拌过夜。此后,将所得混合物用饱和nh4cl淬灭。通过过滤收集形成的沉淀物,用水(2*1ml)洗涤并通过hplc(0-2-10分钟43%-50%-85%h2o/meoh;流速30ml/分钟((泵装载4ml meoh)柱:chromatorex c18smb100-5t 100*19mm,5μm)纯化,得到6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺187g(77.9mg,95.0%纯度,157.29μmol,39%产率)。lcms(esi)rt=0.892分钟。ms计算值[m+1]471.2。实测值[m+1]471.0。步骤g:6-(1-(2-氨基乙基)-1h-吡唑-3-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(187)。向6-(1-(2-叠氮基乙基)-1h-吡唑-3-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺187g(77.9mg,165.67μmol)在thf(5ml)中的溶液中一次性添加三苯基磷烷(45.57mg,173.86μmol)。将混合物在室温下搅拌过夜。滴加1n hcl(1ml)后,在2小时内搅拌。将所得混合物用ch2cl2(2x5ml)洗涤,用nahco3(水溶液)调节至ph 8并用etoac(3x5ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过hplc(0-2-12分钟0-55h2o/meoh/0.1fa;流速30ml/分钟((泵装载4mlmeoh)柱:xbridge beh c18 100*19mm,5μm))纯化:得到6-(1-(2-氨基乙基)-1h-吡唑-3-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(187)(2.9mg,93.0%纯度,6.07μmol,3.7%产率)。lcms(esi)rt=0.775分钟。计算值[m+1]445.2。实测值[m+1]445.2。实施例188:化合物188的合成步骤a:2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇188a。将氢化钠(934.36mg,38.94mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-3-甲基-4-(1-甲基-1h-吡唑-3-基)-1h-吡咯-2-甲酸乙酯99d(2.9g,11.68mmol)(如实施例99程序b步骤c中所述制备)和1-(2-叠氮基乙基)-1i-咪唑-2-甲腈(2.27g,14.02mmol)在二噁烷(20ml)中的溶液中。将反应混合物回流加热16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*10ml)洗涤并真空干燥。获得2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇188a(1.0g,2.74mmol,23.5%产率)。步骤b:2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-4-氯-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪188b。将2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇188a(1.0g,2.74mmol)溶于三氯氧磷(8.42g,54.91mmol,5.12ml)中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(5ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*5ml)洗涤并真空空干燥。获得2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-4-氯-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪188b(740.0mg,1.93mmol,70.4%产率)。步骤c:2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺188c。将氢化钠(135.23mg,5.64mmol)(60%在矿物油中)逐份添加到-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-4-氯-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪188b(740.0mg,1.93mmol)和4-甲氧基吡啶-2-胺(359.76mg,2.9mmol)在dmf(10ml)中的溶液中。将混合物在室温下搅拌16小时。将混合物用浓nh4cl水溶液淬灭。通过过滤收集形成的沉淀物,用mecn研磨并真空干燥。获得2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺188c(400.0mg,850.18μmol,44%产率)。步骤d:2-(1-(2-氨基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(188)。在室温下向2-(1-(2-叠氮基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺188c(400.0mg,850.18μmol)在10ml thf中的溶液中,逐份添加三苯基磷烷(267.66mg,1.02mmol)。将混合物搅拌30分钟并一次性添加水(15.32mg,850.41μmol,20.0μl)。将混合物在室温下搅拌16小时,然后浓缩并用0.5m hcl水溶液(10ml)稀释。将溶液用etoac(5ml)萃取3次。真空干燥水相。获得2-(1-(2-氨基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(188)(350.0mg,676.44μmol,92.6%产率)。将分析样品通过hplc(0-2-10分钟40%-60%-85%h2o/meoh;流速30ml/分钟((泵装载4mlmeoh);柱:xbridge beh c18 100*19mm,5μm)纯化,得到2-(1-(2-氨基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(188)(6.0mg,11.6μmol)(纯度95%)。lcms(esi)rt=0.638分钟。计算值[m+1]445.2。实测值[m+1]445.2。实施例189:化合物189的合成步骤a:3-((苯磺酰基)甲基)吡啶169b。将3-(氯甲基)吡啶盐酸盐169a(60.0g,368.11mmol)、苯亚磺酸钠(90.07g,549.23mmol)和乙酸钠(60.01g,731.84mmol)溶于600ml ipa中。将混合物在80℃下搅拌16小时。然后,将混合物冷却至室温并通过过滤收集形成的沉淀物,然后用300ml mtbe洗涤。将沉淀物溶于500ml二氯甲烷中并用0.5m k2co3(4*300ml)萃取4次。有机相经硫酸钠干燥,过滤并真空蒸发溶剂。获得呈黄色固体的3-((苯磺酰基)甲基)吡啶169b(27.7g,118.74mmol,32.5%产率)。lcms(esi)rt=0.819分钟。ms计算值[m+1]234.2。实测值[m+1]234.2。步骤b:(z)-3-(2-苯基-1-(苯磺酰基)乙烯基)吡啶189a。在0℃下将钠(3.33g,145.03mmol)一次性添加到300ml meoh中。将混合物搅拌1小时直至停止气体形成。向混合物中添加3-((苯磺酰基)甲基)吡啶169b(26.0g,111.56mmol),随后添加苯甲醛(11.83g,111.56mmol)。将混合物加热至60℃并在该温度下搅拌16小时。观察到45%转化率(lcms对照),并添加苯甲醛(11.83g,111.56mmol)。将混合物在60℃下搅拌16小时并重复该程序直至获得>90%的转化率(lcms对照)。将混合物浓缩并用500ml水和500ml dcm稀释。分离有机相,用盐水洗涤,经硫酸钠干燥并真空蒸发。将残余物在己烷∶mtbe(2∶1)中研磨并通过过滤收集形成的沉淀物,并通过快速色谱法纯化。获得(z)-3-(2-苯基-1-(苯磺酰基)乙烯基)吡啶189a(8.0g,24.89mmol,22.3%产率)。lcms(esi)rt=1.300分钟。ms计算值[m+1]322.2。实测值[m+1]322.0。步骤c:3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189b。在0℃下,将(z)-3-(2-苯基-1-(苯磺酰基)乙烯基)吡啶189a(27.7g,86.28mmol)一次性添加到叔丁醇钾(9.67g,86.33mmol)在300ml thf中的溶液中。滴加2-异氰基乙酸乙酯(9.75g,86.24mmol,9.42ml)并将混合物在室温下搅拌3小时。将混合物真空浓缩,用300ml水和300ml etoac稀释。分离有机相并用0.5m k2co3(300ml)洗涤3次,经na2so4干燥并真空浓缩。将残余物在mtbe中研磨并通过过滤收集形成的沉淀物。获得3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189b(15.0g,51.31mmol,59.5%产率)。lcms(esi)rt=0.816分钟。ms计算值[m+1]293.2。实测值[m+1]293.2。步骤d:1-氨基-3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189c。在0℃下将3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189b(15.0g,51.35mmol)逐份添加到(60%在矿物油中)氢化钠(2.67g,111.17mmol)在200ml dmf中的悬浮液中。将混合物搅拌1小时并一次性添加o-(2,4-二硝基苯基)羟胺(13.28g,66.74mmol)。将混合物在室温下搅拌16小时,然后用400ml水淬灭。将混合物用etoac(3*300ml)萃取3次。将有机相用盐水(5*300ml)洗涤5次,经硫酸钠干燥并真空浓缩。获得1-氨基-3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189c(15.0g,48.8mmol,95.1%产率)并且无需进一步纯化即用于下一步骤。lcms(esi)rt=1.022分钟。ms计算值[m+1]308.2。实测值[m+1]451.2。步骤e:2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(189)。将氢化钠(3.91g,162.8mmol)(60%在矿物油中)逐份(在3分钟内)添加到1-氨基-3-苯基-4-(吡啶-3-基)-1h-吡咯-2-甲酸乙酯189c(15.0g,48.84mmol)和1-甲基-1h-咪唑-2-甲腈(6.27g,58.61mmol)在二噁烷(300ml)中的溶液中。将反应混合物加热至回流,并在该温度下搅拌16小时。然后将混合物冷却至室温,倒入冰水中并用乙酸中和。通过过滤收集形成的沉淀物,用水(2*50ml)洗涤,真空干燥,得到2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(189)(6.0g,16.29mmol,33.3%产率)(100%纯度)。lcms(esi)rt=1.043分钟。ms计算值[m+1]369.0。实测值[m+1]369.0。1h nmr(400mhz,cdcl3)δ(ppm)4.20(s,3h),7.11(m,3h),7.27(m,6h),7.63(s,1h),8.42(s,1h),8.56(s,1h),9.63(br s,1h)。实施例190:化合物190的合成步骤a:4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪190a。将2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇(189)(如实施例189步骤e中所述制备)(6.0g,16.3mmol)悬浮在100ml pocl3中。将混合物加热至100℃,并在该温度下搅拌16小时。将反应混合物真空浓缩,倒入冰水(50ml)中并用k2co3中和。通过过滤收集形成的沉淀物,用水(2*50ml)洗涤并真空干燥。将残余物通过快速色谱法纯化(用dcm∶ipa 100∶1至1∶100洗脱)。获得4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪190a(1.5g,3.88mmol,23.8%产率)并且无需进一步纯化即用于下一步骤。lcms(esi)rt=0.808分钟。ms计算值[m+1]387.0。实测值[m+1]387.0。步骤b:rac n-((1r,2r)-2-甲氧基环丙基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(190)。使用实施例103步骤a中描述的程序,在dmf(1ml)中的diea(150.8mg,1.31mmol,200.0μl)、4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪190a(101.49mg,262.86μmol)和rac((1r,2r)-2-甲氧基环丙-1-胺盐酸盐(64.69mg,525.72μmol)得到呈黄色固体的rac n-((1r,2r)-2-甲氧基环丙基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(190)(8.5mg,95.0%纯度,18.46μmol,7%产率)。lcms(esi)rt=0.834分钟。ms计算值[m+1]438.2。实测值[m+1]438.2。1h nmr(500mhz,dmso-d6)δ(ppm)0.50(m,1h),1.01(m,1h),2.82(m,2h),3.01(m,2h),4.00(s,3h),5.28(m,2h),6.98(s,1h),7.23(m,2h),7.35(m,2h),7.52(m,4h),8.17(s,1h),8.39(m,2h)。实施例191-实施例196按照实施例190步骤b中描述的程序,将4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪190a用适当的相应胺处理,生成实施例191-195的化合物。按照实施例102步骤a中描述的程序,将4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基-6-(吡啶-3-基)吡咯并[2,1-f][1,2,4]三嗪190a用适当的相应胺处理,生成实施例196的化合物。实施例化合物(191)-(196)与它们的分析数据示于表c中。实施例197-实施例202使用与实施例189和实施例190中描述的程序相似的程序,使用适当的原材料制备实施例化合物(197)-(202)。实施例化合物(197)-(202)与它们的分析数据示于表c中。实施例203:化合物203的合成步骤a:2-(3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203a。将4-溴-3-苯基-1h-吡咯-2-甲酸乙酯4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42c(如实施例42步骤b中所述制备)(1.0g,3.41mmol)、苯基硼酸(414.32mg,3.39mmol)、碳酸铯(2.21g,6.8mmol)、pd(dppf)cl2*2dcm(277.5mg,340.95μmol)在二噁烷/h2o(20ml/1ml)中的混合物在100℃下在氩气气氛下加热过夜。蒸发反应混合物,并通过快速色谱法纯化粗制化合物,得到2-(3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203a(0.5g,91.9%纯度,46.4%产率)。lcms(esi)rt=1.317分钟。ms计算值[m+1]292.2。实测值[m+1]292.2。步骤b:2-(1-氨基-3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203b。在0℃下向2-(3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203a(500.22mg,1.72mmol)在dmf(15ml)中的溶液中添加氢化钠(60%在矿物油中)(89.27mg,3.72mmol)。1小时后,在0℃下逐份添加o-(2,4-二硝基苯基)羟胺(444.44mg,2.23mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*15ml)萃取,将合并的etoac用水(7*10ml)洗涤,干燥并减压蒸发,得到2-(1-氨基-3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203b(0.5g,82.9%纯度,87.7%产率)。lcms(esi)rt=1.331分钟。ms计算值[m+1]307.2。实测值[m+1]307.2。步骤c:2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇203c。在用冰冷却下,向得到的2-(1-氨基-3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203b(500.31mg,1.63mmol)和1-甲基-1i-咪唑-2-甲腈(192.42mg,1.8mmol)在二噁烷(20ml)中的混合物中添加氢化钠(60%在矿物油中)(130.63mg,5.44mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中,用etoac(3*40ml)萃取,干燥并减压蒸发,得到2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇203c(0.52g,64.7%纯度,56.1%产率)。lcms(esi)rt=1.447分钟。ms计算值[m+1]368.2。实测值[m+1]368.0。步骤d:4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪203d。将原材料2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇203c(520.0mg,1.42mmol)悬浮在三氯氧磷(2.17g,14.29mmol)中,并将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3水溶液中并将产物用氯仿(3*20ml)萃取,蒸发,得到4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪203d(0.6g,71.2%纯度,78%产率)。lcms(esi)rt=1.264分钟。ms计算值[m+1]386.2。实测值[m+1]386.2。步骤e:n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(203)。在室温下向4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪203d(600.0mg,1.56mmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(321.16mg,2.34mmol)在ch3cn(20ml)中的悬浮液中添加diea(603.28mg,4.67mmol)。将反应混合物在80℃下搅拌过夜。反应完成后,蒸发ch3cn并通过hplc纯化粗制物质,得到呈黄色固体的n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(203)(18.4mg,95%纯度,2.6%产率)。lcms(esi)rt=1.159分钟。ms计算值[m+1]451.2。实测值[m+1]451.2。1h nmr(500mhz,dmso-d6)δ(ppm)1.80(m,2h),2.22(m,2h),3.08(s,3h),3.79(m,1h),3.94(s,3h),4.47(m,1h),5.41(d,1h),7.98(d,1h),7.17(m,1h),7.28(m,5h),7.50(m,5h),8.13(m,1h)。实施例204:化合物204的合成步骤a:2-(4-(3-(叠氮基甲基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯204b。将2-(3-(叠氮基甲基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷204a(1.0g,3.86mmol)、4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42c(如实施例42步骤b中所述制备)(1.14g,3.87mmol)、碳酸铯(2.52g,7.72mmol)和[1,1-(双二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷络合物(315.21mg,387.29μmol)在二噁烷/h2o(20ml/1ml)中的混合物在100℃下在氩气气氛下加热过夜。将反应混合物减压蒸发,并通过快速色谱法(sio2,己烷--etoac)纯化粗制化合物,得到2-(4-(3-(叠氮基甲基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯204b(0.32g,92%纯度,22.1%产率)。lcms(esi)rt=1.569分钟。ms计算值[m+1]347.2。实测值[m+1]347.2。步骤b:2-(1-氨基-3,4-二苯基-ih-吡咯-2-基)-2-氧代乙酸乙酯203b。在0℃下向2-(4-(3-(叠氮基甲基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯204b(320.12mg,924.83μmol)在dmf(15ml)中的溶液中添加氢化钠(48.05mg,2.0mmol)。1小时后,在0℃下逐份添加o-(2,4-二硝基苯基)羟胺(239.23mg,1.2mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中,并用etoac(3*20ml)萃取产物。将合并的etoac层用水(7*10ml)洗涤,经na2so4干燥并减压蒸发,得到2-(1-氨基-3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203b(132mg,93.2%纯度,36.7%产率)。lcms(esi)rt=1.416分钟。ms计算值[m+1]362.2。实测值[m+1]362.2。步骤c:6-(3-(叠氮基甲基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇204d。在用冰冷却下,向2-(1-氨基-3,4-二苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯203b(131.75mg,364.79μmol)和1-甲基-1h-咪唑-2-甲腈(39.0mg,364.32μmol,40.0μl)在二噁烷(15ml)中的混合物中添加氢化钠(29.16mg,1.22mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中。将产物用etoac(3*20ml)萃取,干燥并减压蒸发,得到6-(3-(叠氮基甲基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇204d(141mg,78.5%纯度,71.4%产率)。lcms(esi)rt=1.382分钟。ms计算值[m+1]423.2。实测值[m+1]423.0。步骤d:6-(3-(叠氮基甲基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪204e。将原材料6-(3-(叠氮基甲基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇204d(140.85mg,333.64μmol)悬浮于三氯氧磷(509.95mg,3.36mmol,310.0μl)中。将反应混合物在100℃下加热过夜。将溶液冷却至室温。减压去除挥发物并将残余物倒入nahco3水溶液中。用氯仿(3*20ml)萃取产物。真空去除溶剂,得到6-(3-(叠氮基甲基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪204e(126mg,44.5%纯度,38.1%产率)。lcms(esi)rt=1.204分钟。ms计算值[m+1]441.2。实测值[m+1]441.2。步骤e:6-(3-(叠氮基甲基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺204f。在室温下向6-(3-(叠氮基甲基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪204e(126.45mg,287.3μmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(47.36mg,345.54μmol)在ch3cn中的悬浮液中,添加diea(111.3mg,861.78μmol,150.0μl,3.0当量)。将反应混合物在80℃下搅拌过夜。完成后,过滤反应混合物并蒸发滤液,得到6-(3-(叠氮基甲基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺204f(203mg,68.5%纯度,95.9%产率)。lcms(esi)rt=1.217分钟。ms计算值[m+1]506.2。实测值[m+1]506.2。步骤f:6-(3-(氨基甲基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐(204)。向6-(3-(叠氮基甲基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺204f(203.01mg,500.78μmol)在thf(30ml)中的溶液中,添加水(18.0mg,999.41μmol,20.0μl)和三苯基磷烷(157.51mg,600.98μmol)。将反应混合物在室温下搅拌过夜。反应完成后,蒸发thf。将15ml的5mhcl添加到粗制化合物中并加热至80℃保持5小时。然后,将反应混合物冷却并用dcm(3*10ml)萃取,然后将水蒸发。将粗制化合物通过hplc(0-2-9分钟0-0-40%mecn/h2o+hcl,流速30ml/分钟(泵装载4ml mecn);柱:chromatorex c18 smb100-5t 100*19,5μm)纯化,得到6-(3-(氨基甲基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺盐酸盐(204)(5.2mg,95%纯度,2.4%产率)。lcms(esi)rt=0.779分钟。ms计算值[m+1]480.2。实测值[m+1]480.2。实施例205:化合物205的合成。步骤a:2-(4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205b。将2-(3-(2-叠氮基乙氧基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷205a(1.0g,3.46mmol)、4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42c(如实施例42步骤b中所述制备)(915.7mg,3.13mmol)、碳酸铯(2.25g,6.92mmol)和[1,1′-(双二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷络合物(282.48mg,347.07μmol)在二噁烷/h2o(20ml/1ml)中的混合物在100℃下在氩气气氛下加热过夜。将反应混合物减压蒸发,并通过快速色谱法纯化粗制化合物,得到2-(4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205b(0.5g,70.5%纯度,27.1%产率)。lcms(esi)rt=1.403分钟。ms计算值[m+1]377.2。实测值[m+1]377.2。步骤b:2-(1-氨基-4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205c。在0℃下向2-(4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205b(500.05mg,1.33mmol)在dmf(20ml)中的溶液中添加氢化钠(69.07mg,2.88mmol)。1小时后,在0℃下逐份添加o-(2,4-二硝基苯基)羟胺(343.89mg,1.73mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中。用etoac(3*75ml)萃取产物。将合并的etoac层用水(7*10ml)洗涤,干燥并减压蒸发,得到2-(1-氨基-4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205c(0.38g,59.1%纯度,43.1%产率)。lcms(esi);rt=1.507分钟。ms计算值[m+1]392.2。实测值[m+1]392.2。步骤c:6-(3-(2-叠氮基乙氧基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇205d。在用冰冷却下,向2-(1-氨基-4-(3-(2-叠氮基乙氧基)苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯205c(379.77mg,970.88μmol)和1-甲基-1h-咪唑-2-甲腈(114.32mg,1.07mmol)在二噁烷(20ml)中的混合物中添加氢化钠(77.61mg,3.23mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中。将产物用etoac(3*20ml)萃取,干燥并减压蒸发,得到6-(3-(2-叠氮基乙氧基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇205d(0.42g,61.7%纯度,60.5%产率)。lcms(esi)rt=1.510分钟。ms计算值[m+1]453.2。实测值[m+1]453.2。步骤d:6-(3-(2-叠氮基乙氧基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪205e。将6-(3-(2-叠氮基乙氧基)苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇205d(417.0mg,922.22μmol)悬浮于三氯氧磷(1.41g,9.31mmol,860.0μl)中,并将反应混合物在100℃下加热过夜。将溶液冷却至室温。减压去除挥发物。将残余物倒入nahco3水溶液中并用氯仿(3*15ml)萃取产物。减压蒸发溶剂,得到6-(3-(2-叠氮基乙氧基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪205e(0.33g,72.7%纯度,55.2%产率)。lcms(esi)rt=1.340分钟。ms计算值[m+1]471.2。实测值[m+1]471.0。步骤e:6-(3-(2-叠氮基乙氧基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺205f。在室温下向6-(3-(2-叠氮基乙氧基)苯基)-4-氯-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪205e(333.23mg,708.79μmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(116.85mg,852.53μmol)在ch3cn中的悬浮液中,添加diea(274.54mg,2.13mmol,370.0μl)。将反应混合物在80℃下搅拌过夜。然后,冷却并过滤混合物。减压蒸发滤液,得到6-(3-(2-叠氮基乙氧基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺205f(0.5g,54.8%纯度,74.3%产率)。lcms(e6i)rt=1.191分钟。ms计算值[m+1]53.2。实测值[m+1]53.2。步骤f:6-(3-(2-氨基乙氧基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(205)。向6-(3-(2-叠氮基乙氧基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺205f(505.54mg,944.5μmol)在thf(30ml)中的溶液中,添加水(34.0mg,1.89mmol,30.0μl)和三苯基磷烷(272.32mg,1.04mmol)。将反应混合物在室温下搅拌过夜。完成后,蒸发thf。然后,将15ml的5mhcl添加到粗制化合物并加热至80℃保持5小时。将反应混合物冷却并用dcm(3*10ml)萃取,然后将水蒸发。将粗制化合物用hplc(0-2-9分钟3-10-70%meoh/h2o+hcl,流速30ml/分钟(泵装载4ml meoh);柱:chromatorex c18 smb100-5t 100*19,5μm)纯化,得到6-(3-(2-氨基乙氧基)苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(205)(47.4mg,93.01μmol,96%纯度,9.9%产率)。lcms(esi)rt=0.783分钟。ms计算值[m+1]510.2。实测值[m+1]510.2。1h nmr(500mhz,dmso-d6)δ(ppm)1.81(m,2h),2.30(m,2h),3.10(m,5h),3.76(m,1h),4.05(m,2h),4.24(s,3h),4.70(m,1h),5.70(d,1h),6.81(m,2h),6.88(s,1h),7.17(dd,1h),7.45(m,2h),7.56(m,3h),7.80(d,1h),7.92(d,1h),8.28(m,4h)。实施例206-实施例210实施例化合物(206)和实施例化合物(207)使用与针对实施例化合物(204)描述的程序相似的程序,在步骤a中使用适当的叠氮化物取代的硼酸制备。实施例化合物(208)使用与针对实施例化合物(205)描述的程序相似的程序,在步骤a中使用适当的叠氮化物取代的硼酸制备。实施例化合物(206)-(208)与它们的分析数据示于表c中。实施例209:化合物209的合成步骤a:2-(4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209b。将4-溴-3-苯基-1h-吡咯-2-甲酸乙酯42(如实施例42步骤b中所述制备)(1.0g,3.41mmol)、2-(3-甲氧基-2-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷209a(843.37mg,3.4mmol)、碳酸铯(2.21g,6.8mmol)和[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷络合物(84.72mg,340.15μmol)在二噁烷/h2o(20ml/1ml)中的混合物在氩气气氛下在100℃下加热过夜。蒸发反应混合物,并通过快速色谱法纯化粗制化合物,得到2-(4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209b(670mg,75%纯度,44%产率)。lcms(esi)rt=1.442分钟。ms计算值[m+1]336.2。实测值[m+1]336.0。步骤b:2-(1-氨基-4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209c。在0℃下向2-(4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209b(670.01mg,2.0mmol)在dmf(20ml)中的溶液中添加氢化钠(103.87mg,4.33mmol)。1小时后,在0℃下逐份添加o-(2,4-二硝基苯基)羟胺(517.11mg,2.6mmol)。将反应混合物在室温下搅拌过夜。将nh4cl水溶液添加到反应混合物中。用etoac(3*30ml)萃取产物。将合并的etoac层用水(7*10ml)洗涤,干燥并减压蒸发,得到2-(1-氨基-4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209c(620mg,71.1%纯度,62.9%产率)。lcms(esi)rt=1.453分钟。ms计算值[m+1]351.2。实测值[m+1]351.0。步骤c:6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇209d。在用冰冷却下,向2-(1-氨基-4-(3-甲氧基-2-甲基苯基)-3-苯基-1h-吡咯-2-基)-2-氧代乙酸乙酯209c(620mg,1.77mmol)和1-甲基-1h-咪唑-2-甲腈(208.47mg,1.95mmol)在二噁烷(20ml)中的混合物中添加氢化钠(141.53mg,5.9mmol)。将反应混合物在100℃下搅拌过夜。将nh4cl水溶液添加到反应混合物中。将产物用etoac(3*15ml)萃取,干燥并减压蒸发,得到6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇209d(750mg,56%纯度,57.5%产率)。lcms(esi)rt=1.338分钟。ms计算值[m+1]412.2。实测值[m+1]412.2。步骤d:4-氯-6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪209e。将6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇209d(750.36mg,1.82mmol)悬浮于三氯氧磷(2.8g,18.41mmol,1.7ml)中,并将反应混合物在100℃下加热过夜。将溶液冷却至室温,减压蒸发,倒入nahco3水溶液中并将产物用氯仿(3*20ml)萃取,蒸发,得到4-氯-6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪209e(715mg,58%纯度,53.2%产率)。lcms(esi)rt=1.140分钟。ms计算值[m+1]430.2。实测值[m+1]430.0。步骤e:6-(3-甲氧基-2-甲基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(209)。在室温下向4-氯-6-(3-甲氧基-2-甲基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪209e(715.36mg,1.67mmol)和(1r,3r)-3-甲氧基环丁-1-胺盐酸盐(343.47mg,2.51mmol)在ch3cn中的悬浮液中,添加diea(645.54mg,5.0mmol,870.0μl)。将反应混合物在80℃下搅拌过夜。完成后,蒸发ch3cn并将粗制物质通过hplc(0-2-10分钟48%-55%-85%h2o/meoh/0.1nh4oh,流速30ml/分钟(泵装载4ml meoh);柱:xbridge behc18 100*19mm,5μm)纯化,得到6-(3-甲氧基-2-甲基苯基)-n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(209)(59.5mg,96%纯度,7.2%产率)。lcms(esi)rt=1.181分钟。ms计算值[m+1]496.2。实测值[m+1]496.2。1h nmr(500mhz,dmso-d6)δ(ppm)1.72(s,3h),1.89(m,2h),2.25(m,2h),3.10(s,3h),3.71(s,3h),3.82(m,1h),3.94(s,3h),4.49(m,1h),6.75(d,1h),6.69(dd,1h),6.80(m,1h),6.96(s,1h),7.05(dd,1h),7.26(m,3h),7.42(m,3h),7.85(s,1h)。实施例210:化合物210的合成实施例化合物(210)使用实施例209中描述的方法,在步骤a中使用适当取代的4,4,5,5-四甲基-2-苯基-1,3,2-二氧杂环戊硼烷制备。实施例化合物(210)与分析数据示于表c。实施例211:化合物211的合成步骤a:1-氨基-4-碘-3-甲基-1h-吡咯-2-甲酸乙酯211a。在0℃下(在5分钟的时间段内)向4-碘-3-甲基-1h-吡咯-2-甲酸乙酯50a(如实施例50步骤a中所述制备)(8.00g,28.77mmol)在dmf(80ml)中的搅拌溶液,添加t-buok(3.22g,28.77mmol)并搅拌30分钟(在相同温度下),随后添加o-二苯基氧膦基羟胺(3)(8.04g,34.53mmol)。添加完成后,使所得反应混合物达到室温并在室温下搅拌4小时。将反应混合物用饱和nh4cl溶液(50ml)淬灭,用乙酸乙酯(3x100ml)萃取水层。合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏,得到粗制1-氨基-4-碘-3-甲基-1h-吡咯-2-甲酸乙酯211a(7.50g),其无需任何纯化即用于下一步骤。ms(esi+apci;多模式):ms计算值[m+1]294,实测值[m+1]294。步骤b:4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸乙酯211b。在0℃下,向粗制1-氨基-4-碘-3-甲基-1h-吡咯-2-甲酸乙酯211a(7.50g,25.59mmol)在ch2cl2(150ml)中的搅拌溶液中添加diea(8.25g,63.97mmol)、1-甲基-1h-咪唑-2-甲酸(3.54g,28.14mmol),随后添加t3p(丙烷膦酸酸酐)(50%在etoac中)(20.34g,63.97mmol)。添加完成后,使所得反应混合物达到室温并搅拌12小时。将反应混合物用h2o(400ml)淬灭,用ch2cl2(3x100ml)萃取水层。将合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏,得到粗制物质。通过组合快速柱色谱法(50%乙酸乙酯的己烷溶液)纯化获得的粗制物质,提供呈灰白色固体的4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸乙酯211b(5.50g,44%{经2个步骤}产率)。ms(esi+apci;多模式):计算值[m+1]403。实测值[m+1]403。步骤c:4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸211c。向4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸乙酯211b(5.50g,13.68mmol)在etoh∶h2o(1∶11{100ml})的混合物中的搅拌溶液中添加naoh(2.73g,68.4mmol)并加热至80℃保持5小时。减压蒸发过量的溶剂,留下粘性物质,将其用稀hcl中和,过滤沉淀出的固体,用水洗涤并真空干燥,得到呈灰白色固体的4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸211c(5.50g粗品)。ms(esi+apci;多模式):计算值[m+1]375。实测值[m+1]375。步骤d:n-(2-氨基甲酰基-4-碘-3-甲基-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺211d。在室温下向4-碘-3-甲基-1-(1-甲基-1h-咪唑-2-甲酰胺基)-1h-吡咯-2-甲酸211c(4.00g,10.72mmol)在dmf(80ml)中的搅拌溶液中添加hatu(4.90g,12.88mmol)、nh4cl(3.44g,64.34mmol),随后添加diea(8.30g,64.3mmol)并搅拌12小时。将反应混合物用h2o(100ml)淬灭,用乙酸乙酯(3x100ml)萃取水层。合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥并减压蒸馏,得到呈褐色粘性物质的粗制n-(2-氨基甲酰基-4-碘-3-甲基-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺211d(5.50g,粗品),其无需任何进一步纯化即用于下一步骤。ms(esi+apci;多模式):计算值[m+1]374。实测值[m+1]374。步骤e:6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇211e。向n-(2-氨基甲酰基-4-碘-3-甲基-1h-吡咯-1-基)-1-甲基-1h-咪唑-2-甲酰胺211d(5.50g,14.74mmol)在etoh∶h2o(1∶1{160ml})的混合物中的搅拌溶液中,添加koh(2.48g,44.23mmol)并将所得混合物加热至100℃保持16小时。减压蒸馏出过量的etoh,留下水层;用稀hcl将水层的ph调节至中性,过滤沉淀出的固体,用水(25ml)洗涤,得到粗制物质。通过组合快速柱色谱法(50%-100%乙酸乙酯的己烷溶液)纯化获得的粗制物质,获得呈灰白色固体的6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇211e(2.50g,51%{经3步}产率)。ms(esi+apci;多模式):计算值[m+1]356。实测值[m+1]356。1h nmr(400mhz,dmso-d6)δ2.35(s,3h),3.85(s,3h),6.89(s,1h),7.10(s,1h),7.35(s,1h)。步骤f:4-氯-6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪211f。将6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-醇211e(1.50g,4.23mmol)在pocl3(20ml)中的混合物在100-110℃下加热18小时。减压蒸馏出过量的pocl3,留下粘性深褐色物质,将其在ch2cl2(20ml)中稀释并用nahco3水溶液(50ml)碱化至ph=8-9。再次用ch2cl2(2x100ml)萃取获得的粗制物质,将合并的有机层用盐水溶液(100ml)洗涤,经无水na2so4干燥,并减压浓缩,得到粗制物质,将其用mtbe(20ml)研磨,随后用己烷(20ml)研磨,得到呈黄褐色固体的4-氯-6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪211f(0.80g,粗品)。ms(esi+apci;多模式):计算值[m+1]374。实测值374。步骤g:6-碘-n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211g。在室温下向4-氯-6-碘-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪211f(0.40g,1.07mmol)在dmso(8ml)中的搅拌溶液中,添加4-甲氧基苄胺(176.2mg,1.28mmol)、diea(0.35ml,2.14mmol),然后将所得反应混合物加热至90℃保持16小时。16小时后,将反应混合物倒在冰冷的水(50ml)上,过滤出沉淀的固体,用h2o(2x50ml)洗涤,随后用己烷(2x50ml)洗涤并真空干燥,得到呈灰白色固体的粗制6-碘-n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211g(0.40g,粗品)。ms(esi+apci;多模式):计算值[m+1]475。实测值475。步骤h:n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211h。向6-碘-n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211g(0.40g,0.84mmol)在1,4-二噁烷∶h2o(5∶1,20ml)中的搅拌溶液中,添加cs2co3(685mg,2.10mmol),将所得反应混合物用氩气脱气5分钟,随后添加pd(dppf)cl2(0.030g,0.04mmol)并将所得反应混合物在60℃下搅拌1小时。在1小时内向上述反应混合物中滴加1-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑(0.35g,1.68mmol)在1,4-二噁烷(50ml)中的溶液并将所得反应混合物加热至90℃保持16小时。反应完成后,减压去除所有挥发物,留下粗制物质,将其通过组合快速柱色谱法(5-10%meoh的ch2cl2溶液)纯化,得到呈褐色固体的不纯的n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211h(0.30g,不纯)。ms(esi+apci;多模式):计算值[m+1]429。实测值429。步骤i:5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(211)。向粗制n-(4-甲氧基苄基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺211h(0.30g,0.70mmol)中添加tfa(3ml)并加热至80℃保持4小时。反应完成后,减压去除所有挥发物。将获得的残余物用30ml水淬灭,然后用ch2cl2(2x60ml)萃取。使用饱和nahco3溶液碱化分离的水层,然后用ch2cl2(2x80ml)萃取。将合并的有机层用盐水溶液(50ml)洗涤,经无水na2so4干燥并减压蒸馏,得到5-甲基-2-(1-甲基-1h-咪唑-2-基)-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(211)(120mg,粗品,18%(经4步)产率)。ms(esi+apci;多模式):计算值[m+1]309。实测值[m+1]309。1h nmr(400mhz,dmso-d6)δ7.92(s,1h),7.72(s,1h),7.26(s,1h),6.96(s,1h),6.54(s,1h),3.95(s,3h),3.88(s,3h),2.71(s,3h)。实施例212:化合物212的合成步骤a:2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺212a。将4-氯-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪203d(如实施例203步骤d中所述制备)(2.0g,5.19mmol)溶于30ml mecn中。一次性添加25%nh4oh水溶液。将混合物加热至60℃,并在该温度下搅拌36小时。冷却混合物并通过过滤收集形成的沉淀物,用20ml水、20ml mecn洗涤2次并真空干燥。获得呈浅褐色粉末的2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺212a(1.1g,3.0mmol,57.8%产率)。步骤b:n-(2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-基)甲磺酰胺(212)。使用实施例102步骤a中描述的方法,在dmf(2ml)中的2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺212a(50.0mg,129.87mmol)、甲磺酰胺(24.7mg,260.0mmol)、氢化钠(11.4mg,475.13μmol)(60%在矿物油中)得到呈黄色固体的n-(2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-基)甲磺酰胺(212)(8.5mg,14.8%产率)(纯度100%)。lcms(esi)rt=1.277分钟。计算值[m+1]445.2。实测值[m+1]455.0。实施例213-实施例214使用实施例212中描述的方法,在dmf(1ml)中的2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺212a(100.0mg,0.273mmol)、3-甲氧基丙烷-1-磺酰胺、氢化钠(22.76mg,0.948mmol)(60%在矿物油中)得到实施例化合物(213)。使用实施例212中描述的方法,在dmf(1ml)中的2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺212a(100.0mg,0.259mmol)、(1r,3r)-3-甲氧基环丁烷-1-磺酰氯(100.47mg,0.546mmol)、氢化钠(22.76mg,0.948mmol)(60%在矿物油中)得到实施例化合物(213)。实施例化合物(213)和实施例化合物(214)与分析数据一起示于表c中。实施例215:化合物215的合成步骤a:n-(2-(3-(4-((4-甲氧基吡啶-2-基)氨基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-6-基)-1h-吡唑-1-基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(215)。向生物素186c(19.8mg,81.1μmol)在dmf(2ml)中的溶液中一次性添加tcfh(氯-n,n,n′,n′-四甲基甲脒六氟磷酸盐)(36.99mg,97.32μmol),随后滴加乙基双(丙-2-基)胺(52.37mg,405.49μm ol)。将混合物在室温下搅拌15分钟并添加n-((1r,3r)-3-甲氧基环丁基)-2-(1-甲基-1h-咪唑-2-基)-5,6-二苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(203)(如实施例187步骤g中所述制备)(90.0mg,202.61μmol)在dmf(0.5ml)中的溶液。将混合物搅拌1小时(反应已经完成),然后通过hplc(0-2-12分钟0-55h2o/meoh/0.1fa;流速30ml/分钟((泵装载4ml meoh)柱:xbridge beh c18 100*19mm,5μm))纯化,得到n-(2-(3-(4-((4-甲氧基吡啶-2-基)氨基)-5-甲基-2-(1-甲基-1h-咪唑-2-基)吡咯并[2,1-f][1,2,4]三嗪-6-基)-1h-吡唑-1-基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(215)(7.5mg,95.0%纯度,10.62μmol,13.1%产率)。lcms(esi)rt=0.773分钟。计算值[m+1]671.2。实测值[m+1]671.4。1h nmr(500mhz,dmso-d6)δ(ppm)1.20(m,3h),1.50(m,5h),1.99(t,2h),2.71(m,1h),2.83(s,3h),3.01(m,1h),3.43(m,2h),3.88(s,3h),4.02(m,4h),4.21(m,3h),6.33(m,2h),6.51(s,1h),6.70(m,1h),7.35(m,2h),7.70(s,1h),7.96(m,2h),8.20(m,1h)。实施例216:化合物216的合成步骤e:n-(2-(2-(4-((4-甲氧基吡啶-2-基)氨基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-2-基)-1h-咪唑-1-基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(216)。向生物素186c(165.35mg,676.82μmol)在dmf(2ml)中的溶液中一次性添加hatu(308.81mg,812.18μmol)。然后一次性添加diea(437.78mg,3.39mmol,590.0μl)并将混合物搅拌15分钟。添加2-(1-(2-氨基乙基)-1h-咪唑-2-基)-n-(4-甲氧基吡啶-2-基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-4-胺(188)(如实施例188步骤d中所述制备)(350.19mg,676.82μmol)并将混合物在室温下搅拌16小时。hplc(0-2-9分钟0-0-50%meoh/h2o+hcl,流速:30ml/分钟(泵装载4ml meoh);柱:chromatorex c18 smb100-5t100*19mm,5μm)纯化后,获得呈褐色固体的n-(2-(2-(4-((4-甲氧基吡啶-2-基)氨基)-5-甲基-6-(1-甲基-1h-吡唑-3-基)吡咯并[2,1-f][1,2,4]三嗪-2-基)-1h-咪唑-1-基)乙基)-5-((3ar,4r,6as)-2-氧代六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰胺(216)(60.0mg,89.45μmol,13.2%产率)(纯度97%)。lcms(esi)rt=0.774分钟。计算值[m+1]671.2。实测值[m+1]671.2。1h nmr(500mhz,dmso-d6)δ(ppm)1.15(m,2h),1.26(m,3h),1.50(m,1h),1.99(m,2h),2.77(m,1h),2.81(m,3h),3.01(m,1h),3.20(m,1h),3.50(m,2h),3.80(m,7h),4.03(m,1h),4.14(m,1h),4.58(m,2h),6.27(m,2h),6.52(s,1h),6.74(m,2h),7.20(d,1h),7.48(m,1h),7.70(m,1h),7.84(m,2h),8.24(m,1h)。实施例217:化合物217的合成步骤a:(2-氟-6-甲氧基苯基)甲醇217b。在室温下向2-氟-6-甲氧基苯甲醛217a(49.12g,318.87mmol)在无水meoh(600ml)中的溶液中,逐份添加硼氢化钠(14.55g,382.64mmol),并搅拌过夜。减压蒸发反应混合物后,用水(500ml)稀释并用etoac(3*300ml)稀释3倍。将有机相用水、盐水洗涤,经na2so4干燥并真空浓缩,得到(2-氟-6-甲氧基苯基)甲醇217b(49.75g,95.0%纯度,302.67mmol,94%产率)。1h nmr(400mhz,dmso-d6)δ(ppm)3.87(s,3h),4.62(s,3h),6.770(m,2h),7.20(dd,1h)。步骤b:2-(氯甲基)-1-氟-3-甲氧基苯217c。在室温下向(2-氟-6-甲氧基苯基)甲醇217b(49.75g,318.79mmol)在无水ch2cl2(600ml)和2滴dmf中的溶液中,滴加硫酰二氯(82.69g,701.34mmol),并且搅拌过夜。减压蒸发反应混合物后,得到2-(氯甲基)-1-氟-3-甲氧基苯217c(59.0g,92.0%纯度,310.88mmol,97.5%产率)。1h nmr(400mhz,cdcl3)δ(ppm)3.89(s,3h),4.69(s,2h),6.69(m,2h),7.21(dd,1h)。步骤c:1-氟-3-甲氧基-2-((苯磺酰基)甲基)苯217d。在室温下向2-(氯甲基)-1-氟-3-甲氧基苯217c(59.0g,339.03mmol)在无水ipa(650ml)中的溶液中,逐份添加苯亚磺酸钠(61.16g,372.94mmol),并在80℃下加热过夜。减压蒸发反应混合物后,用水(500ml)稀释并用etoac(3*300ml)稀释3倍。将有机相用水、盐水洗涤,经na2so4干燥并真空浓缩,得到1-氟-3-甲氧基-2-((苯磺酰基)甲基)苯217d(84.25g,90.0%纯度,270.5mmol,79.8%产率)。步骤d:(e)-1-氟-3-甲氧基-2-(2-苯基-1-(苯磺酰基)乙烯基)苯217e。在-78℃下向thf(1500ml)中的1-氟-3-甲氧基-2-((苯磺酰基)甲基)苯217d(50.0g,178.37mmol)中添加lihmds(1.1m在thf/乙苯中,194ml),并将混合物搅拌10分钟。向溶液中添加苯甲醛(22.7g,214.05mmol),并将混合物搅拌1小时。添加氯膦酸二乙酯(36.82g,214.05mmol),并将混合物搅拌1小时。然后在-78℃下添加lihmds(1.1m在thf/乙苯中,194ml),并将混合物搅拌至环境温度。将所得混合物倒入nh4cl(饱和水溶液,800ml)中并用etoac(3*400ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(interchim;800g sio2;石油醚/乙酸乙酯(含0~60%乙酸乙酯),流速=ml/分钟,rv=7.5-10cv)纯化,得到(e)-1-氟-3-甲氧基-2-(2-苯基-1-(苯磺酰基)乙烯基)苯217e(29.0g,85.0%纯度,66.91mmol,37.5%产率)。1h nmr(400mhz,cdcl3)δ(ppm)3.25(s,3h),6.60(m,1h),6.73(m,1h),7.30(m,8h),7.52(m,1h),7.73(m,2h),8.14(s,1h)。步骤e:5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217f。在(-10℃)下将叔丁醇钾(8.83g,78.79mmol)逐份添加到(e)-1-氟-3-甲氧基-2-(2-苯基-1-(苯磺酰基)乙烯基)苯217e(29.0g,78.79mmol)和2-异氰基乙酸乙酯(8.91g,78.79mmol)在无水thf(600ml)中的溶液中,并且在室温下搅拌过夜。然后将反应混合物用冰水(400ml)稀释并用etoac(3*400ml)萃取3次。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩并通过fcc(interchim,330g sio2,己烷/乙酸乙酯(10%-32%),流速=127ml/分钟,7,1-8,6cv)纯化,得到5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217f(12.6g,95.0%纯度,35.27mmol,44.8%产率)。lcms(esi)rt=1.264分钟。计算值[m+1]340.2。实测值[m+1]340.0。1h nmr(400mhz,dmso-d6)δ(ppm)1.02(t,3h),3.40(s,3h),4.09(q,2h),6.54(m,2h),6.87(s,1h),6.95(m,2h),7.17(m,4h),11.97(s,1h)。步骤f:1-氨基-5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217g。在0℃下将氢化钠(2.2g,55mmol)(60%在矿物油中)逐份添加到5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217f(11.97g,35.3mmol)在dmf(120ml)中的溶液中。将混合物在室温下搅拌1小时。然后,将混合物冷却至0℃并逐份添加o-(2,4-二硝基苯基)羟胺(10.54g,52.94mmol)。将反应混合物在室温下搅拌16h。然后,将其倒入冰水中,并用etoac(3*100ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到呈深色油状物的1-氨基-5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217g(15.94g,75.0%纯度,33.74mmol,95.6%产率)。lcms(esi)rt=3.730分钟。计算值[m+1]355.2。实测值[m+1]355.2。步骤g:6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇217h。将氢化钠(3.6g,0.09mol)(60%在矿物油中)逐份添加到1-氨基-5-(2-氟-6-甲氧基苯基)-4-苯基-1h-吡咯-3-甲酸乙酯217g(15.94g,45.01mmol)和1-甲基-1h-咪唑-2-甲腈(5.42g,50.64mmol)在无水二噁烷(160ml)中的溶液中。然后,将反应混合物在80℃下加热并在该温度下搅拌16小时。然后,将其冷却至室温,倒入冰水中,用乙酸中和并用etoac(3*100ml)萃取。将有机相用水、盐水洗涤,经na2so4干燥,真空浓缩,得到6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇217h(16.8g,60.0%纯度,24.26mmol,71.9%产率)。lcms(esi)rt=1.294分钟。计算值[m+1]416.2。实测值[m+1]416.2。步骤h:4-氯-6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪217i。向6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-醇217h(7.0g,16.85mmol)在ch3cn(150ml)中的溶液中,滴加三氯氧磷(7.17g,47.19mmol)。将混合物加热至80℃并在该温度下搅拌16小时,然后真空浓缩,倒入冰水(5ml)中并用nahco3(水溶液)中和。通过过滤收集形成的沉淀物,用水(2*20ml)洗涤并真空干燥,得到呈黄色固体的4-氯-6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪217i(7.1g,70.0%纯度,11.46mmol,97.1%产率)。lcms(esi)rt=2.925分钟。计算值[m+1]434.2。实测值[m+1]434.0。步骤i:6-(2-氟-6-甲氧基苯基)-n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(217)。将氢化钠(46mg,1.15mmol)(60%在矿物油中)逐份添加到4-甲氧基吡啶-2-胺(79.93mg,644.24μmol)在dmf(1ml)中的溶液中。将混合物在室温下搅拌30分钟,然后一次性添加4-氯-6-(2-氟-6-甲氧基苯基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪217i(200.0mg,460.97μmol),并搅拌过夜。此后,将所得混合物用nh4cl(饱和水溶液)淬灭。通过过滤收集形成的沉淀物,用水(2*1ml)洗涤并通过hplc(柱:xbridge behc18 100*19mm,5μm(48%-55%-85%0-2-10;流速30ml/分钟meoh/h2o/0.1nh4oh(泵装载4mlmeoh),得到6-(2-氟-6-甲氧基苯基)-n-(4-甲氧基吡啶-2-基)-2-(1-甲基-1h-咪唑-2-基)-5-苯基吡咯并[2,1-f][1,2,4]三嗪-4-胺(217)(50.7mg,95.0%纯度,92.35μmol,28.7%产率)。lcms(esi)rt=1.319分钟。计算值[m+1]522.2。实测值[m+1]522.2。1h nmr(500mhz,dmso-d6)δ(ppm)3.45(s,3h),3.84(s,3h),4.00(s,3h),6.42(m,3h),7.08(s,1h),7.35(m,7h),7.71(s,1h),7.94(d,1h),8.07(s,1h),8.70(s,1h)。实施例218-实施例276使用前述实施例中描述的方法,使用适当的相应原材料合成实施例化合物(218)-(276)。实施例化合物(218)-(276)的结构和数据在表c中。实施例218、219、269、270、271和272按照实施例209中描述的用于制备化合物(209)的方法制备。除了在实施例102步骤a的程序中使用4-甲氧基吡啶-2-醇代替胺之外,由实施例99程序b化合物(99)制备实施例220。使用实施例102步骤a中描述的程序,由实施例99程序b化合物(99)制备实施例221-268。实施例261和262都是由实施例99程序b化合物(99)与5-氨基-1,2-二氢-3h-吡唑-3-酮反应获得的产物。在实施例252化合物(252)的制备中,在最后一步中还生成异构体副产物(10.5mg,8.8%产率)(纯度93%)。lcms esi计算值[m+1]405.2。实测值[m+1]405.2。在实施例256化合物(256)的制备中,在最后一步中还生成异构体副产物(10.0mg,8.8%产率)(纯度98%)。lcms esi计算值[m+1]375.2。实测值[m+1]375.2。在实施例260化合物(260)的制备中,在最后一步中还生成异构体副产物(15mg,11.5%产率)(纯度96%)。lcms esi计算值[m+1]419.2。实测值[m+1]419.2。实施例273、274、275和276按照实施例166中描述的用于制备化合物(166)的方法制备。合成实施例276化合物(276)的最后一步使用实施例102步骤a中描述的条件代替实施例166步骤g中描述的那些条件。表c:化合物和分析数据表注:*量和产率分别是指在相应化合物合成的最后一步获得的最终总量和产率。4.2生物学实施例生物学实施例1:用于基于细胞的测定的方案用于磷酸-smad2/3抑制测定的方案该测定在本技术全篇称为“磷酸-smad2/3抑制测定”。细胞系:人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12d突变体)和小鼠肌肉成肌细胞c2c12购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fb s的完全dmem-高葡萄糖中生长。方法:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育3小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接着,用10ng/ml tgf-b1刺激panc-1细胞1小时,并用10ng/ml tgf-b1刺激c2c12细胞20分钟(重组人tgf-b1,r&d systems)。刺激后,用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹(western blot)确定smad2/smad3的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与以下抗体温育过夜来评估smad2/smad3的磷酸化水平:磷酸-smad2(ser465/467)和磷酸-smad3(ser423/425),两者都来自cell signaling technology。然后将膜与hrp缀合的二抗(jackson immunoresearch,west grove,pa)一起温育。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。用于jnk激活测定的方案该测定在本技术全篇称为“jnk激活测定”。细胞系:人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12c突变体)购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fb s的完全dmem-高葡萄糖培养基中生长。方法1:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用1.5ng/ml egf刺激细胞15分钟,然后用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermoscientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定jnk的磷酸化水平。方法2:在10%fbs的存在下,将细胞以350000个细胞/孔的密度接种在12孔板中。第二天,在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermoscientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定jnk的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与来自cell signaling technology的抗体磷酸-sapk/jnk(thr183/tyr185)温育过夜来评估jnk的磷酸化水平。然后将膜与hrp缀合的二抗(jackson immunoresearch,west grove,pa)一起温育。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。用于mapk p38激活测定的方案该测定在本技术全篇称为“mapk p38激活测定”。细胞系:人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12d突变体)购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fb s的完全dmem-高葡萄糖培养基中生长。方法1:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用1.5ng/ml egf刺激细胞15分钟,然后用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermoscientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定mapk p38的磷酸化水平。方法2:将细胞以350000个细胞/孔的密度接种在12孔板中的10%fbs中。第二天,在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用含有1%tritonx-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定mapk p38的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与以下抗体温育过夜来评估mapk p38的磷酸化水平:磷酸-p38mapk(thr180/tyr182),来自cellsignaling technology。然后将膜与hrp缀合的二抗(jackson immunoresearch,westgrove,pa)一起温育。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。用于基于细胞的western erk1/2磷酸化测定的方案该测定在本技术全篇称为“erk1/2磷酸化测定”。细胞系:人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12d突变体)购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fb s的完全dmem-高葡萄糖培养基中生长。方法1:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用1.5ng/ml egf刺激细胞15分钟,然后用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermoscientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定erk1/2的磷酸化水平。方法2:将细胞以350000个细胞/孔的密度接种在12孔板中的10%fbs中。第二天,在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用含有1%tritonx-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定erk1/2的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与抗磷酸-p44/42(thr202/tyr204)抗体(cell signaling)温育过夜,随后与hrp缀合的二抗(jackson immunoresearch,west grove,pa)温育过夜来评估erk1/2的磷酸化水平。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。用于基于细胞的western akt磷酸化测定的方案该测定在本技术全篇称为“akt磷酸化测定”。人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12d突变体)购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs的完全dmem-高葡萄糖中生长。方法1:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。接下来,用1.5ng/ml egf刺激细胞15分钟,然后用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定akt的磷酸化水平。方法2:将细胞以350000个细胞/孔的密度接种在12孔板中的10%fbs中。第二天,在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定akt的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与抗磷酸-akt(ser473)抗体(cell signaling)温育过夜,随后与hrp缀合的二抗(jacksonimmunoresearch,west grove,pa)温育过夜来评估akt的磷酸化水平。将条带在amershamecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。表3示出上述一种或多种细胞测定中测试的选定化合物的抑制数据。用于基于细胞的western s-6核糖体蛋白磷酸化测定的方案细胞系:人肿瘤来源的胰腺癌细胞系panc-1(表达kras g12d突变体)和miapaca-2(表达kras g12c突变体)购自美国模式培养物保藏中心并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs的完全dmem-高葡萄糖培养基中生长。方法:将细胞以350000个细胞/孔的密度接种在12孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。在0.3%dmso的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,在37℃下温育6小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。接下来,用1.5ng/ml egf刺激细胞15分钟,然后用含有1%triton x-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹确定s-6核糖体蛋白的磷酸化水平。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与来自cell signaling technology的磷酸s-6核糖体蛋白(ser 235/236)(d57.2.2e)抗体温育过夜,随后与hrp缀合的二抗(jackson immunoresearch,west grove,pa)温育过夜来评估erk1/2的磷酸化水平。将条带在amersham ecl prime蛋白质印迹检测试剂(gehealthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。用于小鼠tnf-α和il6定量测定的方案这些测定在本技术全篇分别称为“il-6定量测定法”和tnf-α定量测定法”。细胞系:abelson鼠白血病病毒转化的巨噬细胞细胞系raw264.7购自atcc并在具有5%co2的加湿培养箱中在37℃下在补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs的完全dmem-高葡萄糖培养基中生长。方法:将细胞以40000个细胞/孔的密度接种在96孔板中。温育3小时后,用dmem加上0.5%fbs使巨噬细胞饥饿过夜。第二天,在lps刺激(100ng/ml)前3小时,将待测试的小分子以30μm的最终浓度(含有0.3%dmso)添加到细胞中。lps刺激后,将细胞在37℃下温育16小时。在温育期结束时,收集培养基并使用elisa检测试剂盒测量lps诱导的tnfα和il6细胞因子的产生。夹心elisa:elisa immunoassays quantikine小鼠tnf-α(目录号mta00b)和il6(目录号m6000b)购自r&d systems inc.,minneapolis,mn。这些4.5小时固相elisa用于测量巨噬细胞培养物上清液中的小鼠tnfα或il6水平。根据制造商的说明书执行测定。用于增殖测定的方案该测定在本技术全篇称为“增殖测定”或“细胞活力测定”。细胞系:人肿瘤来源的细胞系购自美国模式培养物保藏中心。人肿瘤来源的胰腺癌细胞系miapaca-2(表达kras g12c突变体)和panc-1(表达kras g12d突变体),及人非小细胞肺癌(nsclc)细胞系a549(表达kras g12s突变体)在完全dmem-高葡萄糖培养基中生长。人结肠癌细胞系sw-620(表达kras g12v突变体)在rpmi 1640培养基中生长。所有细胞系在具有5%co2的加湿培养箱中在37℃下补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs。方法:将细胞以2000至5000个细胞/孔的密度接种在96孔板中并培养过夜。在0.3%dmso和10%fbs的存在下,将待测试的小分子以10μm的最终浓度添加到细胞中,并在具有5%co2的加湿培养箱中在37℃下温育2-4天。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。测定:在温育期结束时,使用celltiteraqueous one solution细胞增殖测定根据制造商说明书(promega,madison,wi)确定细胞活力。从原始数据计算小分子对细胞增殖抑制的百分比。表2和表3示出了在上述一种或多种细胞测定中,诸如在人肿瘤来源的胰腺癌细胞系panc-1中测试的这些选定化合物的数据。表2:各自在panc-1胰腺癌细胞系中smad2/3、jnk和mapkp38(在10μm下)的抑制0=0%抑制,a=1%-25%抑制,b=26%-45%抑制,c=46%-75%抑制,d=76%-100%抑制,e=1%-30%抑制,f=31%-74%抑制,g=75%-99%抑制,h=100%抑制,a*=1%-25%激活,b*=26%-45%激活,c*=46%-75%激活,d*=76%-100%激活,e*=1%-30%激活,f*=31%-74%激活,g*=75%-99%激活,h*≥100%激活,nd=未确定。表3:在10μm下对erk1/2、akt、il-6、tnf-α和miapaca-2增殖的抑制%0=0%抑制,a=1%-25%抑制,b=26%-49%抑制,c=50%-84%抑制,d=85%-100%抑制,a*=1%-25%激活,b*=26%-49%激活,c*=46%-84%激活,d*=85%-100%激活,e=1%-24%抑制,f=25%-49%抑制,g=50%-74%抑制,h=75%-100%抑制,e*=1%-24%激活,f*=25%-49%激活,g*=50%-74%激活,h*=75%-100%激活,i=>1um ic50,j=0.51-1um ic50,k=0.15-0.5um ic50,l=<0.15um ic50,nd=未确定。生物学实施例2:与化合物温育后基于细胞的增殖用于增殖测定的方案该测定在本技术全篇称为“增殖测定”或“细胞活力测定”。细胞系:这些人肿瘤来源的细胞系购自美国模式培养物保藏中心。人肿瘤来源的胰腺癌细胞系miapaca-2(表达kras g12c突变体)和panc-1(表达kras g12d突变体),及人非小细胞肺癌(nsclc)细胞系a549(表达kras g12s突变体),和人黑素瘤细胞系a375(野生型kras)在完全dmem-高葡萄糖培养基中生长。使人肿瘤来源的胰腺癌细胞系su86.86(表达kras g12d突变体)、bxpc3(表达野生型k-ras)和人非小细胞肺癌(nsclc)细胞系nci-h441(表达kras g12s突变体)、nci-h1975(表达野生型kras)、nci-h358(表达kras g12c突变体)、nci-h 1299(表达nras q61h突变体)和人结肠癌细胞系sw-620(表达kras g12v突变体)、人三阴性乳腺癌细胞系hcc-1806(表达野生型kras)和人肿瘤来源的多发性骨髓瘤细胞系mm.1r(表达野生型kras)在rpmi 1640培养基中生长。使人肿瘤来源的乳腺癌细胞系bt-549(表达野生型kras)在rpmi 1640培养基中在11.8u胰岛素的存在下生长。使人肿瘤来源的胰腺癌细胞系hpaf-ii(表达kras g12d突变体)、人三阴性乳腺癌细胞系bt-20(表达野生型kras)和人结肠癌细胞系ls 123(表达kras g126突变体)在emem培养基中生长。使人肿瘤来源的胰腺癌细胞系cf-pac 1(表达kras g12v突变体)在imdm培养基中生长,并且使人结肠癌细胞系ht29(表达野生型kras)在mccoy 5a培养基中生长。结肠癌细胞系gp2d(表达kras g12d突变体)购自milliporesigma并且在dmem-高葡萄糖培养基中生长。所有细胞系在具有5%co2的加湿培养箱中在37℃下补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs。方法:将细胞以2000至5000个细胞/孔的密度接种在96孔板中并培养过夜。在0.3%dmso和10%fbs的存在下,将测试的小分子以10μm的最终浓度添加到细胞中,并在具有5%co2的加湿培养箱中在37℃下温育2-4天。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。测定:在温育期结束时,使用celltiteraqueous one solution细胞增殖测定根据制造商说明书(promega,madison,wi)确定细胞活力。从原始数据计算小分子对细胞增殖抑制的百分比。表4a和表4b示出了在上述一种或多种细胞测定中,诸如在人肿瘤来源的胰腺癌细胞系panc-1中测试的这些选定化合物的数据。表4a:增殖测定ic50数据i=>1um ic50,j=0.51-1um ic50,k=0.15-0.5um ic50,l=<0.15um ic50,nd=未确定表4b:增殖测定ic50数据m=>50nm ic50,n=10-50nm ic50,o=1-10nm ic50,p=<1nm ic50,nd=未确定生物学实施例3:ras gtp结合结构域抑制测定实施例3中描述的测定在本技术全篇统称为“ras超家族测定”。使用ras超家族活性测定(如2018年6月20日提交的国际申请号pct/us2018/038613中公开的,该国际申请通过引用整体并入本文)作为特异性测定针对以下ras超家族蛋白来评价以下化合物:kras野生型、kras q61h突变体、kras g12c突变体、kras g12d突变体、rac-1和rho-a。缓冲液-i:25mm tris-hcl,ph 7.427mm kcl137mm nacl1mm mgcl21mm dtt缓冲液-ii:50mm tris-hcl,ph 7.01mm mgcl21mm dtt小gtp酶蛋白:kras野生型。kras q61h突变体、kras g12c突变体、kras g12d突变体、rac-1和rho-a表达为his标记的蛋白质。另外,鸟苷核苷酸交换因子(gef)sos蛋白(残基556-1049)表达为his标记的蛋白质。在细胞中,鸟嘌呤核苷酸交换因子sos蛋白通过刺激gdp交换成gtp而促进ras蛋白的激活。将sos包括到ras gtp结合结构域抑制测定中可以被认为是用于评价一些测试的小分子的抑制活性的生理细胞条件的替代表示。对于该测定,将所有纯化的小gtp酶蛋白在缓冲液-i或缓冲液-ii中稀释到10-30μg/ml的最终浓度。将各200μl稀释蛋白添加到镍包被的96孔板中并在4℃温育过夜。然后弃去蛋白质液并且在1%dmso的存在下,向每个孔中添加200μl缓冲液-i或缓冲液-ii。将待测试的化合物以20μm的最终浓度添加到蛋白质包被的孔中,并在室温下温育3小时,在温育的最后一小时添加或不添加10-30μg/ml的sos。当进行ic50测量时,添加所有测试浓度的连续稀释液。然后向每个孔中添加cy3-gtp或cy5-gtp至最终浓度为100nm。将带标签的gtp在室温下温育45分钟。gtp温育后,将孔在缓冲液-i或缓冲液-ii中洗涤3次,并向每个孔中添加200μl缓冲液-i或缓冲液-ii。洗涤后,使用spectramax m3(molecular devices)测量结合的带标签的gtp的量。用于cdc42和rheb gtp结合结构域抑制测定的方案开发以下方法作为用于cdc42和rheb蛋白质的特异性测定。缓冲液-i:25mm tris-hcl,ph 7.427mm kcl137mm nacl1mm mgcl21mm dtt缓冲液-ii:50mm tris-hcl,ph 7.01mm mgcl21mm dtt小gtp酶蛋白cdc42和rheb表达为his标记的蛋白质。对于该测定,将cdc42和rheb纯化的小gtp酶蛋白在缓冲液-i或缓冲液-ii中稀释到10-30μg/ml的最终浓度。将各200μl稀释蛋白添加到镍包被的96孔板中并在40℃温育过夜。然后弃去蛋白质液并且在1%dmso的存在下,向每个孔中添加200μl缓冲液-i或缓冲液-ii。将待测试的化合物以20μm的最终浓度添加到蛋白质包被的孔中,并在室温下温育3小时,在温育的最后一小时添加或不添加10-30μg/ml的sos。当进行ic50测量时,添加所有测试浓度的连续稀释液。然后向每个孔中添加cy3-gtp或cy5-gtp至最终浓度为100nm。将带标签的gtp在室温下温育45分钟。gtp温育后,将孔在缓冲液-i或缓冲液-ii中洗涤3次,并向每个孔中添加200μl缓冲液-i或缓冲液-ii。洗涤后,使用spectramax m3(molecular devices)测量结合的带标签的gtp的量。表5-6示出了上述筛选测定中测试的选定化合物的抑制%数据。表5:k-ras突变体和野生型蛋白在20μm下的抑制%0=0%抑制,a=1%-25%抑制,b=26%-49%抑制,c=50%-75%抑制,d=76%-100%抑制,nd=未确定表6:rac-1、rho-a、cdc42和rheb蛋白在20μm下的抑制%0=0%抑制,a=1%-25%抑制,b=26%-49%抑制,c=50%-75%抑制,d=76%-100%抑制,nd=未确定。生物学实施例4:puma表达和半胱天冬酶激活测定用于基于细胞的puma表达和半胱天冬酶激活测定的方案细胞系:所有人肿瘤来源的癌细胞系购自美国模式培养物保藏中心。使人肿瘤来源的癌细胞系panc-1(表达kras g12d突变体)、miapaca-2(表达kras g12c突变体)、a549(表达kras g12s突变体)和a375(表达野生型kras)在完全dmem-高葡萄糖培养基中生长,并且使nci-h1975(表达野生型kras)、mm.1r(表达野生型kras)和im.9(表达野生型kras)在rpmi1640培养基中生长。使人肿瘤来源的癌细胞系bt-549(表达野生型kras)在含11.8u胰岛素的rpmi1640培养基中生长。所有培养基在具有5%co2的加湿培养箱中在37℃下补充有青霉素(100u/ml)、链霉素(100μg/ml)和10%热灭活fbs。方法:在10%fbs的存在下,将细胞以300,000至800,000个细胞/孔的密度接种在6孔板中。第二天,在0.3%dmso的存在下,将待测试的小分子以3μm的最终浓度添加到细胞中,在37℃下温育48小时。对于ic50值确定,在相同条件下将化合物的连续稀释液添加到细胞中。温育48小时后,用含有1%tritonx-100、edta和halttm蛋白酶和磷酸酶抑制剂混合物(thermo scientific)的裂解缓冲液裂解细胞。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。通过蛋白质印迹检测puma的表达增加和半胱天冬酶3、半胱天冬酶6和半胱天冬酶9的活性/裂解形式。蛋白质印迹方案:通过sds-page分离等量的蛋白质(15-50μg)并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(bostonbioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭并通过在4℃下与来自cell signaling technology的抗体puma(d30c10)(#12450)温育过夜来评估puma的表达水平,并通过在4℃下与以下抗体温育过夜来评估半胱天冬酶3、半胱天冬酶6和半胱天冬酶9的活性/裂解形式:裂解的半胱天冬酶-3(asp 175)(5a1e)、裂解的半胱天冬酶-6(asp162)和裂解的半胱天冬酶-9(asp330)(d2d4)(所有抗体均来自cell signaling technology)。然后将膜与hrp缀合的二抗(jackson immunoresearch,west grove,pa)一起温育。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。表7示出了在上述基于细胞的puma表达和半胱天冬酶激活测定中测试的选定化合物在48小时后凋亡相关的半胱天冬酶激活和增加的puma表达。表7:48小时后凋亡相关的半胱天冬酶激活和增加的puma表达生物学实施例5:miapaca-2细胞系中对于化合物34的基于细胞的磷酸化和ras-gtp下拉测定细胞系:人肿瘤来源的胰腺细胞系miapaca-2(表达kras g12c突变体)购自美国模式培养物保藏中心并在完全dmem-高葡萄糖培养基中生长。方法:将细胞以2x106个细胞/孔的密度接种在6孔板中,使其粘附于该板3小时,然后在0.5%fbs的存在下在适当培养基中饥饿过夜。将待测试的小分子的连续稀释液添加到在0.3%dmso存在下的细胞中,在37℃下温育6小时。接下来,用1.5ng/ml egf刺激细胞15分钟,用冰冷的pbs冲洗,然后用500μl裂解/结合/洗涤缓冲液(25mm tris-hcl(ph 7.2)、150mm nacl、5mm mgcl2、5%甘油、1%np40)裂解,该缓冲液来自活性ras检测试剂盒(cellsignaling technology),补充有halttm蛋白酶和磷酸酶抑制剂混合物(thermoscientific)。为了说明由于处理引起的细胞数目的显著差异,保存少量裂解物样品用于蛋白质定量,并将剩余裂解物快速冷冻。通过bca蛋白测定(thermo scientific)评估蛋白质浓度。为了确保等量的蛋白质经历rbd下拉,随后将裂解物解冻(在23℃下)并用裂解/结合/洗涤缓冲液(0.5ml体积)调节至1mg/ml。然后将等量的裂解物添加到含有raf-rbd的0.5ml裂解缓冲液(1ml总体积)中。将裂解物涡旋,在冰上温育10分钟,随后在4℃下以14,000rpm预先清洗5分钟。随后在4℃下在不断摇晃下将90%预先清洗的裂解物添加到来自活性ras检测试剂盒(cell signaling technology,#8821)的经过预先洗涤的谷胱甘肽琼脂糖珠粒中保持1小时。随后使珠粒团块化,用裂解/结合/洗涤缓冲液洗涤3次,并用50μl的1x sds-page样品缓冲液洗脱进行蛋白质印迹分析。通过蛋白质印迹确定gtp结合的ras水平。蛋白质印迹方案:通过sds-page分离洗脱的样品并转移至硝酸纤维素膜(invitrogen,thermo fisher scientific)。将膜用ponceau s染剂(boston bioproducts)染色以证实均匀的蛋白质负载。将膜用10%牛奶封闭,并通过在4℃下与试剂盒(cellsignaling technology,#8821)中提供的ras抗体温育过夜来评估ras结合水平。然后将膜与hrp缀合的二抗(jackson immunoresearch,west grove,pa)一起温育。将条带在amersham ecl prime蛋白质印迹检测试剂(ge healthcare)中温育,并使用chemidoc mp成像系统(bio-rad)可视化。生物学实施例6:无细胞mek1激酶测定mek1激酶系统(目录号va7216)购自promega(madison,wisco nsin)并根据制造商说明书执行。将所有组分在激酶反应缓冲液中稀释,然后向白色96孔板的每个孔中添加10μl mek(最终浓度100ng/25μl)、5μl atp(最终浓度100μm)/chk底物(最终浓度1μg/25μl)和10μl抑制剂溶液(最终浓度10μm)、星形孢菌素(最终浓度1μm,ce llsignaling,danvers,ma)或激酶反应缓冲液(空白),并在室温下温育1小时。接下来,向每个孔中添加25μl adp-glo激酶试剂(目录号v9101,promega,madison,wisconsin),并在室温下温育40分钟。然后向每个孔中添加50μl激酶检测试剂,将板用铝箔覆盖,并在室温下温育30分钟。使用spectramax m3(molecular devices,san jo se,california)测量1秒积分时间的发光。生物学实施例7:无细胞b-raf(v600e突变体)激酶测定b-raf(v600e突变体)激酶测定试剂盒(目录号48688)购自bps bioscience,sandiego,ca。根据制造商的说明执行测定。制备由激酶缓冲液+10mm dtt、20μm atp、raf底物和水组成的主混合物。然后,向每个孔中添加25μl主混合物。接下来,将5μl抑制剂溶液(最终浓度10μm)、星形孢菌素(最终浓度1μm,cell signaling,danvers,ma)或激酶缓冲液(空白)添加到白色96孔板的每个孔中。将b-raf(v600e)或b-raf(wt)酶在冰上解冻并用激酶缓冲液稀释至2ng/ml(v600e)或2.5ng/ml(wt),然后向除空白对照孔之外的所有孔中添加20μl以引发反应并在30℃下温育45分钟。为了测量在激酶反应期间生成的adp的量,使用spectramax m3(molecular devices,san jose,california)测量发光(积分时间1秒)。生物学实施例8:化合物6在nci-h358(g12c)模型中的体内功效细胞系:使人肿瘤来源的非小细胞肺癌细胞系nci-h358(表达kras g12c突变体)在补充有10%胎牛血清(fbs)和青霉素/链霉素100u/ml(lonza biowhittaker,morrisville,nc)的rpmi-1640培养基atcc 30-2001中生长。将细胞胰蛋白酶化,在无菌pbs中洗涤,计数,并以25×106/ml的浓度重悬于1∶1混合pbs/hc matrigel(corning,glendale,az)中。将细胞保持在冰上直至注射。向无胸腺裸-foxn1 nu小鼠(the jackson laboratory,harbor,me)的右胁腹皮下注射在200μl无菌pbs/matrigel溶液中的5×106个细胞。注射后4天首先测量肿瘤质量,并基于这些测量将小鼠随机分组。在注射后~5-8天当肿瘤达到150-200mm3时,开始治疗。将化合物6配制在20%captisol(50mm柠檬酸盐缓冲液,ph 5.0)中,并且小鼠接受日剂量的媒介物或50mg/kg体重的配制的化合物6。使用数字卡尺测量肿瘤并且使用公式v=(w(2)×l)/2计算体积(v),其中v是肿瘤体积,w是肿瘤宽度,并且l是肿瘤长度。按照iacuc指南饲养小鼠。计算的肿瘤生长抑制(tgi)为80%。未检测到重量减轻。生物学实施例9:动力学溶解度根据以下方案进行在ph 7.4缓冲液+2%dmso中的动力学溶解度测定(“动力学溶解度测定”):简言之,使用测试化合物在100%dmso中的20mm储备溶液,在含2%最终dmso的磷酸盐缓冲盐水ph 7.4(138mm nacl、2.7mm kcl、10mm磷酸钾)中以一式两份制备稀释液达到400μm的理论浓度。使测试化合物在pb s中的稀释液在恒温振荡器上在25℃下进一步平衡两小时,然后使用真空歧管通过hts滤板过滤。测试化合物的滤液在测量前用含2%dmso的乙腈稀释2倍。并行地,使用测试化合物在100%dmso中的20mm储备溶液,在含2%最终dmso的50%乙腈/pbs中制备稀释液,达到0μm(空白)、10μm、25μm、50μm、100μm和200μm的理论浓度以生成校准曲线。昂丹司琼(ondansetron)用作参考化合物以控制恰当的测定性能。将各200μl样品转移至96孔板中并在230-550nm范围内以5nm步长测量。使用专用的microsoft excel计算脚本计算pbs滤液中化合物的浓度。对于每种化合物基于吸光度最大值(在0-3od范围内的最小和最大浓度点的绝对吸光度单位值)手动选择用于计算的恰当吸光度波长。每个最终数据集由操作者视觉评价,并且计算每个校准曲线的拟合优度(r2)。该测定的有效范围为大约2-400μm,返回接近该范围上限的值的化合物可具有较高的实际溶解度(例如,5′-脱氧-5-氟尿苷)。表8示出了上述动力学溶解度测定中测试的选定化合物的动力学溶解度数据。表8:在ph 7.4缓冲液+2%dmso中的动力学溶解度a表示<10μm,b表示10-30μm,c表示>30μm。生物学实施例10:在小鼠肝微粒体中的代谢稳定性的评估代谢稳定性测定:在96孔板中以各30μl的5个等分试样(每个时间点一个)进行微粒体温育。肝微粒体温育培养基由磷酸盐缓冲液(100mm,ph 7.4)、mgcl2(3.3mm)、nadph(3mm)、葡萄糖-6-磷酸(5.3mm)、葡萄糖-6-磷酸脱氢酶(0.67单位/ml)和0.42mg肝微粒体蛋白/ml组成。在对照反应中,用磷酸盐缓冲液代替nadph-辅因子体系。将测试化合物(2μm,最终溶剂浓度1.6%)与微粒体在37℃下在100rpm振荡下温育。每个反应一式两份地进行。分析40分钟内的五个时间点。通过向温育等分试样中添加5体积的含有内标的甲醇,随后通过以5500rpm离心4分钟使蛋白质沉降来终止反应。使用与串联质谱仪耦合的hplc系统分析上清液。在ln(auc)对比时间的图中,使用线性回归分析确定消除常数(kel)、半衰期(t1/2)和固有清除率(clint):kel=-斜率为了指示线性回归分析的质量,提供r(相关系数)值。在一些情况下,从计算中排除最后的时间点以确保可接受的衰减对数线性。表9示出了上述小鼠肝微粒体代谢稳定性测定中测试的选定化合物的代谢稳定性数据。表9:小鼠肝微粒体代谢稳定性测定
实施例编号
t1/2(分钟)
实施例编号
t1/2(分钟)
6
b
158
a
102
b
222
a
104
b
224
b
124
b
226
b
126
b
227
b
127
a
235
b
128
b
238
b
129
b
248
b
137
b
250
a
141
b
252
a
142
b
255
b
143
a
260
a
144
b
265
b
145
b
267
b
156
b
268
a
157
b
a表示<10分钟,b表示>10分钟。示例性实施方案a1.一种式i的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或or2a;y是咪唑基、吡啶基或8-10元稠合杂芳基;其中所述咪唑基任选地被1个r6a取代基取代并且任选地被1-2个r7a取代基取代;并且所述吡啶基或所述8-10元稠合杂芳基任选地被1-4个r7a取代基取代;r1a是氢或c1-6烷基,其中所述c1-6烷基任选地被1-4个r8a取代基取代;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、c3-7杂环烷基、c5-10元芳基、-s(o)2r15a、-p(o)r16ar17a或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基和5-10元杂芳基各自独立任选地被1-4个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,任选地其中r1a和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-7环烷基、c1-6杂烷基、芳基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、芳基或5-10元杂芳基,其中所述芳基和5-10元杂芳基各自独立任选地被1-4个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、-c(o)or14a、-c(o)nr12ar13a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是-oh、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基或5-10元杂芳基,其中所述c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、c1-6烷氧基、c1-6卤代烷氧基、c3-7杂环烷基、芳基和5-10元杂芳基任选地被1-3个r8a取代基取代,或r12a和r13a组合形成包括它们均附接的氮原子的3-7元杂环烷基;r14a是氢、c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r15a是c1-6烷基、c3-6环烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。a2.如实施方案a1所述的化合物,其中y是任选地被1个r6a取代基取代并且任选地被1-2个r7a取代基取代的咪唑基。a3.如实施方案a1或实施方案a2所述的化合物,其中y是c连接的咪唑基,其在咪唑基环的氮处被1个r6a取代基取代并且任选地在所述咪唑基环的碳处被1-2个r7a取代基取代。a4.如实施方案a1至a3中任一项所述的化合物,其中所述化合物是式ia的化合物:或其药学上可接受的形式。a5.如实施方案a1至a3中任一项所述的化合物,其中所述化合物是式ib的化合物:或其药学上可接受的形式。a6.如实施方案a1所述的化合物,其中y是任选地被1-4个r7a取代基取代的吡啶基。a7.如实施方案a1或实施方案a6所述的化合物,其中所述化合物是式ib的化合物:或其药学上可接受的形式。a8.如实施方案a1所述的化合物,其中y是任选地被1-4个r7a取代基取代的8-10元稠合杂芳基。a9.如实施方案a1至a8中任一项所述的化合物,其中x是-or2a。a10.如实施方案a1至a8中任一项所述的化合物,其中x是-nr1ar2a。a11.一种式ii的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-7环烷基、c1-6杂烷基、-s(o)2r15a、-p(o)r16ar17a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基,任选地其中r1a和r2a形成的所述3-6元杂环烷基与5-6元杂芳基稠合;r3a是c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基、5-10元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、-oh、c1-6烷氧基或c1-6卤代烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r15a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r16a和r17a各自独立地选自c1-6烷基、c1-6烷氧基或c1-6杂烷基,其中所述c1-6烷基、c1-6烷氧基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代,或r16a和r17a组合形成包括它们均附接的磷原子的3-7元杂环烷基;m是0、1或2;并且其中,当x是oh或y是n-甲基咪唑基,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。a12.一种式iia的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基、-s(o)2ri5a或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基、5元、6元或9元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-3烷基、c3-6环烷基、c1-6杂烷基、苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5元、6元或9元杂芳基,其中所述苯基和5元、6元或9元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是c1-3烷基或c1-3杂烷基,其中所述c1-3烷基或c1-3杂烷基任选地被生物素酰胺取代;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr11ar12a或5-6元杂芳基,其中所述c1-6烷基或c1-6杂烷基任选地被生物素酰胺取代;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;r15a是c1-3烷基、c3-6环烷基或c1-4杂烷基;r16a和r17a各自独立地选自c1-3烷基或c1-3烷氧基,或r16a和r17a组合形成包括它们均附接的磷原子的5元杂环烷基;并且m是0或1。a13.如实施方案a12所述的化合物,其中:r1a和r2a连同它们附接的氮具有以下结构:-nh2、r3a是-ch3、未取代的苯基、异丙基、环丙基、r4a是氢、未取代的苯基、rsa是氢;r6a是甲基、-ch2ch2nh2或r7a是甲基;并且m是0或1。a14.如实施方案a12所述的化合物,其中:r1a和r2a连同它们附接的氮具有以下结构:-nh2、r3a是-ch3、未取代的苯基、异丙基、环丙基、r4a是氢、未取代的苯基、r5a是氢;r6a是甲基、-ch2ch2nh2或并且m是0。a15.一种式iib的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基,任选地其中r1a和r2a形成的所述4-6元杂环烷基与6元杂芳基稠合;r3a是c1-3烷基或苯基,其中所述c1-3烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是苯基或5元杂芳基,其中所述苯基和5元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r1a和r2a组合形成r6a是甲基,m是0,并且rsa是h时,r3a和r4a中的至少一者不是未取代的苯基。a16.如实施方案a15所述的化合物,其中:r1a和r2a组合形成r3a是-ch3、未取代的苯基、(4-甲氧基)-苯基或异丙基;r4a是r5a是氢;r6a是甲基;并且m是0。a17.如实施方案a15所述的化合物,其中:r1a和r2a组合形成r3a是-ch3或经取代的苯基;r4a是rsa是氢;r6a是甲基;并且m是0。a18.一种式iic的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6杂烷基或6元杂芳基,其中所述c1-6杂烷基和5-6元杂芳基各自任选地被1-3个r8a取代基取代;r3a是c1-3烷基或苯基,其中所述c1-3烷基或苯基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5或6元杂芳基,其中所述苯基和5或6元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r6a是甲基;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;m是0或1;并且其中,当r2a是h,r6a是甲基,m是0,并且r5a是h时,r3a和r4a中的至少一者不是未取代的苯基。a19.如实施方案a18所述的化合物,其中:r2a连同其附接的氧具有以下结构:-oh、r3a是-ch3或未取代的苯基;r4a是氢、未取代的苯基、r5a是氢;r6a是甲基;并且m是0。a20.一种式iii的化合物:或其药学上可接受的形式,其中:x是nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。a21.一种式iiia的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。a22.一种式iiib的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。a23.一种式iiic的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的ri0a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r6a和r7a各自独立地是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1或2。a24.一种式iv的化合物:或其药学上可接受的形式,其中:x是-nr1ar2a或-or2a;r1a是氢或c1-6烷基;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;或r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢或c1-6烷基;r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基、c1-6杂烷基、卤基、-nr12ar13a、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a、-c(o)or14a或cn,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。a25.一种式iva的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的ri0a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。a26.如实施方案a25所述的化合物,其中:r1a和r2a连同它们附接的氮具有以下结构:r3a是-ch3或未取代的苯基;r4a是r5a是氢;r7a是甲基;并且m是0。a27.一种式ivb的化合物:或其药学上可接受的形式,其中:r1a和r2a组合形成包括它们均附接的氮原子的4-6元杂环烷基;r3a是c1-6烷基或苯基,其中所述c1-6烷基和苯基各自独立任选地被1-3个r9a取代基取代;r4a是5元杂芳基,其中所述5元杂芳基任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是甲基;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。a28.如实施方案a27所述的化合物,其中:r1a和r2a组合形成r3a是-ch3或未取代的苯基;r4a是r5a是氢;r7a是甲基;并且m是0。a29.一种式ivc的化合物:或其药学上可接受的形式,其中:r2a是氢、c1-6烷基、c3-6环烷基、c1-6杂烷基或5-6元杂芳基,其中所述c1-6烷基、c3-6环烷基、c1-6杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代;r3a是c1-6烷基、c1-6杂烷基、苯基或5-10元杂芳基,其中所述c1-6烷基、c1-6杂烷基、苯基和5-10元杂芳基各自独立任选地被1-3个r9a取代基取代;r4a是氢、苯基或5-10元杂芳基,其中所述苯基和5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r5a是氢;r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r8a和r9a各自独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基或5-6元杂芳基;r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基;并且m是0、1、2、3或4。a30.如实施方案a29所述的化合物,其中:r2a是氢;r3a是-ch3;r4a是rsa是氢;r7a是甲基;m是0。a31.如实施方案a1至a30中任一项所述的化合物,其中r4a和r5a中不超过一者是氢。a32.如实施方案a1至a31中任一项所述的化合物,其中r5a是氢、甲基、乙基或异丙基。a33.如实施方案a1至a32中任一项所述的化合物,其中r5a是氢。a34.如实施方案a1至a33中任一项所述的化合物,其中r6a是c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、cs-10杂芳基、c3-7杂环烷基、c1-6杂烷基、c1-6烷氧基、c1-6卤代烷氧基、-c(o)nr12ar13a、-(co)r11a或-c(o)or14a,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基、芳基、c5-10杂芳基、c3-7杂环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。a35.如实施方案a1至a34中任一项所述的化合物,其中r6a是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。a36.如实施方案a1至a35中任一项所述的化合物,其中r6a是甲基、乙基或异丙基,其中所述甲基、乙基和异丙基各自独立任选地被1-3个r8a取代,其中r8a是-oh、c1-3烷氧基或c1-3卤代烷氧基。a37.如实施方案a1至a36中任一项所述的化合物,其中r6a是甲基、乙基或异丙基。a38.如实施方案a1至a37中任一项所述的化合物,其中r6a是甲基。a39.如实施方案a1至a38中任一项所述的化合物,其中r7a是c1-6烷基、c3-6环烷基、c1-6卤代烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基、c1-6卤代烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代。a40.如实施方案a1至a39中任一项所述的化合物,其中r7a是甲基、乙基或异丙基,其中所述甲基、乙基和异丙基各自独立任选地被1-3个r8a取代,其中r8a是-oh、c1-3烷氧基或c1-3卤代烷氧基。a41.如实施方案a1至a40中任一项所述的化合物,其中r7a是甲基、乙基或异丙基。a42.如实施方案a1至a41中任一项所述的化合物,其中r7a是甲基。a43.如实施方案a1至a42中任一项所述的化合物,其中m是1。a44.如实施方案a1至a42中任一项所述的化合物,其中m是0。a45.如实施方案a1至a44中任一项所述的化合物,其中x是氮,并且r1a和r2a组合形成包括它们均附接的氮原子的3-6元杂环烷基。a46.如实施方案a1至a44中任一项所述的化合物,其中r1a是氢或c1-3烷基。a47.如实施方案a1至a44或a46中任一项所述的化合物,其中r1a是甲基、乙基或异丙基。a48.如实施方案a1至a44或a46中任一项所述的化合物,其中r1a是氢。a49.如实施方案a1至a44或a46至a48中任一项所述的化合物,其中r2a是c1-4烷基、c4-5环烷基、c1-4杂烷基或5-6元杂芳基,其中所述c1-4烷基、c4-5环烷基、c1-4杂烷基和5-6元杂芳基各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a50.如实施方案a1至a44或a46至a49中任一项所述的化合物,其中r2a是5-6元杂芳基,其中各自独立任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a51.如实施方案a1至a44或a46至a50中任一项所述的化合物,其中r2a是选自以下的5-6元杂芳基:吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基或噻二唑基,各自独立任选地被1-3个r8a取代基取代。a52.如实施方案a51所述的化合物,其中所述5-6元杂芳基被2个独立的r8a取代基取代,所述取代基组合形成包括各自附接的一个或多个原子的与所述5-6元杂芳基稠合的5-6元环烷基。a53.如实施方案a51所述的化合物,其中所述5-6元杂芳基被2个独立的r8a取代基取代,所述取代基组合形成包括各自附接的一个或多个原子的与所述5-6元杂芳基稠合的5-6元杂环烷基。a54.如实施方案a53所述的化合物,其中所述2个r8a取代基组合形成2,3-二氢吡唑并[5,1-b]噁唑基环。a55.如实施方案a54所述的化合物,其中所述5-6元杂芳基是吡唑基。a56.如实施方案a51所述的化合物,其中r8a独立地选自c1-6烷基、c1-6卤代烷基、c3-6环烷基、-nr12ar13a、-(co)r11a、氧代、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、c1-6烷氧基、c3-6环烷氧基、生物素酰胺或生物素化取代基。a57.如实施方案a51或实施方案a56所述的化合物,其中r8a独立地选自c1-4烷基、c1-4卤代烷基、c3-5环烷基、-nr12ar13a、-(co)r11a、氧代、c1-4羟烷基、c1-4杂烷基、3-5元杂环烷基、c1-4烷氧基、c3-5环烷氧基、生物素酰胺或生物素化取代基。a58.如实施方案a51至a57中任一项所述的化合物,其中r8a独立地选自甲基、乙基、异丙基、环丙基、环丁基、-(co)r11a、氧代、c2-3羟烷基、c2-4杂烷基、甲氧基、乙氧基、异丙氧基、环丙氧基或环丁氧基。a59.如实施方案a1至a58中任一项所述的化合物,其中x是:-oh、-nh2、a60.如实施方案a59所述的化合物,其中x是:-oh、-nh2、a61.如实施方案a1至a60中任一项所述的化合物,其中r3a是c1-4烷基、c3-6环烷基、c1-4杂烷基、苯基、5-6元杂芳基、-(co)r11a或-c(o)nr12ar13a,其中所述c1-4烷基、c3-6环烷基、c1-4杂烷基、苯基和5-6元杂芳基各自独立任选地被1-3个r9a取代基取代。a62.如实施方案a61所述的化合物,其中r9a独立地选自c1-4烷基、c3-5环烷基、-(co)r11a、c1-4羟烷基、c1-4杂烷基、4-6元杂环烷基、c1-4烷氧基或c3-5环烷氧基。a63.如实施方案a61或实施方案a62所述的化合物,其中r9a独立地选自甲基、乙基、异丙基、环丙基、环丁基、-(co)r11a、c2-3羟烷基、c2-4杂烷基、甲氧基、乙氧基、异丙氧基、环丙氧基、环丁氧基、咪唑基或哌啶基。a64.如实施方案a1至a63中任一项所述的化合物,其中r3a是:-ch3、未取代的苯基、(4-甲氧基)-苯基、异丙基、环丙基、a65.如实施方案a64所述的化合物,其中r3a是:-ch3、未取代的苯基、异丙基、环丙基、a66.如实施方案a1至a65中任一项所述的化合物,其中r4a是苯基或5-10元杂芳基,其中所述苯基或5-10元杂芳基各自独立任选地被1-3个r10a取代基取代,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a67.如实施方案a1至a66中任一项所述的化合物,其中r4a是任选地被1-3个r10a取代基取代的苯基,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a68.如实施方案a1至a66中任一项所述的化合物,其中r4a是任选地被1-3个r10a取代基取代的5-6元杂芳基,任选地其中2个独立的r10a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a69.如实施方案a66至a68中任一项所述的化合物,其中r10a独立地选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、-nr12ar13a或5-6元杂芳基。a70.如实施方案a66至a69中任一项所述的化合物,其中r10a独立地选自卤基、c1-4烷基、c3-5环烷基、c1-4卤代烷基、c1-4羟烷基、c1-4杂烷基、3-5元杂环烷基、-oh、c1-4烷氧基、c3-5环烷氧基、c1-4卤代烷氧基或-nr12ar13a。a71.如实施方案a66至a70中任一项所述的化合物,其中r10a独立地选自卤基、甲基、乙基、异丙基、环丙基、环丁基、c1-3卤代烷基、c2-3羟烷基、c2-4杂烷基、-oh、甲氧基、乙氧基、异丙氧基、环丙氧基、环丁氧基、c1-4卤代烷氧基或-nr12ar13a。a72.如实施方案a69至a71中任一项所述的化合物,其中r12a和r13a各自独立地选自氢、c1-4烷基、c3-5环烷基、c1-4羟烷基、c1-4杂烷基、-oh或c1-4烷氧基。a73.如实施方案a69至a72中任一项所述的化合物,其中r12a和r13a各自独立地选自氢、甲基、乙基、异丙基、环丙基、环丁基、甲氧基或乙氧基。a74.如实施方案a69至a73中任一项所述的化合物,其中r12a和r13a各自独立地选自氢或甲基。a75.如实施方案a69至a74中任一项所述的化合物,其中r12a和r13a各自为氢。a76.如实施方案a1至a75中任一项所述的化合物,其中r4a是:氢、未取代的苯基、a77.如实施方案a76所述的化合物,其中r4a是:氢、未取代的苯基、a78.一种式iia(1)的化合物:或其药学上可接受的形式,其中:r1a是氢;r2a是5或6元杂芳基,其中所述5或6元杂芳基任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基;r8a选自卤基、cn、c1-6烷基、c3-6环烷基、c1-6卤代烷基、c1-6羟烷基、c1-6杂烷基、3-6元杂环烷基、-nr12ar13a、-(co)r11a、氧代、-oh、c1-6烷氧基、c3-6环烷氧基、c1-6卤代烷氧基、5-6元杂芳基、生物素酰胺或生物素化取代基;r11a是c1-6烷基、c3-6环烷基或c1-6杂烷基,其中所述c1-6烷基、c3-6环烷基和c1-6杂烷基各自独立任选地被1-3个r8a取代基取代;r12a和r13a各自独立地选自氢、c1-6烷基、c3-6环烷基、c1-6羟烷基、c1-6杂烷基、-oh或c1-6烷氧基,或r12a和r13a组合形成包括它们均附接的氮原子的5或6元杂环烷基;并且r18a是c1-3烷基或c3-6环烷基。a79.如实施方案a78所述的化合物,其中r18a是甲基、乙基、异丙基或环丙基。a80.如实施方案a79所述的化合物,其中r18a是甲基。a81.如实施方案a79所述的化合物,其中r18a是乙基。a82.如实施方案a79所述的化合物,其中r18a是异丙基。a83.如实施方案a79所述的化合物,其中r18a是环丙基。a84.如实施方案a78-a83中任一项所述的化合物,其中r8a选自c1-6烷基、c3-6环烷基、3-6元杂环烷基、c1-6烷氧基或c3-6环烷氧基、-nr12ar13a或5-6元杂芳基。a85.如实施方案a78-a84中任一项所述的化合物,其中r2a是吡啶基、嘧啶基、吡唑基或吡唑基,其中所述吡啶基、嘧啶基、吡唑基或吡唑基任选地被1-3个r8a取代基取代,任选地其中2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5-6元环烷基或5-6元杂环烷基。a86.如实施方案a85所述的化合物,其中r2a是任选地被1-2个r8a取代基取代的吡啶基。a87.如实施方案a86所述的化合物,其中r2a是a88.如实施方案a85所述的化合物,其中r2a是任选地被1-2个r8a取代基取代的嘧啶基。a89.如实施方案a88所述的化合物,其中r2a是a90.如实施方案a85所述的化合物,其中r2a是任选地被1-2个r8a取代基取代的吡唑基(pyrazyl)。a91.如实施方案a85所述的化合物,其中r2a是任选地被1-2个r8a取代基取代的吡唑基(pyrazolyl)。a92.如实施方案a91所述的化合物,其中r2a是a93.如实施方案a85-a92中任一项所述的化合物,其中所述2个独立的r8a取代基组合形成包括各自附接的一个或多个原子的5元环烷基或5元杂环烷基。a94.如实施方案a78-a93中任一项所述的化合物,其中r1a和r2a连同它们附接的氮具有以下结构:a95.如实施方案a78-a94中任一项所述的化合物,其中r1a和r2a连同它们附接的氮具有以下结构:a96.如实施方案a78-a95中任一项所述的化合物,其中所述化合物选自化合物6、57、58、62、63、64、68、84、91、100、102、104、107、124、126、136、137、141、142、143、144、145、157、221、222、226、235、238、252、255、260、265、267和268。a97.如实施方案a78-a96中任一项所述的化合物,其中所述化合物选自化合物6、84、100、102、104、124、221、222、235、238、252、255、260和267。a98.如实施方案a1至a97中任一项所述的化合物,其中所述化合物具有不超过1,000g/mol的mw。a99.如实施方案a1至a98中任一项所述的化合物,其中所述化合物具有不超过900g/mol、不超过800g/mol、不超过700g/mol、不超过600g/mol或不超过500g/mol的mw。a100.如实施方案a1至a99中任一项所述的化合物,其中所述化合物具有不超过600g/mol的mw。a101.如实施方案a1至a100中任一项所述的化合物,其中所述化合物具有不超过500g/mol的mw。a102.如实施方案a1至a101中任一项所述的化合物,其中所述化合物选自化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275和276或其药学上可接受的形式。a103.如实施方案a1至a102中任一项所述的化合物,其中所述化合物选自化合物6、17、22、32、34、37、42、43、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、113、114、116、118、119、120、121、122、123、124、125、126、127、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、156、157、158、165、166、167、169、170、172、173、174、175、176、177、178、179、186、187、188、196、200、202、208、211、212、213、214、215、216、217、220、221、222、223、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。a104.如实施方案a1至a103中任一项所述的化合物,其中所述化合物选自化合物6、17、22、37、44、45、46、48、49、50、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、72、73、75、76、77、78、79、81、82、83、84、86、89、90、91、93、94、95、96、97、98、99、100、101、102、104、105、107、108、109、110、111、1l3、114、116、118、119、120、121、122、123、124、125、127、135、136、137、138、139、140、141、142、143、144、145、146、147、149、150、151、152、153、154、156、157、158、165、166、169、170、173、175、176、177、178、179、186、187、188、196、202、208、211、212、213、214、215、216、217、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、261、262、263、264、265、266、267、268、269、270和276或其药学上可接受的形式。a105.如实施方案a1至a104中任一项所述的化合物,其中所述化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、36、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。a106.如实施方案a1至a105中任一项所述的化合物,其中所述化合物选自化合物3、4、20、23、26、29、30、31、32、33、34、42、43、53、58、67、93、203、209、210、219、266、269、270、271、272、273和274或其药学上可接受的形式。a107.如实施方案a1至a104中任一项所述的化合物,其中所述化合物选自化合物49、68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、130、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。a108.如实施方案a1至a104或a107中任一项所述的化合物,其中所述化合物选自化合物68、69、71、72、73、74、77、78、79、80、83、84、86、87、89、90、91、94、95、97、98、99、100、104、107、113、116、118、120、121、124、126、127、128、129、135、136、138、143、145、148、149、151、154、156、157、165、174、175、176、177、178、179、183、190、191、192、193、194、196、197、198、199、200、201、202、204、205、207、208、213、216、217、218、224、227、230、231、233、234、236、239、243、247、248、249、250、253、254、257、267、268和276或其药学上可接受的形式。a109.如实施方案a1至a108中任一项所述的化合物,其中所述化合物选自化合物17、20、23、25、29、30、31、32、33、34、42、203、209、210、219、270、271、272、273和274或其药学上可接受的形式。a110.如实施方案a1至a108中任一项所述的化合物,其中所述化合物选自化合物1、2、18、19、21、47、48、49、50、51、57、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、76、77、78、79、80、81、82、83、84、85、86、87、88、89、91、93、94、95、96、97、98、100、101、102、103、104、106、107、108、109、110、111、112、113、114、115、116、118、119、122、124、125、126、127、128、129、130、135、136、13/、138、143、145、149、151、156、157、158、165、166、169、170、173、174、175、176、178、179、187、190、191、192、193、194、195、196、204、205、207、208、213、217、218、221、222、224、226、227、228、229、230、231、232、233、234、235、237、238、240、241、242、243、244、245、246、247、248、249、250、252、253、254、255、256、257、259、260、263、264、265、266、267、268、275和276或其药学上可接受的形式。a111.如实施方案a1至a110中任一项所述的化合物,其中所述化合物选自化合物27、29、30、31、32、33、36、43、44、47、51、52、55、59、85、96、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。a112.如实施方案a1至a111中任一项所述的化合物,其中所述化合物选自化合物29、30、31、32、33、36、44、47、59、85、97、98、99、116、141、144、156、203、205、207、208、209、210、211、214、219、230、269、272、273和274或其药学上可接受的形式。a113.如实施方案a1至a110中任一项所述的化合物,其中所述化合物选自化合物56、63、84、88、89、90、95、100、101、103、104、106、108、109、111、112、113、114、129、166、173、179、183、186、216、241、247、248、250、255、256、257和266或其药学上可接受的形式。a114.如实施方案a1至a113中任一项所述的化合物,其中所述化合物选自化合物29、30、32、33和34或其药学上可接受的形式。a115.如实施方案a1至a114中任一项所述的化合物,其中所述化合物选自化合物29、32、33和34或其药学上可接受的形式。a116.如实施方案a1至a115中任一项所述的化合物,其中所述化合物选自化合物29、32和34或其药学上可接受的形式。a117.如实施方案a1至a113中任一项所述的化合物,其中所述化合物选自化合物1、2、3、4、6、7、8、9、11、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。a118.如实施方案a1至a113或a117中任一项所述的化合物,其中所述化合物选自化合物3、4、6、7、11、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。a119.如实施方案a1至a113、a117或a118中任一项所述的化合物,其中所述化合物选自化合物3、6、7、13、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、46、47、51、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。a120.如实施方案a1至a119中任一项所述的化合物,其中所述化合物选自化合物29、30、32、33、34、46、47、188、196、197、203、205、207、208、209、210、212、213、214、215、217和220或其药学上可接受的形式。a121.如实施方案a1至a120中任一项所述的化合物,其中所述化合物选自化合物29、32、33、34、46、207和209或其药学上可接受的形式。a122.如实施方案a1至a119中任一项所述的化合物,其中所述化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、69、70、71、72、93和218或其药学上可接受的形式。a123.如实施方案a1至a119或a122中任一项所述的化合物,其中所述化合物选自化合物1、2、3、4、7、8、9、10、11、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。a124.如实施方案a1至a119、a122或a123中任一项所述的化合物,其中所述化合物选自化合物1、2、3、7、8、12、13、14、15、16、18、19、20、21、22、23、24、25、26、27、28、31、35、36、42、43、44、45、51、53、54、55、56、59、60、61、62、63、64、65、66、67、69、70、71、72和93或其药学上可接受的形式。a125.如实施方案a1至a124中任一项所述的化合物,其中所述化合物选自化合物6、13、22、26、29、30、32、33、34、42、45、46、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、214、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。a126.如实施方案a1至a125中任一项所述的化合物,其中所述化合物选自化合物6、13、22、26、29、30、32、33、34、42、48、49、50、53、54、55、56、57、58、59、61、62、63、64、65、68、72、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、149、156、157、158、165、169、170、173、174、175、176、196、203、209、210、213、217、219、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、253、255、257、263、264、265、266、267、268、269、270、271、274和276或其药学上可接受的形式。a127.如实施方案a1至a126中任一项所述的化合物,其中所述化合物选自化合物6、13、22、32、34、48、49、50、53、54、55、56、57、58、59、62、63、64、65、68、73、74、76、78、79、81、82、83、84、86、89、91、93、94、95、96、97、98、100、101、102、104、106、107、110、111、112、113、114、115、116、117、118、120、122、123、124、125、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、146、156、157、158、165、169、170、174、175、196、209、221、222、224、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、243、244、245、246、247、248、249、250、252、255、257、263、264、265、266、267、268、270、271、274和276或其药学上可接受的形式。a128.如实施方案a1至a127中任一项所述的化合物,其中所述化合物选自化合物6、48、49、50、53、54、55、57、58、62、63、64、65、68、73、76、79、82、84、89、91、94、95、97、98、100、102、104、106、107、110、112、113、114、115、117、118、120、122、123、124、126、127、128、129、135、136、137、138、139、140、141、142、143、144、145、156、157、158、165、169、170、196、221、222、224、226、227、228、230、231、232、233、234、235、236、237、238、239、240、243、244、245、248、249、250、252、255、257、263、265、266、267和268或其药学上可接受的形式。a129.如实施方案a1至a128中任一项所述的化合物,其中所述化合物选自化合物1、4、6、13、19、20、22、23、27、29、30、31、32、33、34、40、42、45、46、67、81、82、85、86、89、93、99、104、105、111、113、143、149、160、161、163、164、166、173、175、176、177、192、193、194、196、199、201、203、204、206、207、208、209、210、217、219、238、247、248、249、250、257、260、263、264、265、268、269、270、271、272、273和274或其药学上可接受的形式。a130.如实施方案a1至a129中任一项所述的化合物,其中所述化合物选自化合物4、23、29、30、31、32、33、42、45、46、93、99、149、166、196、203、207、209、210、219、269、270、271、272、273和274或其药学上可接受的形式。a131.如实施方案a1至a130中任一项所述的化合物,其中所述化合物选自化合物53、55、57、58、84、91、100、102、116、118、124、137、141、142、145、158、221、222、255和267或其药学上可接受的形式。a132.如实施方案a1至a131中任一项所述的化合物,其中所述化合物选自化合物91、102、118和255或其药学上可接受的形式。a133.如实施方案a1至a132中任一项所述的化合物,其中所述化合物选自化合物6、102、104、124、126、128、129、137、141、142、144、145、156、157、224、226、227、235、238、248、255、265和267或其药学上可接受的形式。a134.如实施方案a1至a133中任一项所述的化合物,其中所述化合物选自化合物6、58、84、100、102、104、124、221、222、235、238、252、255和267或其药学上可接受的形式。a135.如实施方案a1至a134中任一项所述的化合物,其中所述化合物的所述药学上可接受的形式是所述化合物的异构体、同位素变体、药学上可接受的盐、多晶型物或溶剂化物。a136.如实施方案a1至a134中任一项所述的化合物,其中所述化合物的所述药学上可接受的形式不包括盐形式。a137.如实施方案a1至a136中任一项所述的化合物,其中所述化合物的所述异构体是所述化合物的非对映异构体或对映异构体。a138.如实施方案a1至a137中任一项所述的化合物,其中所述化合物是所述化合物的互变异构体。a139.如实施方案a1至a138中任一项所述的化合物,其中所述化合物是外消旋体或非对映异构体的混合物。a140.如实施方案a1至a138中任一项所述的化合物,其中所述化合物是单一对映异构体或单一非对映异构体。a141.如实施方案a140所述的化合物,其中所述化合物是(r)-对映异构体。a142.如实施方案a140或实施方案a141所述的化合物,其中所述化合物具有大于10%对映异构体过量的-对映异构体。a143.如实施方案a140至a142中任一项所述的化合物,其中所述化合物具有15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、98%或更多或99%或更多对映异构体过量的所述-对映异构体。a144.如实施方案a140至a143中任一项所述的化合物,其中所述化合物具有约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%对映异构体过量的所述(r)-对映异构体。a145.如实施方案a140所述的化合物,其中所述化合物是(s)-对映异构体。a146.如实施方案a140或实施方案a145所述的化合物,其中所述化合物具有大于10%对映异构体过量的所述(s)-对映异构体。a147.如实施方案a140、a145或a146中任一项所述的化合物,其中所述化合物具有15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、98%或更多或99%或更多对映异构体过量的所述(s)-对映异构体。a148.如实施方案a140或a145至a147中任一项所述的化合物,其中所述化合物具有约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%对映异构体过量的所述(6)-对映异构体。a149.如实施方案a1至a148中任一项所述的化合物,其中根据ras超家族活性测定,所述化合物或其药学上可接受的形式是ras超家族活性的调节剂。a150.如实施方案a149所述的化合物,其中根据ras超家族活性测定,所述化合物或其药学上可接受的形式在20μm下将一种或多种gtp酶的ras超家族活性调节50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a151.如实施方案a1至a150中任一项所述的化合物,其中根据erk1/2磷酸化测定,所述化合物或其药学上可接受的形式抑制erk1/2的磷酸化。a152.如实施方案a151所述的化合物,其中根据erk1/2磷酸化测定,所述化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a153.如实施方案a1至a150中任一项所述的化合物,其中根据erk1/2磷酸化测定,所述化合物或其药学上可接受的形式激活erk1/2的磷酸化。a154.如实施方案153所述的化合物,其中根据erk1/2磷酸化测定,所述化合物或其药学上可接受的形式在10μm下将erk1/2的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。a155.如实施方案a1至a154中任一项所述的化合物,其中根据akt磷酸化测定,所述化合物或其药学上可接受的形式抑制akt的磷酸化。a156.如实施方案a155所述的化合物,其中根据akt磷酸化测定,所述化合物或其药学上可接受的形式在10μm下将akt的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a157.如实施方案a1至a154中任一项所述的化合物,其中根据akt磷酸化测定,所述化合物或其药学上可接受的形式激活akt的磷酸化。a158.如实施方案a157所述的化合物,其中根据akt磷酸化测定,所述化合物或其药学上可接受的形式在10μm下将akt的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。a159.如实施方案a1至a158中任一项所述的化合物,其中根据磷酸-smad2/3抑制测定,所述化合物或其药学上可接受的形式抑制smad2/3的磷酸化。a160.如实施方案a159所述的化合物,其中根据磷酸-smad2/3抑制测定,所述化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a161.如实施方案a1至a158中任一项所述的化合物,其中根据磷酸-smad2/3抑制测定,所述化合物或其药学上可接受的形式激活smad2/3的磷酸化。a162.如实施方案a161所述的化合物,其中根据磷酸-smad2/3抑制测定,所述化合物或其药学上可接受的形式在10μm下将smad2/3的磷酸化激活50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。a163.如实施方案a1至a162中任一项所述的化合物,其中根据jnk激活测定,所述化合物或其药学上可接受的形式抑制jnk。a164.如实施方案a163所述的化合物,其中根据jnk激活测定,所述化合物或其药学上可接受的形式在10μm下将jnk抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a165.如实施方案a1至a162中任一项所述的化合物,其中根据jnk激活测定,所述化合物或其药学上可接受的形式激活jnk。a166.如实施方案a165所述的化合物,其中根据jnk激活测定,所述化合物或其药学上可接受的形式在10μm下将jnk激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。a167.如实施方案a1至a166中任一项所述的化合物,其中根据mapk p38激活测定,所述化合物或其药学上可接受的形式抑制mapk p38。a168.如实施方案a167所述的化合物,其中根据mapk p38激活测定,所述化合物或其药学上可接受的形式在10μm下将mapk p38抑制25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a169.如实施方案a1至a166中任一项所述的化合物,其中根据mapk p38激活测定,所述化合物或其药学上可接受的形式激活mapk p38。a170.如实施方案a169所述的化合物,其中根据mapk p38激活测定,所述化合物或其药学上可接受的形式在10μm下将mapk p38激活25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或等于或大于100%。a171.如实施方案a1至a170中任一项所述的化合物,其中根据增殖测定,所述化合物或其药学上可接受的形式抑制miapaca2的增殖。a172.如实施方案a171所述的化合物,其中根据增殖测定,所述化合物或其药学上可接受的形式以1μm或更小、0.9μm或更小、0.8μm或更小、0.75μm或更小、0.7μm或更小、0.6μm或更小、0.5μm或更小、0.4μm或更小、0.3μm或更小、0.25μm或更小、0.2μm或更小、0.15μm或更小、或0.1μm或更小的ic50值抑制miapaca2的增殖。a173.如实施方案a1至a172中任一项所述的化合物,其中根据il-6定量测定,所述化合物或其药学上可接受的形式抑制il-6。a174.如实施方案a173所述的化合物,其中根据il-6定量测定,所述化合物或其药学上可接受的形式在10μm下将il-6抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a175.如实施方案a1至a174中任一项所述的化合物,其中根据tnf-α定量测定,所述化合物或其药学上可接受的形式抑制tnf-α。a176.如实施方案a175所述的化合物,其中根据tnf-α定量测定,所述化合物或其药学上可接受的形式在10μm下将tnf-α抑制50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、或95%或更多。a177.如实施方案a1至a176中任一项所述的化合物,其中根据小鼠肝微粒体代谢稳定性测定,所述化合物或其药学上可接受的形式在小鼠肝微粒体中的半衰期为10分钟或更长、20分钟或更长、30分钟或更长、40分钟或更长、或50分钟或更长。a178.如实施方案a1至a177中任一项所述的化合物,其中根据动力学溶解度测定,所述化合物或其药学上可接受的形式在包含2%dmso的ph 7.4缓冲液中的动力学溶解度为10μm或更大、20μm或更大、30μm或更大、40μm或更大、50μm或更大、60μm或更大、70μm或更大、80μm或更大、90μm或更大、100μm或更大、150μm或更大、或200μm或更大。a179.如实施方案a1至a178中任一项所述的化合物,其中根据增殖测定,所述化合物或其药学上可接受的形式抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。a180.如实施方案a179所述的化合物,其中根据增殖测定,所述化合物或其药学上可接受的形式以50nm或更小、40nm或更小、30nm或更小、20nm或更小、10nm或更小、1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制nci-h358、a375、gp2d、bt549或mm.r1的增殖。a181.如实施方案a180所述的化合物,其中根据增殖测定,所述化合物或其药学上可接受的形式以1nm或更小、0.1nm或更小、或0.01nm或更小的ic50值抑制mm.r1的增殖。a182.一种药物组合物,其包含如实施方案a1至a181中任一项所述的化合物或其药学上可接受的形式,以及药学上可接受的载体、赋形剂或稀释剂。a183.一种调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a184.一种调节ras超家族蛋白的方法,其包括使所述ras超家族蛋白与有效量的如实施方案a182所述的药物组合物接触。a185.如实施方案a183或实施方案a184所述的方法,其中所述ras超家族蛋白存在于细胞中。a186.如实施方案a183至a185中任一项所述的方法,其中所述方法抑制所述ras超家族蛋白。a187.如实施方案a183至a186中任一项所述的方法,其中所述ras超家族蛋白是ras蛋白或其突变体。a188.如实施方案a187所述的方法,其中所述ras蛋白是diras i;diras2;diras3;eras;gem;hras;kras;mras;nkirasi;nkiras2;nras;rala;ralb;rapia;rapib;rap2a;rap2b;rap2c;rasdi;rasd2;raslioa;rasliob;rasli ia;rasliib;rasl12;remi;rem2;rerg;rergl;rrad;rras;或rras2。a189.如实施方案a187或实施方案a188所述的方法,其中所述ras蛋白是hras;kras;或nras,或其突变体。a190.如实施方案a187至189中任一项所述的方法,其中所述ras蛋白是kras突变体。a191.如实施方案a190所述的方法,其中所述kras突变体是kras g12d突变体、kras g12c突变体或kras q61h突变体。a192.如实施方案a187至a189中任一项所述的方法,其中所述ras蛋白是hras或其突变体。a193.如实施方案a187至a189中任一项所述的方法,其中所述ras蛋白是nras或其突变体。a194.如实施方案a183至a186中任一项所述的方法,其中所述ras超家族蛋白是rac蛋白或其突变体。a195.如实施方案a194所述的方法,其中所述rac蛋白是rac1;rac2;rac3;rhog,或其突变体。a196.如实施方案a194或实施方案a195所述的方法,其中所述rac蛋白是野生型rac1。a197.如实施方案a183至a186中任一项所述的方法,其中所述ras超家族蛋白是rho蛋白或其突变体。a198.如实施方案a197所述的方法,其中所述rho蛋白是rhoa;rhob;rhobtb1;rhobtb2;rhobtb3;rhoc;rhod;rhof;rhoh;rhoj;rhoq;rhou;rhov;rnd1;rnd2;rnd3;cdc42,或其突变体。a199.如实施方案a197或实施方案a198所述的方法,其中所述rho蛋白是野生型rhoa。a200.如实施方案a183至a186中任一项所述的方法,其中所述ras超家族蛋白是cdc42蛋白或其突变体。a201.如实施方案a183至a186中任一项所述的方法,其中所述ras超家族蛋白是rheb蛋白或其突变体。a202.如实施方案a183至a201中任一项所述的方法,其中所述ras超家族蛋白的接触发生在细胞中。a203.如实施方案a202所述的方法,其中所述细胞在受试者体内。a204.如实施方案a202或实施方案a203所述的方法,其中所述细胞是哺乳动物细胞。a205.如实施方案a202至a204中任一项所述的方法,其中所述细胞是人细胞。a206.如实施方案a203至a205中任一项所述的方法,其中所述受试者患有癌症。a207.如实施方案a183至a206中任一项所述的方法,其中所述调节发生在患有癌症的受试者中。a208.如实施方案a206或实施方案a207所述的方法,其中所述癌症是实体瘤或是血源性肿瘤(或血液癌症)。a209.如实施方案a206至a208中任一项所述的方法,其中所述癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。a210.如实施方案a209所述的方法,其中所述癌症是胰腺癌。a211.如实施方案a209所述的方法,其中所述癌症是结肠癌。a212.如实施方案a209所述的方法,其中所述癌症是三阴性乳腺癌。a213.如实施方案a209所述的方法,其中所述癌症是多发性骨髓瘤。a214.如实施方案a206至213中任一项所述的方法,其中所述癌症是依赖于ras超家族蛋白的癌症。a215.如实施方案a202至214中任一项所述的方法,其中所述受试者是人。a216.一种调节半胱天冬酶活性的方法,其包括使所述半胱天冬酶与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a217.一种调节半胱天冬酶活性的方法,其包括使所述半胱天冬酶与有效量的如实施方案a182所述的药物组合物接触。a218.如实施方案a216或实施方案a217所述的方法,其中所述方法激活所述半胱天冬酶。a219.如实施方案a216至a218中任一项所述的方法,其中所述半胱天冬酶是半胱天冬酶3、半胱天冬酶6或半胱天冬酶9。a220.如实施方案a216至a219中任一项所述的方法,其中所述半胱天冬酶的接触发生在细胞中。a221.如实施方案a220所述的方法,其中所述调节半胱天冬酶活性诱导所述细胞的凋亡。a222.如实施方案a220或a221所述的方法,其中所述细胞在受试者体内。a223.如实施方案a220至a222中任一项所述的方法,其中所述细胞是哺乳动物细胞。a224.如实施方案a220至a223中任一项所述的方法,其中所述细胞是人细胞。a225.如实施方案a220至a224中任一项所述的方法,其中所述受试者患有癌症。a226.如实施方案a216至a225中任一项所述的方法,其中所述调节发生在患有癌症的受试者中。a227.如实施方案a225或实施方案a226所述的方法,其中所述癌症是实体瘤或是血源性肿瘤(或血液癌症)。a228.如实施方案a225至a227中任一项所述的方法,其中所述癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。a229.如实施方案a228所述的方法,其中所述癌症是胰腺癌。a230.如实施方案a228所述的方法,其中所述癌症是结肠癌。a231.如实施方案a228所述的方法,其中所述癌症是三阴性乳腺癌。a232.如实施方案a228所述的方法,其中所述癌症是多发性骨髓瘤。a233.如实施方案a222至a232中任一项所述的方法,其中所述受试者是人。a234.一种治疗受试者的癌症的方法,其包括向患有癌症的所述受试者施用治疗有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式。a235.一种治疗受试者的癌症的方法,其包括向患有癌症的所述受试者施用治疗有效量的如实施方案a182所述的药物组合物。a236.如实施方案a234或实施方案a235所述的方法,其中所述癌症是实体瘤或是血源性肿瘤(或血液癌症)。a237.如实施方案a234至a236中任一项所述的方法,其中所述癌症是肝细胞癌、前列腺癌、胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌、小肠癌、胆道癌、子宫内膜癌、皮肤癌(黑素瘤)、宫颈癌、尿道癌、成胶质细胞瘤或多发性骨髓瘤。a238.如实施方案a237所述的方法,其中所述癌症是胰腺癌。a239.如实施方案a237所述的方法,其中所述癌症是结肠癌。a240.如实施方案a237所述的方法,其中所述癌症是三阴性乳腺癌。a241.如实施方案a237所述的方法,其中所述癌症是多发性骨髓瘤。a242.如实施方案a234至241中任一项所述的方法,其中所述癌症是依赖于ras超家族蛋白的癌症。a243.如实施方案a242所述的方法,其中所述ras超家族蛋白是ras蛋白或其突变体。a244.如实施方案a243所述的方法,其中所述ras蛋白是diras i;diras2;diras3;eras;gem;hras;kras;mras;nkirasi;nkiras2;nras;rala;ralb;rapia;rapib;rap2a;rap2b;rap2c;rasdi;rasd2;raslioa;rasliob;rasliia;rasliib;rasl12;remi;rem2;rerg;rergl;rrad;rras;或rras2。a245.如实施方案a244所述的方法,其中所述ras蛋白是hras;kras;或nras,或其突变体。a246.如实施方案a245所述的方法,其中所述ras蛋白是kras突变体。a247.如实施方案a246所述的方法,其中所述kras突变体是kras g12d突变体、kras g12c突变体或kras q61h突变体。a248.如实施方案a245所述的方法,其中所述ras蛋白是hras或其突变体。a249.如实施方案a245所述的方法,其中所述ras蛋白是nras或其突变体。a250.如实施方案a242所述的方法,其中所述ras超家族蛋白是rac蛋白或其突变体。a251.如实施方案a250所述的方法,其中所述rac蛋白是rac1;rac2;rac3;rhog,或其突变体。a252.如实施方案a251所述的方法,其中所述rac蛋白是野生型rac1。a253.如实施方案a242所述的方法,其中所述ras超家族蛋白是rho蛋白或其突变体。a254.如实施方案a253所述的方法,其中所述rho蛋白是rhoa;rhob;rhobtb1;rhobtb2;rhobtb3;rhoc;rhod;rhof;rhoh;rhoj;rhoq;rhou;rhov;rnd1;rnd2;rnd3;cdc42,或其突变体。a255.如实施方案a254所述的方法,其中所述rho蛋白是野生型rhoa。a256.如实施方案a242所述的方法,其中所述ras超家族蛋白是cdc42蛋白或其突变体。a257.如实施方案a242所述的方法,其中所述ras超家族蛋白是rheb蛋白或其突变体。a258.如实施方案a234至a240中任一项的方法,其中所述施用激活所述受试者的癌细胞中的半胱天冬酶活性。a259.如实施方案a258所述的方法,其中所述激活诱导所述癌细胞的凋亡。a260.如实施方案a234至a259中任一项所述的方法,其中所述受试者是人。a261.一种调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a262.一种调节erk1/2活性的方法,其包括使erk1/2蛋白与有效量的如实施方案a182所述的药物组合物接触。a263.如实施方案a261或实施方案a262所述的方法,其中所述方法抑制所述erk1/2蛋白的磷酸化。a264.如实施方案a261或实施方案a262所述的方法,其中所述方法激活所述erk1/2蛋白的磷酸化。a265.一种调节akt活性的方法,其包括使akt蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a266.一种调节akt活性的方法,其包括使akt蛋白与有效量的如实施方案a182所述的药物组合物接触。a267.如实施方案a265或实施方案a266所述的方法,其中所述方法抑制所述akt蛋白的磷酸化。a268.如实施方案a265或实施方案a266所述的方法,其中所述方法激活所述akt蛋白的磷酸化。a269.一种调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a270.一种调节smad2/3活性的方法,其包括使smad2/3蛋白与有效量的如实施方案a182所述的药物组合物接触。a271.如实施方案a269或实施方案a270所述的方法,其中所述方法抑制所述smad2/3蛋白的磷酸化。a272.如实施方案a269或实施方案a270所述的方法,其中所述方法激活所述smad2/3蛋白的磷酸化。a273.一种调节jnk活性的方法,其包括使jnk蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a274.一种调节jnk活性的方法,其包括使jnk蛋白与有效量的如实施方案a182所述的药物组合物接触。a275.如实施方案a273或实施方案a274所述的方法,其中所述方法抑制所述jnk蛋白的磷酸化。a276.如实施方案a273或实施方案a274所述的方法,其中所述方法激活所述jnk蛋白的磷酸化。a277.一种调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a278.一种调节mapk p38活性的方法,其包括使mapk p38蛋白与有效量的如实施方案a182所述的药物组合物接触。a279.如实施方案a277或实施方案a278所述的方法,其中所述方法抑制所述mapkp38蛋白的磷酸化。a280.如实施方案a277或实施方案a278所述的方法,其中所述方法激活所述mapkp38蛋白的磷酸化。a281.一种调节il-6活性的方法,其包括使il-6蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a282.一种调节il-6活性的方法,其包括使il-6蛋白与有效量的如实施方案a182所述的药物组合物接触。a283.如实施方案a281或实施方案a282所述的方法,其中所述方法抑制il-6活性。a284.一种调节tnf-a活性的方法,其包括使tnf-α蛋白与有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式接触。a285.一种调节tnf-α活性的方法,其包括使tnf-α蛋白与有效量的如实施方案a182所述的药物组合物接触。a286.如实施方案a284或实施方案a285所述的方法,其中所述方法抑制tnf-α活性。a287.一种治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式。a288.一种治疗受试者的纤维化疾病的方法,其包括向所述受试者施用治疗有效量的如实施方案a182所述的药物组合物。a289.一种治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的如实施方案a1-a181中任一项所述的化合物或其药学上可接受的形式。a290.一种治疗受试者的炎性疾病的方法,其包括向所述受试者施用治疗有效量的如实施方案a182所述的药物组合物。本公开在范围上不受实施例中公开的实施方案的限制,这些实施例旨在作为单独方面的单个说明,并且功能上等同的任何方法也在本公开的范围内。实际上,除了本文示出和描述的那些之外,根据前面的描述,各种修改对于本领域技术人员将变得显而易见。此类修改旨在落入所附权利要求的范围内。本公开在范围上不受限制,或者以任何方式通过使用任何子标题来约束,这些子标题仅为了方便读者而提供。本说明书中提及的所有参考文献,诸如出版物、专利和专利申请通过引用整体并入本文,其程度如同每个单独的出版物、专利和专利申请被具体地和单独地指明通过引用整体并入。
背景技术:
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!