一种自组装蛋白支架共固定化酶及其应用
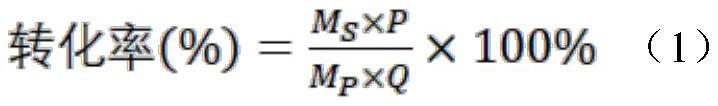
本发明涉及一种自组装蛋白支架,共固定来源于aspergillus terreus的r-ω-转氨酶以及乙醇脱氢酶,并将其应用于1-(4-甲氧基苯基)丙酮的不对称选择性胺化制备(r)-1-(4-甲氧基苯基)丙-2-胺。
背景技术:
1、(r)-1-(4-甲氧基苯基)丙-2-胺((r)-1-(4-methoxyphenyl)propan-2-amine,4-mppa),cas号:58993-79-6,分子式为:c10h15no,分子量:165.23,密度为:0.99g/ml,沸点为:90-95℃,不溶于水,易溶于乙酸乙酯等有机溶剂。(r)-1-(4-甲氧基苯基)丙-2-胺是合成治疗哮喘与慢性阻塞性肺病强效药福莫特罗等多种药物的关键手性中间体,故如何经济、绿色以及高效的制备(r)-1-(4-甲氧基苯基)丙-2-胺是国内外相关领域的研究热点之一。
2、生物催化作为化学催化的替代品在可持续化学中有着广泛的应用,其中在制药工业中合成手性药物关键中间体较为突出。随着生物合成学与代谢工程学的发展,并基于工程设计以及基因编辑,研究人员在微生物体内以及体外构建了人工多酶复合物体系。为实现理想的催化效果,众多的多酶级联固定策略被开发,其中包括载体介导的共固定、酶支架、蛋白融合等技术。
3、多酶共固定化技术具有诸多优势,不仅使酶分子具有良好的稳定性和重复利用性,同时充分发挥了多酶之间协同催化的性能,提高了催化效率。通过基因工程改造来自肠道沙门氏菌的细菌微室蛋白eutm,在体内外可以自发地组装成晶体阵列的形式,形成一个稳定的蛋白支架。将spycatcher基因融合到eutm的c-端,短肽spytag基因融合到目标蛋白r-atta、adh的n-端,通过自组装蛋白eutm自发地形成蛋白支架以及spycatcher/spytag体系自发地形成异肽键来固定目标蛋白,创建了一个基于蛋白质的支架共固定化生物催化系统。相比游离酶混合物催化级联反应,蛋白支架共固定化多酶催化体系提供了一个模块化、易于使用的固定化系统,为胺化反应提供了一个稳定的微环境,提高了酶的热稳定性;并利用蛋白支架将多酶进行近距离排列,触发底物通道效应,实现辅因子的高效利用和级联催化,从而提高了催化效率。
技术实现思路
1、本发明目的是提供一种自组装蛋白支架共固定化r-ω-转氨酶(r-ω-atta)与乙醇脱氢酶(adh)双酶级联合成(r)-1-(4-甲氧基苯基)丙-2-胺((r)-4-mppa)的方法,利用自组装蛋白支架固定化转氨酶和乙醇脱氢酶,形成高效的、用于辅酶再生循环的多酶级联反应系统,提高多酶的催化效率与稳定性,降低成本,为后续共固定化双酶级联催化工艺提供了参考。
2、本发明采用的技术方案是:
3、第一方面,本发明提供一种自组装蛋白支架共固定化酶,所述自组装蛋白支架共固定化酶采用eutm-spycatcher/spytag体系固定r-ω-转氨酶和乙醇脱氢酶得到;所述r-ω-转氨酶的氨基酸序列如seq id no:14所示,所述乙醇脱氢酶的氨基酸序列如seq idno:18所示。
4、本发明通过eutm-spycatcher/spytag体系得到的双酶体系可以有效提高酶的热稳定性,进一步提高酶促反应温度、转化率和ee值。
5、进一步,所述自组装蛋白支架共固定化酶采用如下方法构建:
6、将重组蛋白spytag-r-ω-转氨酶(spytag-atta)、重组蛋白spytag-乙醇脱氢酶(spytag-adh)和重组蛋白eutm-spycatcher混合于水中,0-37℃(优选4℃)下孵育1-12h(优选2h),超滤,所得截留液冷冻干燥,得到所述自组装蛋白支架共固定化酶。
7、上述重组蛋白spytag-r-ω-转氨酶是将短肽spytag与r-ω-转氨酶连接得到;重组蛋白spytag-乙醇脱氢酶是将短肽spytag与r-ω-转氨酶连接得到,所述重组蛋白eutm-spycatcher是将spycatcher结构域与eutm蛋白连接得到(连到eutm的c端)。
8、孵育过程中每半小时轻轻晃动,促进组装。优选地,各个重组蛋白先配置成水溶液再进行混合,进一步水溶液浓度均为2μm。
9、在本发明的实施例中,所述重组蛋白spytag-r-ω-转氨酶的氨基酸序列如seq idno:16所示;所述重组蛋白spytag-乙醇脱氢酶的氨基酸序列如seq id no:20所示;重组蛋白eutm-spycatcher的氨基酸序列如seq id no:6所示。
10、优选地,所述重组蛋白spytag-r-ω-转氨酶、重组蛋白spytag-乙醇脱氢酶与重组蛋白eutm-spycatcher的摩尔比为1:0.5-2:1-7(优选1:1:3)。
11、进一步,所述冷冻干燥的程序为:在-80℃冰箱中预冻8h后放入冷冻干燥机-65℃真空干燥24h。
12、催化体系是将spycatcher结构域融合到eutm的c端,形成eutm-spycatcher结构域支架构建块,支架上的spycatcher结构域与spytag结构域融合的目标蛋白r-ω-转氨酶(r-ω-atta)和乙醇脱氢酶(adh)形成共价异肽键,从而形成共固定化酶催化体系。
13、优选的,所述重组蛋白eutm-spycatcher的纯酶按如下方法制备:(1)将重组质粒pet22b-eutm-spycatcher导入感受态大肠杆菌bl21(de3)中,挑单菌落接种到含50-100μg/ml(优选50μg/ml)氨苄青霉素的lb培养基中,37℃、150-200rpm(优选180rpm)培养过夜,获得种子液;(2)将种子液按体积浓度1%-5%(优选3%)接种量转接到新鲜含50-100μg/ml(优选50μg/ml)氨苄青霉素的lb培养基中,37℃、150-200rpm(优选180rpm)发酵培养至600nm处光密度(od600)为0.6-1.0(优选0.8),加入终浓度为0.1-1.0mm(优选0.5m)的异丙基-β-硫代半乳糖苷(iptg),在16-30℃(优选18℃)恒温摇床中继续诱导培养8-24h(优选16h);将诱导结束后的发酵液置于4℃,8000rpm离心10min,沉淀用0.9%(v/w)生理盐水洗涤1-4次(优选3次),收集湿细胞;(3)将步骤(2)收获的湿细胞以50g/l重悬于ph 7.0、100mm磷酸钠缓冲液中,在功率360w、工作3s、间歇7s条件下超声破碎15min;收集破碎液,8000rpm,4℃离心10min后,取上清液,得到粗酶液;(4)将经0.45μm滤膜过滤后的粗酶液与耐还原型镍柱(beyogoldtmhis-tag)的层析介质按体积比8:1混匀(优选置于冰块中,在40rpm摇床中缓慢摇动1h),上样到耐还原型镍柱(beyogoldtmhis-tag),先用非变性洗涤液洗柱5次去除杂蛋白,每次洗脱1-2个柱体积;然后用非变性洗脱液洗脱6~10次(优选8次),每次洗脱1-2个柱体积,收集含有目标蛋白的洗脱液,用0.01m、ph 8.0的磷酸钠缓冲液透析24h,更换三次透析液,取截留液冻干(在-80℃冰箱中预冻8h后放入冷冻干燥机-65℃真空干燥24h),获得纯酶;非变性洗涤液是含300mm nacl和2mm咪唑的ph8.0、50mm磷酸二氢钠缓冲液;非变性洗脱液是含300mm nacl和50mm咪唑的ph8.0、50mm磷酸二氢钠缓冲液。
14、在本发明的实施例中,重组蛋白spytag-r-ω-转氨酶、重组蛋白spytag-乙醇脱氢酶、重组蛋白eutm-spycatcher分别是经如下操作制备的:构建重组表达质粒,将所述重组表达质粒转入宿主细胞,诱导表达,纯化分离。上述操作是本领域常规步骤,本发明优选所述重组蛋白spytag-r-ω-转氨酶、重组蛋白spytag-乙醇脱氢酶的重组表达质粒的载体为pet28a,所述重组蛋白eutm-spycatcher的重组表达质粒的载体为pet22b;上述重组蛋白的宿主细胞都是大肠杆菌bl21(de3)。
15、所述重组质粒pet22b-eutm-spycatcher采用如下方法构建:(1)将eutm基因构建于pet-22b质粒的xba i和bamh i酶切位点之间,获得质粒pet22b-eutm;所述eutm基因的核苷酸序列如seq id no:1所示;
16、所述质粒pet22b-eutm用限制性内切酶bamh i和xho i进行双酶切,得到线性化载体;
17、(2)将spycatcher基因插入到pet-28a(+)质粒的bamh i和xho i位点之间,得到质粒pet-28a-spycatcher;所述spycatcher基因的核苷酸序列如seq id no:3所示;
18、以所述质粒pet-28a-spycatcher为模板,以以下引物对进行pcr扩增,得到目的基因片段:
19、正向引物:catcaccacagccaggatccggtagtggtggtagtggtg
20、反向引物:tggtggtggtggtgctcgagtgcggccgcaagcttgtc;
21、(3)将步骤(1)所述线性化载体和步骤(2)所述目的基因片段进行无缝连接,获得所述重组质粒pet22b-eutm-spycatcher。
22、进一步,所述重组蛋白spytag-atta、spytag-adh的纯酶采用上述eutm-spycatcher的纯酶制备方法,区别在于:①步骤(1)中所述重组质粒分别为pet28a-spytag-atta、pet28a-spytag-adh;②步骤(2)中所述诱导培养的温度为16-30℃(优选23℃)。
23、进一步,所述重组质粒pet28a-spytag-atta的构建方法与pet22b-eutm-spycatcher相同,区别在于为:步骤(1)中如seq id no:9所示的spytag基因构建于pet28a(+)质粒的nde i和bamh i酶切位点之间,获得质粒pet28a-spytag;然后用限制性内切酶bamh i和xho i进行酶切得到线性化载体;步骤(2)为:将spycatcher基因替换为seq idno:13所示的atta转氨酶基因,得到质粒pet-28a-atta;以所述质粒pet-28a-atta为模板,以以下引物对进行pcr扩增,得到目的基因片段:
24、正向引物:tggtgtagacggattcgcgagcatggataaagttttcg
25、反向引物:tggtggtggtggtgctcgagttagttacgttcgttgtagtcaatt。
26、进一步,所述重组质粒pet28a-adh的构建方法与pet28a-spytag-atta相同,区别在于为:步骤(1)中用;步骤(2)为:将atta转氨酶基因替换为如seq id no:17所示的adh乙醇脱氢酶基因,得到质粒pet228a-adh;以所述质粒pet-28a-adh为模板,以以下引物对进行pcr扩增,得到目的基因片段:
27、正向引物:tggtgtagacggattcatgagcattccggaaacccaga;
28、反向引物:tggtggtggtggtgctcgagtttgctggtatcaacaacataacga。
29、第二方面,本发明还提供一种所述自组装蛋白支架固定化酶在不对称还原1-(4-甲氧基苯基)丙酮合成(r)-1-(4-甲氧基苯基)丙-2-胺((r)-4-mppa)的应用。
30、具体地,所述的应用为:以所述自组装蛋白支架固定化酶为催化剂,以1-(4-甲氧基苯基)丙酮为底物,以二甲基亚砜(dmso)为助溶剂,以异丙胺盐酸盐为供氨体,以磷酸吡哆醛(plp)为辅酶,以nad+为辅助因子、以乙醇为辅底物、以ph 6-10的缓冲液为反应介质构成反应体系,在25-45℃(优选32℃)、150-200rpm(优选180rpm)摇床中混合搅拌反应12-36h(优选24h),所得反应液经分离纯化,获得(r)-1-(4-甲氧基苯基)丙-2-胺。
31、优选的,所述反应体系中,所述催化剂的终浓度为0.5-5g/l(优选1g/l),所述1-(4-甲氧基苯基)丙酮的终浓度为25-125mm(优选125mm),所述异丙胺盐酸盐的终浓度为25-125mm(优选100mm),所述磷酸吡哆醛的终浓度0.5-1.5mm(优选1mm),所述nad+的终浓度为0.5-1.5mm(优选1mm),所述辅底物的终浓度为25-125mm(优选50mm),所述助溶剂的体积为所述反应体系体积的10%-30%(优选20%)。
32、优选的,所述缓冲液为ph 7.0、100mm磷酸钠缓冲液。
33、优选的,所述分离纯化为:所述反应液离心,收集上清液,加入所述上清液等体积的乙酸乙酯萃取,收集有机相,无水硫酸钠干燥,在常温下挥发溶剂,获得(r)-1-(4-甲氧基苯基)丙-2-胺。
34、与现有技术相比,本发明的有益效果主要体现在:
35、本发明方法首次采用eutm支架用于固定化r-转氨酶(r-atta)与乙醇脱氢酶(adh),具有简化反应过程、便于操作与高效催化等优势。在体外构建固定化多酶催化体系,实现atta、adh双酶共固定化形成级联反应,产生高效的辅酶再生系统,提高了nadh的再生效率,为生物催化反应提供了充足的nadh,从而加强酶的级联作用和催化效率;同时蛋白支架也为胺化反应提供了良好的环境,提高了酶的热稳定性。本发明方法在底物浓度为125mm时将催化的产率84.7%(游离双酶)提高到97.7%(共固定化双酶),显著提高了底物1-(4-甲氧基苯基)丙酮的胺化效率,从而建立高效胺化1-(4-甲氧基苯基)丙酮制备r-4-mppa的工艺。
- 还没有人留言评论。精彩留言会获得点赞!