AsCas12f1蛋白在链霉菌基因组编辑中的应用和基因编辑方法
本发明涉及ascas12f1蛋白在链霉菌基因组编辑中的应用和基因编辑方法,涉及基因编辑。
背景技术:
1、crispr(clustered regularly interspaced short palindromic repeats)系统是一种广泛分布于细菌和古细菌中的适应性免疫系统,存在于约40%细菌和90%古细菌中。其中cas(crispr-associated protein)蛋白可在具有向导功能的grna(guide rna)引导下结合并切割外源dna,造成dna双链断裂(double strand break,dsb),从而抵抗外源遗传物质入侵。crispr靶向特异性依靠grna和目标dna之间的碱基配对,且同时依赖于靶dna序列5'或3'末端的一段短的序列和cas蛋白的相互作用,十分保守,被称为protospaceradjacent motif(pam)。crispr/cas系统主要分成2大类:第一类,由多个cas蛋白组成效应复合体,在grna引导下降解外源侵入的dna;第二类,只需要单个的cas效应蛋白(如目前广泛应用的cas9和cpf1),在grna引导下降解外源侵入的dna。目前,已知的crispr/cas系统中第一、二类各占90%和10%。这两大类crispr/cas系统又可以进行细分,如第一类包括i型、iii型和iv型,第二类包括ii型、v型和vi型。由于二类crispr/cas系统仅需单一的cas效应蛋白就能很好发挥功能,因此,已被广泛开发用于生物体的基因组编辑,给生命科学研究带来了革命性变化。其中ii型的cas9(主要来源于酿脓链球菌的cas9)研究得最深入、应用最成熟;其次是v型的cpf1(或称cas12a,如来源于新弗朗西斯菌的fncas12a)。
2、至今,已在链霉菌中开发了基于crispr/spcas9(酿脓链球菌来源,简称为cas9)或fncpf1(新凶手弗朗西斯菌来源,简称为fncpf1)系统的高效基因组编辑技术,实现了在模式菌株和一些工业链霉菌的高效基因组编辑,包括单基因或单基因簇缺失、多基因(2-3个)或多基因簇(2个)的同时缺失、点突变等,最高编辑效率可达100%。然而研究发现,因非特异性dna切割或结合,cas9和cpf1对宿主细胞存在较大的细胞毒性,无法应用于dna转化效率低的链霉菌的遗传改造。为此,科研人员分别通过从转录、翻译等层面控制cas9蛋白的表达量及活性,显著降低了cas9蛋白对细胞的毒性,一定程度上实现了基因组的高效编辑。这些技术的开发为dna转化效率低下的链霉菌遗传改造带来了福音。但由于这些技术中涉及的功能元件较多,载体构建比较繁琐,编辑载体尺度偏大(超过15kb),会大大降低dna转化效率;另外相关生物元件(如cas9、抗cas蛋白等)的表达需要添加诱导剂,操作相对繁琐。
技术实现思路
1、本发明提供一种ascas12f1蛋白在链霉菌基因组编辑中的应用,用于解决cas9和cpf1对宿主细胞存在较大的细胞毒性,无法应用于dna转化效率低的链霉菌的遗传改造的问题。
2、本发明还提供一种对链霉菌基因组编辑的方法,使用包括ascas12f1蛋白的基因编辑载体对链霉菌基因组进行编辑。
3、本发明第一方面提供ascas12f1蛋白在链霉菌基因组编辑中的应用,所述ascas12f1蛋白的氨基酸序列如seq id no:1所示。
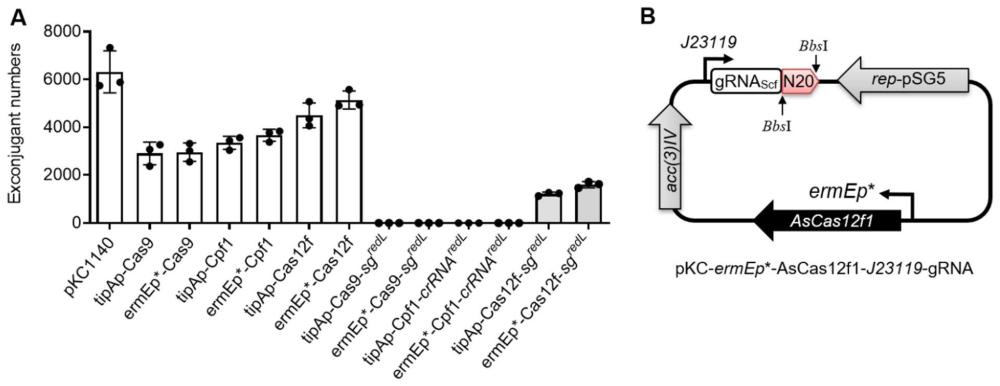
4、与目前常用的cas9(约1400aa)和cpf1蛋白相比(约1300aa)相比,来源于嗜热细菌(acidibacillus sulfuroxidans)的ascas12f1蛋白(422aa)的大小仅是它们的1/3,由于ascas12f蛋白体积小,基于其构建的基因编辑载体将显著小于现有cas9和cpf1编辑载体,其转化效率也将显著高于cas9和cpf1编辑载体。另外,在靶向sgrna(ascas12f1、cas9)或crrna(cpf1)存在情况下,ascas12f1对宿主细胞毒性显著低于cas9和cpf1;与导入cas9/sgrna和cpf1/crrna的重组质粒导致细胞死亡(无接合子长出)相比,ascas12f1/sgrna重组质粒仍有大量接合子长出。因此本发明将其应用于链霉菌的基因组编辑,以期为dna转化效率低下的工业链霉菌菌株代谢工程改造或合成生物学手段育种提供一种有效的遗传操作工具。
5、在一种具体实施方式中,编码所述ascas12f1蛋白的基因由组成型启动子ermep*驱动表达,有助于进一步降低对宿主细胞的毒性,提高基因编辑效率。
6、在一种具体实施方式中,所述基因组编辑包括对链霉菌基因组内的目标基因进行敲除。进一步地,所述目标基因为单基因或单基因簇。
7、在一种具体实施方式中,所述基因组编辑包括对链霉菌基因组内的目标基因进行敲除,具体包括:
8、构建得到包括所述ascas12f1蛋白的基因编辑载体,将所述基因编辑载体导入链霉菌内,以对链霉菌基因组内的目标基因进行敲除;
9、所述基因编辑载体还包括sgrna模块,所述sgrna模块包括能够与目标基因碱基配对的grna。
10、在一种具体实施方式中,所述grna由启动子j231109驱动表达。
11、在一种具体实施方式中,所述目标基因的5'端含有pam序列,所述pam序列的核苷酸为5′-tttg-3′、5′-cttg-3′、5′-gttg-3′中的一种。
12、进一步地,所述pam序列的核苷酸为5′-tttg-3′。
13、在一种具体实施方式中,所述基因编辑载体还包括修复模块,所述修复模块包括目标基因的上游同源臂和下游同源臂。
14、在一种具体实施方式中,所述基因编辑载体还包括温敏型复制子和/或抗性基因。
15、在一种具体实施方式中,所述链霉菌包括天蓝色链霉菌、吸水链霉菌中的一种或多种。
16、本发明第二方面提供一种对链霉菌基因组进行编辑的方法,包括:构建得到包括ascas12f1蛋白的基因编辑载体,将所述基因编辑载体导入链霉菌内,以对链霉菌基因组内的目标基因进行敲除;
17、所述ascas12f1蛋白的氨基酸序列如seq id no:1所示。
18、可以理解,本发明以ascas12f1蛋白为研究对象,首次证实该类小cas蛋白在链霉菌基因组编辑中的实用性及先进性。对本领域专业人员,通过更换类似的cas12f蛋白,或简单的改变某些生物原件如启动子、密码子同义突变等手段是简便或容易的替代方案。
19、本发明采用一种小型低毒的cas蛋白ascas12f1对链霉菌基因组进行编辑,ascas12f1蛋白的细胞毒性显著低于现有cas9和cpf1,含有ascas12f1编码基因的质粒的转化效率显著高于目前广泛使用的cas9和cpf1的重组质粒(尤其是存在靶向sgrna或crrna的存在下),可稳定获得更多的接合子,且编辑效率与cas9相当;此外,基于ascas12f1构建的编辑载体将显著小于现有cas9和cpf1编辑载体,不仅方便质粒构建,也具有更高的转化效率。本发明首次在dna转化效率低下的链霉菌中建立一种高效实用的遗传改造工具,为链霉菌药物的高产改造及新药发现奠定重要基础,从而为链霉菌药物的研发(高产改造以及新药发现)做出重要贡献。
- 还没有人留言评论。精彩留言会获得点赞!